
Mechanizmy
nadwrażliwości
alergicznej na pokarm

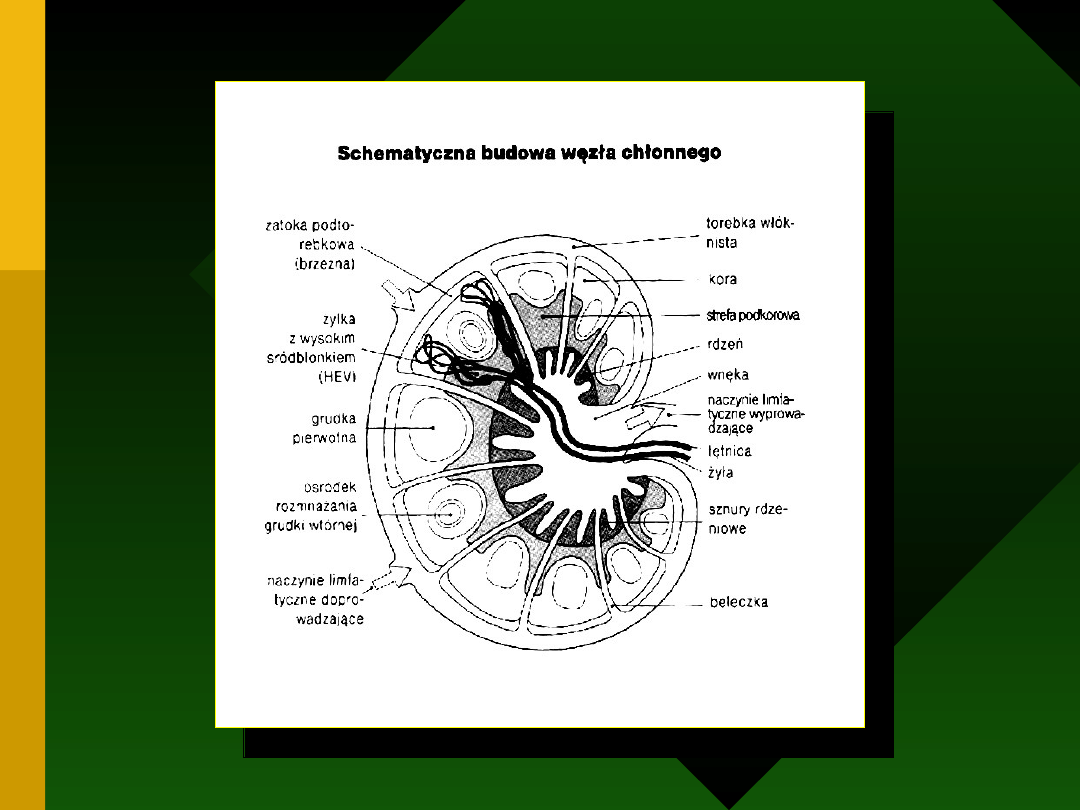
MALT - mucosa associated lymphoid tissue
MALT - mucosa associated lymphoid tissue
GALT - gut associated lymphoid tissue
GALT - gut associated lymphoid tissue
Zorganizowana tkanka limfatyczna związana z nabłonkiem
OMALT - organized mucosa associated lymphoid tssue
Limfocyty rozproszone w blaszce właściwej
DMAL - diffuse mucosa associated lymphoid tissue
Wewnątrznabłonkowe limfocyty
IELs - intra-epithelial lymphocytes
Zorganizowana tkanka limfatyczna związana z nabłonkiem
OMALT - organized mucosa associated lymphoid tssue
Limfocyty rozproszone w blaszce właściwej
DMAL - diffuse mucosa associated lymphoid tissue
Wewnątrznabłonkowe limfocyty
IELs - intra-epithelial lymphocytes

MALT - mucosa associated lymphoid tissue
MALT - mucosa associated lymphoid tissue
GALT - gut associated lymphoid tissue
GALT - gut associated lymphoid tissue
Zorganizowana tkanka limfatyczna związana z
nabłonkiem OMALT - organized mucosa associated
lymphoid tssue
Limfocyty rozproszone w blaszce właściwej
DMAL - diffuse mucosa associated lymphoid tissue
Wewnątrznabłonkowe limfocyty
IELs - intra-epithelial lymphocytes
Zorganizowana tkanka limfatyczna związana z
nabłonkiem OMALT - organized mucosa associated
lymphoid tssue
Limfocyty rozproszone w blaszce właściwej
DMAL - diffuse mucosa associated lymphoid tissue
Wewnątrznabłonkowe limfocyty
IELs - intra-epithelial lymphocytes
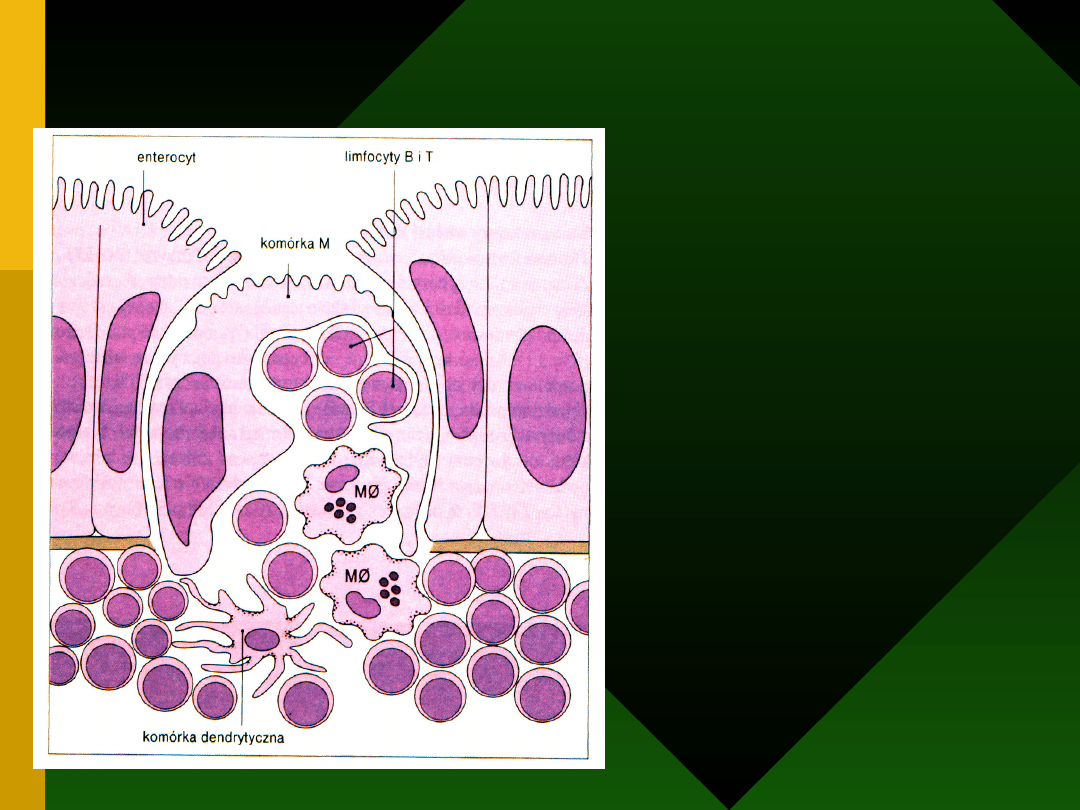
Schematyczny
obraz komórki M
Schematyczny
obraz komórki M

MALT - mucosa associated lymphoid tissue
MALT - mucosa associated lymphoid tissue
GALT - gut associated lymphoid tissue
GALT - gut associated lymphoid tissue
Część aferentna - rola „ustawodawcza”: część nabłonka
położona bezpośrednio nad grudką chłonną, grudki
chłonne samotne i skupione oraz węzły chłonne skupione
Część aferentna - rola „ustawodawcza”: część nabłonka
położona bezpośrednio nad grudką chłonną, grudki
chłonne samotne i skupione oraz węzły chłonne skupione
Część eferentna - rola „wykonawcza”- rozsiane komórki
układu chłonnego: limfocyty nabłonka i limfocyty
i komórki blaszki właściwej
Część eferentna - rola „wykonawcza”- rozsiane komórki
układu chłonnego: limfocyty nabłonka i limfocyty
i komórki blaszki właściwej
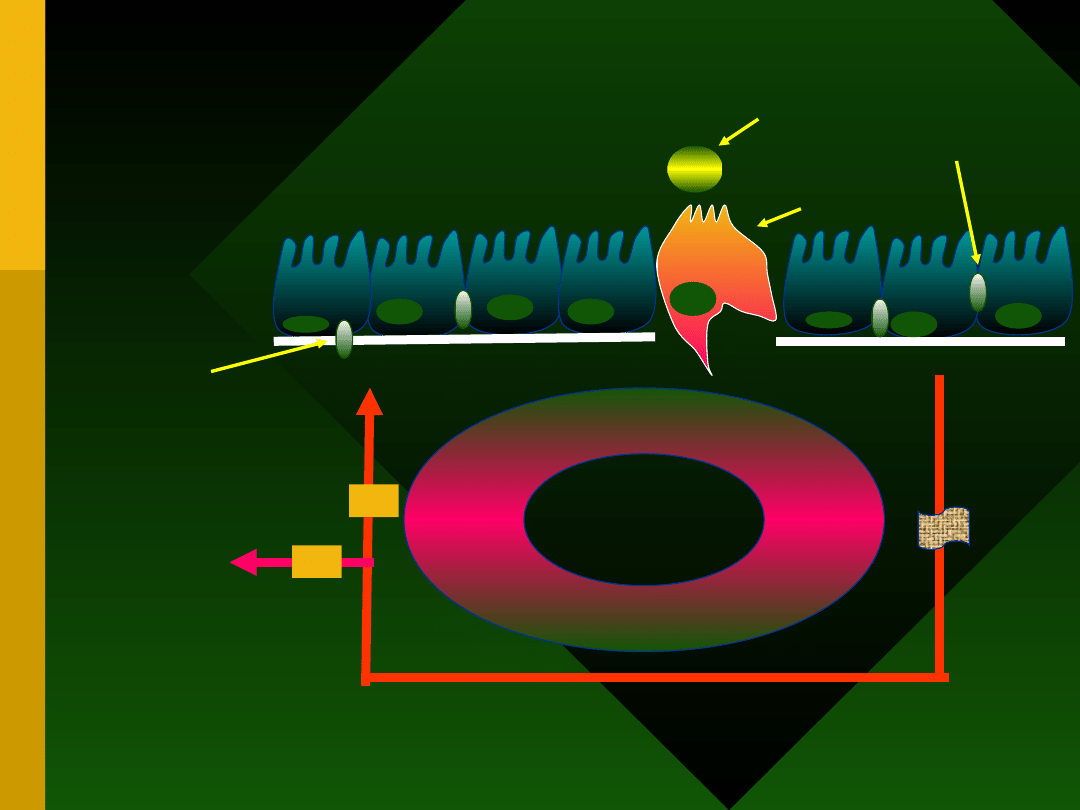
R
Z
RZ
RZ
krążenie
systemowe
pokarm
komórka M
komórki nabłonka
jelita
limfocyt blaszki
właściwej
limfocyt blaszki
właściwej
ramie efferentne
ramie efferentne
inne narządy
inne narządy
ramie
afferentn
e
ramie
afferentn
e
węzeł
chłonny
węzeł
chłonny
limfocyt
śródnabłonkowy
limfocyt
śródnabłonkowy
Schemat indukcji odpowiedzi
immunologicznej

B
B
Patogeneza alergii na pokarmy
Kępki Peyera
Kępki Peyera
aktywacja i uwalnianie cytokin
IgE zależne
IgE zależne
komórkowe
IL 4, 5
10
IL 2
٣IFN
Przeciwciała IgE, IgA, IgG, IgM
Przeciwciała IgE, IgA, IgG, IgM
kompleksy immunologiczne
kompleksy immunologiczne
Objawy kliniczne:
Przewód pokarmowy
Płuca
Nerki, drogi moczowe,
Skóra, układ krążenia
Przenikanie przez jelita
Przenikanie przez jelita
Klirens poprzez system retikularno-endotelialny ( RES)
mastocyt
mastocyt
kom. M
białka pokarmowe
innunokompetentne
komórki GALT
limfocyty T i B

Mechanizm immunologiczny
Mechanizm immunologiczny
Mechanizm immunologiczny
Mechanizm immunologiczny
Odsetek pacjentów
Odsetek pacjentów
Odsetek pacjentów
Odsetek pacjentów
Typ I - zależny od IgE
Typ I - zależny od IgE
Typ I - zależny od IgE
Typ I - zależny od IgE
Typ II- reakcje cytotoksyczne
Typ II- reakcje cytotoksyczne
Typ II- reakcje cytotoksyczne
Typ II- reakcje cytotoksyczne
Typ IV-
Typ IV-
nadwrażliwość typu późngo
nadwrażliwość typu późngo
Typ IV-
Typ IV-
nadwrażliwość typu późngo
nadwrażliwość typu późngo
Typ III-
Typ III-
reakcje z udziałem kompleksów
reakcje z udziałem kompleksów
Typ III-
Typ III-
reakcje z udziałem kompleksów
reakcje z udziałem kompleksów
Więcej niż jeden typ reakcji
Więcej niż jeden typ reakcji
Więcej niż jeden typ reakcji
Więcej niż jeden typ reakcji
48%
48%
48%
48%
6%
6%
6%
6%
10%
10%
10%
10%
18%
18%
18%
18%
28%
28%
28%
28%
w / g Chandra
w / g Chandra

Mechanizmy
patogenetyczne
• W rozwoju alergii pokarmowej biorą udział
wszystkie mechanizmy patogenetyczne
oparte na klasyfikacji Gella i Coombsa;
jednak najczęściej mamy do czynienia z
reakcjami IgE-zależnymi (48 % wg
Chandry), zaś najrzadziej z mechanizmem
cytotoksycznym (6 %). U 28 % chorych z
alergią pokarmową obserwuje się
nakładające się mechanizmy
patogenetyczne

Mechanizmy
patogenetyczne
• Większość limfocytów przestrzeni
śródnabłonkowej należy do subpopulacji
limfocytów CD8+, a ich pobudzenie
antygenem, może doprowadzić do stanu
immunotolerancji.
• Limfocyty blaszki właściwej, to głównie
subpopulacje limfocytów CD4+, których
stymulacja wywołuje odpowiedź
immunologiczną zarówno z udziałem
przeciwciał w klasie IgG, jak i IgE

Mechanizmy
patogenetyczne
• Odpowiedź komórkowa może być modyfikowana przez
niektóre cytokiny uwalniane z preferencyjnie
aktywowanych limfocytów (np. Th2), co dodatkowo
indukuje syntezę określonych immunoglobulin (np.
IgE), prowadząc do nasilenia niepożądanych reakcji
immunologicznych w obrębie śluzówki przewodu
pokarmowego (I typ reakcji immunologicznej).
• W wyniku amplifikacji odpowiedzi immunologicznej
przez wydzielanie różnych cytokin (np. Il-2, Il-8, IFN-γ)
i mediatorów procesu zapalnego (histamina,
serotonina) dochodzi m. in. do wzrostu
przepuszczalności ściany jelita, powstania kompleksów
antygen-przeciwciało, które mogą docierać i osadzać
się w tkankach i narządach (III typ reakcji
immunologicznej).

Mechanizmy
patogenetyczne
• Niezależnie od typu reakcji immunologicznej,
główny udział zarówno w reakcjach IgE-
zależnych, jak i IgE-niezależnych odgrywają
limfocyty T. Odpowiedź z udziałem limfocytów
T jest regulowana przez szereg znanych
cytokin (m. in. IL-4, Il-5, TNF-β itd.) jak i
nowych, odgrywających rolę w patogenezie
reakcji nadwrażliwości typu późnego.
• Wykazano znacząco wyższe stężenie TNF-α w
surowicy pacjentów, których limfocyty uległy
proliferacji w wyniku stymulacji antygenami
białek mleka krowiego

Mechanizmy
patogenetyczne IgE –
zależne
• Reakcje nadwrażliwości pokarmowej przebiegające z
udziałem przeciwciał w klasie IgE stanowią blisko połowę
wszystkich reakcji o podłożu immunologicznym. Dotyczą
one chorych z predyspozycją genetyczną do wytwarzania
przeciwciał w klasie IgE w odpowiedzi na szkodliwe dla
nich alergeny (atopia)
• Degranulacja komórek tucznych i bazofilów odbywa się
poprzez przyłączenie swoistych przeciwciał IgE do
zlokalizowanych na nich receptorów o wysokim
powinowactwie (FcεRI) oraz do receptorów o niskim
powinowactwie (FcεRII), występujących na makrofagach,
neutrofilach. Modyfikowanie charakteru reakcji IgE-
zależnej odbywa się poprzez cytokiny uwalniane z
limfocytów Th2 (Il-4, Il-5, Il-10, Il-13) i Th1 (IFN-γ, lL-2)

Mechanizmy
patogenetyczne IgE –
niezależne
• stanowią wg Chandry, 52 % wszystkich reakcji popokarmowych
• W reakcji cytotoksycznej uszkodzenie narządów (tkanek) jest
związane z eliminacją komórek obcych lub mających na powierzchni
nowe antygeny. Dominującą rolę odgrywają makrofagi, monocyty,
niektóre limfocyty T (CD3+, CD16+) oraz komórki NK.
• wyróżnia się: cytotoksyczność komórkową zależną od przeciwciał
(ADCC), cytotoksyczność przeciwciał z udziałem dopełniacza,
cytotoksyczność limfocytów Tc, cytotoksyczność komórek NK i
makrofagów
• Uszkodzenie tkanki powstaje, jeśli dojdzie do aktywacji układu
dopełniacza i lizy komórki, fagocytozy lub ADCC. Udział
poszczególnych komórek uwarunkowany jest obecnością receptorów
dla fragmentu Fc przeciwciała. Niektóre cytokiny (IFN-γ, GM-CSF, Il-
2) wzmagają ADCC poprzez zwiększenie ekspresji dla receptora Fc.
Najistotniejszą rolę odgrywają receptory dla IgG1 i IgG3 – FcγRI i
FcγRIIIA/CD16.
• W przypadku alergii pokarmowej proces autoimmunologiczny
uwarunkowany jest reakcją krzyżową z antygenami tkankowymi. W
obrazie klinicznym mamy do czynienia najczęściej z
trombocytopenią, występującą np.: w alergii na białka mleka
krowiego

Mechanizmy
patogenetyczne IgE –
niezależne
• Spożycie antygenów pokarmowych (np.: białek mleka
krowiego) w warunkach fizjologicznych, może uruchomić
odpowiedź z udziałem przeciwciał w klasie IgG. Małe ilości
białek pokarmowych pojawiają się w krążeniu, pobudzając
zwiększone wydzielanie swoistych IgG i tworzą z nimi
kompleksy immunologiczne. Po posiłku, w surowicy można
stwierdzić zarówno przeciwciała, jak i krążące kompleksy
antygenów pokarmowych związanych ze swoistymi IgG. W
warunkach fizjologicznych są one szybko wychwytywane
przez układ siateczkowo-śródbłonkowy.
• W sytuacji patologicznej, w której mamy do czynienia z
pojawieniem się nadmiaru antygenu lub przeciwciał,
dochodzi do odkładania się kompleksów w naczyniach
krwionośnych skóry, nerek i stawów (choroba posurowicza
lub odczyn Arthusa). Obserwacje kliniczne wskazują, że
zjawiska te mogą odgrywać istotną rolę w patogenezie
przewlekłych schorzeń zapalnych jelita. W niektórych
przypadkach enteropatii uwarunkowanej pokarmem
stwierdza się obecność kompleksów immunologicznych w
obrębie błony śluzowej uszkodzonego jelita

Mechanizmy
patogenetyczne IgE –
niezależne
• W reakcji nadwrażliwości typu późnego zaangażowane
są przede wszystkim limfocyty T i aktywowane przez nie
komórki, głównie makrofagi. Zmiany zapalne wynikają z
działania, wydzielanych przez limfocyty T pomocnicze,
cytokin (m. in. IFN-γ, Il-2, TNF-β, GM-CSF), które
miejscowo aktywują inne komórki (makrofagi, limfocyty
T cytotoksyczne, bazofile). Objawy występują w
kilkanaście godzin od narażenia na antygen, osiągając
maksimum w 24 - 48 godzinie.
• Podobieństwo histologiczne obrazu uszkodzonej śluzówki
jelita w przebiegu choroby trzewnej, enteropatii jelitowej
indukowanej białkami mleka krowiego, potwierdza
możliwość udziału tego typu reakcji w wystąpieniu
alergii pokarmowej

Tolerancja pokarmowa
•
Zjawiskiem, które występuje w
warunkach fizjologicznych i zapobiega
uogólnionej odpowiedzi immunologicznej
na antygeny pokarmowe, przedostające
się do krążenia w wyniku zmian
szczelności bariery między światłem jelita
i krwią, jest tolerancja pokarmowa, czyli
stan braku immunologicznej reaktywności
na działanie spożytego alergenu.

Tolerancja pokarmowa
• Badania w warunkach doświadczalnych,
in vitro i in vivo, wykazały, że główną rolę
w tym zjawisku odgrywa modulacja
odpowiedzi zależnej od limfocytów T
oraz zjawisko supresji, które jest ważnym,
choć nie jedynym, mechanizmem
warunkującym brak odpowiedzi i stan
tolerancji immunologicznej w stosunku do
danego antygenu

Limfocyty T
Rola w
immunomodulacji
CD4+ Th3 – TGFβ
Limfocyty aktywowane w
kępkach Peyera po
doustnym podaniu antygenu
– TGFβ –działanie
immunosupresyjne;
tolerancja pokarmowa
CD4+ T1 (TR1) – Il-10
Rola w immunosupresji po
transplantacjach; w
badaniach doświadczalnych
– immunosupresja w
chorobach zapalnych jelit
CD4+/25+, CD45RA+ T -
cytokiny inhibicji
kontaktowej
Rola w schorzeniach o
podłożu
autoimmunologicznym;
cytokina supresji zależnej od
kontaktu komórka/komórka
CD8+ limfocyty T supresory Mechanizm ??
(supresja swoista i
nieswoista)

Tolerancja pokarmowa
• Aktywna supresja jest uwarunkowana aktywnością
limfocytów T supresprowych lub przeciwciał
antyidiotypowych. Limfocyty Ts mogą hamować odpowiedź
immunologiczną w sposób antygenowo swoisty lub
nieswoisty. Supresja nieswoista może być ograniczona do
hamowania przeciwciał określonej klasy lub dotyczyć
przeciwciał różnych klas.
• Istotną rolę, w modyfikowaniu tolerancji pokarmowej
odgrywa sposób prezentacji antygenu. Po wędrówce
antygenu przez błonę śluzową przewodu pokarmowego i
kępki Peyera, prezentacja antygenu odbywa się przy
współudziale cząsteczek MHC klasy I lub II. Prezentacja w
połączeniu z MHC I może prowadzić do aktywacji komórek
supresorowych CD8+; w połączeniu z MCH II aktywuje
limfocyty CD4+ i indukuje pamięć immunologiczną
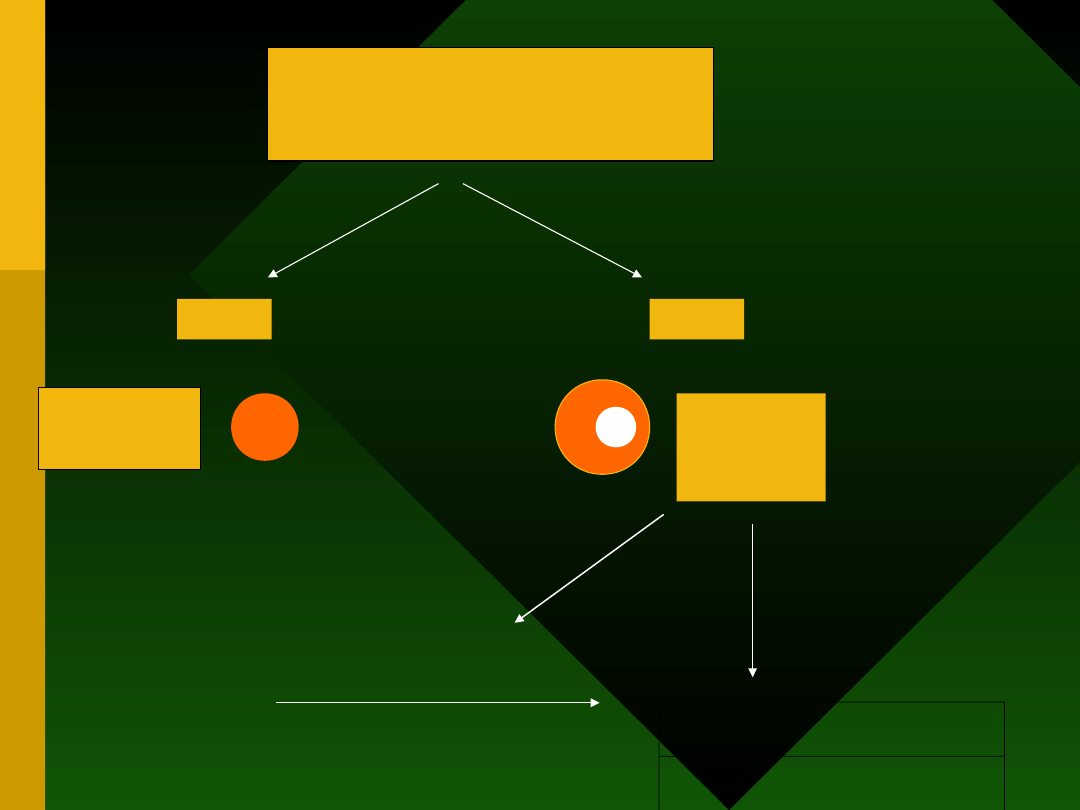
Prezentacja antygenu
(system GALT)
MHC II
MHC I
CD8
Supresja
Indukcja
tolerancji
CD4
Pamięć
immunologicz
na
CD8
CD4
sygnał negatywny
cytokiny
Mechanizmy tolerancji
pokarmowej
Delecja
Anergia
Supresja

Mechanizmy odpowiedzialne za
wystąpienie tolerancji pokarmowej
obejmują
•
delecję klonalną (utrata lub zamaskowanie
determinantów antygenowych obecnych w
komórkach macierzystych)
•
anergię (niedostateczna odpowiedź ustroju na
czynniki wzbudzające odpowiedź
immunologiczną w warunkach fizjologicznych)
•
aktywną supresję komórek CD8
(zahamowanie zdolności niektórych limfocytów
do proliferacji, poprzez oddziaływanie cytokin
wytwarzanych przez określone limfocyty
aktywowane antygenem)

Tolerancja pokarmowa
• Wystąpienie określonego mechanizmu
determinowane jest dawką doustnie podanego
antygenu, którym indukowana jest tolerancja
pokarmowa. W przypadku użycia małej dawki, za
tolerancję odpowiedzialne są mechanizmy
supresji, w których dominującą rolę odgrywają
limfocyty Th2 oraz Il-4, Il-10 oraz TGF-β.
Następstwem podaży dużych dawek antygenu
jest zniszczenie limfocytów efektorowych i ich
anergia. Niewykształcenie lub upośledzenie
jednego z powyższych procesów doprowadza do
wystąpienia objawów nadwrażliwości pokarmowej
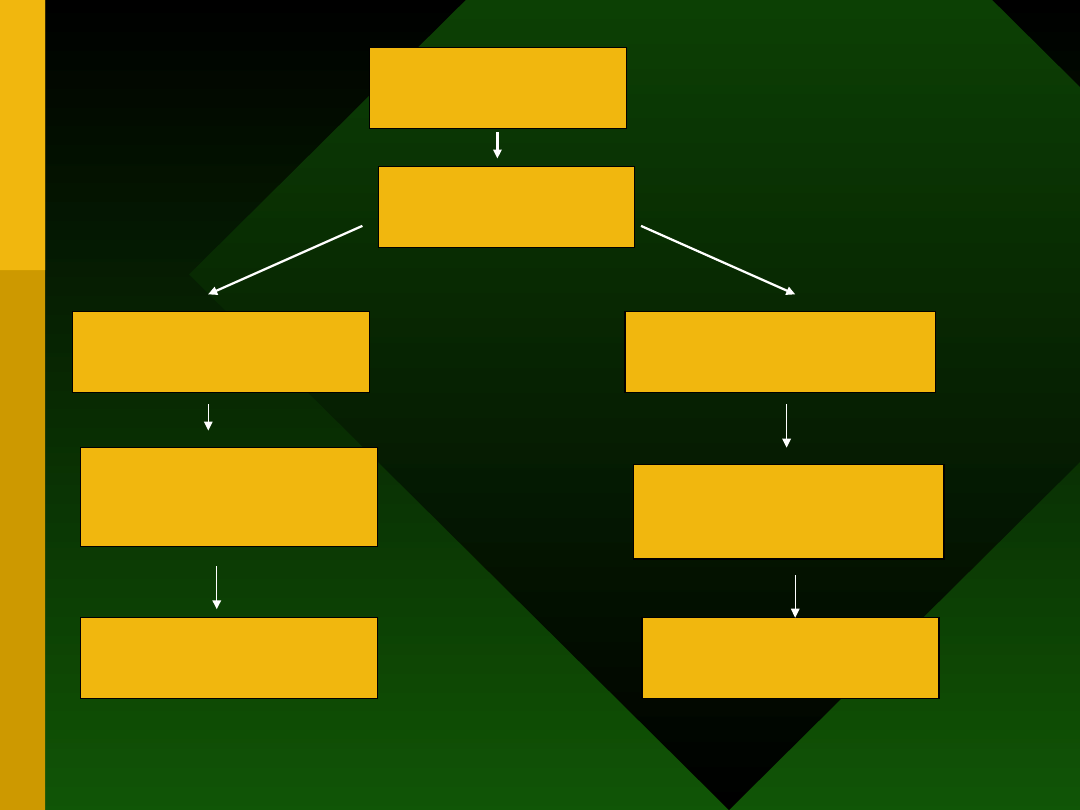
Doustna podaż
alergenu
GALT
(gut associated
lymphoid tissue)
Niska dawka alergenu
Stymulacja Th2
Wydzielanie Il-4, Il-10,
TGFβ
Regulacja odpowiedzi
immunologicznej
Aktywna supresja
Wysoka dawka alergenu
Delecja lub anergia
limfocytów Th1
(Th2 ?)
Anergia lub delecja
klonalna
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
Wyszukiwarka
Podobne podstrony:
Diagnostyka alergii na pokarmy
Dolny odcinek przewodu pokarmowego a alergia na pokarm
Alergia na pokarm i leki
ALERGIA NA POKARMY DLA MADZI
Alergia na pokarmy u doroslych w praktyce lekarskiej
Nadwrażliwość na pokarm i leki
Nadwrażliwość na pokarmy, OML, III rok, Alergologia
Imm Cw 2 Nadwra liwo Ť¦ç na pokarmy
Alergie i wrażliwość na pokarmy, Autyzm
Nadwrażliwość na pokarmy
Nadwrazliwosc czy alergia na sr Nieznany
więcej podobnych podstron