
CHEMIA
Wiązania
chemiczne
Marek Jasiorski

Cząsteczka
Aby powstało wiązanie, spełnione muszą być poniższe
warunki:
− reagujące atomy powinny się zderzyć ze sobą,
− zderzenie to musi być efektywne.
Gdy dwa atomy zbliżają się do siebie, zewnętrzne,
luźno związane elektrony zostają mocno zaburzone,
oddziałując na wszystkie cząstki układu (jony,
elektrony). Oddziaływanie to może prowadzić do
powstania wiązania, gdy jądra/jony są blisko siebie.
Proces powstawania cząsteczki
jest korzystny energetycznie -
prowadzi do zmniejszenia
energii układu.
Utworzona cząsteczka jest
trwalsza niż poszczególne atomy.
H· + ·H = H−H
∆E = -435 kJ/mol
produktu
:N + N: = :N
∶
∶
≡N:
∆E = -946 kJ/mol
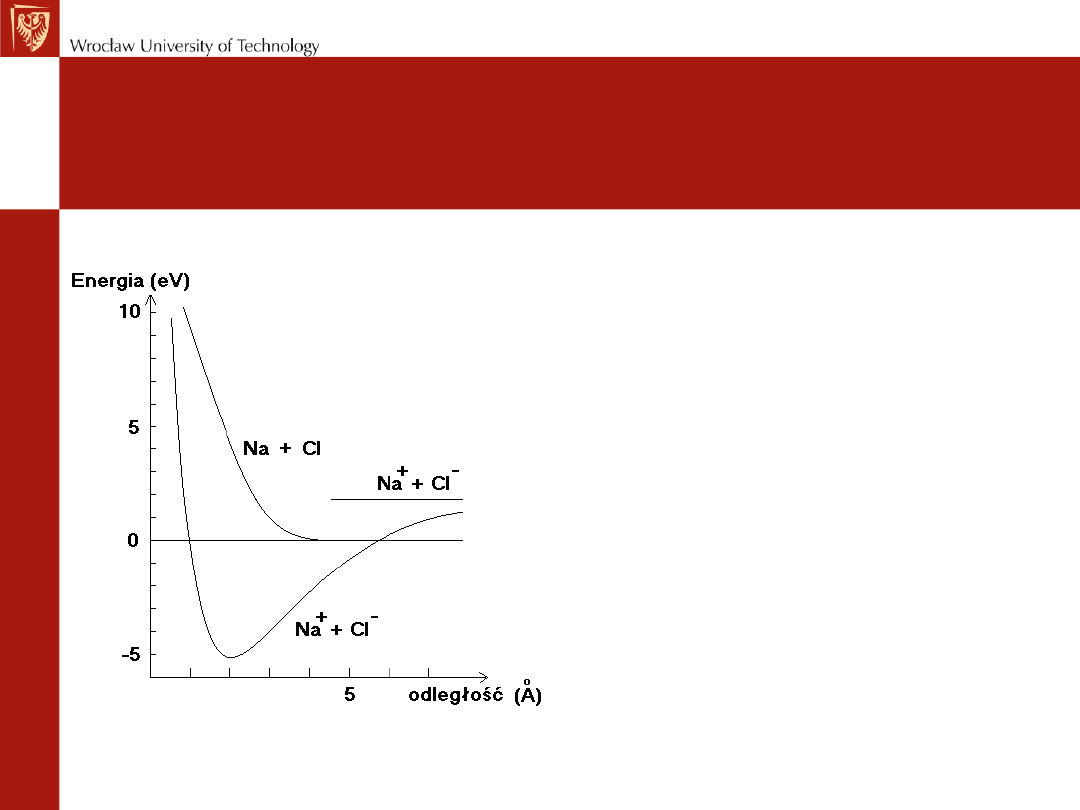
Krzywe energii potencjalnej układu
Na + Cl

Wiązanie wg elektronowej teorii
wiązań
Wiązania tworzą elektrony zewnętrznej powłoki
elektronowej atomu (
walencyjne
), przy czym cząsteczki
powstają jedynie wówczas, gdy w wyniku reakcji każdy
atom osiąga trwałą konfigurację elektronową.
Najtrwalsze konfiguracje elektronowe mają atomy
gazów szlachetnych (8 elektronów na powłoce
walencyjnej) – pierwiastki bierne chemicznie.
Cząsteczki dążą do wypełnienia powłoki walencyjnej,
czyli obsadzenia jej 8 elektronami (
reguła oktetu
)
/nie zawsze jest spełniona, np. w
SF
6
/
Atomy mogą osiągać trwałą konfigurację elektronową
przez oddawanie, przyłączanie lub uwspólnianie
elektronów.
Wiązanie jonowe (I)
Powstaje gdy różnica elektroujemności pomiędzy
łączącymi się pierwiastkami wynosi więcej niż 1,7.
Następuje wówczas
przesunięcie elektronów
w stronę
atomu bardziej elektroujemnego, który staje się
anionem
,
natomiast atom oddający elektrony staje się
kationem
.
Siłą, która utrzymuje dwa atomy ze sobą jest siłą
przyciągania elektrostatycznego (brak kierunkowości).
11
Na 1s
2
2s
2
p
6
3s
1
Na
+
1s
2
2s
2
p
6
17
Cl 1s
2
2s
2
p
6
3s
2
p
5
Cl
−
1s
2
2s
2
p
6
3s
2
p
6

Wiązanie jonowe (II)
Na przykład w związkach pierwiastków z pierwszej kolumny
tablicy okresowej z pierwiastkami przedostatniej kolumny
(halogenki metali alkalicznych: KCl, LiBr)
/ pierwiastek elektrododatni - pierwiastek elektroujemny/
Cechy związków z przewagą wiązania jonowego:
• ciała w stanie stałym,
• zbudowane z kationów i anionów, przyciągających się ze
stosunkowo dużą siłą,
• twarde kryształy o wysokiej temperaturze topnienia i wrzenia,
• rozpuszczają się dobrze w rozpuszczalnikach polarnych (woda),
• w stanie stopionym lub w roztworze dobrze przewodzą prąd
elektryczny (nośnikiem ładunków są ruchliwe jony),
• ich reakcje zachodzą stosunkowo szybko.
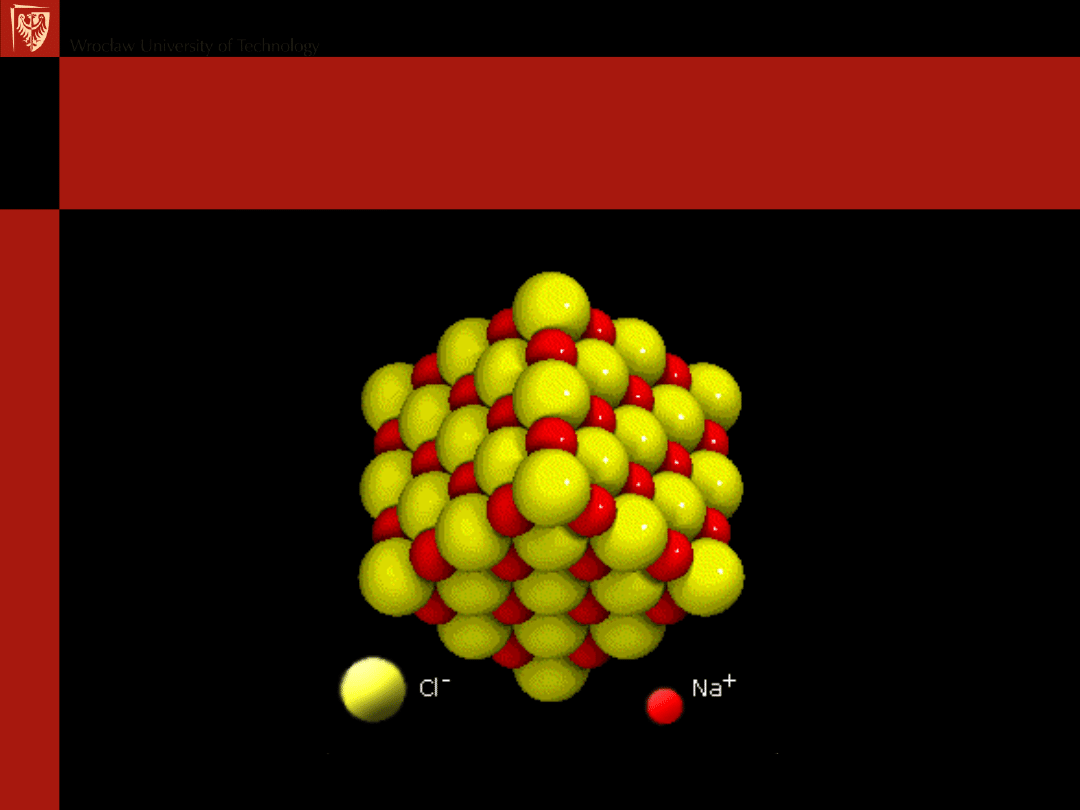
Struktura kryształu jonowego
Wiązanie kowalencyjne
(atomowe) (I)
• Jest wynikiem
uwspólniena pary elektronowej
, przy
czym każdy atom dostarcza jeden elektron.
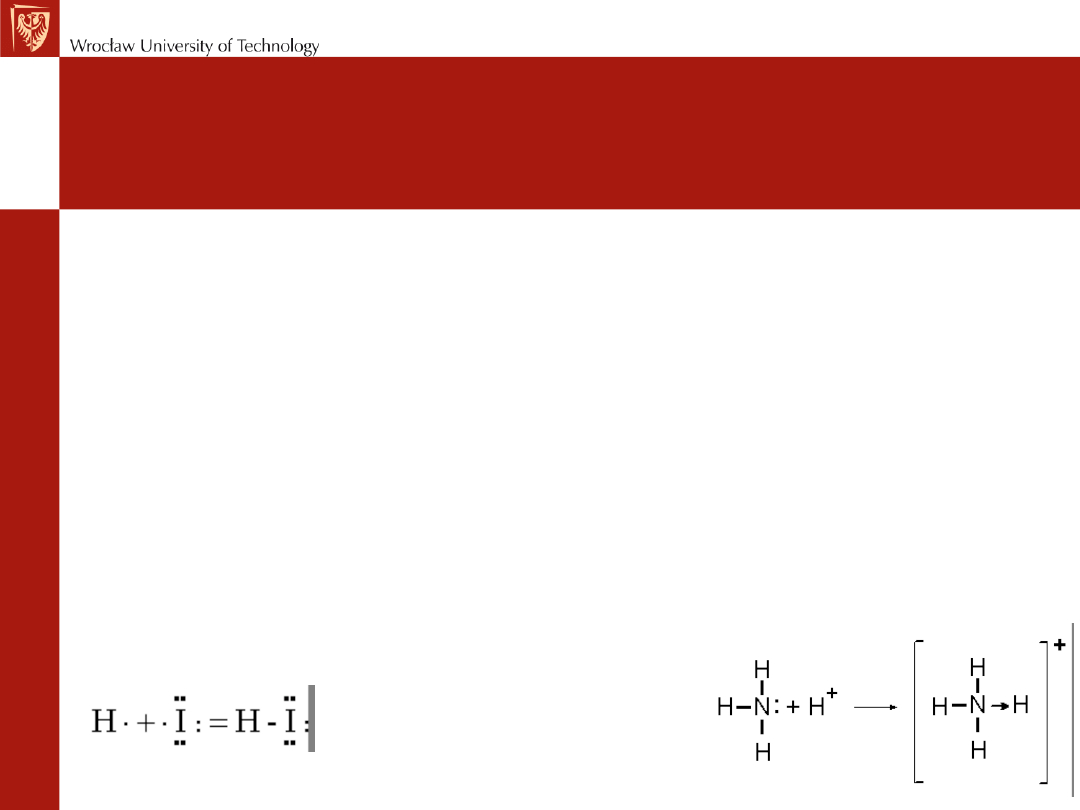
• Wiązanie koordynacyjne – szczególny przypadek
w. kowalencyjnego, gdy uwspólniona para
elektronów wiązania pochodzi od jednego atomu
(NH
4
Cl).
• Mogą powstawać także tzw.
wiązania podwójne
lub
potrójne
przez uwspólnienie 4 lub 6 elektronów (np.
atomy azotu o konfiguracji 1s
2
2s
2
p
3
- 5 elektronów
walencyjnych - tworząc trzy wspólne pary
elektronowe uzyskują oktet).
• Wiązanie ukierunkowane.
:N∶ + ∶N: =
:N≡N:

Wiązanie kowalencyjne
(atomowe) (II)
Na przykład H
2
, O
2
/pierwiastek elektroujemny - pierwiastek elektroujemny/
Cechy związków z przewagą wiązania jonowego:
• ich cząsteczki słabo na siebie oddziałują,
• ich kryształy wykazują niewielką odporność na działanie
czynników mechanicznych,
• mają niskie temperatury przejść fazowych,
• rozpuszczają się w rozpuszczalnikach niepolarnych (benzen,
tetrachlorek węgla),
• w stanie stopionym lub w roztworze nie przewodzą prądu
elektrycznego,
• reagują stosunkowo wolno.

Wiązanie kowalencyjne
spolaryzowane
• Pośrednie między wiązaniem atomowym i jonowym.
• Tworzy się jeśli różnica elektroujemności łączących się
pierwiastków zawiera się w granicach 0,4-1,7.
• Uwspólniona, wiążąca para elektronów przesunięta jest
w stronę atomu pierwiastka bardziej ujemnego.
• Np. HCl – charakter wiązania jest w ok. 80% atomowy i
w 20% jonowy.
• Cząsteczki w związku z takim nierównomiernym
rozmieszcze-niem ładunków tworzą dipole (cząsteczki
dwubiegunowe).
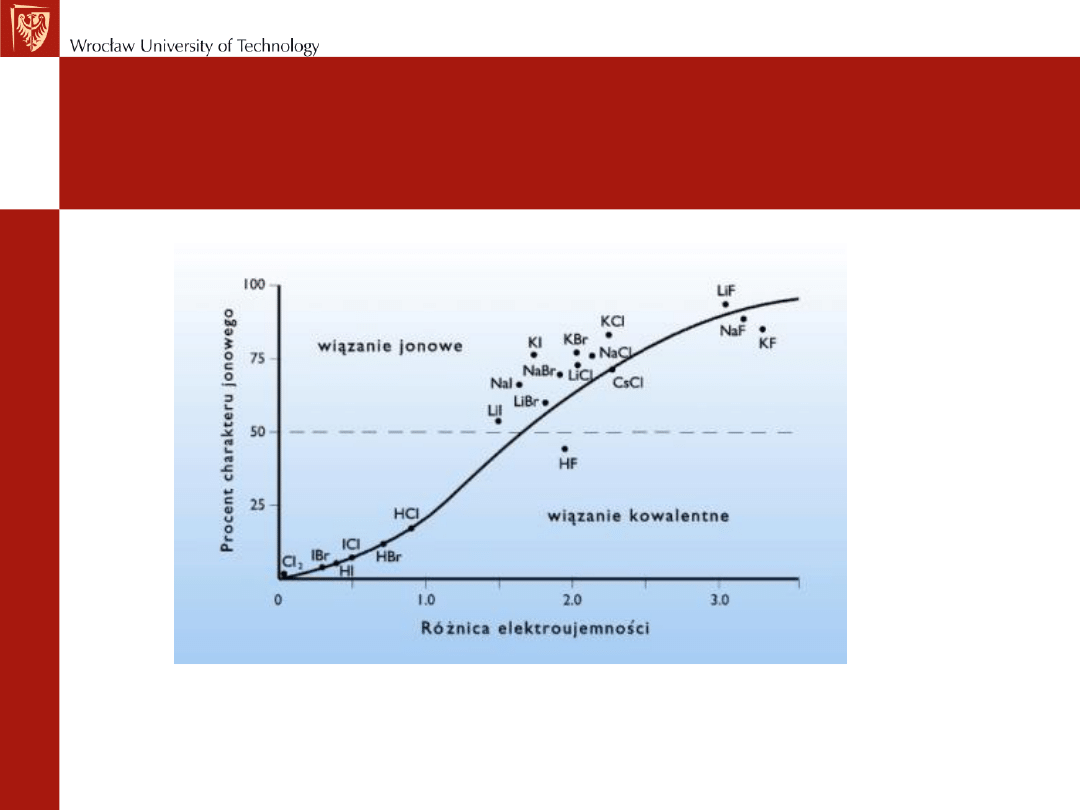
Udział charakteru jonowego w wiązaniu w zależności od różnicy
elektroujemności pierwiastków w związku chemicznym.
Wiazanie metaliczne
• W sieci metalicznej każdy elektron z zewnętrznych
powłok znajduje się pod wpływem kilku jąder
sąsiednich atomów, co powoduje rozmycie się ściśle
określonych poziomów energetycznych w jedno
ciągłe
pasmo przewodnictwa.
• Elektrony walencyjne mogą
się swobodnie
przemieszczać.
• pierwiastek elektrododatni -
pierwiastek elektrododatni
• brak kierunkowości
• Materiały o dobrym
przewodnictwie
elektrycznym.

Inne rodzaje wiązań
Wiązanie wodorowe
• dwie cząsteczki/jony połączone są jonem wodorowym
• szczególne znaczenie ma wiązanie −O−H‐‐‐‐O−
• pełni istotną rolę w utrzymaniu struktury białek i kwasów
nukleinowych
Wiązanie van der Waalsa
(międzycząsteczkowe)
• występuje między wszystkimi cząsteczkami
• związane z przyciąganiem się dipoli lub dipoli
indukowanych
• odpowiedzialne za właściwości fizyczne substancji (np.
stan skupienia, temperatury przejść fazowych)
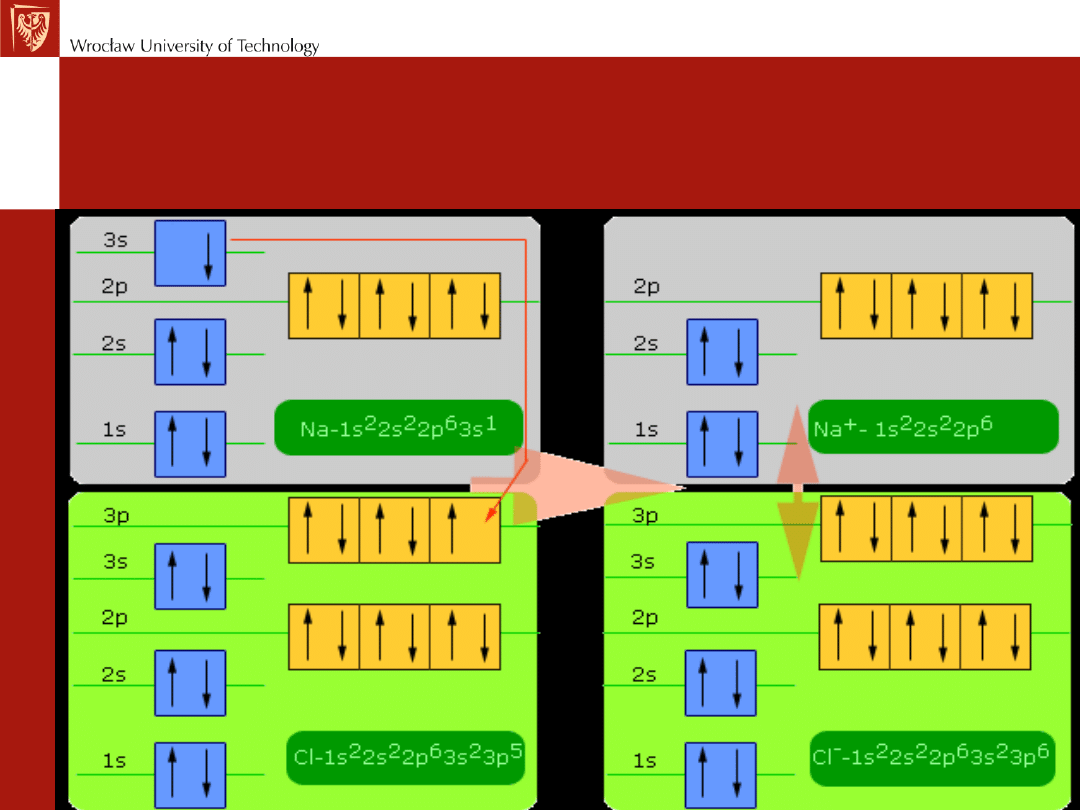
Wiązanie jonowe wg kwantowej teorii
wiązań
Powstanie cząsteczki NaCl
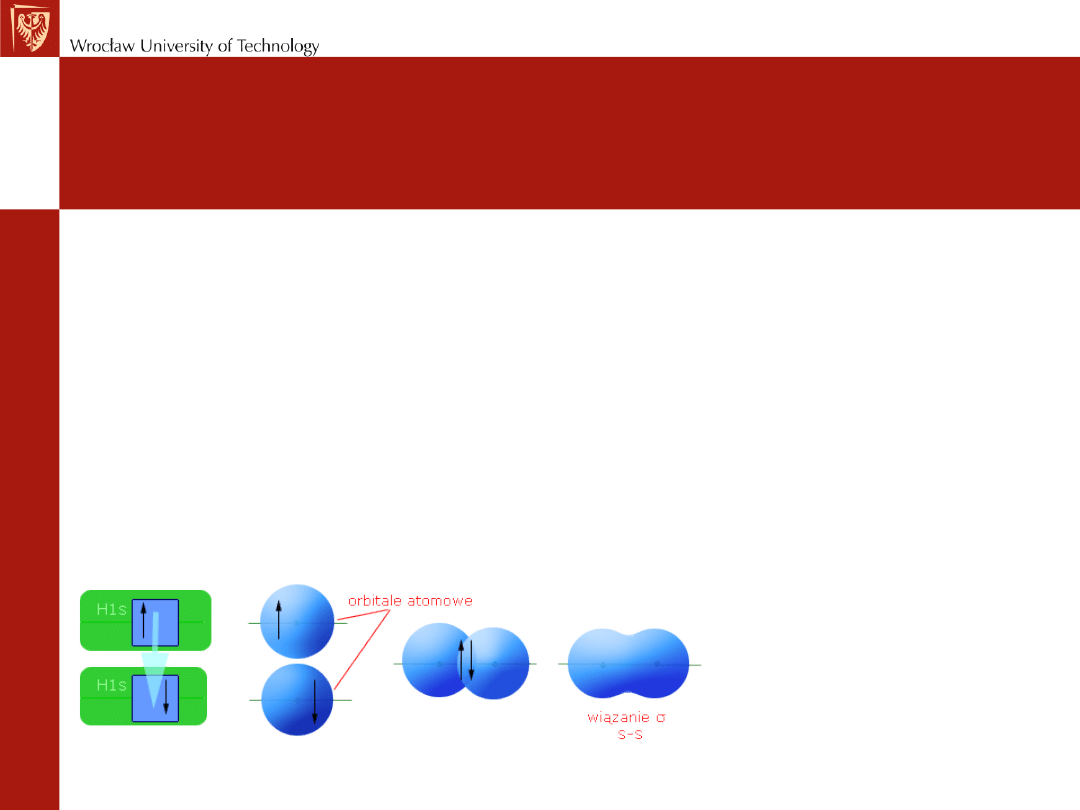
Wiązanie kowalencyjne wg kwantowej teorii
wiązań
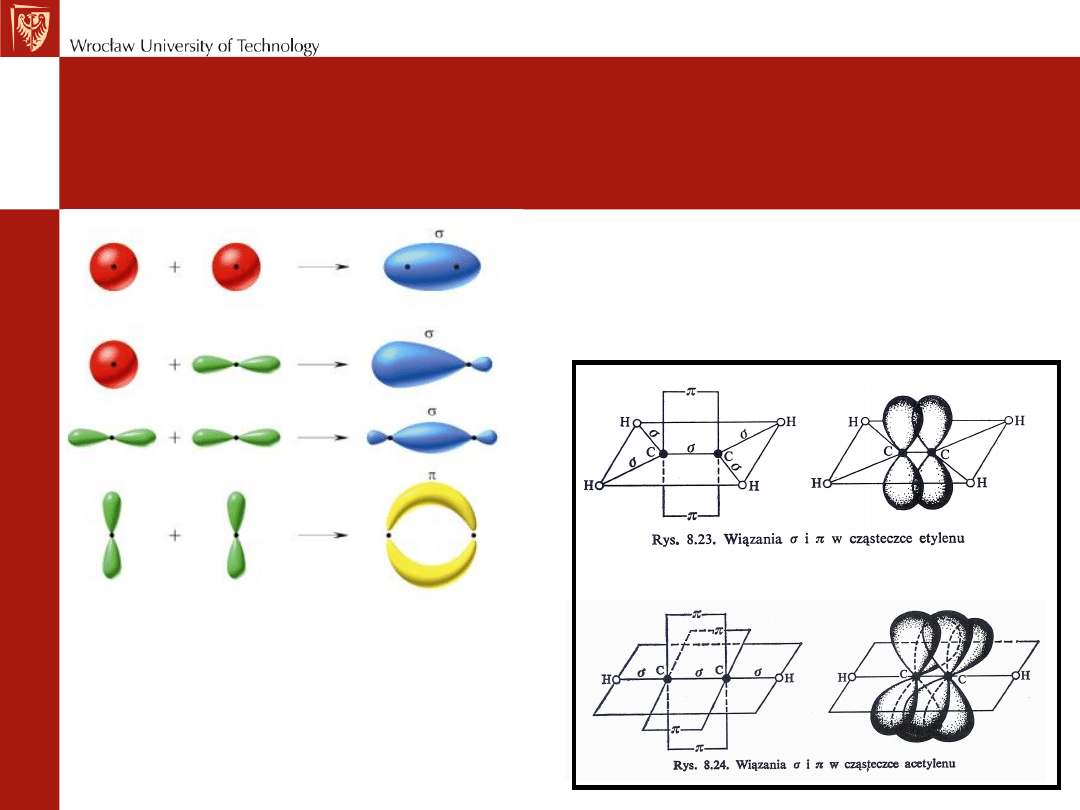
• Wiązanie powstaje w wyniku nakładania się orbitali
atomowych i ma miejsce zawsze wtedy kiedy na
orbitalach znajdują się niesparowane elektrony.
• Wszystkie wiązania powstające w wyniku czołowego
nakładania się orbitali nazywa się
wiązaniami σ
(najbardziej prawdopodobne występowanie elektronu
pokrywa się z osią łączącą oba atomy).
cząsteczka H
2
nakładanie się dwóch
orbitali s
(mogą się też nakładać
orbitale typu p, np. w
F
2
)
W przypadku wiązań podwójnych lub potrójnych
występuje boczne nakładanie się orbitali z utworzeniem
wiązań π
(najbardziej prawdopodobne występowanie
elektronu znajduje się powyżej/poniżej osi łączącej oba
atomy).
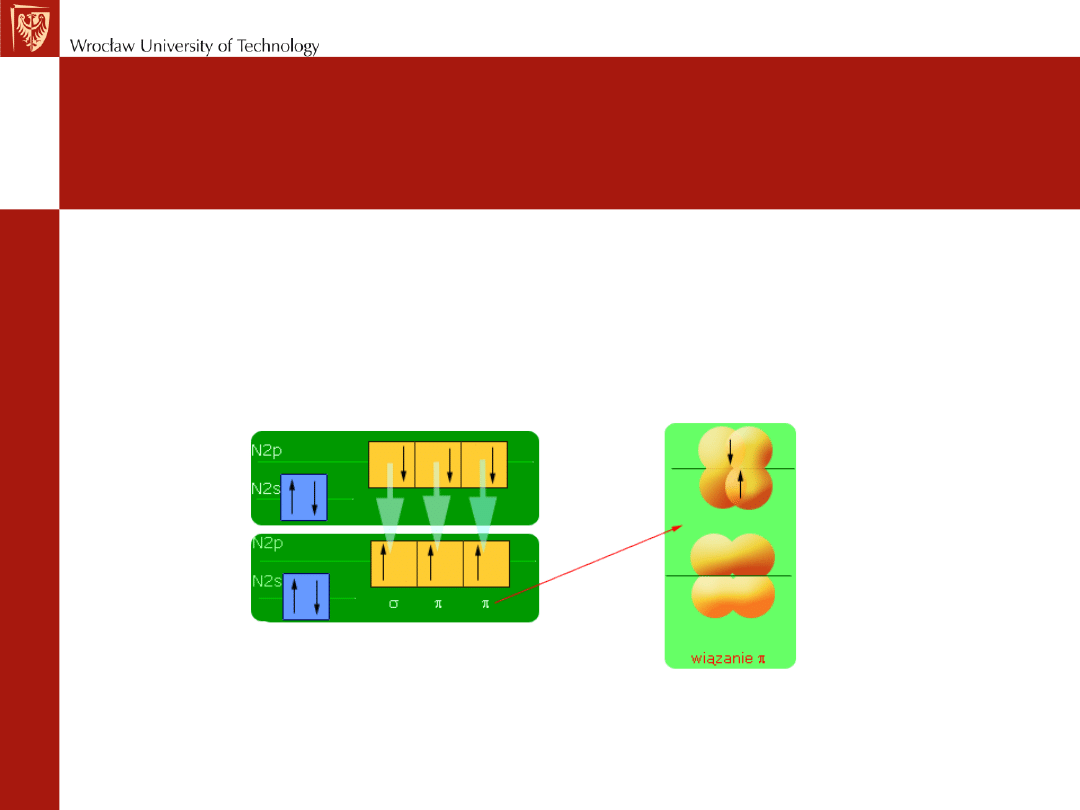
cząsteczka N
2
czołowe nakładanie się dwóch orbitali 2p (po jednym z każdego
atomu)
oraz boczne nakładanie się czterech orbitali 2p
w rezultacie: jedno wiązanie σ i dwa wiązania π
Wiążące orbitale
σ
i
π
s-s
s-p
p-p
p-p

HYBRYDYZACJA (I)
Zakłada się, że wiązanie (orbital cząsteczkowy) powstaje
w wyniku nakładania się orbitali atomowych atomów
tworzących wiązanie.
Proces tworzenia się nowych, jednakowych i
odpowiednio ukierunkowanych orbitali atomowych z
kombinacji orbitali s,p czy d nazywany jest
hybrydyzacją
, a nowe, hipotetyczne orbitale
nazywane są
orbitalami zhybrydyzowanymi
.
Proces hybrydyzacji (ujednorodnienia, wymieszania)
wynika z korzystnych zmian energetycznych
towarzyszących lepszemu usytuowaniu
zhybrydyzowanych orbitali
w przestrzeni.

HYBRYDYZACJA (II)
Orbital zhybrydyzowany skoncentrowany jest
głównie po jednej stronie jądra atomowego i dzięki
temu ma on silniejsze własności kierunkowe.
Każde powstające wiązanie jest równocenne.
Kwantowa teoria wiązań chemicznych (i
hybrydyzacja) pozwala wyjaśnić budowę
cząsteczek wieloatomowych.
orbitale niezhybrydyzowane i hybryda sp
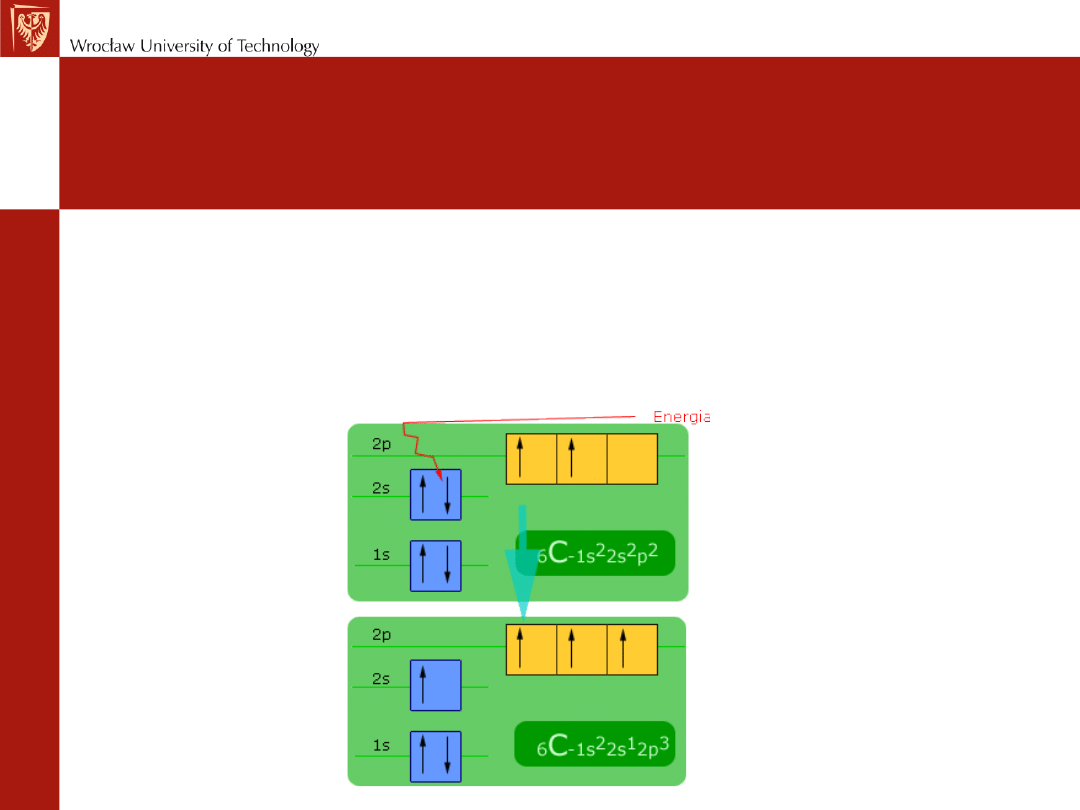
Konfiguracja atomu węgla w stanie
podstawowym i
wzbudzonym
6
C: 1s
2
2s
2
p
2
6
C*: 1s
2
2s
1
*p
3
*
Jeden węgiel kilka struktur
hybrydyzacja sp
3
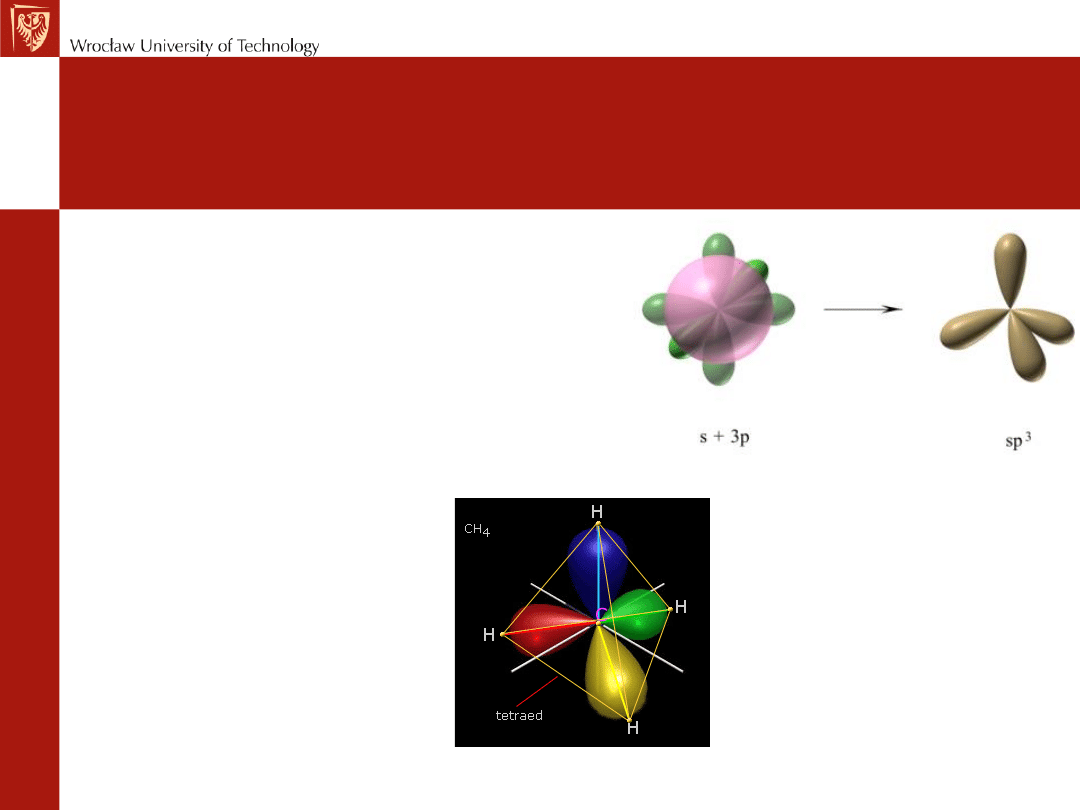
(I)
• wymieszanie się orbitalu s
z trzema orbitalami p
• struktura tetraedryczna
•
METAN (CH
4
)
hybrydyzacja sp
3
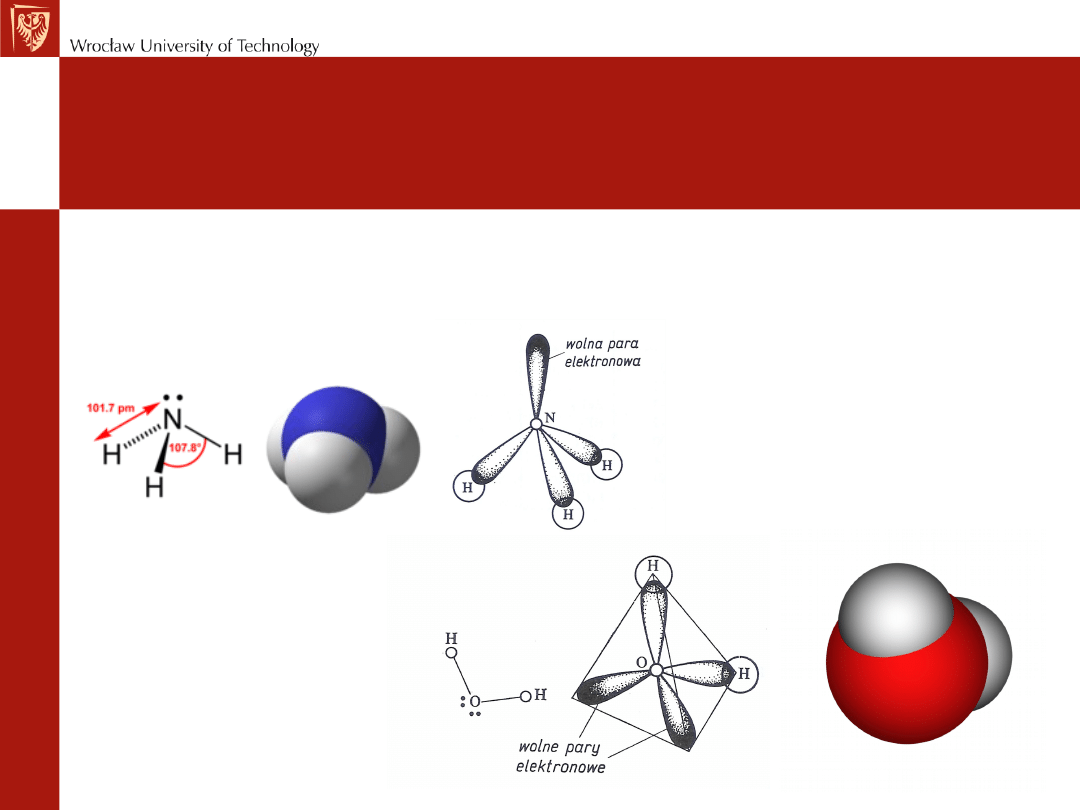
(II)
Niektóre naroża tetraedru mogą zajmować
wolne pary elektronowe (NH
3,
H
2
O).

hybrydyzacja sp
2
• wymieszanie się orbitalu s z dwoma
orbitalami p
• struktura płaska, trygonalna
•
ETEN
(C
2
H
4
)

hybrydyzacja sp
• wymieszanie się orbitalu s z
orbitalem p
• struktura liniowa
•
ETYN (acetylen, C
2
H
2
)
Inne hybrydyzacje
hybrydyzac
ja
konfiguracja
przykład
dsp
2
płaska kwadratowa
PtCl
4
2-
dsp
3
bipiramida
trygonalna
PCl
5
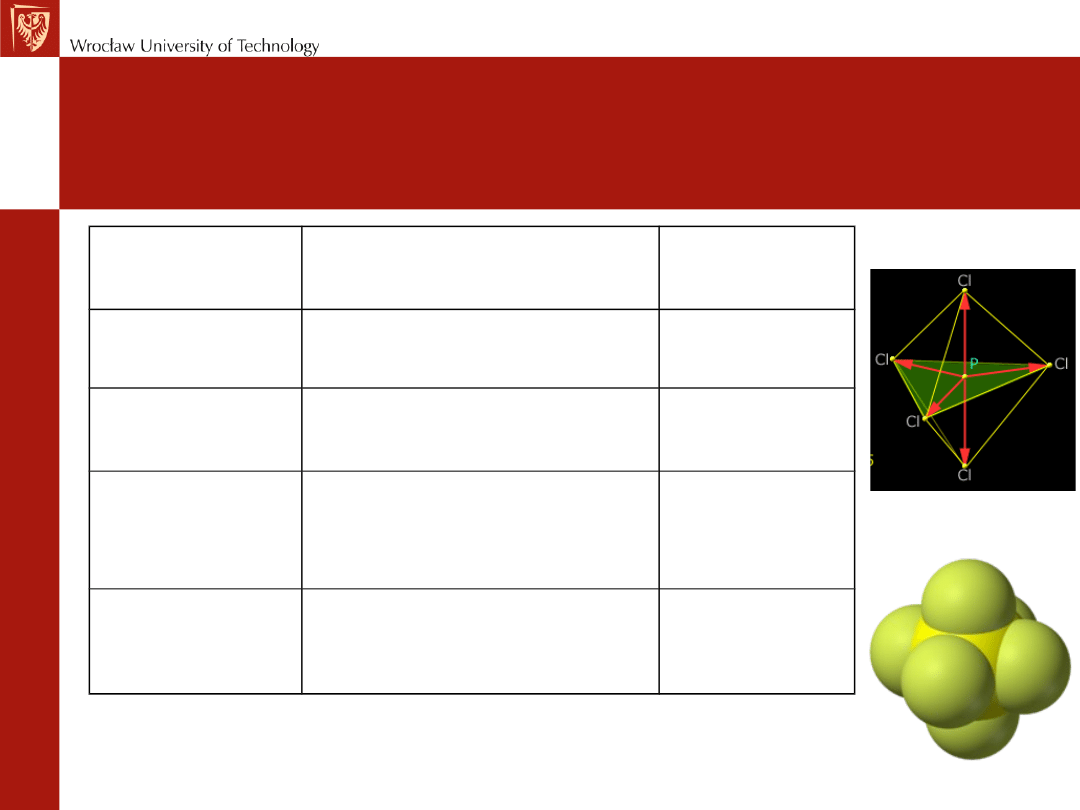
d
2
sp
3
oktaedryczna
SF
6
d
3
sp
3
bipiramida
pentagonalna
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
Wyszukiwarka
Podobne podstrony:
Wyklad 2 Zaoczni
PrawoUpadłościoweINaprawcze Wykład zaoczne całość 2012
pp program wykladu zaoczne 03, wisisz, wydzial informatyki, studia zaoczne inzynierskie, podstawy pr
Wyklad 6 Zaoczni
wykład 3 zaoczne
Wyklad 4 5 Zaoczni
wyklady 1-3 zaoczne, Administracja UŁ, Administracja I rok, Zasady tworzenia i stosowania prawa
wyklad 6 zaoczne, Administracja UŁ, Administracja I rok, Zasady tworzenia i stosowania prawa
wyklady 4-5 zaoczne, Administracja UŁ, Administracja I rok, Zasady tworzenia i stosowania prawa
wyklady 7-8 zaoczne, Administracja UŁ, Administracja I rok, Zasady tworzenia i stosowania prawa
wyklad 9 zaoczne, Administracja UŁ, Administracja I rok, Zasady tworzenia i stosowania prawa
Ekonomia społeczna Wyklady zaoczne
controlling wyklad zaoczne
kryminologia wykladydadak zaoczni
Wyklad 4 5 Zaoczni
więcej podobnych podstron