
1
Wykład 4
Wzór barometryczny
Prawo Boltzmanna
Rozkład prędkości cząsteczek gazu
doskonałego
Równowaga termiczna w gazach i
wymiana energii pomiędzy gazami w
ramach teorii kinetycznej gazów
Średnia energia kinetyczna ŚM
cząsteczki
Średnia energia kinetyczna ruchu
wewnętrznego cząsteczki
Zasada ekwipartycji energii
Energia wewnętrzna gazu doskonałego
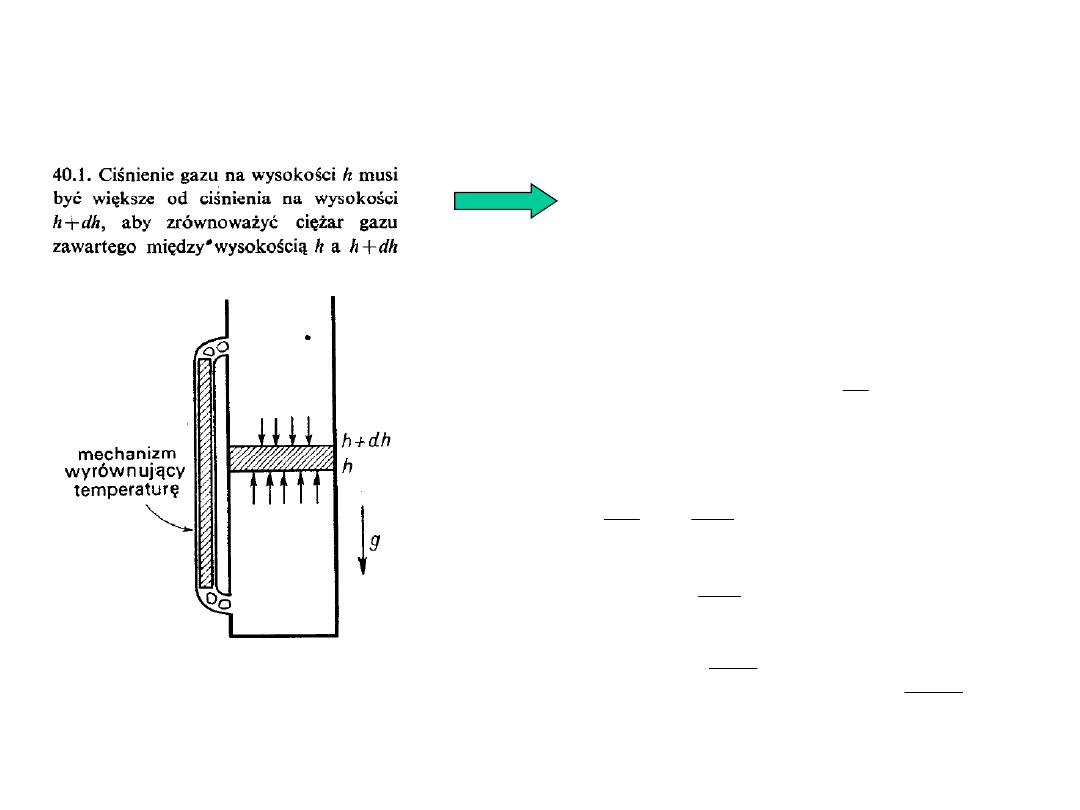
2
dh
n
mg
p
p
dh
h
h
Wzór barometryczny
Rozkład przestrzenny cząsteczek gazu doskonałego w
polu grawitacyjnym
Copyright © 1963, California Institute of
Technology, Polish translation by
permission of Addison-Wesley Publishing
Company, Inc., Reading, Mass, USA
mgndh
p
p
h
dh
h
kT
mgh
exp
n
e
e
n
C
h
kT
mg
n
ln
dh
kT
mg
n
dn
kTdn
dp
0
kT
mgh
C
nkT
kT
V
N
p
;
NkT
pV
mgndh
dp
3
kT
mgh
exp
n
n
0
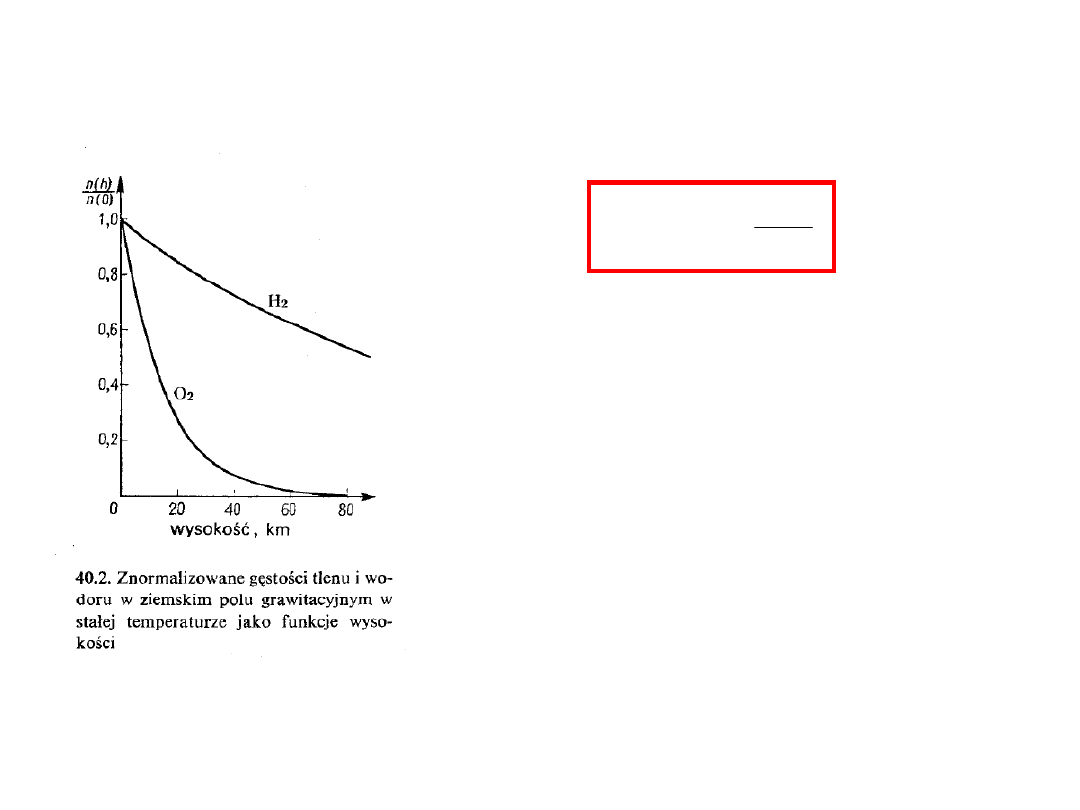
Rozkład przestrzenny cząsteczek
gazu doskonałego w ziemskim
polu grawitacyjnym, dla stałej
temperatury, jest różny dla gazów
tworzących atmosferę i
różniących się masą
cząsteczkową. Koncentracje
lekkich gazów, takich jak wodór,
maleją wolniej z wysokością niż
dla gazów cięższych, takich jak
tlen.
Wzór barometryczny
Rozkład przestrzenny cząsteczek gazu doskonałego w
polu grawitacyjnym
Copyright © 1963, California Institute of
Technology, Polish translation by
permission of Addison-Wesley Publishing
Company, Inc., Reading, Mass, USA
4
Prawo Boltzmanna
kT
mgh
exp
n
n
0
Wzór
barometryczny:
Można traktować jako
szczególny przypadek
wzoru:
kT
E
exp
n
p
gdzie E
p
to energia potencjalna cząsteczki w polu
dowolnej siły potencjalnej działającej na każdą
cząsteczkę. Aby to udowodnić, zauważamy, że:
kTdn
dp
Fndx
siła działająca na element objętości gazu
musi być równoważona przez zmianę
ciśnienia
Praca Fdx jest także zmianą energii potencjalnej
cząsteczki dE
p
ze znakiem minus. Znak wynika stąd, że
jeśli siła pracuje to energia potencjalna musi maleć, jeśli
pracę wykonujemy przeciw sile to zwiększamy energię
potencjalną cząsteczki. Mamy zatem:
kT
E
-
exp
n
;
C
kT
E
n
ln
;
kT
dE
-
n
dn
;
n
dn
kT
dE
p
p
p
p
prawo
Boltzman
na
5
Rozkład prędkości cząsteczek gazu
doskonałego
kT
mgh
exp
n
n
0
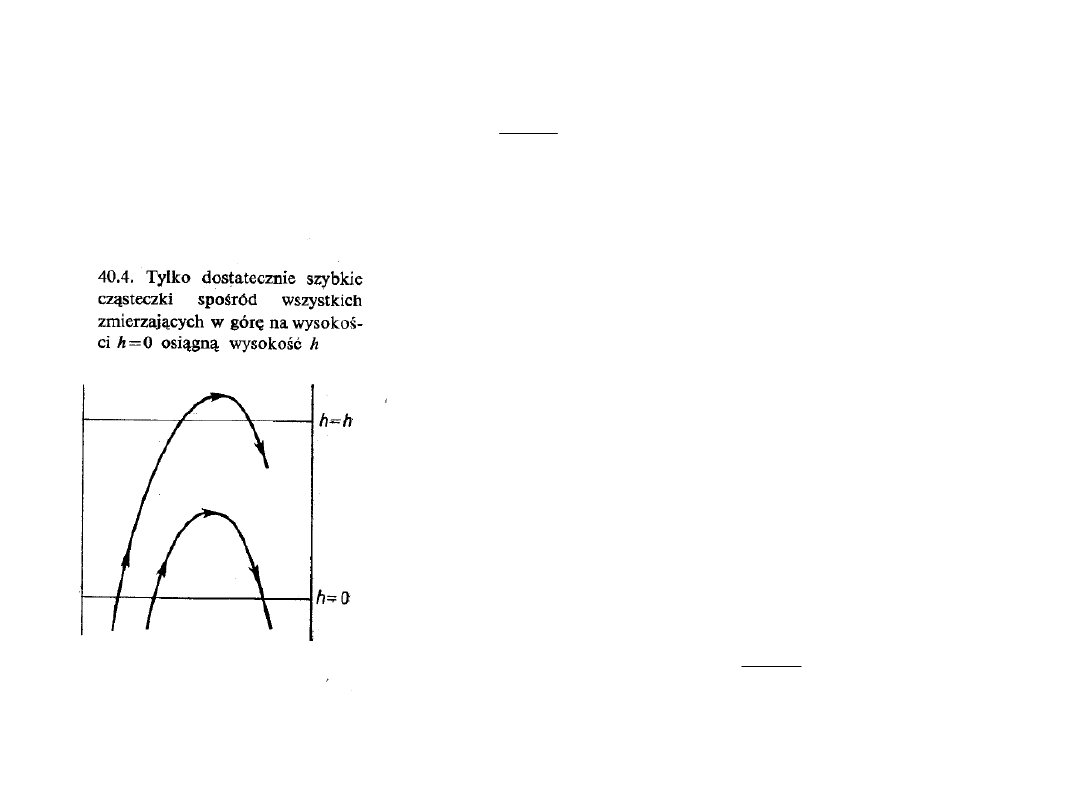
Wzór barometryczny: mówi, że na
wysokości h jest w
jednostce objętości mniej cząsteczek niż na wysokości 0.
Wynika to stąd, że podczas
gdy wszystkie cząsteczki
znajdujące się na wysokości
h i poruszające się w dół
dotrą do celu (wysokość 0),
to ze wszystkich cząsteczek
znajdujących się na
wysokości 0 i poruszających
się do góry dotrzeć do celu
(wysokość h) mogą tylko te o
odpowiednio dużej szybkości
v
z
, większej od szybkości u,
określonej jak niżej:
mgh
2
mu
;
u
v
2
z
Copyright © 1963, California Institute of
Technology, Polish translation by
permission of Addison-Wesley Publishing
Company, Inc., Reading, Mass, USA
6
liczba cząsteczek przebiegających płaszczyznę h = 0 z
szybkością v
z
> u =
= liczbie cząsteczek przebiegających płaszczyznę h = h z
szybkością v
z
> 0
Skorzystamy z faktu, że:
oraz, że:
liczba cząsteczek przebiegających płaszczyznę h = 0 z
szybkością v
z
> 0 musi być
większa niż liczba cząsteczek przebiegających płaszczyznę h =
h z szybkością v
z
> 0
zgodnie ze wzorem
barometrycznym. Czyli:
kT
mgh
0
0
0
u
e
0
n
h
n
0
n
0
n
2
mu
mgh
2
Uwzględniając,
że:
otrzymujemy:
kT
2
mu
exp
0
n
0
n
2
0
u
kT
kinetyczna
energia
exp
n
u
7
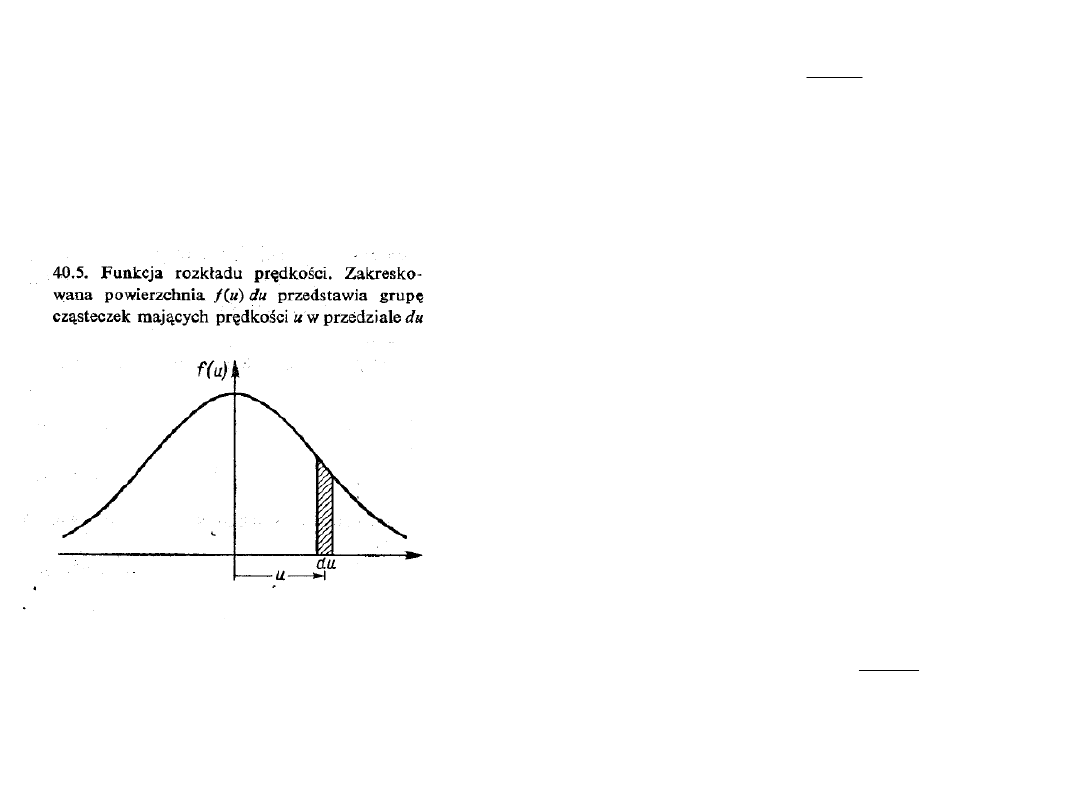
Rozkład prędkości cząsteczek w postaci:
jest niepraktyczny. Chcemy znać funkcję rozkładu f(u) taką by
móc powiedzieć jaka część f(u)du wszystkich cząsteczek ma
prędkości zawarte pomiędzy u i u + du tak jak pokazano na
rysunku. Funkcja f(u) powinna być unormowana tak, by:
kT
2
mu
exp
C
n
2
u
Copyright © 1963, California Institute of
Technology, Polish translation by
permission of Addison-Wesley Publishing
Company, Inc., Reading, Mass, USA
1
du
u
f
Aby znaleźć funkcję f(u) pytamy, jak
obliczyć przy pomocy tej funkcji
liczbę cząsteczek przebiegających
przez pewną powierzchnię w ciągu
sekundy. W czasie t przez
powierzchnię tę przebiegają
cząsteczki zawarte w objętości
wyznaczonej przez tę powierzchnię i
wysokość ut, czyli:
kT
2
mu
exp
C
du
u
f
u
n
2
u
u
8
Różniczkując otrzymane wyrażenie
otrzymamy:
kT
2
mu
exp
C
du
u
f
u
n
2
u
u
kT
2
mu
exp
C
u
f
kT
2
mu
exp
u
C
u
f
u
2
2
Dla obliczenia stałej C obliczamy
całkę:
kT
2
m
C
m
kT
2
C
dx
e
m
kT
2
C
du
kT
2
mu
exp
C
1
du
u
f
2
x
2
kT
2
mu
exp
kT
2
m
u
f
2
0
0
t
0
r
2
0 0
r
y
x
y
x
2
x
e
e
dt
e
rdr
2
e
dr
rd
e
dxdy
e
dy
e
dx
e
I
.
dx
e
I
2
2
2
2
2
2
2

9
Otrzymany rozkład prędkości, zapisany w dwóch alternatywnych
postaciach:
Rozkład trójwymiarowy będzie zawierał rozkłady
jednowymiarowe:
RT
2
Mu
exp
RT
2
M
kT
2
mu
exp
kT
2
m
u
f
2
2
jest rozkładem jednowymiarowym.
W zapisie alternatywnym wykorzystano równość kN
A
= R, M =
mN
A
, gdzie N
A
to liczba Avogadry, m to masa jednej cząsteczki, a
M to masa jednego mola.
R to stała gazowa, a k to stała Boltzmanna
z
y
x
2
z
2
y
2
x
2
3
z
y
x
z
y
x
dv
dv
dv
RT
2
v
v
v
M
exp
RT
2
M
dv
dv
dv
v
,
v
,
v
f
A przejście do rozkładu wartości prędkości v niezależnie od
kierunku wymaga podstawienia (po zamianie zmiennych i
częściowym scałkowaniu, po kątach):
dv
v
4
dv
dv
dv
2
z
y
x
http://hyperphysics.phy-
astr.gsu.edu/HBASE/kinetic/maxspe.html#c4
10
Otrzymujemy wynik, znany jako rozkład Maxwella prędkości
cząsteczek gazu:
dv
RT
2
Mv
exp
v
RT
2
M
4
dv
v
P
2
2
2
3
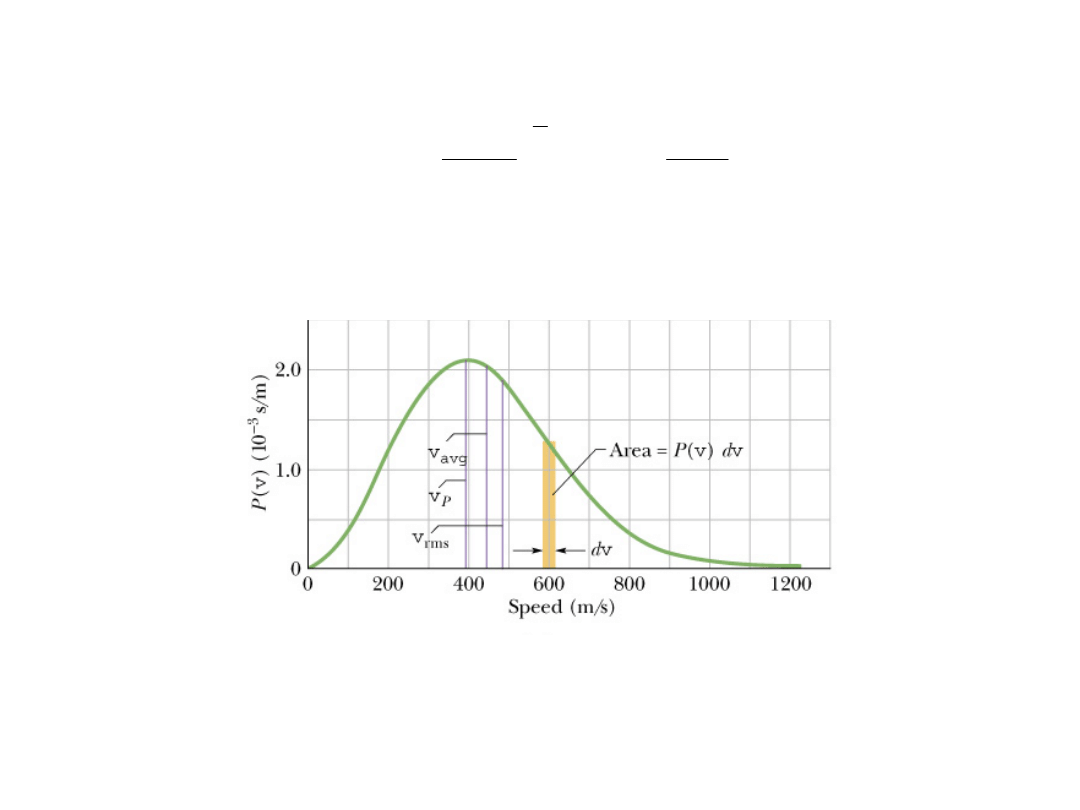
Prędkości te przyjmują wartości z zakresu do 0 do
Rozkład Maxwella prędkości cząsteczek tlenu w temperaturze
300 K. Pole pod krzywą jest równe jedności. Pokazano trzy
prędkości charakterystyczne, w tym v
rms
, prędkość średnią
kwadratową, wprowadzoną wcześniej
Copyright 2005 John Wiley and Sons, Inc
11
Copyright 2005 John Wiley and Sons, Inc
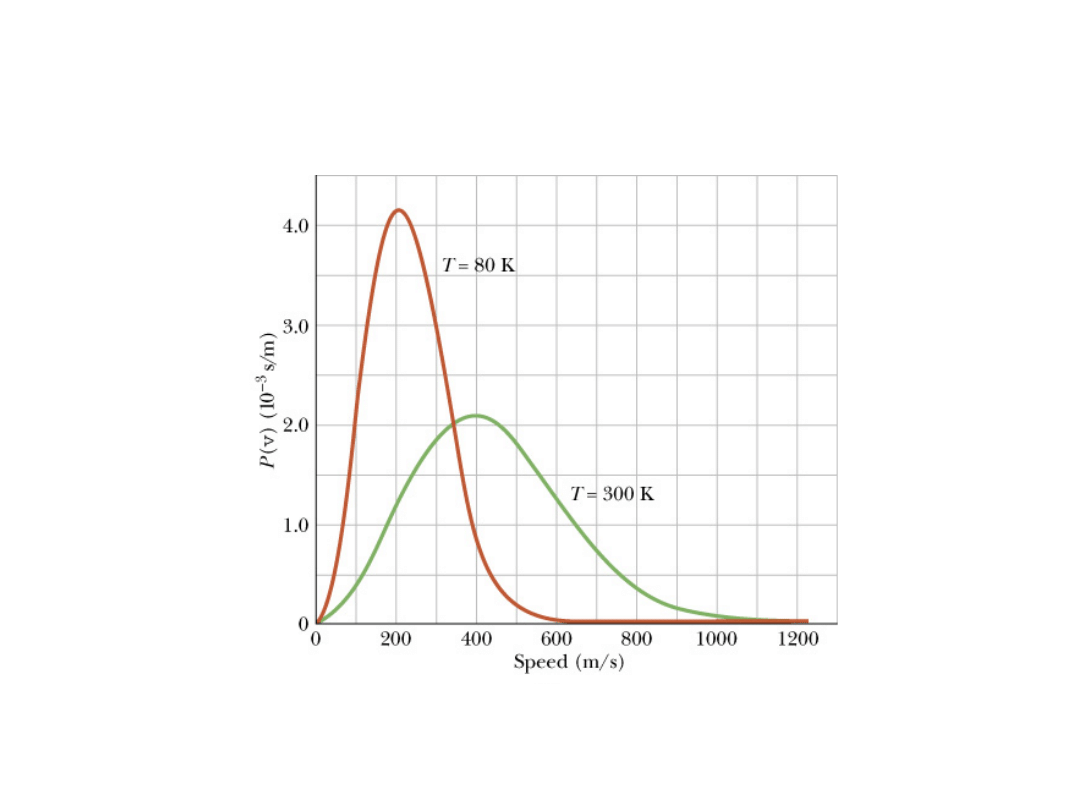
Rozkład Maxwella prędkości cząsteczek tlenu dla temperatury
300 i 80 K.
Pole pod każdą krzywą jest równe jedności.
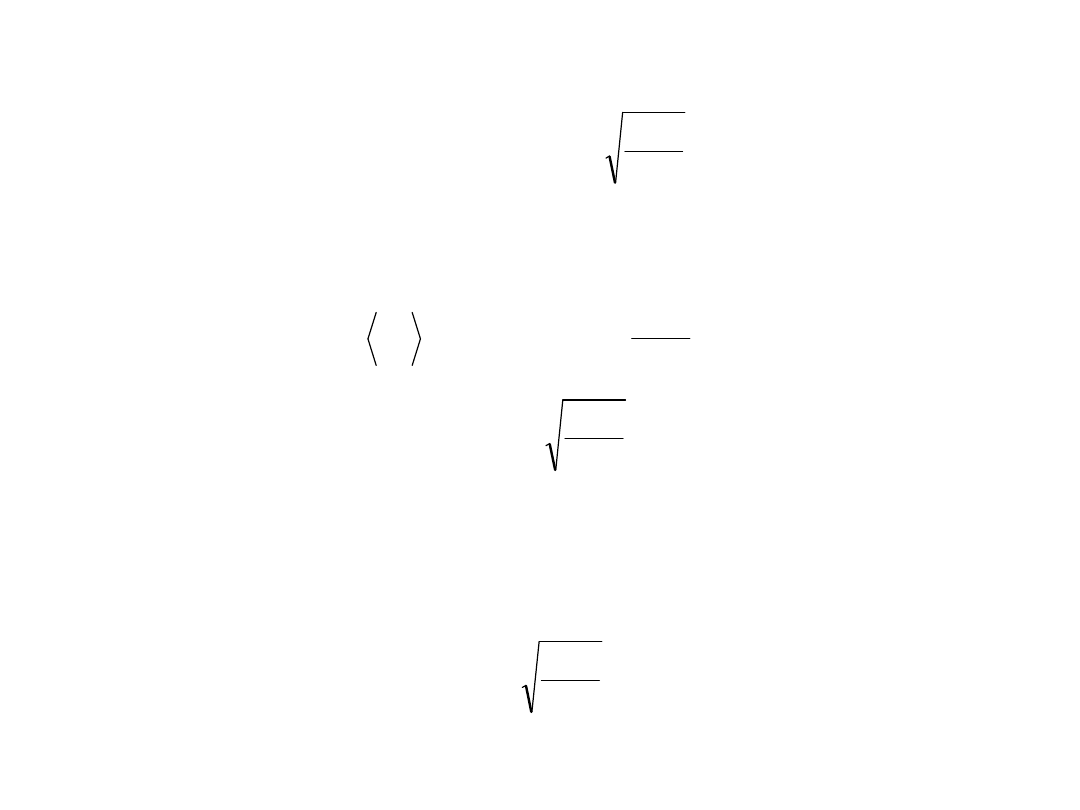
12
Prędkość średnia:
M
RT
8
dv
v
vP
v
0
śr
Prędkość średnia kwadratowa:
M
RT
3
v
M
RT
3
dv
v
P
v
v
.
kw
.
śr
0
2
2
Prędkość najbardziej prawdopodobna to ta, dla
której funkcja P(v) osiąga maksimum:
M
RT
2
v
P

13
Zadanie
Zbiornik wypełniony tlenem znajduje się w temperaturze
pokojowej (300 K). Jaka część wszystkich cząsteczek tlenu ma
prędkości z przedziału od 599 do 601 m/s? Masa molowa tlenu jest
równa 0,032 kg/mol.
Odp. 2,62
.
10
-3
Zadanie
Masa molowa tlenu wynosi M = 0,032 kg/mol.
a) Ile wynosi prędkość średnia cząsteczek tlenu w temperaturze
T = 300 K?
Odp. 445 m/s
b) Jaką wartość ma prędkość średnia kwadratowa v
śr.kw.
W
temperaturze 300 K?
Odp. 483 m/s
c) Ile wynosi prędkość najbardziej prawdopodobna w
temperaturze T = 300 K?
Odp. 395 m/s
14
Copyright © 1963, California Institute of
Technology, Polish translation by
permission of Addison-Wesley Publishing
Company, Inc., Reading, Mass, USA
2
mv
V
N
3
2
p
;
A
F
p
2
.
kw
.
śr
kT
2
3
2
mv
2
mv
N
3
2
NkT
nRT
2
.
kw
.
śr
2
.
kw
.
śr
Równowaga termiczna w gazach i wymiana
energii pomiędzy gazami w ramach teorii
kinetycznej gazów
Kluczowa rola zderzeń pomiędzy cząsteczkami
Na każdy z trzech stopni swobody ruchu ŚM pojedynczej
cząsteczki
gazu przypada energia:
kT
2
1
2
mv
2
mv
2
mv
2
.
kw
.
śr
,
z
2
.
kw
.
śr
,
y
2
.
kw
.
śr
,
x
Liczba cząsteczek dwóch różnych gazów zajmujących taką
samą objętość, w tej samej temperaturze i o tym samym
ciśnieniu, będzie taka sama
15
Zatem bezpośrednia wymiana energii poprzez zderzenia
pomiędzy cząsteczkami różnych gazów w mieszaninie
prowadzi do równości średnich energii kinetycznych
cząsteczek obu gazów. Ciśnienia cząstkowe wywierane
przez oba gazy będą różne i zależne od koncentracji
cząsteczek (N
i
/V) obu gazów.
2
v
m
V
N
3
2
p
2
.
kw
.
śr
,
2
2
2
2
;
2
v
m
V
N
3
2
A
F
p
;
p
p
p
2
.
kw
.
śr
,
1
1
1
1
1
2
1
W mieszaninie dwóch gazów ciśnienie jest sumą ciśnień
cząstkowych:
2
2
1
1
2
.
kw
.
śr
,
2
2
2
2
.
kw
.
śr
,
1
1
1
kT
N
kT
N
3
2
2
v
m
N
3
2
2
v
m
N
3
2
pV
Po wyrównaniu się
temperatur:
.
2
v
m
2
v
m
;
kT
2
3
2
v
m
;
kT
2
3
2
v
m
2
.
kw
.
śr
,
2
2
2
.
kw
.
śr
,
1
1
2
.
kw
.
śr
,
2
2
2
.
kw
.
śr
,
1
1
NkT
3
2
kT
N
N
3
2
pV
2
1
co
oznacza,
że:
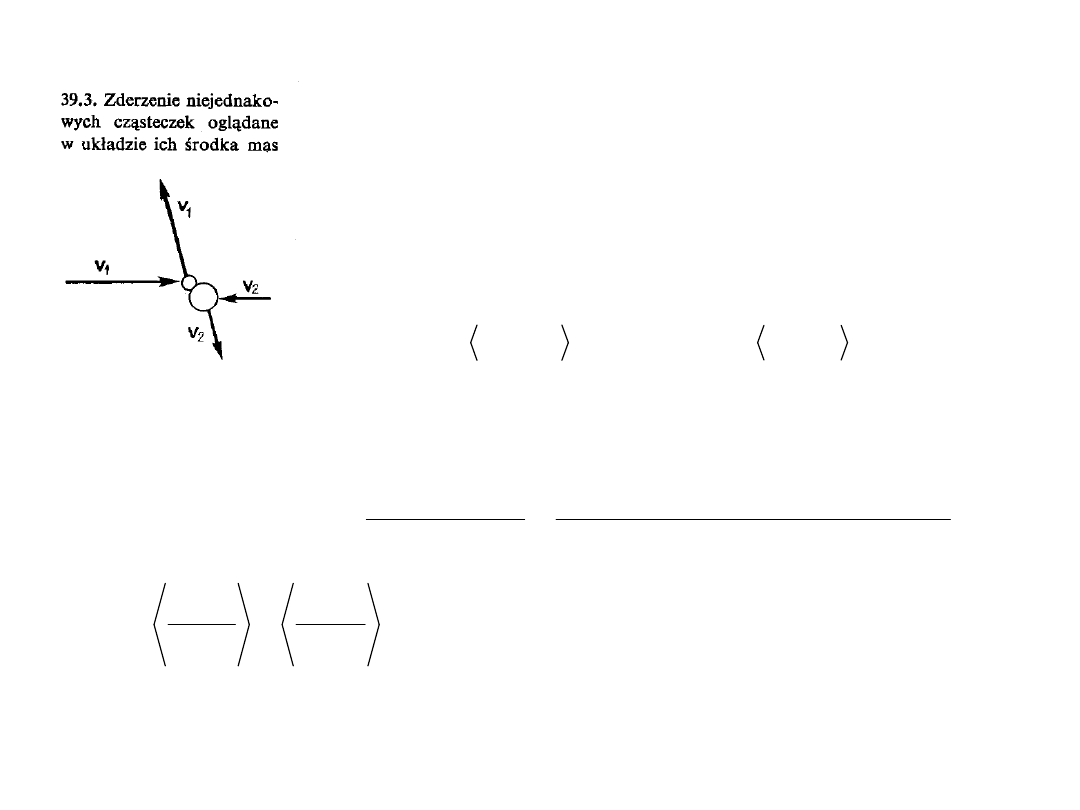
16
Copyright © 1963, California Institute of
Technology, Polish translation by
permission of Addison-Wesley Publishing
Company, Inc., Reading, Mass, USA
Zderzenia pomiędzy cząsteczkami w
układzie ŚM (środka masy) prowadzi
do całkowicie przypadkowego
rozkładu prędkości v
1
i v
2
(a więc
także ) dla którego żadny
kierunek nie jest wyróżniony, w tym
także kierunek ruchu układu ŚM, v
śm
.
Oznacza to, że:
.
0
v
v
;
0
v
w
2
1
śm
2
1
v
v
w
Wyrażając w i v
śm
przez v
1
i v
2
otrzymamy:
2
1
2
1
1
2
2
2
2
2
1
1
2
1
2
2
1
1
2
1
śm
m
m
v
v
m
m
v
m
v
m
m
m
v
m
v
m
v
v
v
w
a więc: ,
średnie energie kinetyczne
są równe.
2
v
m
2
v
m
2
2
2
2
1
1
Dla dwóch gazów w mieszaninie teoria kinetyczna
przewiduje, że:
Potwierdza to teorię kinetyczną i proponowany przez nią
zderzeniowy mechanizm wymiany energii
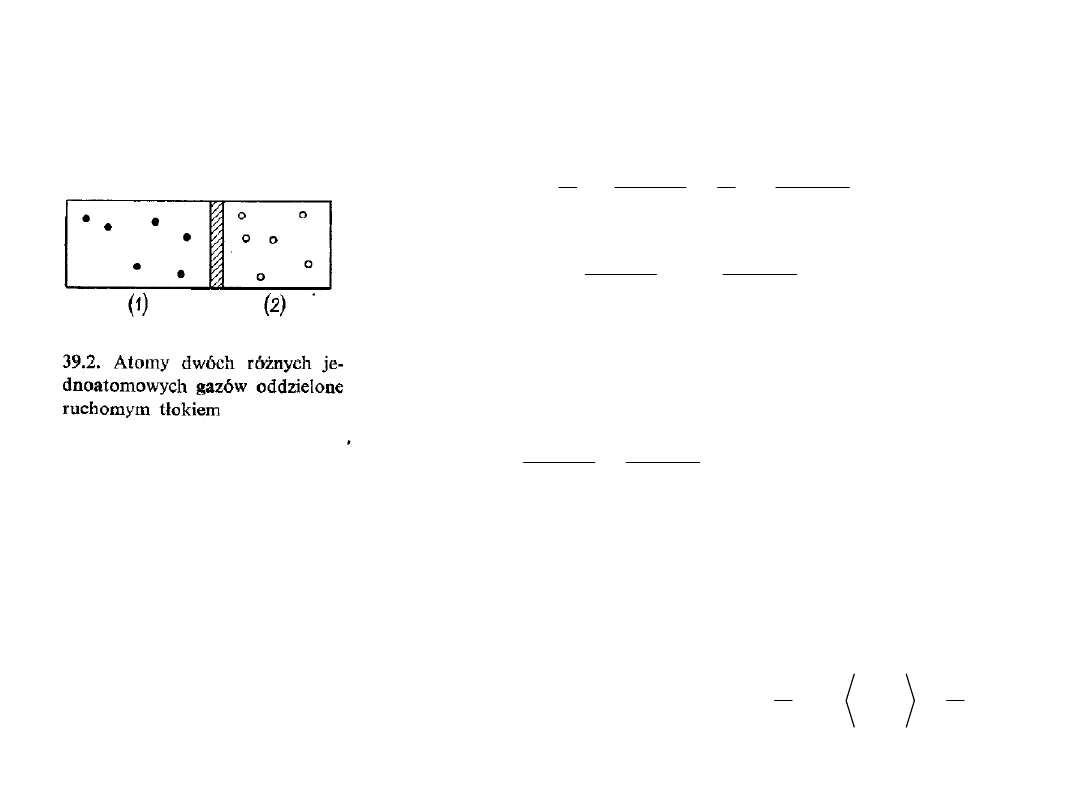
17
W warunkach równowagi mechanicznej ciśnienia z obu
stron tłoka muszą być jednakowe:
2
v
m
n
2
v
m
n
2
v
m
n
3
2
2
v
m
n
3
2
p
2
2
2
2
2
1
1
1
2
2
2
2
2
1
1
1
1
W warunkach równowagi
mechanicznej i termodynamicznej:
2
1
2
2
2
2
1
1
n
n
;
2
v
m
2
v
m
równe muszą być nie tylko ciśnienia, ale także średnie
energie kinetyczne (temperatura) oraz koncentracje
cząsteczek obu gazów. Wymiana energii pomiędzy gazami
za pośrednictwem tłoka prowadzi do równości ciśnień,
średnich energii kinetycznych i koncentracji cząsteczek
obu gazów
Dwa różne gazy oddzielone ruchomym tłokiem
Copyright © 1963, California Institute of
Technology, Polish translation by
permission of Addison-Wesley Publishing
Company, Inc., Reading, Mass, USA
Tłok jako ekstremalnie duża cząsteczka
trzeciego gazu
kT
2
1
v
M
2
1
2
T
T
18
Załóżmy, że w mieszaninie dwóch gazów jednoatomowych
każdy atom gazu A oddziałuje z jakimś atomem gazu B (są
związane w dwuatomową cząsteczkę AB). Przy
zderzeniach, które prowadzą do wymiany energii i do
ustalenia równowagi, ważne są tylko prędkości atomów, a
nie działające pomiędzy nimi siły.
M
v
m
v
m
m
m
v
m
v
m
v
B
B
A
A
B
A
B
B
A
A
śm
kT
2
3
2
v
m
2
v
m
2
B
B
2
A
A
Nadal mamy
zatem:
Ponieważ:
2
2
B
2
B
B
A
B
A
2
A
2
A
2
śm
M
v
m
v
v
m
m
2
v
m
v
Zatem:
kT
2
3
M
kT
m
2
3
v
v
m
m
kT
2
3
m
v
M
2
1
B
B
A
B
A
A
2
śm
co oznacza, że:
gdyż jak
poprzednio.
0
v
v
B
A
(3/2)kT dla
ŚM
cząsteczki i
(3/2)kT dla
atomu
Średnia energia kinetyczna ŚM cząsteczki
19
Z jednej strony mamy
zatem:
kT
3
kT
2
3
kT
2
3
E
calk
,
kin
kT
2
3
2
v
m
2
v
m
2
B
B
2
A
A
co oznacza, że całkowita średnia energia kinetyczna
cząsteczki
dwuatomowej jest równa:
kT
2
3
E
śm
,
kin
z drugiej zaś wiemy, że średnia energia kinetyczna
związana z ruchem
środka masy ŚM wynosi:
Oznacza to, że brakująca energia równa na
cząsteczkę jest
średnią energią kinetyczną ruchu wewnętrznego
cząsteczki dwuatomowej.
kT
2
3
Średnia energia kinetyczna ruchu wewnętrznego
cząsteczki
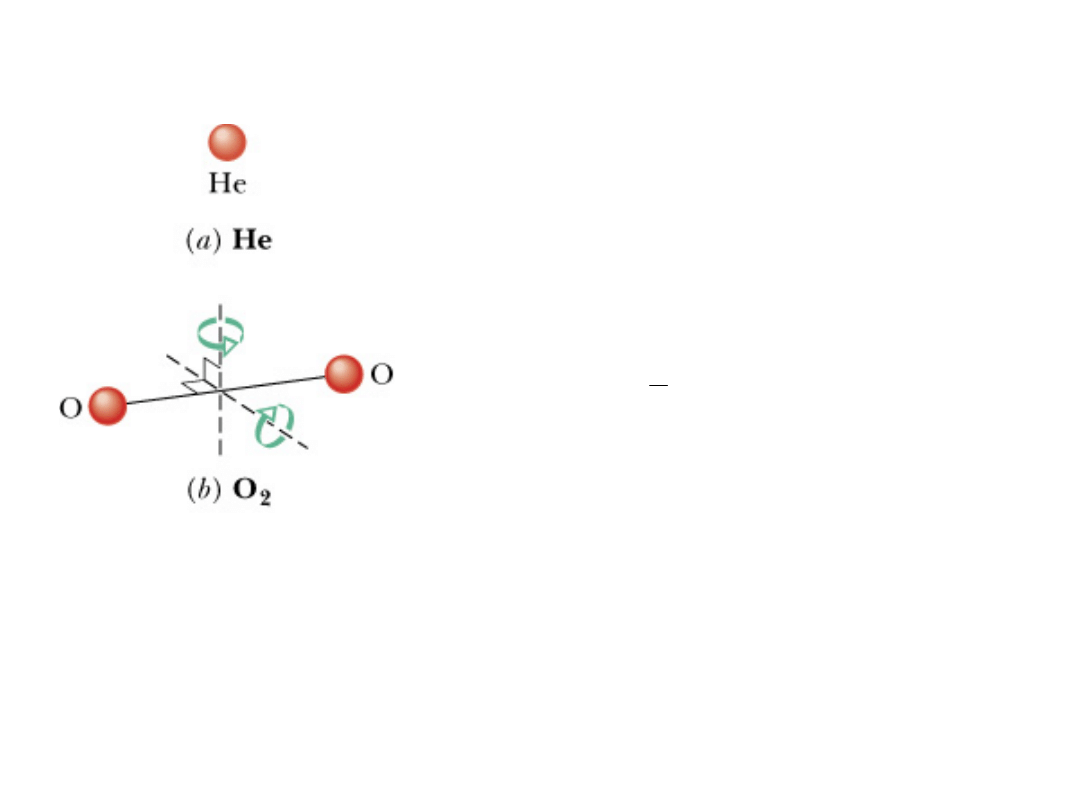
20
Energię ruchu wewnętrznego
cząsteczki dwuatomowej można
wyrazić jako energię ruchu
obrotowego (dwie osie obrotu) i
energię kinetyczną oscylacji wzdłuż
wiązania pomiędzy atomami.
Na każdy stopień swobody przypada
wtedy energia: .
Pojedynczy atom nie ma energii
kinetycznej ruchu obrotowego, a
cząsteczka dwuatomowa nie ma
trzeciej osi obrotu.
kT
2
1
Dla cząsteczki zbudowanej z r atomów liczba stopni
swobody wynosi 3r, po trzy na atom. Całkowita energia
kinetyczna wyniesie wobec tego (3/2)rkT, z tego energia
kinetyczna ruchu ŚM (ruchu postępowego) to (3/2)kT, a
energia kinetyczna przypadająca na pozostałe stopnie
swobody (obroty i oscylacje, bez energii potencjalnej)
wyniesie (3/2)(r-1)kT.
Zasada ekwipartycji energii
zasada
ekwipartycji
energii
Copyright 2005 John Wiley and Sons, Inc
21
Zgodnie z zasadą ekwipartycji energia wewnętrzna gazu
jednoatomowego wyniesie:
Energia wewnętrzna gazu
kT
2
3
N
2
mv
N
U
2
.
kw
.
śr
Dla gazu złożonego z większych cząsteczek, oprócz energii
kinetycznej ruchu postępowego (ruchu środka masy)
musimy uwzględnić energię kinetyczną związaną z
obrotami i oscylacjami. Z oscylacjami związana też jest
energia potencjalna. Średnie wartości energii kinetycznej
i potencjalnej są równe.
Dla oscylatora harmonicznego mamy:
2
0
2
pot
2
2
0
2
2
pot
2
0
2
kin
2
2
0
2
2
kin
x
m
4
1
E
;
t
cos
x
m
2
1
2
kx
E
x
m
4
1
E
;
t
sin
x
m
2
1
2
mv
E
pot
kin
E
E
Energia wewnętrzna U gazu doskonałego zależy tylko od
temperatury gazu i nie zależy od żadnej innej wielkości
opisującej jego stan.
2
1
x
sin
x
cos
2
2
m
k
;
t
sin
x
v
;
t
cos
x
x
0
0
22
kT
2
5
N
kT
2
1
2
kT
2
1
3
N
U
Energia wewnętrzna gazu dwuatomowego bez oscylacji
wyniesie:
NkT
3
kT
2
6
N
kT
2
1
3
kT
2
1
3
N
U
A dla większych cząsteczek, dla których liczba atomów
wynosi r > 3, bez oscylacji (6 stopni swobody, 3 dla ŚM i 3
obroty):
Uwzględnienie oscylacji zwiększa U o (3r-6)kT.
Udział lub brak udziału oscylacji w energii wewnętrznej,
jest efektem kwantowym, do którego wrócimy później.
kT
2
7
N
kT
2
1
1
kT
2
1
1
kT
2
1
2
kT
2
1
3
N
U
Całkowita energia wewnętrzna gazu
dwuatomowego wyniesie:
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
Wyszukiwarka
Podobne podstrony:
Wykłady i wzór projektu, Zarządzanie projektami wprowadzenie
w5 wzor reakcja chemiczna ilościowo
oferta wzor
2012 poz wzor umowy
Indywidualny program edukacyjno terapeutyczny (wzór)
wzór zwolnienia praca, STRAŻ, Druki
uposażeni polisa 28 - oświadczenie wzór, Ratownictwo medyczne, Ratownictwo
Wzór rezygnacji z usługi NEOSTRADA z TELEWIZJĄ w T.P, Wzory
umowa agencyjna wzor, Dokumenty, różne pisma, Wzory pism
karta przekazania odpadu WZÓR, Ochrona środowiska, ekologia przemyslowa, GR 7 c, Filtry olejowe 16
Konspekt gimnastyki - gibkość - wzór, Fizjoterapia, MNR
wzor zaswiadczenia lekarskiego - obszar C Pegaz 2003, DOKUMENTY WNIOSKI PFRON
wzor opinii do ppp, referaty i materiały
praca dyplomowa 1 strona wzor, Szkoła, prywatne, Podstawy informatyki
KONTRAKT wzór, awans zawodowy - stażysta
wzor profesjonalne CV, Zarządzanie - Zarządzanie Zasobami Ludzkimi WSB Chorzów, Semestr Sesja 4, Wpr
Wzor skierowania na bad profilaktyczne
Wzór Sprawozdanie sem 4 (3)
więcej podobnych podstron