Białko
Aminokwas
y
Turnover:
P
R
O
T
E
O
L
I
Z
A
S
Y
N
T
E
Z
A

Proteoliza wewnątrzkomórkowa
Funkcje proteolizy wewnątrzkomórkowej:
• powiązanie metabolizmu białek z
metabolizmem energetycznym
• zapewnienie odpowiedniej jakości białek w
komórce przez usuwanie białek o
nieprawidłowej strukturze
• dopasowanie metabolizmu do aktualnych
potrzeb przez rozkładanie enzymów i innych
czynników regulujących
• regulacja wydzielania hormonów

Okresy półtrwania wybranych
enzymów
Enzym
t
1/2
(dni)
Dh mleczanowa
6.0
Aldolaza
4.9
Dh glukozo-6-fosforanu
1
Glukokinaza
1
Karboksykinaza
fosfoeneolopirogronianow
a
0.3
Kinaza tymidynowa
0.1

Dekarboksylaza
ornitynowa
0.008
Polimeraza RNA I
0.05
Aminotransferaza
tyrozynowa
0.06
Oksygenaza
tryptofanu
0.08
Karboksylaza acetylo-
CoA
2
Dh aldehydu
fosfoglicerynowego
3.4
Arginaza
4.5

Zmiany wiekowe okresu półtrwania
różnych białek w ludzkich
fibroblastach (godziny)
Białko
Organizm
młody
Organizm stary
aminotransferaza
asparaginianowa
55
90
lizozym
28
80
aldolaza
175
520
rybonukleaza
88
120

Główne systemy proteolityczne w
komórce
• Lizosomalny
• Zależny od jonów wapniowych
• Zależny od ubikwityny i ATP
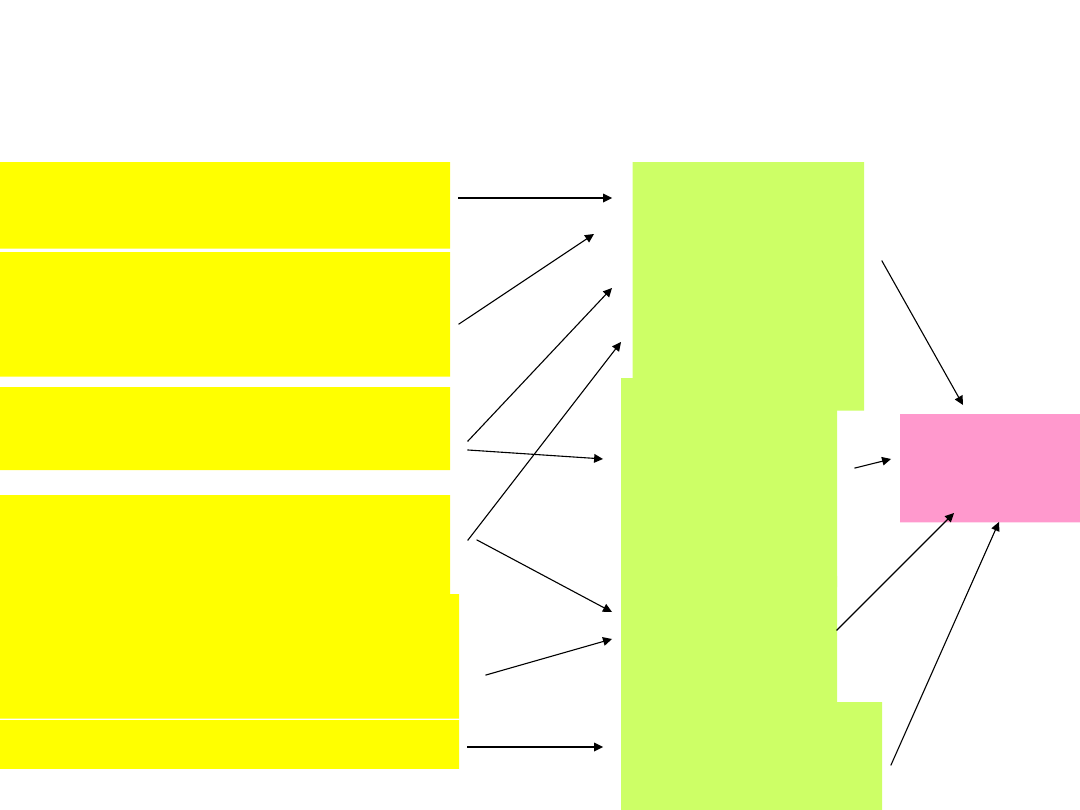
Turnover białka - klasy białek i mechanizmy
Rola komórkowych systemów proteolitycznych
Białka zmutowane lub
uszkodzone
Krótko żyjące białka -
regulatorowe, enzymy
kluczowe
Długo żyjące normalne
białka (np. kurczliwe)
Białka błonowe
(receptory, kanały,
transportery)
B
iałka po endocytozie -
białka osoczowe,
hormony, lipoproteiny
Białka mitochondrialne
Proteasom
y -zależne
od
ubikwityny
i ATP,
cytosolowe
Kalpainy,
zależne od
Ca,
cytosolow
e
Katepsyny
,
lizosomal
ne
Proteazy
mitochondri
alne
Wolne
aminokwa
sy

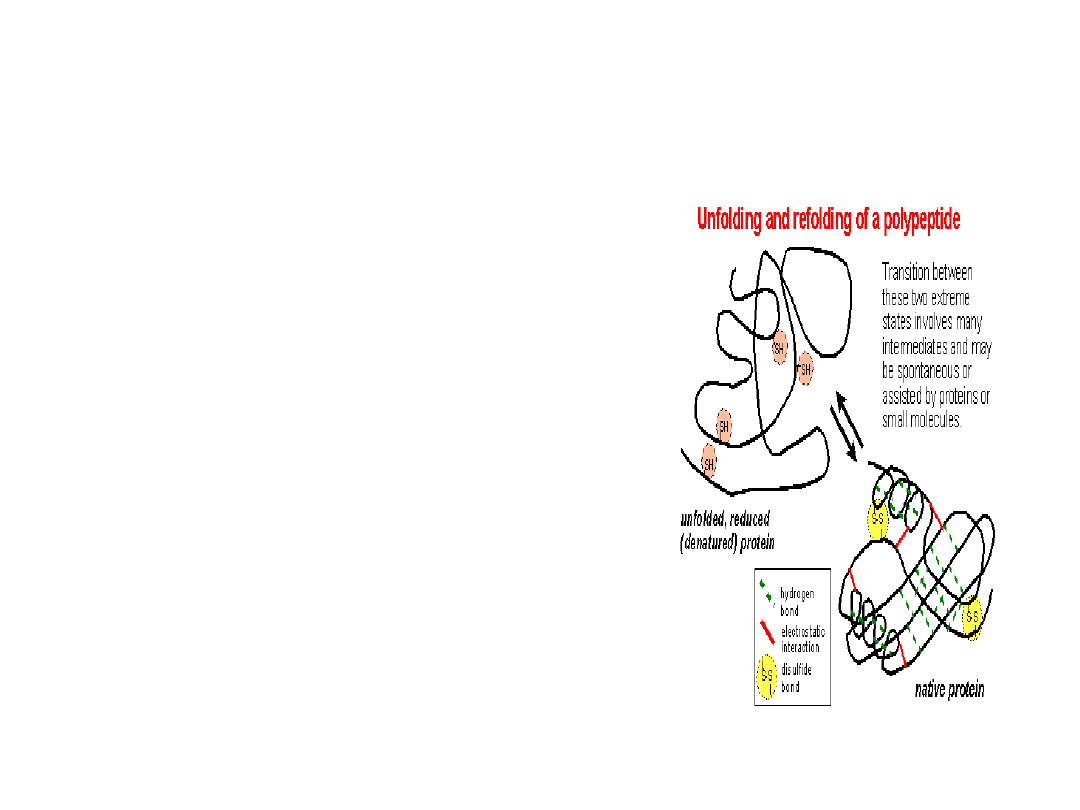
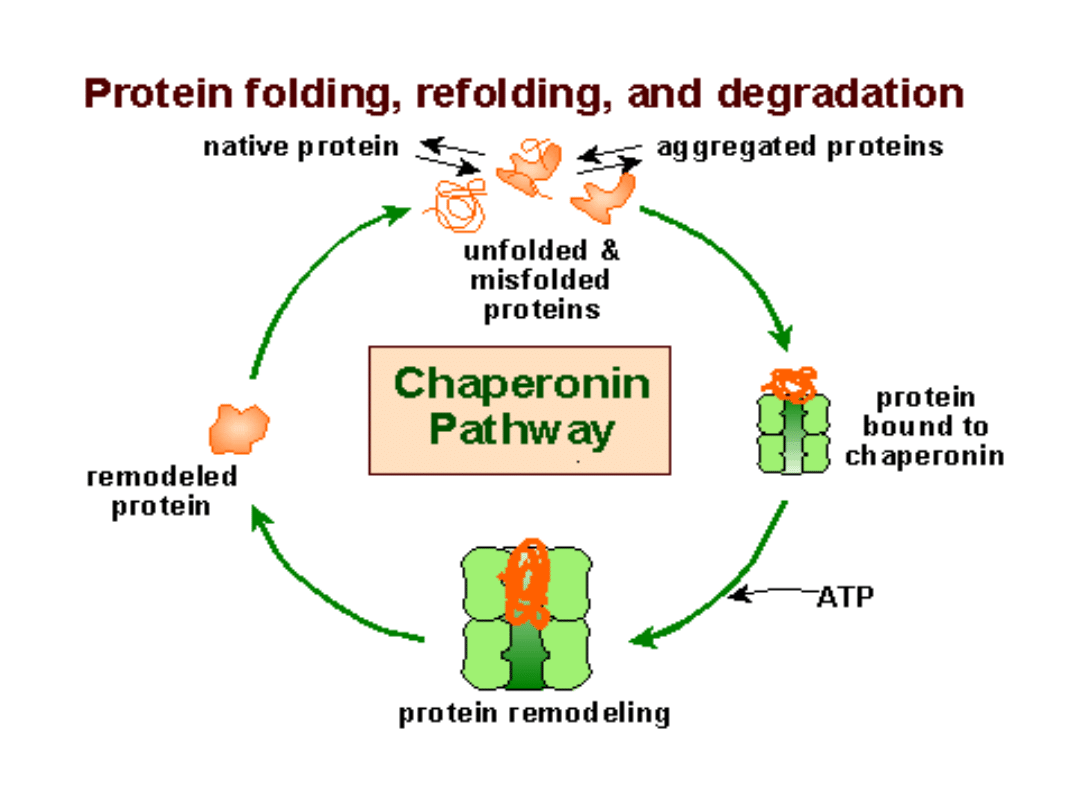
Ukierunkowywanie przemian białka
molekularne chaperony
(białka
opiekuńcze)
wiążąc się z innymi białkami kierują
je do odpowiedniej przemiany, jak:
pofałdowanie łańcucha,
oligomeryzacja, transport do innego
przedziału komórkowego lub
degradacja
• Chaperony korzystają z
energii ATP - są ATP-
azami.
• Chaperony pomagają przy
fałdowaniu poprzez
blokowanie
niedozwolonych interakcji
między cząsteczkami.
• Kompleks ATP-chaperon
ma powinowactwo do
peptydów
niesfałdowanych, a nie
ma do białek natywnych.

• Chaperony przeciwdziałają agregacji białek
charakterystycznej dla takich schorzeń jak
choroba Alzheimera, Creutzfelda-Jacoba
• Naprawianie cząsteczki białka przez chaperony
może polegać na ułatwianiu „odfałdowania” w celu
możliwości nowego, prawidłowego pofałdowania.
• Niektóre chaperony działają jak enzymy
zwiększające tempo fałdowania cząsteczki białka –
peptydylo-prolylo-izomerazy, izomerazy białkowych
mostków dwusiarczkowych
.
Do rodziny chaperonów należą białka
szoku cieplnego (Hsp)
Indukowane w odpowiedzi na:
stres termiczny
stres oksydacyjny
zatrucie metalami ciężkimi
zatrucie alkoholem
inhibitory przemian energetycznych
zapalenie

• Białka szoku termicznego zwiększają
szansę przeżycia komórki w warunkach
szoku przez dezagregację białek
wrażliwych na stres i doprowadzanie do
proteolizy białek uszkodzonych.
• W warunkach nie-stresowych biorą
udział w regulacji podstawowych
życiowych funkcji komórki
(housekeeping): oprócz fałdowania i
translokacji białek, aktywują białka
regulatorowe - np. czynniki
transkrypcyjne, kinazy.

• Hsp70 (70 kDa)
- rodzina białek
kodowanych u człowieka przez 11 różnych
genów w kilku różnych chromosomach,
stanowi 1-2% białek w komórce.
• Indukcja ekspresji genów Hsp70 pod
wpływem czynnika transkrypcyjnego -
czynnika szoku cieplnego - HSF
oraz
różnych komórkowych procesów - cyklu
komórkowego. proliferacji i różnicowania.
• Nadekspresja Hsp70 obserwowana w
neuronach i miocytach mutantów
Cyanorhabdis elegans o wydłużonym
okresie życia.

• Wpływając na białka związane z
podziałami komórki Hsp70 mogą mieć
stymulujący wpływ na proces
transformacji nowotworowej i proliferacji
nowotworu - wysoki poziom ekspresji w
niektórych nowotworach (np. rak piersi)
związany z niekorzystną prognozą.
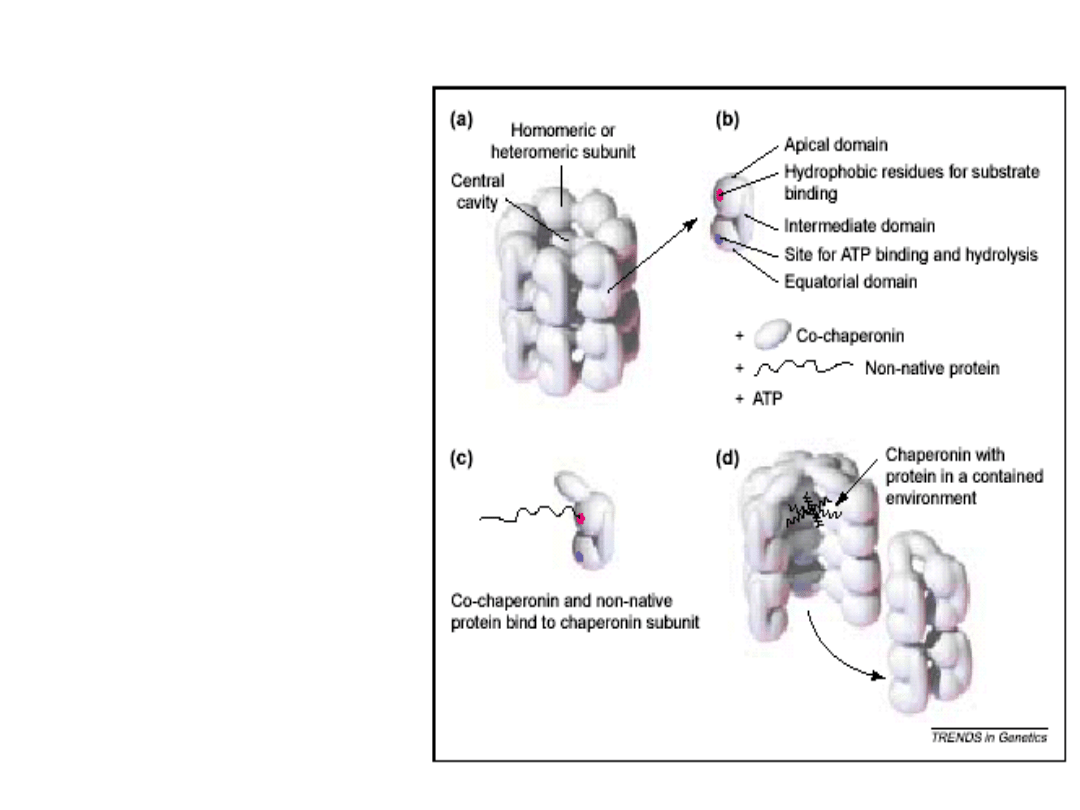
Hsp60 -
chaperoniny
-
związanie
niepofałdowane
go białka
powoduje
zmianę
konformacyjną
- skrócenie
cząsteczki
chaperoniny -
utworzenie
„formy” i
sfałdowanie
białka
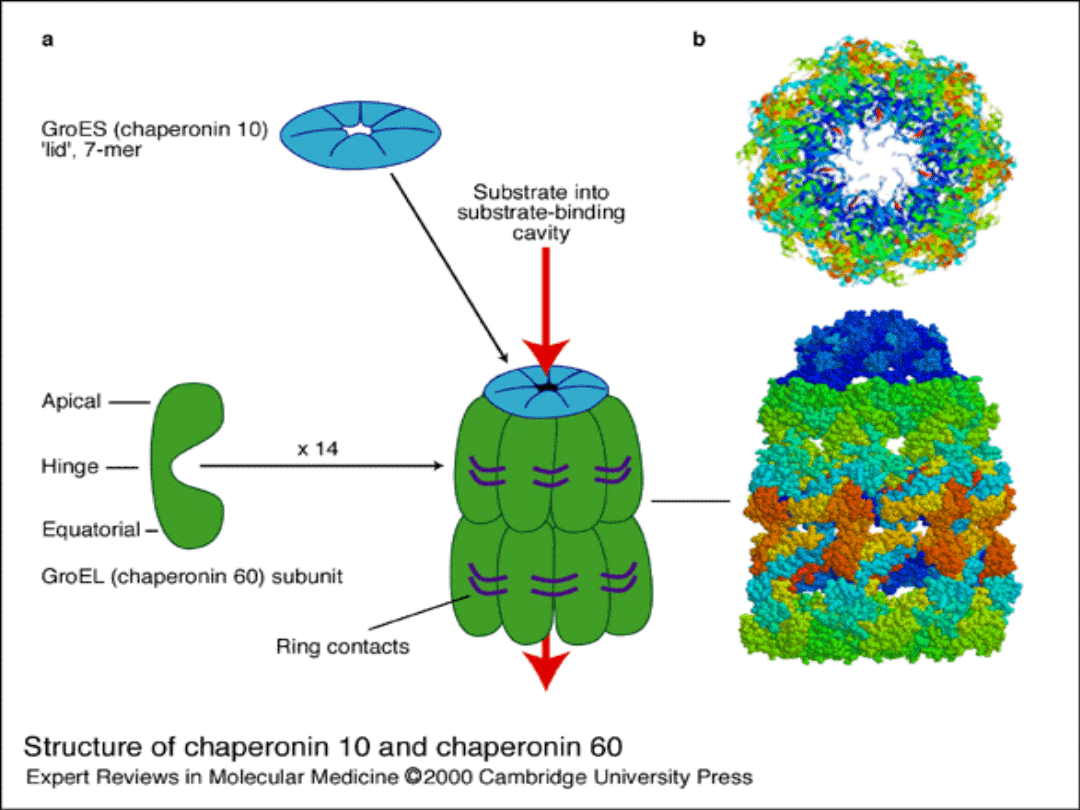


Wrodzone schorzenia spowodowane
przez mutacje chaperonów i
chaperonin
• Syndrom McCusicka-Kaufmana -
m.in.wrodzona wada serca
• Syndrom Bardet-Biedl - retinopatia, opóźnienie
umysłowe, otyłość, dysfunkcja nerek
• Autosomalna recesywna ataksja Charlevoix-
Saguenay - neuropatia motoryczna, atrofia
móżdżku, hipermielinizacja siatkówki
• wrodzona katarakta

Degradacja lizosomalna
• Lizosomy - organelle zawierające liczne
hydrolazy
• pH lizosomalne między 4 i 5
• Proteazy lizosomalne -
katepsyny -
mają
optimum pH w tym zakresie
• Proteazy lizosomalne działają na białka
pobierane drogą endocytozy z zewnątrz
komórki, z jej powierzchni lub wnętrza
• Lizosomalne proteazy są zdolne do
degradowania białek aż do aminokwasów.
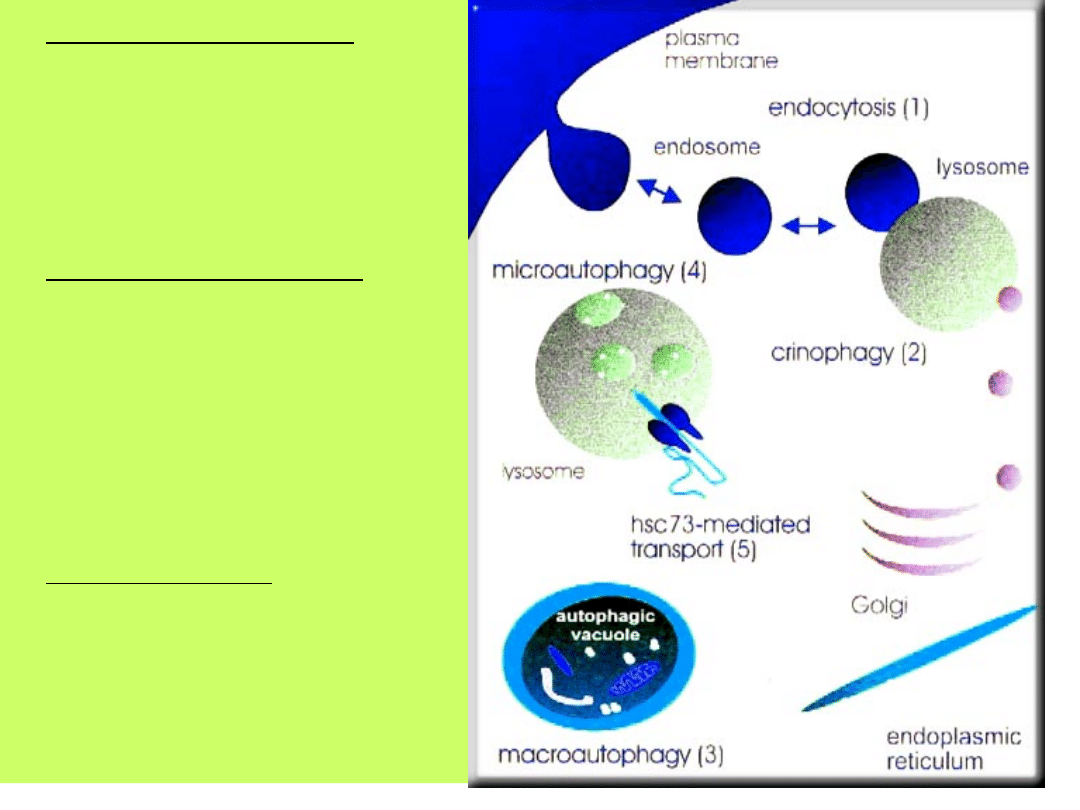
• Mikroautofagia -
małe porcje cytoplazmy
tworzą wgłębienia na
powierzchni lizosomów
- odpowiedzialna za
ciągłą degradację
długożyjących białek
• Makroautofagia -
duże fragmenty
cytosolu lub całe
organelle zostają
otoczone przez
wakuole - powstają
autofagosomy- po fuzji
z lizosomami następuje
proteoliza
• Krinofagia -
pochłanianie przez
lizosomy pęcherzyków
aparatu Golgiego -
ograniczenie
wydzielania

• Makroautofagia w wątrobie
odpowiedzialna za prawie całą
proteolizę, zwłaszcza w okresie
głodzenia.
• Czynniki hamujące makroutofagię:
- aminokwasy
- insulina
- puchnięcie komórki
- rozerwanie cytoszkieletu

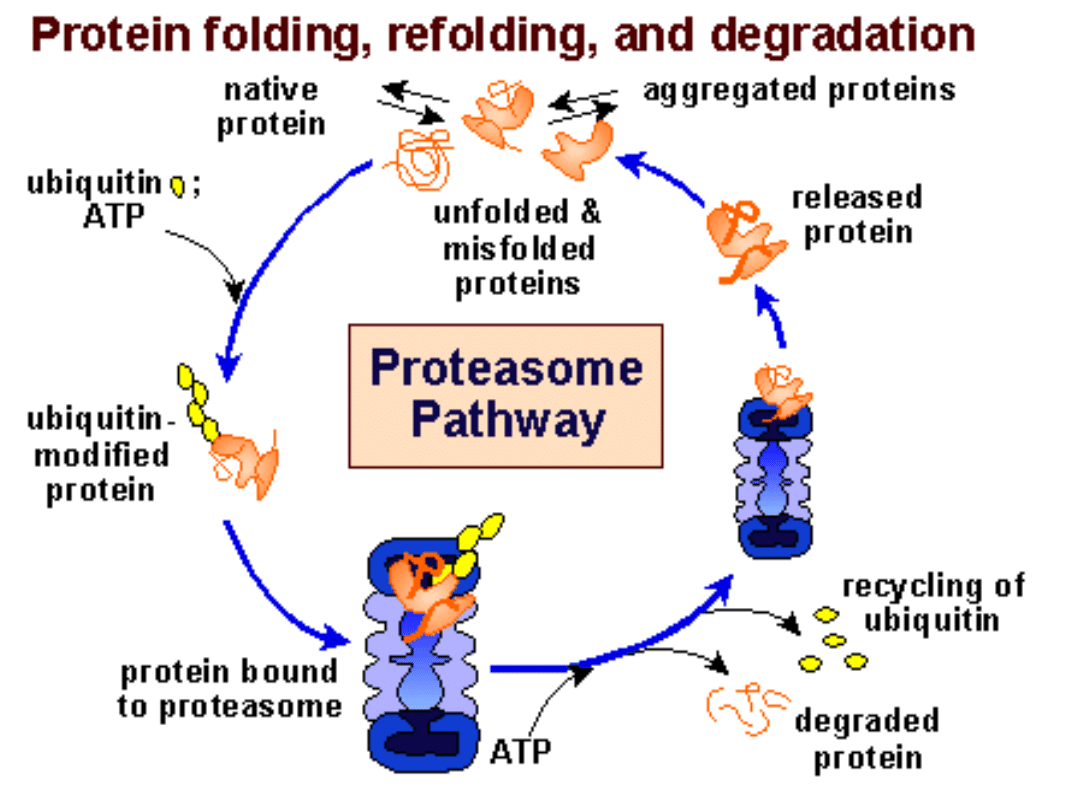
Degradacja zależna od
ubikwityny
• Białka zostają „naznaczone” przez
związanie z ubikwityną - stają się
rozpoznawalne przez proteasomy i ulegają
degradacji pod ich wpływem.
• Proteasomy - multikatalityczny kompleks
proteaz cytosolowych.
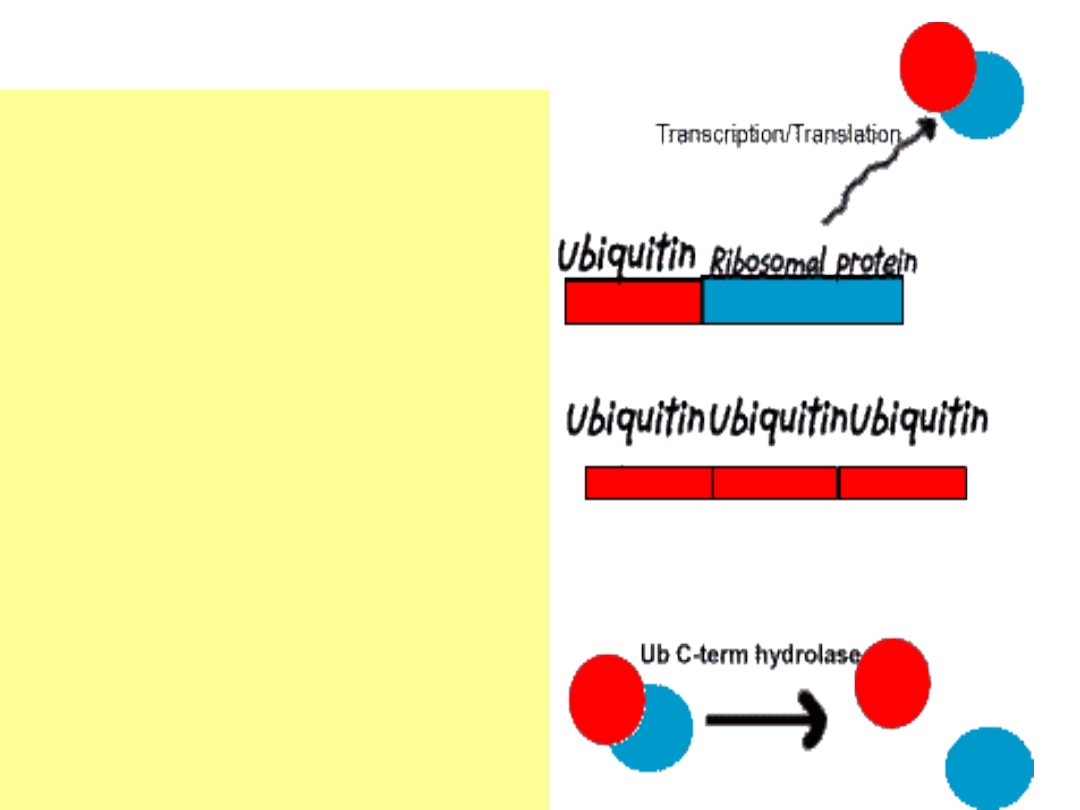
Ubikwityna
(8.5 kDa – 76
aminokwasów)
•Ub kodowana jest przez
rodzinę genów.
•Geny Ub albo w połączeniu
z genem białka
rybosomalnego, albo w
kilkukrotnych
powtórzeniach.
•Po translacji powstaje albo
Ub połączona z białkiem
rybosomalnym, albo
poliubikwityna. W obydwu
przypadkach hydrolaza C
powoduje powstanie
osobnych cząsteczek Ub.

UB przyłącza się kowalentnie do białek
docelowych w reakcji wymagającej
ATP:
1.Aktywacja UB przez E1, E2 i ATP.
2.Połączenie E3 z substratem i Ub.
3
. Dołączenie kolejnych Ub - powstaje
poliubikwityna połączona z
substratem - cząsteczka
rozpoznawana przez proteasomy.
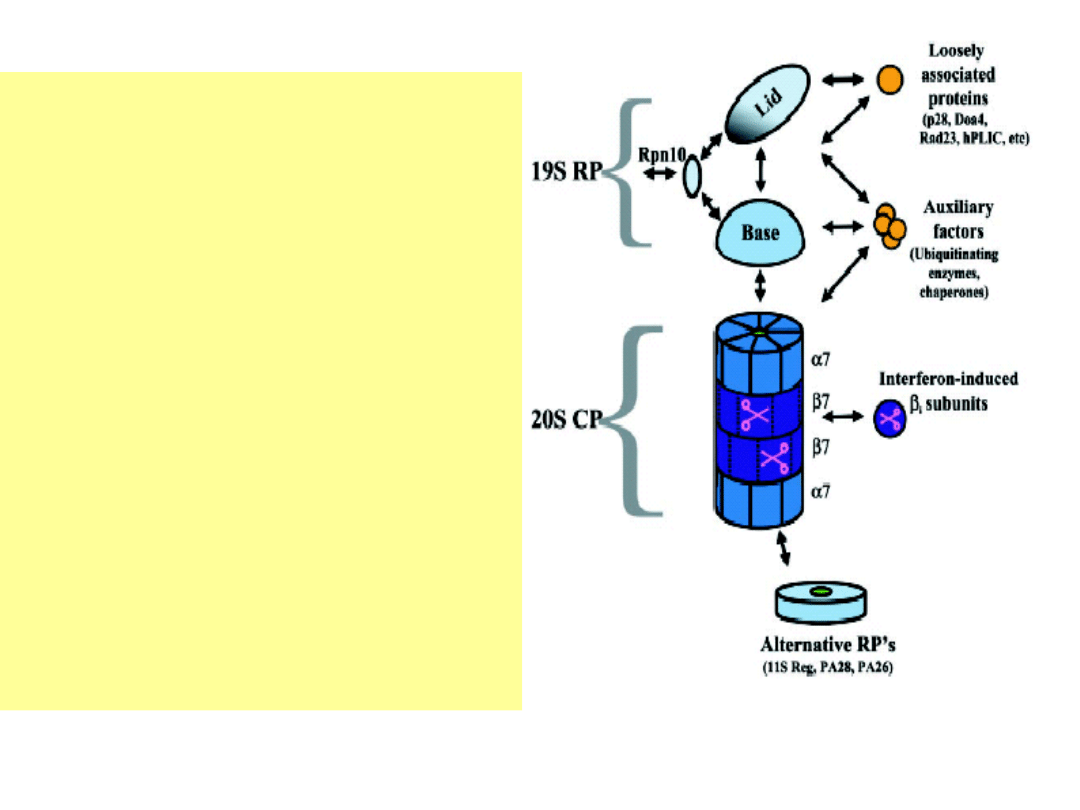
Proteasom 20S
przykryty 19S -
kompleks 26S.
Aktywność
enzymatyczna 26S
oprócz proteolitycznej –
ATPazowa.
Współpraca z
dodatkowymi
czynnikami
modulującymi
aktywność
proteolityczną - m.in.
chaperonami

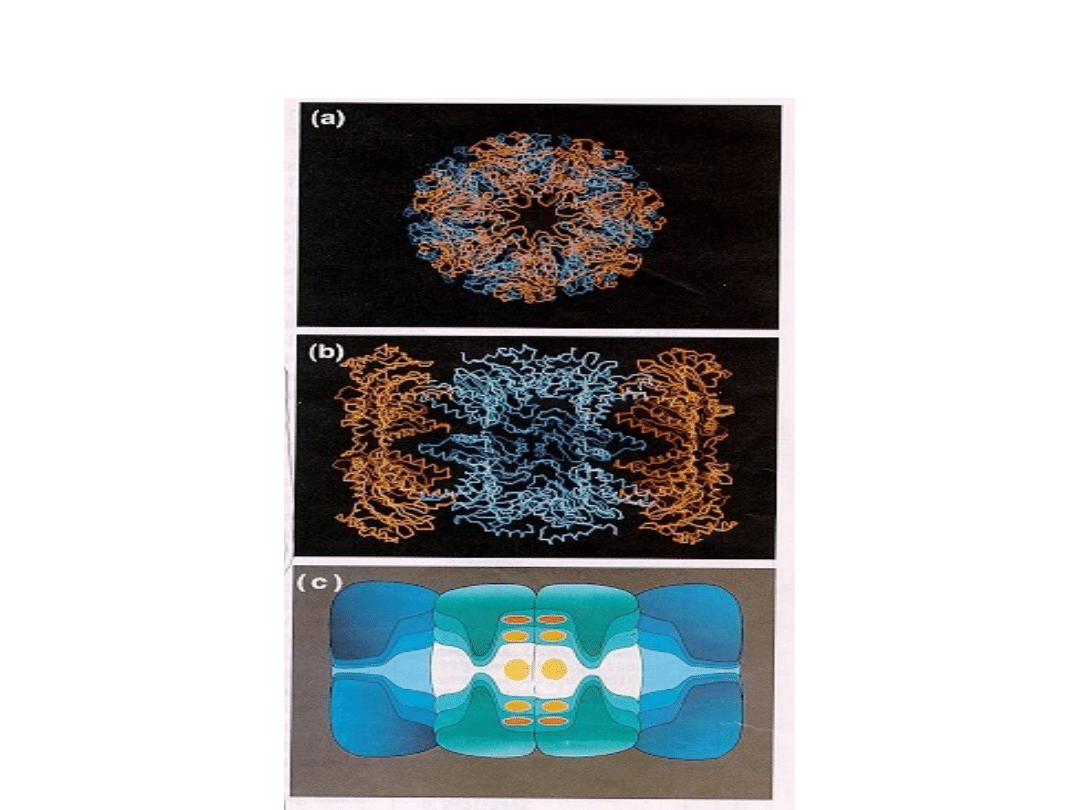
Widok proteasomu

Proteoliza zależna od ubikwityny zaangażowana
jest w następujące procesy w komórce:
•regulacja cyklu komórkowego i podziałów
komórki
•regulacja różnicowania
•odpowiedź na stres komórkowy i czynniki
zewnętrzne
•morfogeneza połączeń nerwowych
•modulacja receptorów powierzchniowych
• „ kanałów jonowych
•naprawa DNA
•regulacja transkrypcyjna
•pamięć długotrwała
•rytmy dobowe
•regulacja reakcji zapalnych i odpornościowych
•biogeneza organelli


• Proteoliza zależna od ubikwityny zależy od
żywienia – zwiększa się w stanie głodu i
niedożywienia białkowego.
• Aktywność fizyczna zmniejsza, a bezczynność
mięśni zwiększa intensywność proteolizy
zależnej od ubikwityny.
• Sepsa, choroba nowotworowa, zakwaszenie
zwiększają proteolizę tego typu, ma ona
znaczący udział w powstawaniu wyniszczenia.

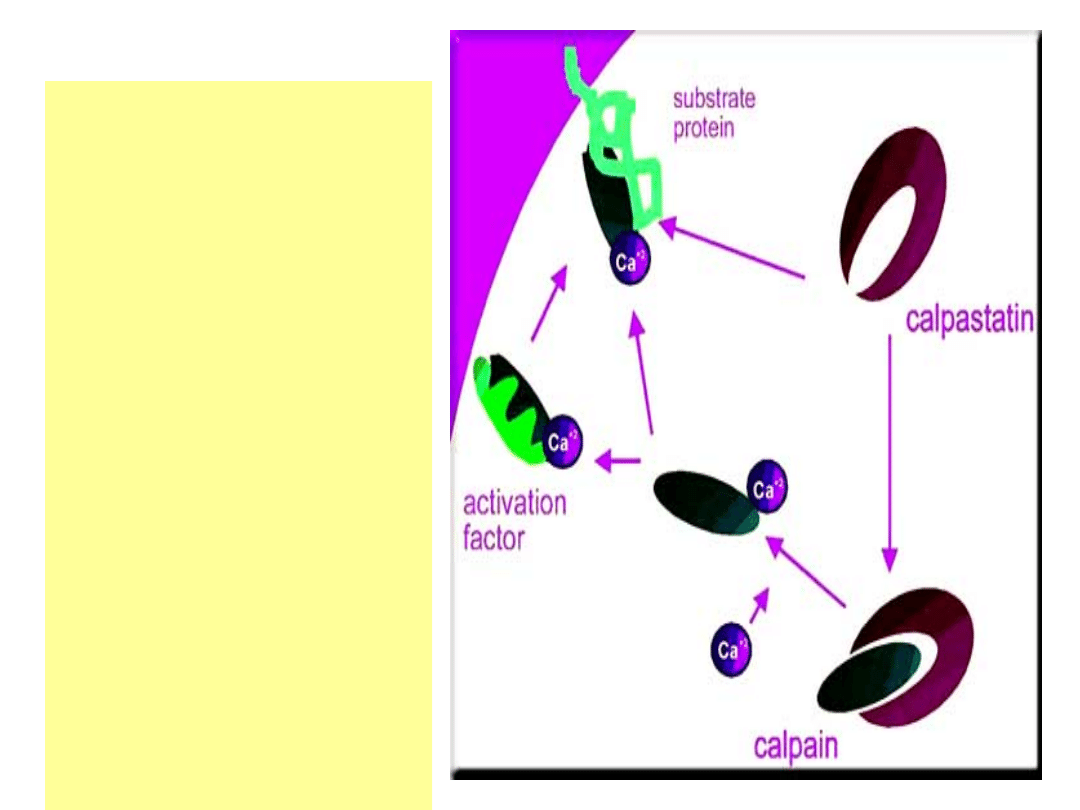
Kalpainy są
unieczynniane
przez
wewnątrzkomórk
owe inhibitory -
kalpastatyny.
Uaktywnienie pod
wpływem
przeniesienia w
okolice błony
komórkowej i
ograniczonej
autolizy, a
następnie jonów
wapniowych i
innych czynników
aktywujących.

• Kalpainy degradują białka błonowe i
cytoszkieletu, a także enzymy związane z
błonami.
• Działają podczas fuzji błon.
• Substratami są np. kinazy białkowe i
erytrocytarny transporter anionowy.
• Proteoliza kinaz białkowych wskazuje na ich
wpływ na przeniesienie sygnałów
informacyjnych wewnątrz komórki.
Aktywowane są przez czynniki regulacyjne.
• Przypuszczalnie odgrywają rolę w podziałach
komórek

• Rozkładają niektóre czynniki
transkrypcyjne. Regulacja ekspresji
genów?
• Zaangażowane są w programowaną
śmierć komórki - apoptozę w niektórych
typach komórek w przypadku działania
określonych czynników stymulujących.
• Zaangażowane w wiele stanów
patologicznych związanych z
zaburzeniami wewnątrzkomórkowej
homeostazy wapniowej.

Choroby związane z podwyższoną
aktywnością kalpain
• Choroba Alzheimera
- w korze mózgu 3x wyższa
aktywność kalpainy i tyle samo niższa
kalpastatyny.
• Katarakta
- napływ wapnia (1 mM lub więcej)
aktywuje m-kalpainę, która rozkłada białko
krystalinę. Fragmenty krystaliny tworzą agregaty -
kataraktę.
• Dystrofia mięśni - choroba Duchenne -
utrata
białka błonowego, dystrofiny, powoduje napływ
wapnia, wzrost aktywności kalpain i intensywną
proteolizę.
• Zawał mięśnia sercowego -
w miejscach
niedotlenienia wzrost poziomu wapnia. Kalpainy
degradują białka desminę i alfa-spektrynę.
Choroby związane z podwyższoną
aktywnością kalpain
• Stwardnienie rozsiane -
wszystkie główne
białka mieliny są substratami kalpain.
Aktywność kalpain wzrasta pod wpływem zmian
zapalnych. Inhibitory kalpain hamują
degradację neurofilamentów.
• Udar mózgu -
aktywność kalpain wzrasta, a
poziom kalpastatyny ulega obniżeniu w
miejscach niedotlenienia. Kalpainy uczestniczą
zarówno w apoptozie, jak i nekrozie komórek
nerwowych. Inhibitory kalpain zmniejszają
degradację spektryny.

Apoptoza -
programowana lub
genetycznie sterowana
śmierć komórki
Śmierć komórki
nekroza
apoptoza

Nekroza
-
wywołana przez uszkadzające
czynniki mechaniczne lub chemiczne:
• puchnięcie komórki i jej organelli
spowodowane uszkodzeniem błony
komórkowej
• wypływanie zawartości komórki
• reakcja zapalna

•Nobel 2002:
Brenner, Horvitz i Sulston
„for establishing the precise order in
which cells in the worm Cyanorhabdis
elegans divide and die, and for
elucidating the process of programmed
cell death or apoptosis”

Apoptoza
-
wywołana przez
czynniki wewnętrzne lub
zewnętrzne z uruchomieniem
aparatu apoptotycznego:
• kurczenie się komórki
• powstawanie pęcherzyków na
powierzchni błony komórkowej
• rozpad mitochondriów i
uwolnienie cytochromu C
• degradacja chromatyny
jądrowej

• fragmentacja komórki w otoczone błoną
pakiety
• fosfolipid - fosfatydyloseryna wychodzi z
wnętrza błony na jej powierzchnię pod
wpływem enzymu flippazy
• fosfatydyloseryna jest wiązana przez
receptory makrofagów i komórek
dendrytycznych, co rozpoczyna proces
fagocytozy fragmentów komórki
• komórki fagocytujące wydzielają cytokiny
hamujące rozwój reakcji zapalnej

Programowana śmierć komórki jest
potrzebna do normalnego rozwoju,
jak np. mitoza.
Przykłady:
• tworzenie palców dłoni i stóp u płodu
wymaga apoptozy łączącej je tkanki
• martwica endometrium macicy przed
menstruacją jest spowodowana apoptozą
• tworzenie właściwych połączeń między
neuronami w mózgu wymaga usunięcia
nadmiaru komórek przez apoptozę.

Programowana śmierć komórki jest
potrzebna do usunięcia komórek
stanowiących zagrożenie dla
organizmu
Przykłady:
• komórki zainfekowane przez wirusy
• komórki systemu immunologicznego
zaangażowane w odpowiedź komórkową
muszą być usunięte, aby nie atakowały
komórek własnego ciała - defekt apoptozy
powoduje choroby autoimmunologiczne
• komórki z defektem DNA - defekt apoptozy
podczas życia płodowego- wrodzone wady,
później - rozwój nowotworu

Apoptoza rozpoczyna się, gdy zaczynają
przeważać sygnały indukujące proces
apoptozy nad warunkującymi życie
komórki
Sygnały warunkujące życie komórki, różne dla
różnych komórek, na przykład:
• czynniki wzrostu dla neuronów
• hormony płciowe dla komórek układu
rozrodczego
• interleukina-2 dla limfocytów

Sygnały negatywne:
• uszkodzenie DNA przez: promienie
ultrafioletowe, promienie X, leki
chemoterapeutyczne
• nagromadzenie białek nieprawidłowo
pofałdowanych
• cząsteczki wiążące się na powierzchni
komórek do specyficznych receptorów -
„aktywatory śmierci”
- czynnik martwicy guza (TNF-alfa) -
receptor TNF
- limfotoksyna (TNF-beta) - receptor TNF
- ligand Fas (FasL) - receptor Fas, także
nazywany CD95

Mechanizmy apoptozy
1.
Generowany przez sygnały z wnętrza
komórki.
2. Wywołany przez „aktywatory śmierci” -
FasL, TNFalfa i beta. Do ligandów
receptorów Fas należą powierzchniowe
cząsteczki limfocytów cytotoksycznych.
3. Wywołany przez wolne rodniki.
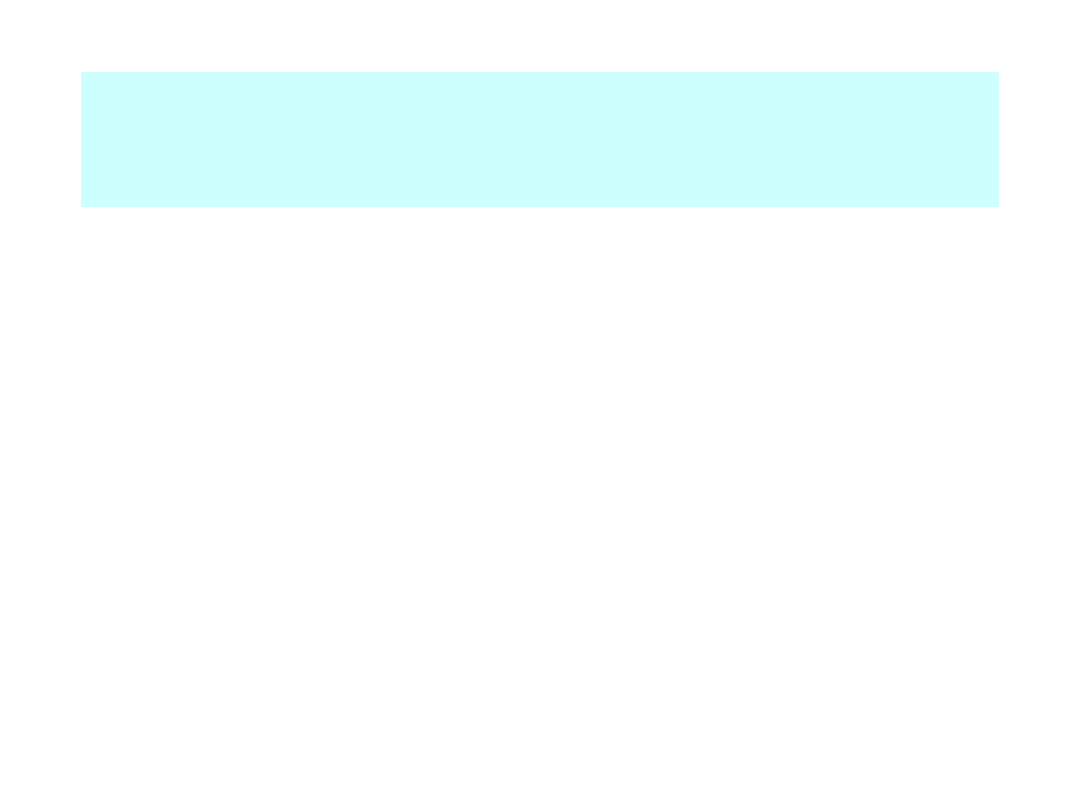
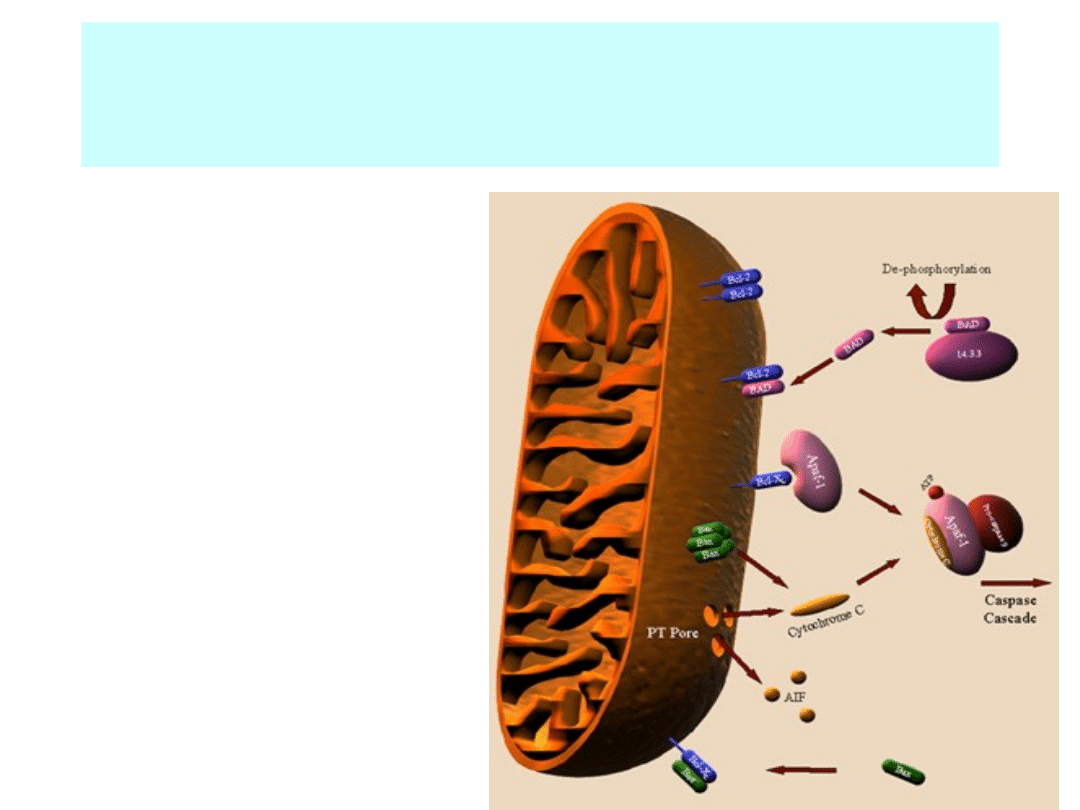
Apoptoza wywołana przez sygnały
wewnętrzne
• Błona zewnętrzna mitochondrium zawiera
na powierzchni białko Bcl-2
• Białko Bcl-2 wiąże się z cząsteczką Apaf-1
(apoptotic protease activating factor-1)
• Uszkodzenie komórki, np. przez wolne
rodniki powoduje uwolnienie Apaf-1 i
penetrację błon mitochondrialnych przez
białko Bax.
• Otwarcie mitochondrium przezBax
powoduje wypłynięcie cytochromu C.
• CytC, Apaf-1 i ATP wiążą się z kaspazą 9
tworząc
apoptosom.
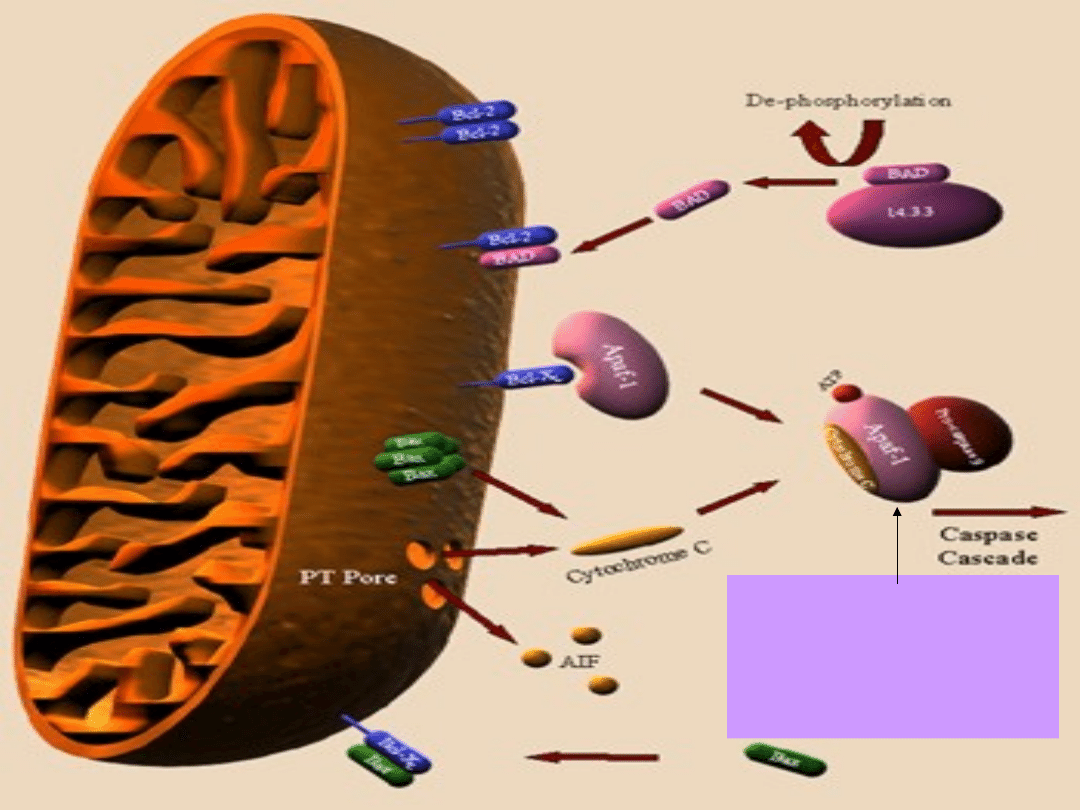
Apoptosom:
Kaspaza9+ATP
+cytC+Apaf-1
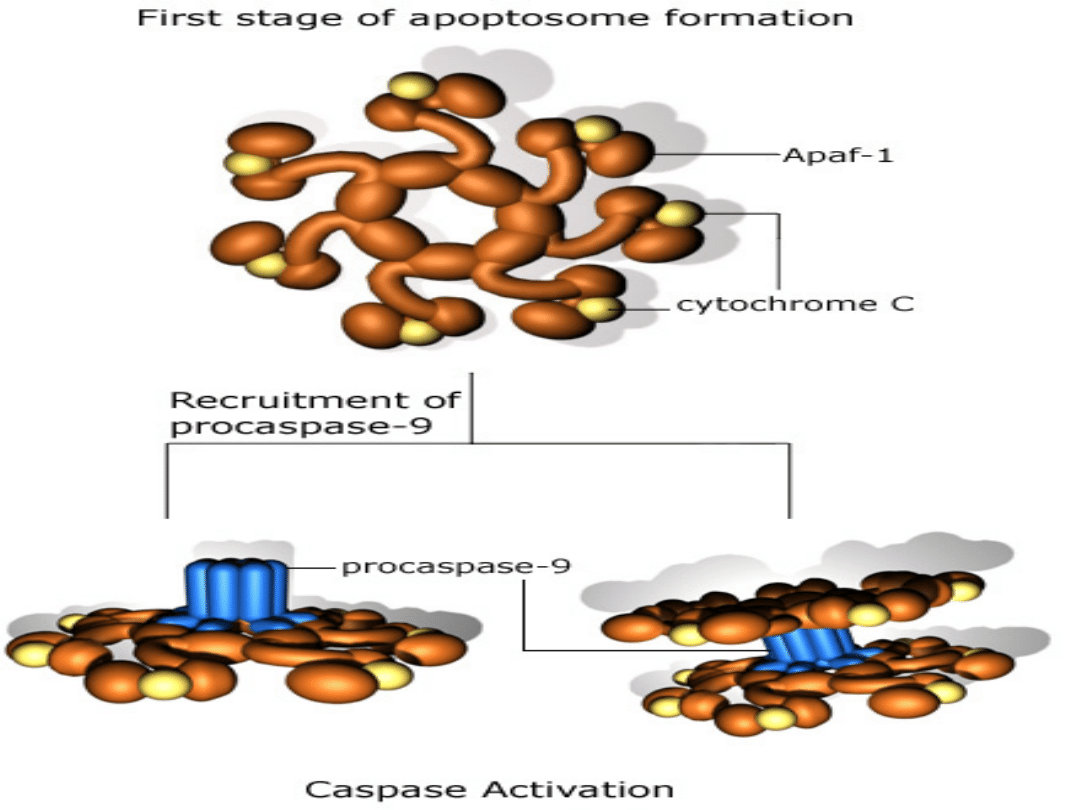

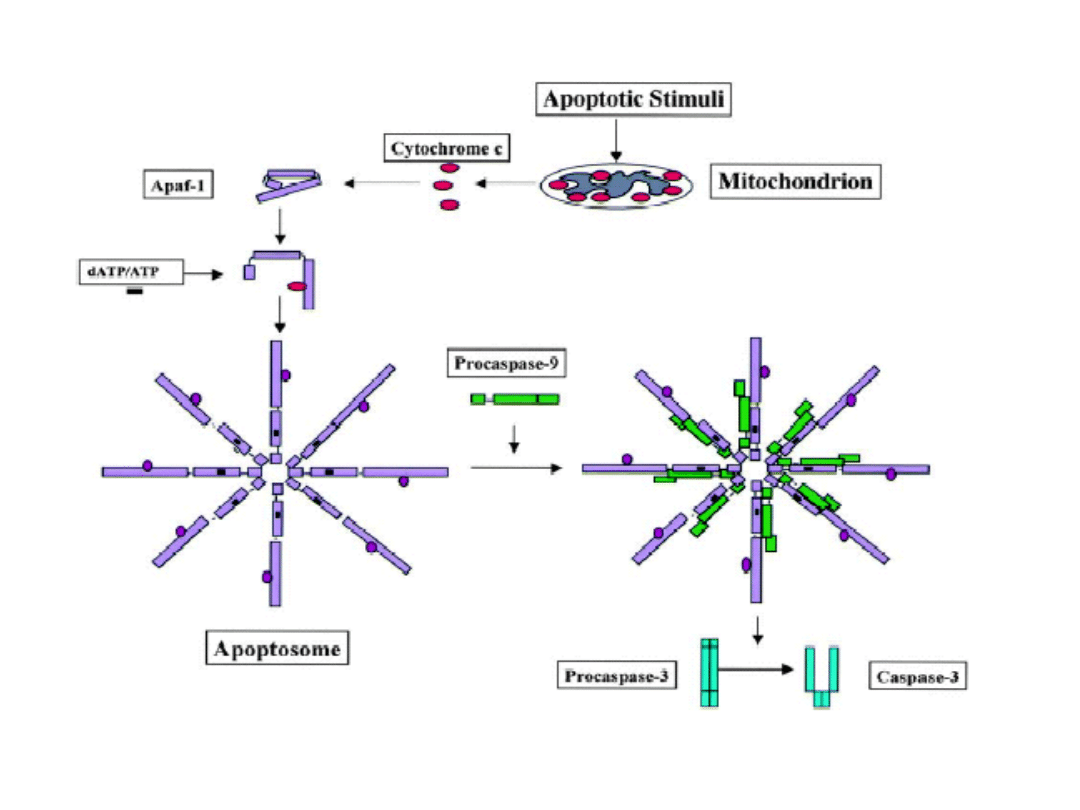

• Apoptosomy agregują w cytosolu.
• Kaspaza 9 inicjuje aktywację innych
- 12 - kaspaz.
• Kaspazy - proteazy, których nazwa
pochodzi od specyficzności działania
- rozszczepienie wiązania przy
reszcie kwasu asparaginianowego.
• Kaspazy powodują degradację białek
jądrowych i cytosolowych, nukleazy
rozkładają kwasy nukleinowe.
• Fagocytoza
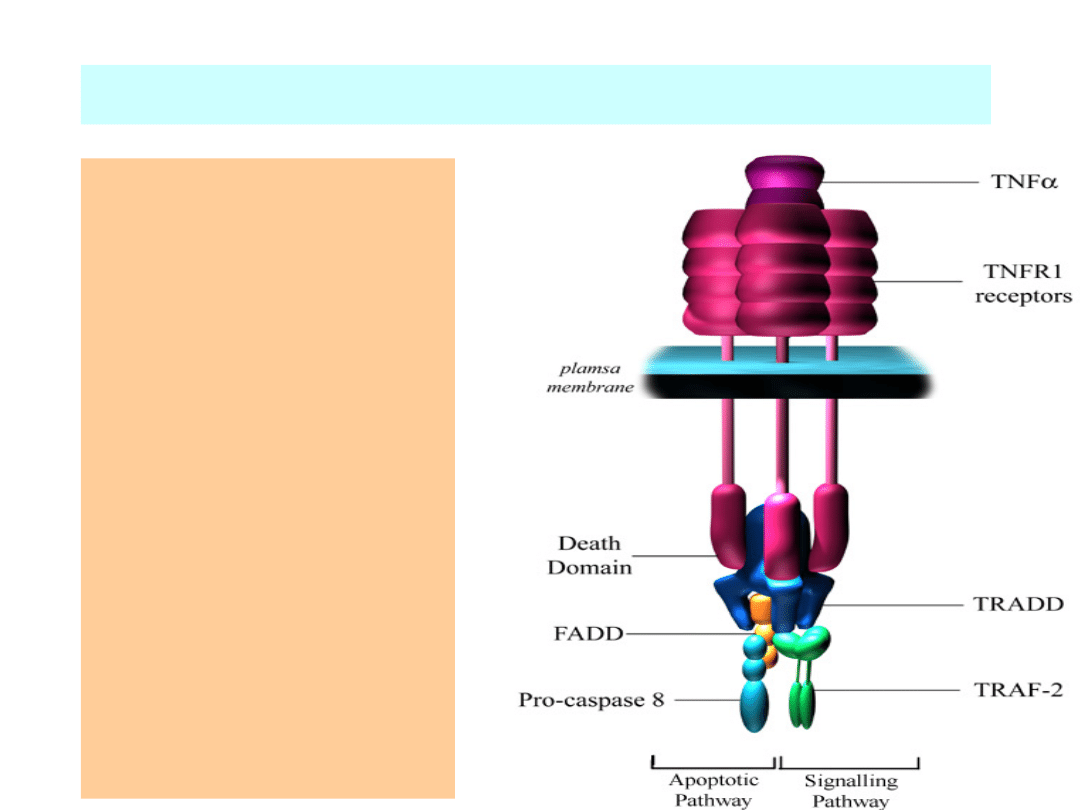
Apoptoza wywołana przez czynniki zewnętrzne
•Związanie
aktywatora
śmierci z
receptorem na
powierzchni
komórki
•Aktywacja
kaspazy 8.
•Kaspaza 8
inicjuje kaskadę
aktywacji kaspaz.
•Fagocytoza
komórki.
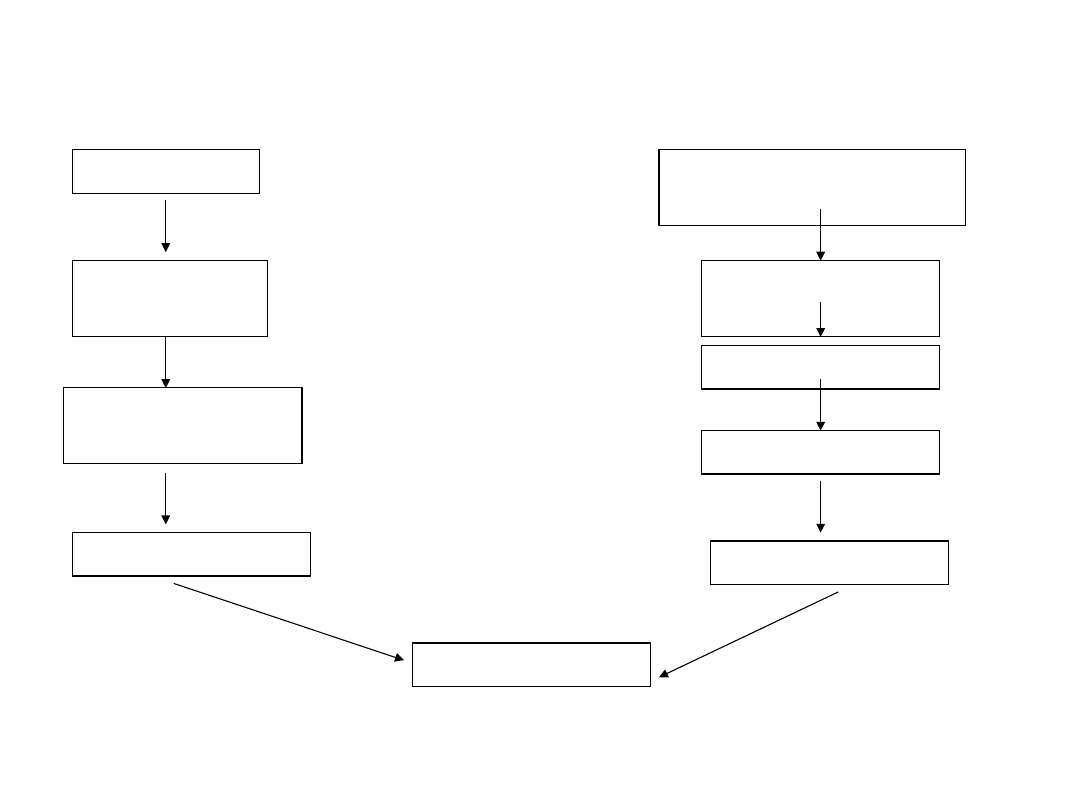
ligand
receptor
śmierci
adaptor
Fadd/mort-1
Kaspaza 8
Kaspaza 3
mitochondriu
m
cytochrom C
Apaf-1
kaspaza 9
Czynnik
proapoptotyczny
Ścieżka
receptora
śmierci
Ścieżka
mitochondrialna

Czynnik wywołujący apoptozę -
AIF (apoptosis inducing factor) -
w neuronach, bez aktywności
kaspaz
• AIF ulokowany w
międzybłonowej
przestrzeni w
mitochondriach
• po otrzymaniu
sygnału śmierci
AIF jest uwalniany
z mitochondrium
• migruje do jądra
• wiąże się z DNA
• następuje
destrukcja DNA i
śmierć komórki

Apoptoza i nowotwory
• Wirusy wywołujące raka blokują
apoptozę w transformowanych
komórkach:
- wirus opryszczki (Papilloma - rak szyjki
macicy) wytwarza białko E6 blokujące
białko p53 indukujące apoptozę
- wirus Epsteina-Barra (mononukleoza i
chłoniaki) wytwarza białko
zwiększające syntezę Bcl-2 w
atakowanej komórce

Komórki rakowe przeciwdziałają apoptozie
w transformowanych komórkach:
-
komórki białaczkowe wytwarzają duże
ilości białek Bcl-2,
- komórki czerniaka produkują inhibitory
Apaf-1,
- komórki raka płuc i jelita grubego
syntetyzują cząsteczki blokujące na
limfocytach FasL,
-
inne komórki za pomocą FasL zabijają
limfocyty cytotoksyczne
Wpływ żywienia na proces
apoptozy

Głodzenie i ograniczenie spożycia -
efekty specyficzne tkankowo
• Zmniejszenie proliferacji hepatocytów w
wątrobie i zwiększenie częstości apoptozy.
• W innych komórkach - wzrost aktywności
deacetylazy histonów, która uaktywnia
czynnik Ku70 naprawiający DNA i
usuwający z mitochondriów
proapoptotyczny czynnik Bax zapobiegając
apoptozie indukowanej przez stres. W ten
sposób może wydłużać się czas życia
komórek nerwowych.

U gryzoni ograniczenie kaloryczne
hamuje rozwój zmian
nowotworowych:
• mniejsza częstość nowotworów
wątroby chemicznie indukowanych
przy żywieniu ograniczonym (4%)
niż ad libitum (27%).

• przy żywieniu ograniczonym
mniejsza częstość nowotworów
sutka, większa liczba
cytotoksycznych limfocytów, wzrost
ekspresji
białka p53*
, enzymów
antyoksydacyjnych, wyższy poziom
proapoptotycznych białek Bax I
Apaf-1 i kaspaz, niższy
antyapoptotycznych Bcl.

• Białko p53 jest supresorem
transformacji nowotworowej,
ponieważ wykrywa uszkodzenia
DNA i doprowadza do wystąpienia
apoptozy - nazywane
„molekularnym policjantem”.
Mutacje białka p53 uniemożliwiają
destrukcję zmutowanych komórek
.

Wpływ tłuszczu diety na proces
apoptozy – specyficzny tkankowo
• Tłuszcz diety indukuje
proliferację i hamuje apoptozę
w śluzówce jelita.
• Działanie tłuszczu zależy
jednak od składu kwasów
tłuszczowych - proapoptotyczne
działanie w śluzówce jelita
wykazują wielonienasycone
kwasy n-3.

• Nasycone kwasy tłuszczowe
indukują apoptozę w komórkach
mięśnia sercowego,
hematopoetycznych komórkach
szpiku, trzustkowych komórkach
beta i astrocytach.
• Sprzężony kwas linolowy indukuje
apoptozę i nekrozę w komórkach
nowotworowych.

Wpływ antyoksydantów na proces
apoptozy - Liczne dowody na
antynowotworowe - proapoptotyczne
działanie antyoksydantów:
• likopen i luteolina - karotenoidy zawarte
w pomidorach wpływają hamująco na rozwój
raka prostaty - likopen zmniejsza liczbę
oksydatywnych uszkodzeń DNA komórek
prostaty i zwiększa liczbę komórek w stanie
apoptozy.
• w wątrobie efekt przeciwny - ochronne działanie
likopenu przed apoptozą wywołaną przez
alkohol.

• Dla zawartych w kapustnych takich
związków jak polifenol kwercetyna,
sulfotlenek S-metylocysteiny,
sulforafan, izotiocyjaniany oraz lakton
kwasu glukonowego wykazano
działanie proapoptotyczne.
• Wykazano liczne ujemne korelacje
między spożywaniem kapustnych a
zachorowalnością na raka tarczycy,
płuc, trzustki, prostaty, skóry, żołądka,
pęcherzyka żółciowego i jelita grubego.

• Rezweratrol aktywuje kaspazę-3
oraz aktywuje białko p-53.
• Selen, ale prawdopodobnie
spożywany tylko w ilościach
ponadżywieniowych, działa
antynowotworowo wpływając na cykl
komórkowy, apoptozę i angiogenezę.

• Polifenol kurkumina
uwrażliwia komórki raka
prostaty na proapoptotyczne
działanie TNF-alfa.
• Katechiny zawarte w zielonej
herbacie indukują prowadzące
do apoptozy zmiany w
mitochondriach, aktywują
kaspazę-3 i białko p-53.

Inne czynniki wywołujące
apoptozę w śluzówce jelita
• Głodzenie 72 godz. - mitoz z 6.8 (SD 0.2) do
5.3 (SD 0.3), realimentacja 24 godz. 8 (SD
0.3).
• Gluten u osobników z nadwrażliwością -
intensywne apoptozy prowadzące do zaniku
kosmków pomimo wzrostu proliferacji
komórek krypt w aktywnej celiakii. Dieta
bezglutenowa przywraca proces apoptozy do
normy.
• Przypuszczalnie wzrost apoptozy
odpowiedzialny także za zanik kosmków w
niedoborach witamin - folianów i B12.

• Nieskrobiowe węglowodany (NSW) mogą
zwiększać proliferację komórek nabłonka
jelitowego u gryzoni.
• Ta właściwość zależy od zdolności NSW do
zwiększania lepkości światła jelita,
opóźniania trawienie i wchłaniania oraz
transportu składników pokarmowych, co
powoduje wzrost wydzielania
enteroglukagonu (np. guma guarowa).
• Proliferacja komórek jelita pod wpływem
NSP może także wynikać z fermentacji w
jelicie grubym i produkcji
krótkołańcuchowych kwasów tłuszczowych
(KKT) troficznych dla śluzówki jelita
(wykazano u gryzoni i przeżuwaczy).

• Zapobieganie fermentacji i
produkcji (KKT) hamuje
proliferację. Suplementacja
żywienia pozajelitowego przez KKT
powoduje hipertrofię śluzówki
pozostałej części jelita po resekcji
jelita cienkiego.
• KKT są czynnikami troficznymi dla
śluzówki jelita u gryzoni

• Wzrost proliferacji pod wpływem KKT
nie zagraża jednak przerostem ,
ponieważ towarzyszy jej wzrost
apoptozy. Maślan jest silnym
induktorem apoptozy w kolonocytach.
• W jelicie grubym intensywność
apoptozy znacznie mniejsza niż w
cienkim, co może tłumaczyć znacznie
większą zachorowalność na nowotwory
jelita grubego, niż cienkiego.

Podsumowanie
• Proapoptotyczne działanie składników
pokarmowych, zarówno korzystne, jak i
niekorzystne, jest specyficzne tkankowo.
• Działanie proapoptotyczne jest
jednocześnie działaniem
antynowotworowym.
• Działanie proapoptotyczne wykazano dla
antyoksydantów oraz kwasów
tłuszczowych: krótkołańcuchowych i
wielonienasyconych.
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
- Slide 41
- Slide 42
- Slide 43
- Slide 44
- Slide 45
- Slide 46
- Slide 47
- Slide 48
- Slide 49
- Slide 50
- Slide 51
- Slide 52
- Slide 53
- Slide 54
- Slide 55
- Slide 56
- Slide 57
- Slide 58
- Slide 59
- Slide 60
- Slide 61
- Slide 62
- Slide 63
- Slide 64
- Slide 65
- Slide 66
- Slide 67
- Slide 68
- Slide 69
- Slide 70
- Slide 71
- Slide 72
- Slide 73
- Slide 74
- Slide 75
- Slide 76
- Slide 77
- Slide 78
- Slide 79
Wyszukiwarka
Podobne podstrony:
Przemiany białek i aminokwasów
anatomia 6- Przemiana bialek, Anatomia
Przemiany białek w sutek ogrzewania żywności
3 Metabolizm Przemiana białek
14 Biochemia przemiany bialek i aa
Lekcja II Witaminy jako skladniki koenzymow i ich udzial w przemianiach weglowodanow lipidow i biale
Zagrozenia zwiazane z przemieszczaniem sie ludzi
Przykłady roli biologicznej białek
Właściwości fizykochemiczne białek
1 Przyswajanie białek przez organizmid 8658 ppt
właściwości białek mięśniowych
3 Przemiany fazowe w stopach żelazaPrzemiana martenzytycznaSem2010
przemiennik 1
Przemienienie Jezusa
Przemiany amino
więcej podobnych podstron