
Bakteriologia gruźlicy
Adriana Vrba
Klinika Gruźlicy Chorób i Nowotworów Płuc
www.infectiousdiseasenews.com/200711/
genetics.asp

„ODDECH CHOREGO NA SUCHOTY MOŻE
NISZCZYĆ PŁUCA DRUGIEGO CZŁOWIEKA”
Beniamin Marten w 1722 r.
24 marca 1882 roku R. Koch poinformował świat
naukowy o tym, że udało mu się odkryć i wyizolować
bakterię wywołująca gruźlicę
Ponad 73% polskich lekarzy nie czuje się
odpowiednio przygotowanych do rozpoznawania i
leczenia gruźlicy - wynika z sondażu
przeprowadzonego przez największy portal
społeczności owy dla lekarzy

Stanowisko systematyczne Mycobacterium
Królestwo:
Procaryota
Klasa:
Actinobacteria
Rząd:
Actinomycetales
Podrząd:
Corynebacterineae
Rodzina:
Mycobacteriaceae
Rodzaj:
Mycobacterium
Mycobacteriaceae
– myces – bacterium
(grzyb) (bakteria)
http://fascinatinghistory.blogspot.com/2005_07_01_archive.html
Czas potrzebny do uzyskania hodowli prątków
Prątki wolno rosnące
– 4-8 tyg.
Prątki szybko rosnące
- 5-10 dni
Czas generacji E.coli ok. 27min
Czas generacji prątków zjadliwych- kilkadziesiąt godzin
Klasyfikacja prątków - Meissner
A. Prątki właściwe:
M. tuberculosis
complex
B. Prątki atypowe
wolno rosnące:
I. Foochromogenne
II. Skotochromogenne
III. Niefotochromogenne
C. Prątki szybko rosnące
M.smegmatis
M.phlei
M.fortuitum

Ze względu na rodzaj wywoływanej choroby prątki dzieli się na:
- Mycobacterium tuberculosis complex
-klasyczna postać gruźlicy,
- Mycobacterium other than tuberculosis (MOTT)-
mykobakteriozy

Mycobacterium tuberculosis complex
M.tuberculosis
M.bovis
M.africanum
M.microti
M.canetti

Unikalne cechy Mycobacterium
tuberculosis complex :
Ściana komórkowa z dużą
ilością lipidów
Kwasooporne
Alkoholooporne
Przeżywają kilka miesięcy w stanie wysuszonym
Oporność prątków na działanie kwasów, zasad czy
wysychanie jest uwarunkowane posiadaniem
nietypowej ściany komórkowej
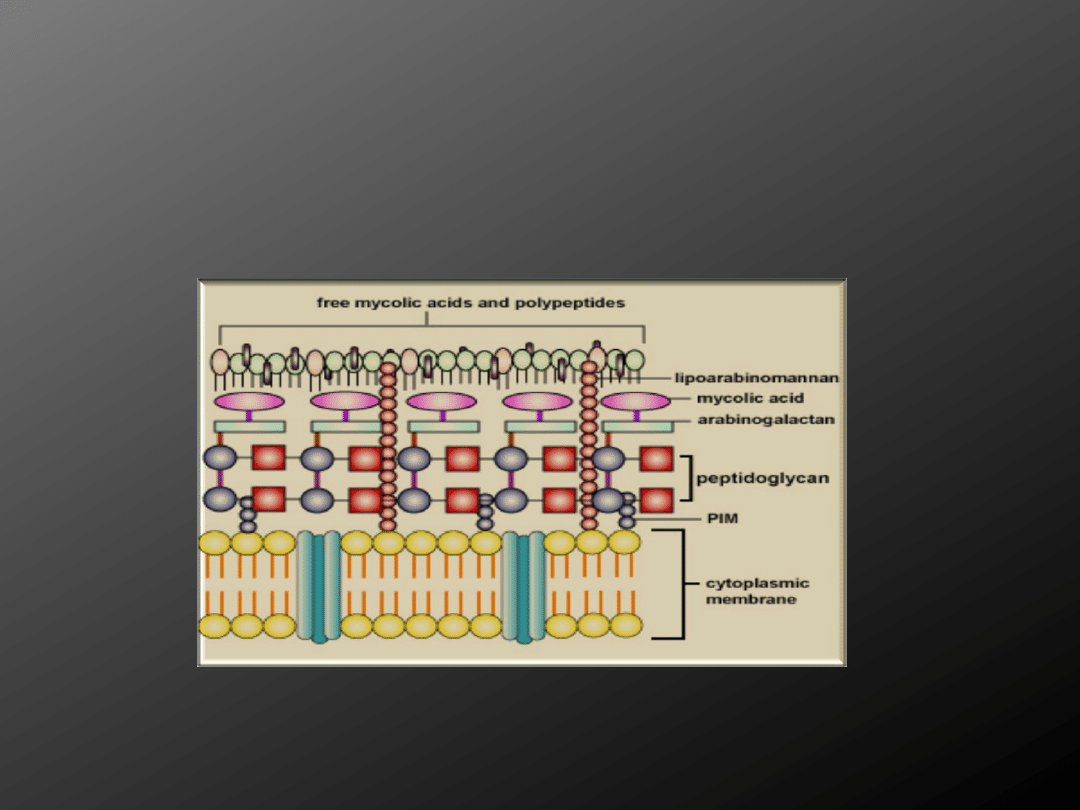
Ściana komórkowa Mycobacterium tuberculosis zasługuje
na specjalną uwagę ponieważ, jest strukturą unikalną u
Prokaryota i determinuje wirulencję prątków. Głównym jej
budulcem są lipidy stanowiące do 60% ściany
komórkowej. Do najważniejszych komponentów ściany
komórkowej odpowiedzialnych za nadawanie prątkom
wyżej wymienionych właściwości należą
:
1. kwasy mykolowe
2. Czynnik
wiązkowy
3.
Lipoarabinomannan
4. Powierzchniowe
sulfatydy
5. MDP - dipeptydy
muramylowe
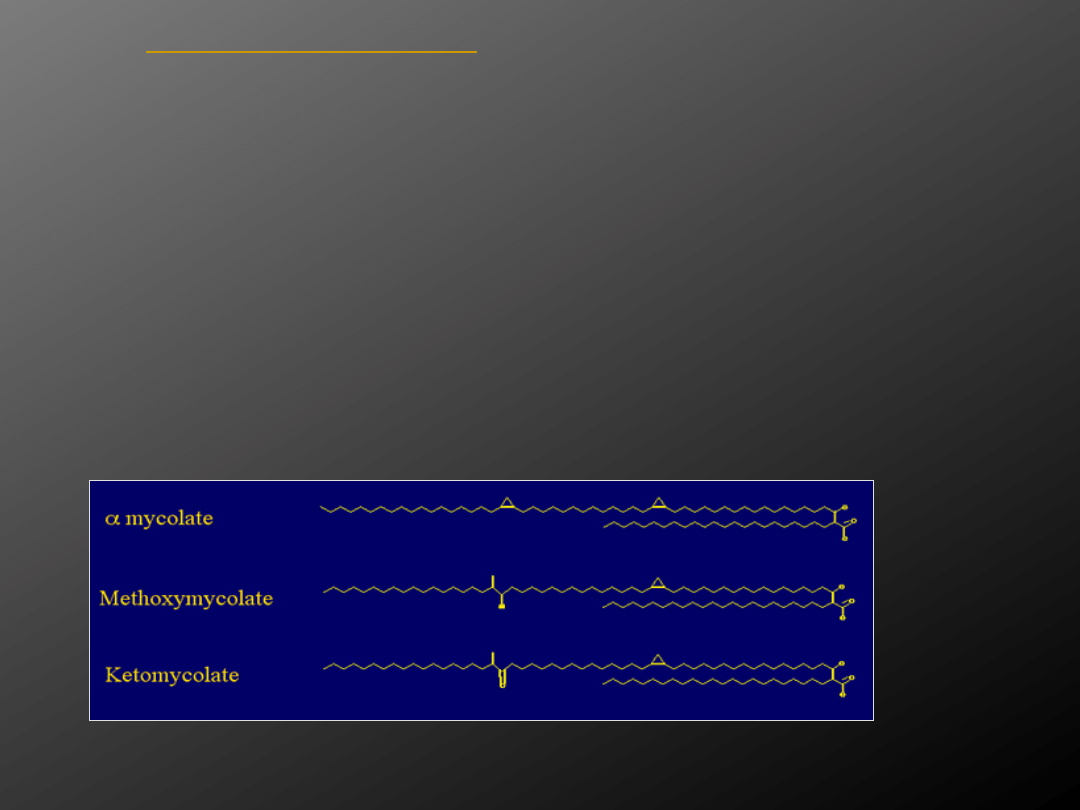
kwasy mikolowe
- hydroksykwasy
podstawione w pozycji α dwoma łańcuchami
alifatycznymi o zróżnicowanej długości.
Mycobacterium tuberculosis syntetyzuje
trzy klasy kwasów mikolowych. Odpowiadają
one za utworzenie silnie hydrofobowej
powierzchni. Kwasy mikolowe są uważane za
bardzo ważny czynnik determinujący
wirulencję prątków. To one warunkują
oporność prątków na kwasy, zasady oraz
wysychanie.

Czynnik wiązkowy
- to dimikolan trehalozy
odkryty przez R. Kocha. Jest on
immunogenny i ma zdolność do
wzbudzania produkcji swoistych
przeciwciał (Ab). Odpowiada on za
zahamowanie migracji makrofagów (MØ) i
ich przeciwprątkowej aktywności. Jest
toksyczny dla komórek ssaków.
Odpowiada za serpentynowaty wzrost
prątków na podłożach sztucznych.
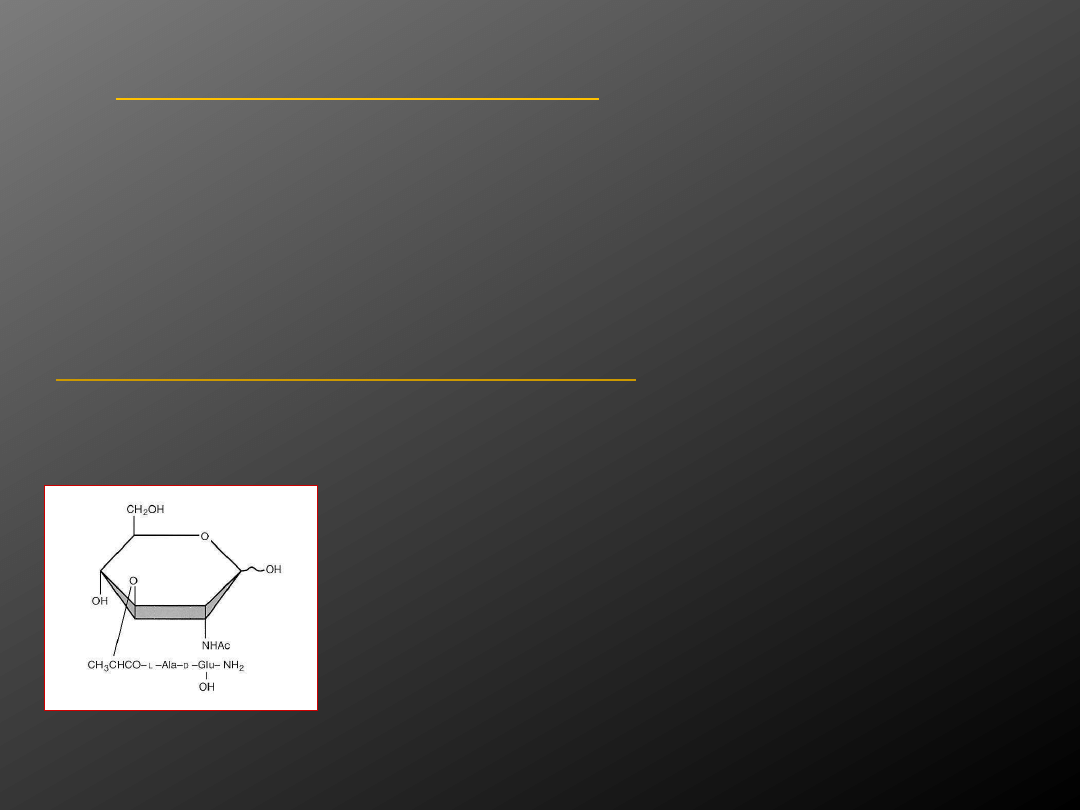
Lipoarabinomannan (LAM)
- to ważny czynnik
wirulencji prątków. Odpowiada on za
upośledzony killing tj. zabijanie prątków przez
MQ, gdyż hamuje powstawanie wolnych
rodników tlenkowych. Czynnik ten hamuje
odpowiedź MØ na IFN-γ, co jest równoznaczne z
hamowaniem aktywacji MØ
Powierzchniowe sulfatydy
ściany komórkowej
mikobakterii, które hamują fuzję fagosomów z
lizosomami. Fagosomy stają się wówczas
bezpiecznym miejscem bytowania prątków.
Ponadto hamują one wybuch tlenowy
MDP - dipeptydy muramylowe
-
nieswoiście nasilają
adaptacyjną odporność komórkową
.

Mycobacterium other than tuberculosis
Prątki zaliczane do tej grupy mogą wywoływać różne postacie chorób,
określanych wspólnym mianem mykobakterioz. Choroby te występują
znacznie rzadziej niż klasyczna gruźlica. Zwykle dotyczą osób
ze szczególnymi predyspozycjami – z zaburzonymi funkcjami układu
immunologicznego

Podział prątków atypowych (MOTT) wg Runyona:
Grupa prątków
Gatunek
Barwa hodowli
I
Fotochromogenne
M. kansasii
M. simiae
Brak zabarwienia
kolonii bez dostępu
światła. Żółte lub
pomarańczowe po
naświetleniu
II
Skotochromogenn
e
M.scrophulaceu
m
M. gordonae
M.xenopi
Żółtopomarańczowe
zabarwienie kolonii
bez względu na
światło
II
I
Niefotochromogen
ne
M.avium
M.intracellulare
Słabo zabarwione lub
bezbarwne kolonie
IV
Szybkorosnące
M.fortuitum
M.phlei
U większości
gatunków kolonie
bezbarwne

Mycobacterium leprae
(prątek trądu) nie jest
zaliczany
do żadnej z powyższych grup. Nie da się go
hodować na
pożywkach sztucznych ani hodowlach
komórkowych.
Specjalne podłoże
półsyntetyczne-półpłynne MY pozwala uzyskać
hodowlę po
23-43tyg.
Jedynym zwierzęciem wrażliwym na zakażenie
M.leprae
jest pancernik.

Według definicji Światowej Organizacji
Zdrowia
za przypadek gruźlicy uważa się
przypadek potwierdzony
bakteriologicznie,
a zatem badanie to zawsze musi
towarzyszyć innej diagnostyce klinicznej

Badaniu w kierunku gruźlicy należy
poddać co najmniej 3 różne materiały
pochodzące od pacjenta.

Czym kierować się przy wyborze
metody diagnostycznej:
Przypadek do wykluczenia
hodowla na
pożywce
Lewensteina-
Jensena
Przypadek do potwierdzenia
dorosły czy
dziecko
postać gruźlicy
wynik
bakterioskopii
wspólne
uzgodnienia
lekarza i laboratorium

Diagnostyka mikrobiologiczna gruźlicy
1. Wykrycie prątków w materiale badanym
2. Sklasyfikowanie patogenu
3.Określenie wrażliwości na stosowane w terapii leki
4. Badanie stopnia odprątkowania chorego w trakcie leczenia

Materiały do badań – podejrzenie gruźlicy płuc :
plwocina
:
- spontaniczna
- indukowana
Popłuczyny żołądkowe
Popłuczyny oskrzelowe
Płyn uzyskany w trakcie płukania oskrzelowo-pęcherzykowy
Bronchoaspirat
Materiał ze szczotkowania
Materiał z oligobiopsji-wycinek

Plwocina
-
najodpowiedniejszy materiał w przypadku podejrzenia gruźlicy
układu oddechowego. Zaleca się pobranie 3 plwocin od jednego chorego.
Ślina jest materiałem nieprzydatnym!!!
Popłuczyny żołądkowe-
pobiera się od pacjentów nie wykrztuszających plwociny.
Trudny materiał diagnostyczny –enzymy soku żołądkowego działają na komórki
prątków (fałszywie ujemny wynik).
Wyższa wykrywalność u kobiet i dzieci-wrodzona tendencja do połykania
plwociny.
Płyn oskrzelowy-
pobierane podczas bronchoskopii. Pozwala często na
wykrycie prątków u chorych z negatywnym wynikiem popłuczyn żołądkowych.

Materiały do badań- podejrzenie gruźlicy
narządowej :
Mocz-
gruźlica nerek i dróg moczowych
Wyskrobiny z kości-
gruźlica kostno stawowa
Płyn mózgowo-rdzeniowy-
gruźlicze zapalenie
opon mózgowo rdzeniowych
Krew menstruacyjna-
gruźlica narządu rodnego

Materiały kliniczne badane w kierunku
obecności prątków
Rodzaj materiału
Minimalne ilości
Plwocina
10-15 ml
Popłuczyny pęcherzykowo-
oskrzelowe (BAL)
Ok.5-10 ml
Aspirat oskrzelowy
Ok.5-10 ml lub na szczoteczce
Popłuczyny żołądkowe
30-60 ml
Płyn z jamy opłucnej
10-15 ml lub bioptat z opłucnej
Płyn z worka osierdziowego
3-5 ml
Płyn mózgowo-rdzeniowy
2 ml
Mocz
200 ml
Krew
5-10 ml tylko od chorych na
AIDS i z niedoborami
immunologicznymi
1. Bakterioskopia
2. Metody hodowli
Metody wykrywania mykobakterii
3. Metody serologiczne
4. Metody genetyczne

Metody historyczne
• Barwienie Z-N
• Hodowla L-J
• Typowanie
biochemiczne
Metody nowoczesne
•
Obraz mikroskopowy
prątków w rozmazie
•
Hodowle płynne
•
Typowanie w metodzie
radioizotopowej, HPLC
•
Wykrywanie DNA, RNA
•
Badanie
pokrewieństwa
genetycznego
1. Bakterioskopia
Stwierdzenie obecności prątków w rozmazach wykonanych
z materiału klinicznego barwionego i oglądanego w mikroskopie
świetlnym lub fluorescencyjnym.
Metoda Ziehla Neelsena (Z-N)-
potwierdzenie kwasooporności
prątków
Metoda fluorescencyjna:
- Auramina
- Rodamina
- Oranż akrydyny
http://pathtalk.org/archives/22
www.lung.ca/tb/images/

Interpretacja badania bakterioskopowego
Liczba
prątków w
preparacie
BK (AFB)
Interpretacja
wyniku
1-9 w 100
polach
widzenia
+
Skąpe
prątkowane
1-9 w 10
polach
widzenia
++
Obfite
prątkowanie
1-9 w każdym
polu widzenia
+++
Bardzo obfite
prątkowanie

Badanie mikroskopowe to jedno z najważniejszych badań
w diagnostyce gruźlicy......
•
proste w wykonaniu
•
tanie
•
szybkie (ok.2h)
•
mało swoiste
•
mała czułość
•
10 000 komórek prątków w 1 ml
•
nie można odróżni prątków saprofitycznych
od chorobotwórczych

2. Wyhodowanie prątków
-
Złoty standard
-metoda bardziej czuła niż bakterioskopia
- umożliwia wykrycie małej ilości prątków
(ok. 10 kom/ml)
- typowanie wyhodowanego gatunku
-testy lekowrażliwości
- genetyczne prześledzenie łańcucha
epidemiologicznego
Przed posianiem materiał musi być poddany upłynnieniu,
dekontaminacji i zagęszczeniu

Opracowaną próbkę posiewa się na specjalne pożywki których skład jest
optymalny dla rozwoju prątków oraz hamuje rozwój innych bakterii.
Najczęściej używa się podłoża Lewensteina-Jensena
oraz Middlebrooka.
W trakcie prowadzenia hodowli (do 10 tyg.) prowadzone są
co tygodniowe odczyty.

Septi-Chek AFB
3 płytki do hodowania M.tuberculosis, MOTT i zanieczyszczeń
umieszczone są w jednej butelce.Dodatkowo, prowadzi się hodowlę
na podłożu płynnym. Wzrost prątków odczytywany jest wizualnie
już po 7 dniach.
www.bd.com/ds/productCenter/MT-Ma
nual.asp

MGIT (Mycobacteria Growth Indicator Tube)
www.bd.com/ds/productCenter/BactecMgit9
60Myco...
Płynny system hodowli na pożywce
Middlebrooka 7H9 z odczynnikiem
fluorescencyjnym który reaguje
na stężenie O
2
w pożywce. Wzrost
odczytywany jest po 7-8 dn. jako
pomiar reakcji fluorescencyjnej (UV).

MB Redox
Płynny system hodowli na podłożu wzbogaconym w surowicę
z dodatkiem soli tereazolowych, które w wyniku aktywnego
metabolizmu prątków ulegają redukcji do barwnego formazanu.
Wzrost mykobakterii oceniany jest wizualnie,
na podstawie barwnego produktu (od żółtego do czerwonego).

Bactec 460-Tb
www.bd.com/scripts/philippines/products
drilld...
Hodowla w pożywce 7H9 zawierającej jako substrat
wzrostowy kwas palmitynowy znakowany
izotopem węgla
14
C. W czasie wzrostu prątki
zużywają substrat i wydalają
14
CO
2
. Mierzona
radioaktywność to tzw. indeks wzrostu.
Odczyt 2-3 razy w tyg. wyniki już po 6 dn.
Diagnostyka materiałów skąpoprątkowych.

Kolorymetryczny system MB/BacT
Prątki hodowane są na pożywce 7H9 a wytwarzany CO
2
powoduje zmianę zabarwienia sensora umieszczonego
na dnie butelki z zielonej na żółtą. Sygnał detekcyjny
w sposób ciągły przekazywany jest do komputera który
rejestruje intensywność wzrostu prątków

Odsetek dodatnich wyników w różnych
metodach hodowli
MB/BacT
Bactec
460
L-J
Mycobacteri
um
tuberculosis
complex
84,5
91,2
70,9

3. Metody serologiczne
Badania serologiczne istotne w gruźlicy wieku dziecięcego oraz
pozapłucnej.
Stosowana jest metoda ELISA oceniająca obecność
Ab przeciwko Ag 38kDa oraz A60.
Czułość tej metody to 30-70 %
Odporność przeciwko prątkom ma charakter
komórkowy a nie humoralny. Odporność
humoralna rośnie wraz ze wzrostem
zaawansowania zmian.

4. Metody genetyczne:
Sondy genetyczne
Polimerazowa reakcja łańcuchowa PCR
Polimorfizm fragmentów restrykcyjnych RFLP
Chromatografia
W 1998r S.T. Cole i wsp. opublikowali
w swej pracy pełną sekwencję genomu prątka gruźlicy
należącego do szczepu H37Rv

Sondy genetyczne
Poprzez wykorzystanie naturalnej zdolność kwasów nukleinowych do tworzenia
hybryd pomiędzy komplementarnymi łańcuchami polinukleotydowymi,
konstruuje się sondy genetyczne złożone z różnej liczby nukleotydów.
Zastosowanie sondy wymaga wcześniejszego namnożenia bakterii
do odpowiedniej gęstości 10
8
-10
9
komórek.
Wyznakowane radioaktywnie lub fluorescencyjnie fragmenty
RNA lub jednoniciowego DNA o sekwencji komplementarnej do
jednej z nici poszukiwanego genu.
Schemat wykonywania badania z użyciem
sondy genetycznej
I. Liza komórek prątków,
oczyszczenie kw. nukleinowych
II. Reakcja z sondami związanymi z
chemicznym znacznikiem
(estry akrydyny, alkaliczna fosfataza)
III. Włączenie znacznika po rozpoznaniu sekwencji
komplementarnej do sondy- powstanie
dwuniciowej hybrydy
IV. Oddzielenie dwuniciowych cząsteczek od jednoniciowych.
Obecność hybrydy wykrywa się metodą chemiluminescencj lub
dodając substrat dla alkalicznej fosfatazy-reakcja barwna.

PCR – polimerazowa reakcja łańcuchowa
Umożliwia wykrycie kwasów nukleinowych prątków
bezpośrednio w materiałach klinicznych. Polega na wielokrotnej
amplifikacji wybranych odcinków genomu prątka. Najczęściej
amplifikowanymi sekwencjami są wstawki insercyjne IS 6110,
IS 986, antygeny HPB 70 i HPB 64.
Zamplifikowany produkt wykrywa się przy pomocy
znakowanych sond.

Sekwencje insercyjne to krótkie fragmenty DNA (500-3000 pz.),
będące rodzajem elementów transpozycyjnych.
W przypadku M. tuberculosis wykazano wysoką stabilność tych elementów
co umożliwiło prowadzenie badań bez ryzyka wpływu transpozycji
na uzyskiwane wzory prążków.
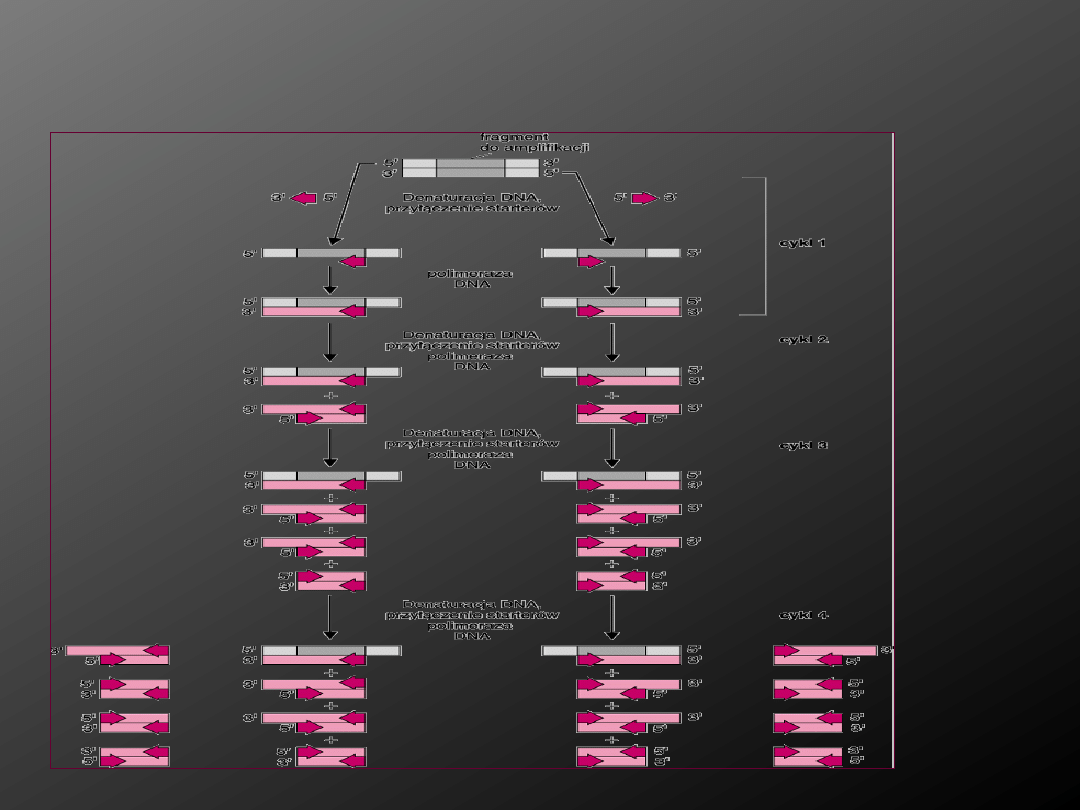
Przebieg
reakcji PCR
http://www.wiw.pl/Biologia/Genetyka/JezykGenow/BigImage.asp?ce=28&cp=1

Polimorfizm fragmentów restrykcyjnych
RFLP
Metoda ta służy do wykrywania różnic w budowie
DNA u różnych szczepów M.tuberculosis głównie
w celach epidemiologicznych.
Oceniana jest ilość oraz umiejscowienie w genomie
prątka sekwencji insercyjnej IS 6110. Wcześniej pocięte
enzymami restrykcyjnymi fragmenty DNA bakterii
ulegają hybrydyzacji ze znakowanymi sondami.
Układ fragmentów restrykcyjnych (prążków) jest
charakterystyczny dla danego gatunku,
można więc go użyć do identyfikacji
gatunku, lub nawet szczepu bakterii.

Etapy reakcji RFLP:
1.Ekstrahowanie DNA z komórek prątków
2. Poddanie go działaniu enzymów restrykcyjnych
3.Rozdzielenie fragmentów restrykcyjnych na żelu agarozowym
4. Przeniesienie rozdzielonego materiału na nylonową membranę
5.Hybrydyzacja ze znakowanymi sondami komplementarnymi do
fragmentu insercyjnego IS6110
6. Odczyt komputerowy układu i ilości linii odpowiada
wielkość poszczególnych fragmentów
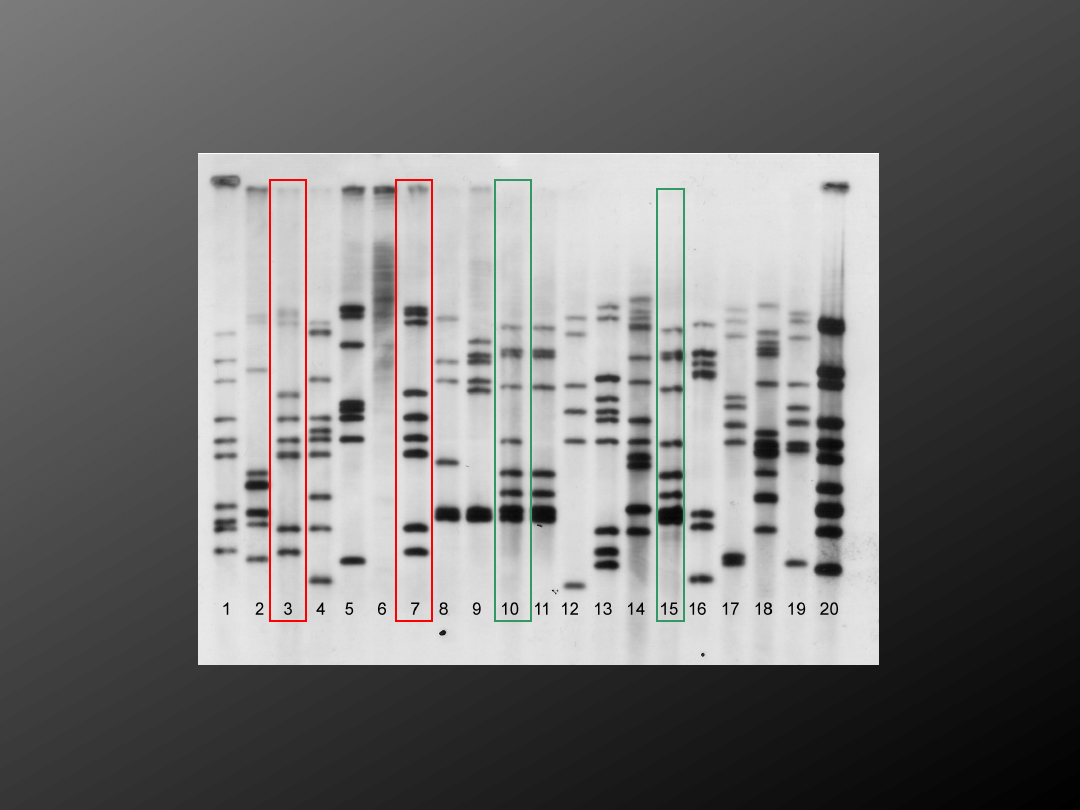
www.scielo.org.ar/scielo.php?pid=S0325
-754120...
Epidemiologia molekularna gruźlicy lek. Michał Krawczyk, prof. dr hab. n med.
Sylwia Kwiatkowska
Analiza RFLP 20 szczepów klinicznych M. tuberculosis od pacjentów z gruźlicą
płuc z terenu Łodzi

Metody chromatograficzne- cieczowa
chromatografia wysokociśnieniowa
Ocenia się różnice w składzie ilościowym i jakościowym kwasów
mykolowych u prątków.
Rozdział wyekstrahowanych kwasów mykolowych zachodzi na
specjalnych kolumnach a uzyskane wzory elucyjne są swoiste
dla danego gatunku prątka.
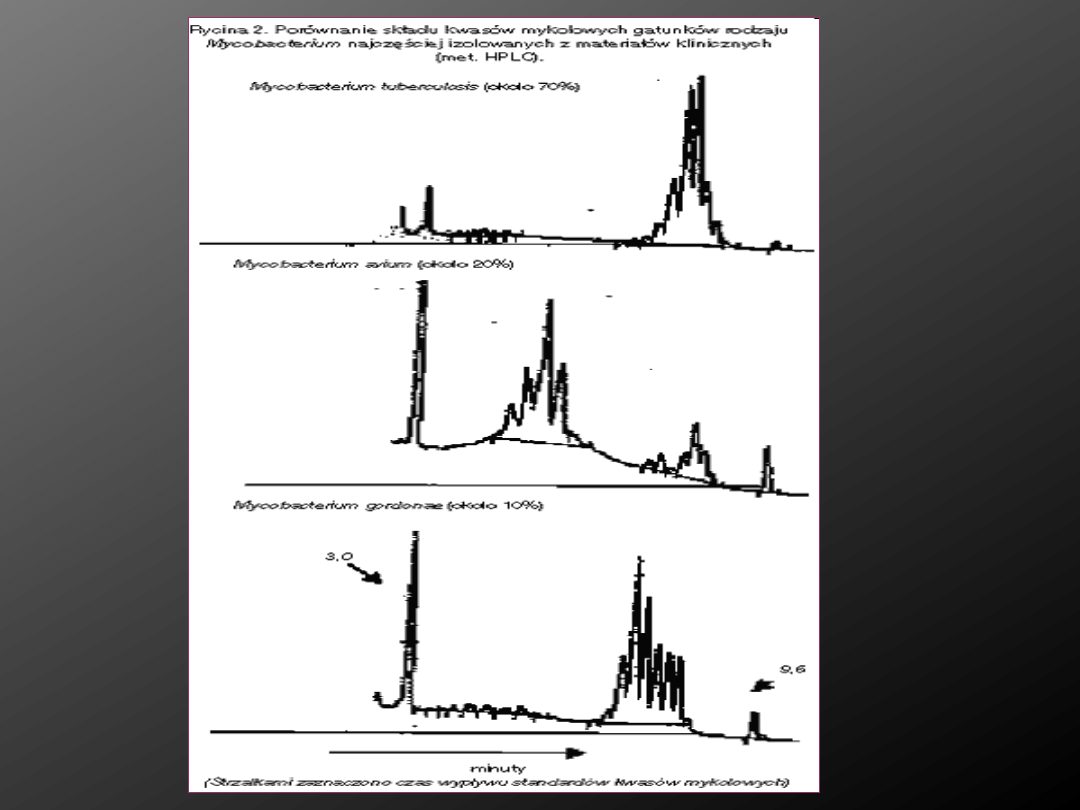

Wykorzystanie metod biologii
molekularnej gruźlicy
Porównując poszczególne genotypy można odnaleźć szczepy,
które charakteryzują się identycznymi wzorami. Świadczyć to
może o transmisji danego szczepu w środowisku.Różne genotypy
stanowią o różnych źródłach zakażenia. Można tym samy śledzić
ewentualne ogniska epidemii gruźlicy lub też wykazać dużą liczbę
jednocześnie występujących, niezwiązanych ze sobą przypadków choroby.
Analiza szczepów wyizolowanych od jednego pacjenta w różnych
punktach czasowych, w przypadku kolejnego zachorowania na gruźlicę.
Ponowne wyizolowanie szczepu o tym samym genotypie stanowi dowód
na reaktywację endogenną. Wówczas możemy kierować się pierwotnie
uzyskanym wzorem lekowrażliwości. Uzyskanie szczepu
odmiennego wskazuję na infekcję egzogenną.
Metody genotypowania są pomocne w udokumentowaniu krzyżowego
zakażenia próbek laboratoryjnych co jest szczególnie istotne w przypadkach
wątpliwego obrazu klinicznego i radiologicznego w kontekście rozpoznania gruźlicy
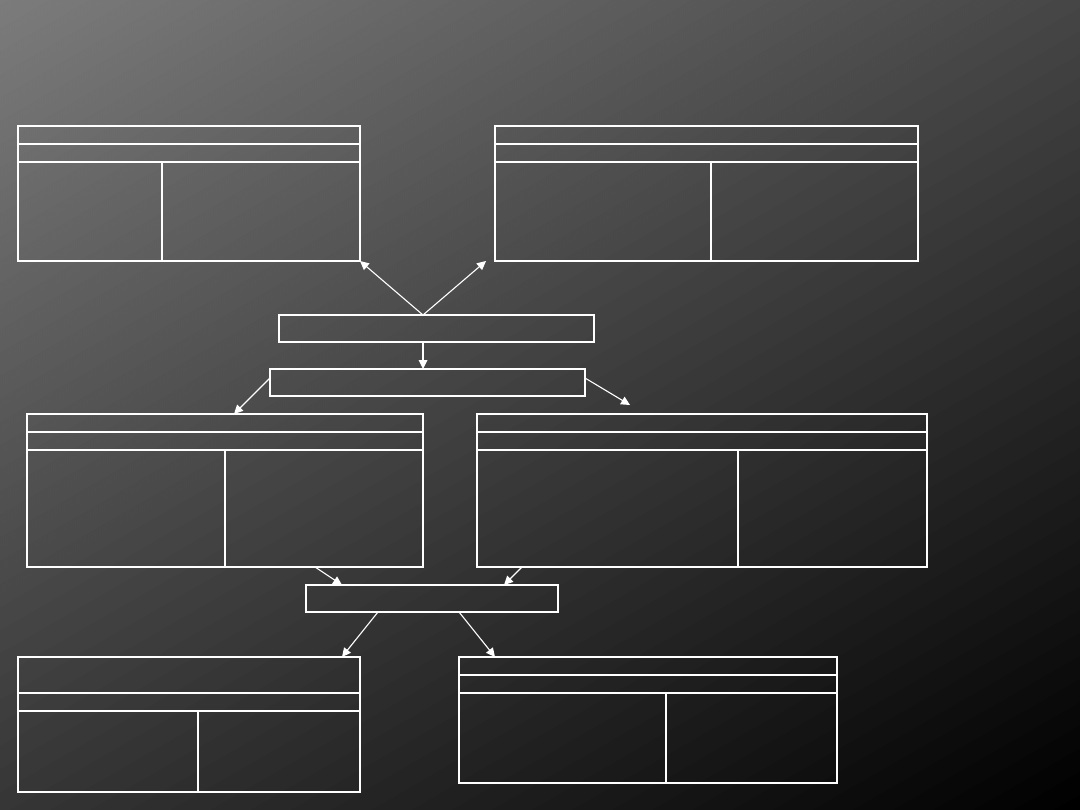
Porównanie zalet (+) i wad (-) tradycyjnych i nowoczesnych metod wykrywania prątków gruźlicy i
atypowych
Bakterioskopia bezpośrednia
(+) (-)
Czas wykonania ok. 2h
Nie różnicuje prątków
żywych i martwych
Nie różnicuje gatunków
prątków (gruźlica, mykobakteriozy,
zanieczyszczenie saprofitem
Metody biologii molekularnej- sondy genetyczne, PCR
(+) (-)
Czas wykonania badania- kilkanaście
godzin
Czułość 70%-90 %
Swoistość 100 %
Nie różnicuje gatunków żywych
i martwych
Konieczność wyszkolenia personelu
Specjalistyczna aparatura
Wysoka cena badania
Kliniczny materiał diagnostyczny
Hodowle na pożywkach
Typowanie gatunku
Posiew na pożywce L-J
(+) (-)
Potwierdzenie obecności żywych
prątków
Pozyskanie szczepu do typowania
gatunku i badania lekowrażliwości
Czułość ok. 70%
Niska cena
Czas oczekiwania na wynik
ok. 6 – 8 tyg.
Posiew na pożywce 7H9- badanie w systemie Bactec 460TB, MB Redox, MGIT
(+) (-)
Potwierdzenie obecności żywych prątków
Pozyskanie szczepu do typowania gatunku
i badania lekowrażliwości
Czułość 70 %
Skrócony czas oczekiwania na wynik
Specjalistyczny sprzęt
Wyszkolenie personelu
Wysokie ceny badania
Typowanie tradycyjnymi metodami mikrobiologiczno-bioche-
micznymi
(+) (-)
Spopularyzowane metody
podręcznikowe
Czas wykonania 28-42 dn.
Typowanie metodami analizy kwasów mykolowych- HPLC
(+) (-)
Czas wykonania-kilkanaście godzin
swoistość 90%
Możliwość rozróżnienia ponad
30 gatunków Mycobacterium
Specjalistyczna aparatura
wyszkolony personel

1. Do jakich 2 grup należą prątki mogące być patogenami człowieka?
Mycobacterium tuberculosis complex, MOTT
2. Twórcą jakiej klasyfikacji był Runyon i w oparciu o jaką cechę drobnoustrojów ją stworzył?
Sklasyfikował prątki atypowe w oparciu o barwę kolonii
3. Jaki materiał pobieramy od pacjenta przy podejrzeniu gruźlicy płuc?
Plwocina, popłuczyny żołądkowe, popłuczyny oskrzelowe, wycinek,
płyn oskrzelowo-pęcherzykowy, bronchoaspirat, materiał ze szczotkowania
4. Co stanowi złoty standard w diagnostyce mikrobiologicznej gruźlicy?
Wyhodowanie prątków
5. Dlaczego stosowanie diagnostyki serologicznej jest ograniczone?
Odpowiedź przeciwko prątkom gruźlicy ma charakter komórkowy
6. Jaki jest cel reakcji PCR?
Amplifikacja wybranego odcinka DNA

7. Czemu w badaniach genetycznych wykorzystuje się IS6110?
Przez wzgląd na jej stabilność- brak ryzyka transpozycji
8. W jakich celach wykorzystuje się analizę fragmentów restrykcyjnych DNA prątków?
Głównie w celach epidemiologicznych
9. Co poddaje się analizie w metodzie cieczowej chromatografii wysokociśnieniowej
Kwasy mykolowe prątków
10. Główny składnik ściany komórkowej Mycobacterium tuberculosis
Lipidy
Unikalne cechy Mycobacterium tuberculosis
Kwaso-, zasado-, alkoholo-oporne
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
- Slide 41
- Slide 42
- Slide 43
- Slide 44
- Slide 45
- Slide 46
- Slide 47
- Slide 48
- Slide 49
- Slide 50
- Slide 51
- Slide 52
- Slide 53
Wyszukiwarka
Podobne podstrony:
Prawo Cywilne wyklad (Word 97-2003) 8.10.2009, prawo cywilne(13)
opracowanie pytań 2009 wersja 97-2003, mechatronika
Technologia spawania stali wysokostopowych 97 2003
ISM Code 97 2003
LEASING 97 2003
SES 97 2003
Pranie brudnych pieniędzy - konspekt 97-2003, Studia, Zarządzanie, Handel i inwestycje zagraniczne
wzor zaswiadczenia lekarskiego - obszar C Pegaz 2003, DOKUMENTY WNIOSKI PFRON
ZAGADNIENIA word 97-2003, Studia licencjackie- UTH Ekonomia
ANTROPOLO SCIAGI 97-2003, APS i inne naukowe, antropologia kulturowa
Nadczynnosc tarczycy 97-2003, szkola
Kopia Wykład 6 folie (word 97-2003), Studia - Gospodarka Przestrzenna UEP, I stopień, III semestr, F
program cwiczenia 2008 2009 lekarski[1]
Wykłady od PODZIAŁU nieruchomości (97 2003)
ćw52 97-2003, Towaroznawstwo SGGW, Rok I, Semestr I, fizyka, Fizyka, Fizyka, Sprawozdania
mimośrody 97-2003(1), Geodezja
wielka brytaniaword 97-2003
więcej podobnych podstron