
Odczyn roztworu charakteryzuje kwasowe lub
zasadowe właściwości roztworu. Odczyn kwaśny, to
taki stan roztworu wodnego, w którym, w roztworze, są
obecne jony wodorowe. Jest to jednak stwierdzenie
bardzo "jakościowe" - ściślej, należałoby podać wartość
stężenia molowego jonów H
+
, oznaczanego najczęściej
symbolem [H
+
].Zatem odczyn kwasowy oznacza,
że w roztworze stężenie jonów wodoru jest
większe niż stężenie anionów wodorotlenkowych
[H
+
] >[OH
-
]. Analogicznie zdefiniować można odczyn
zasadowy, jako taki stan roztworu, w którym obecne
są w nim jony OH
-
, a ściślej, podając ich stężenie, [OH
-
]
w roztworach wodorotlenków, czy - szerzej – zasad
,odczyn zasadowy [H
+
] <[OH
-
].
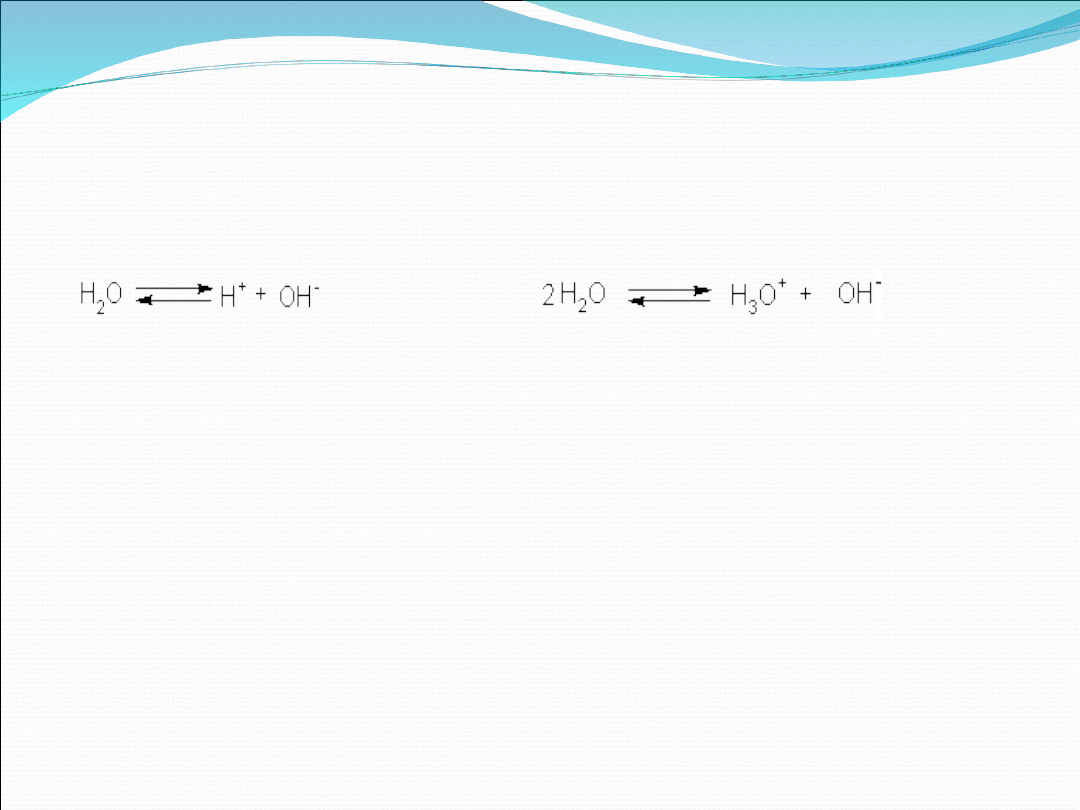
Można by więc przypuszczać, że roztwór obojętny, to roztwór
wodny, który nie zawiera ani jonów wodorowych, ani wodorotlenowych.
Tyle, że taki roztwór wodny ... nie istnieje. Okazuje się bowiem, że
woda ulega w niewielkim stopniu samorzutnej dysocjacji (tzw.
autodysocjacji) na jony:
a ściślej:
Można, więc stwierdzić, że odczyn obojętny jest wynikiem równowagi
między jonami wodoru i anionami wodorotlenku [H
+
] =[OH
-
].
Co więcej, z tzw. prawa działania mas wynika, że dla reakcji
autodysocjacji wody obowiązuje stała równowagi, która w tym
przypadku przyjmuje postać tzw. iloczynu jonowego wody:
K
w
= [H
+
]·[OH
-
] = 10
-14
temperatura pokojowa
Iloczyn jonowy wody to iloczyn stężęń jonów wodorowych i
wodorotlenkowych. Iloczyn jest wielkością stałą w danej
temperaturze.
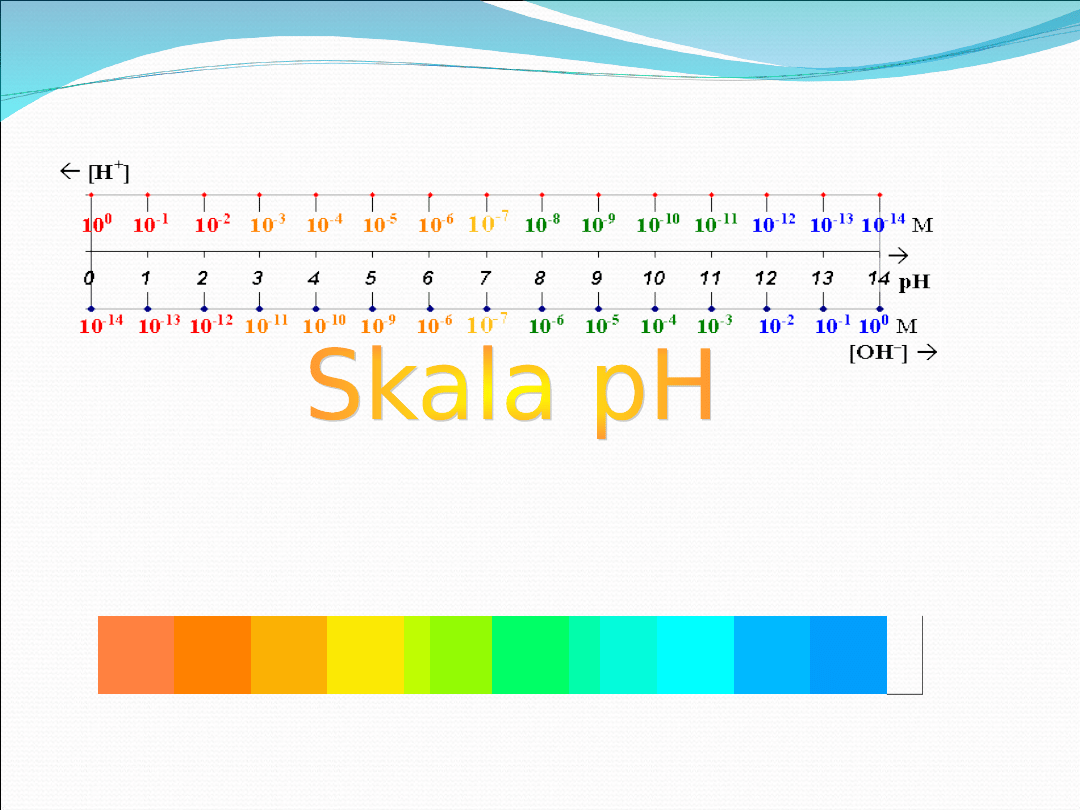
Skala pH, czyli skala odczynu roztworu- jest to skala wartości
liczbowych od 1-14, odpowiadających tężeniu jonów wodoru w
roztworze. Liczby 1-6 oznaczają odczyn kwaśny, 7- odczyn obojętny,
natomiast 8-14 odczyn zasadowy.
<--- odczyn kwaśny
obojętny
odczyn zasadowy --->
3
4
5
6
7
8
9
10
11
12
13
14
Zależność pH od wartości stężenia jonów wodorowych i
wodorotlenowych można przedstawić następującym
diagramem:
Skala pH, która mieści się w granicach 1-14, została wprowadzona w
1909 roku przez Petera Soerensena, duńskiego biochemika i
fizykochemika żyjącego w latach 1868-1939. Celem określenia pH
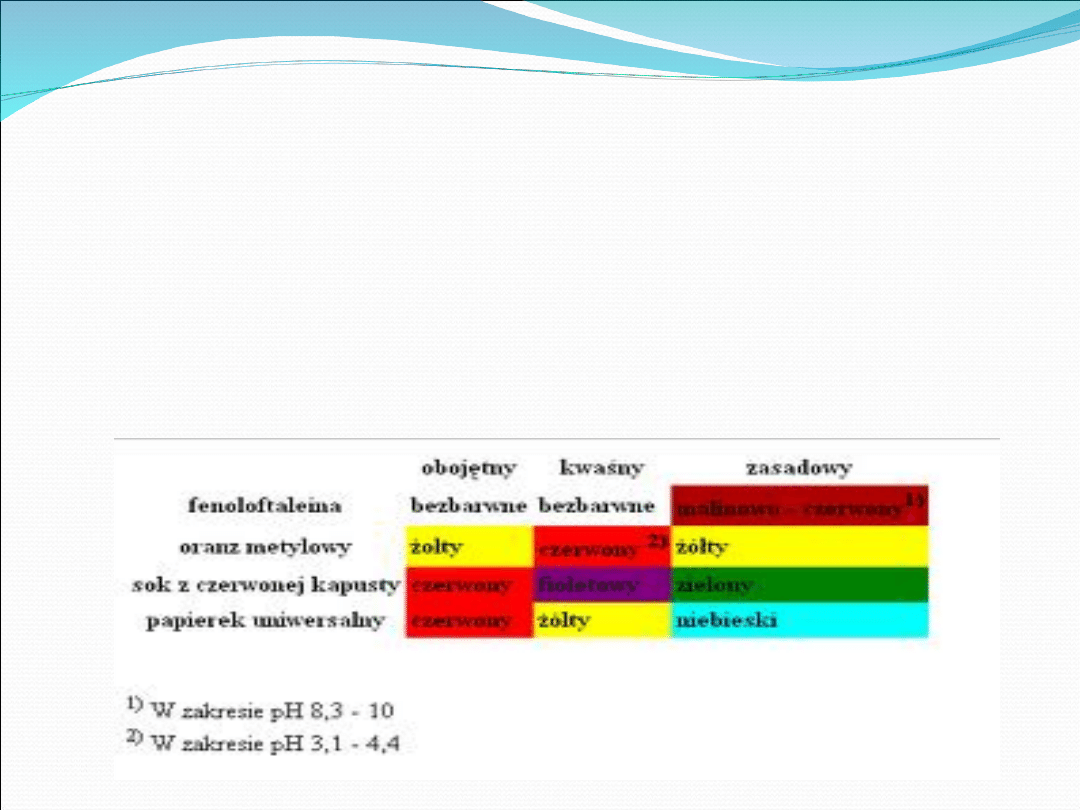
roztworu stosuje się tzw. wskaźniki pH, czyli substancję, których
barwa zmienia się w odpowiedni kolor w zależności od odczynu
roztworu. Wskaźnikami są między innymi: oranż metylowy
,fenoloftaleina, sok z czerwonej kapusty, papierek uniwersalny.

Przez odpowiednie mieszanie wskaźników pH, można otrzymać
wskaźniki uniwersalne, które zależnie od pH roztworu przybierają
charakterystyczną barwę. Przez nasycenie pasków bibułki
roztworami takich wskaźników uniwersalnych i wysuszenie ich
otrzymuje się papierki uniwersalne, stosowane często w
laboratoriach chemicznych do szybkiego określania pH danego
roztworu. Papierki te połączone są często razem z książeczką, na
której okładce jest barwna skala. Odczyn roztworu określa sie,
zanurzając pasek bibułki w badanym roztworze i porównując
uzyskany kolor z barwą dołączonej skali. Wskaźniki uniwersalne,
które obejmują szeroki zakres pH (około 10 jednostek pH),
pozwalają jedynie na oszacowanie wartości pH (z dokładnością
do 0,5 jednostki pH). Znacznie dokładniej pH roztworu można
zmierzyć za pomocą urządzenia zwanego pehametrem.

Pojęcie pH zadomowiło się w języku codziennym. Często
wartośc pH jest podawana na opakowaniach
kosmetyków, różnego rodzaju napoi, w reklamach.
Celem jest oczywiście zwrócenie uwagi na odczyn
roztworu.
Znajomość skali pH i reakcji środowiska na zmiany pH,
pozwala nam kontrolować i dobierać tak substancje aby
przebiegające procesy były optymane dla danego
układu. Szczególnie jest to ważne dla procesów
biologicznych, które są bardzo czułe na mninimalne
zmiany pH.
Przykład: Gleba, na której sadzimy rośliny, musi mieć
odpowiednie pH, by zapewnić roślinom optymalne
warunki wegetacji.

Wartości pH niektórych roztworów znanych Wam z życia są
następujące:
krew pH = 7,35 - 7,45
mleko pH = 6,5
sok żołądkowy pH = 1,0 - 2,0
ocet pH = 3,0
coca cola pH = 2,5 - 3,0
woda destylowana pH = 7,0
woda sodowa pH=5,5
sok pomarańczowy pH= 3,5
amoniak spożywczy(NH
4
HCO
3
) pH=11,5
preparat do udrażniania rur pH=14,0
łzy pH=7,4
soki cytrynowy pH=2,4
sok grapefruitowy pH=3,2

pH+pOH=14
[H
+
] =[OH
-
] -> pH= 7 – ODCZYN OBOJĘTNY
JEŻELI [H
+
] <[OH
-
] ->
pH>7– ODCZYN
ZASADOWY
[H
+
] >[OH
-
] -> pH<7- ODCZYN KWAŚNY
pH= -log [H
+
] pOH= -log[OH
-
]
ZATEM W ROZTWORZE O pH=3 STĘŻENIE
JONÓW H
+
WYNOSI 10
-3
mol/dm
3
.
JEŻELI STĘŻENIE JONÓW H
+
WYNOSI 10
-12
mol/dm
3
TO pH =12.

1.Oblicz pOH i pH roztworu NaOH o stężeniu 0,0001 mol/dm
3
.
NaOH Na
+
+ OH
-
Cm=0,001 mol/dm
3
[OH
-
] = 10
-3
pOH =-log [OH
-
]
pOH=-log *10
-3
pOH=3 czyli pH= 11 zgodnie z pH+pOH=14
pH=14-3
pH= 11
2. Oblicz pOH i pH roztworu Ba(OH)
2
o stężeniu 0,005 mol/dm
3
.
Ba(OH)
2
Ba
2+
+2 OH
-
Cm=0,005 mol/dm
3
[OH
-
] = 0,005*2=0,01 [OH
-
] =10
-2
pOH =-log [OH
-
]
pOH=-log *10
-2
pOH=2 czyli pH= 12 zgodnie z pH+pOH=14 pH=14-2 pH= 12
3. Oblicz pOH i pH roztworu H
2
SO
4
o stężeniu 0,5 mol/dm
3
.
H
2
SO
4
2H
+
+ SO
42-
Cm=0,5 mol/dm
3
[H
+
] = 0,5*2=1
pH=-log *1
pH=0 pOH= 12 zgodnie z pH+pOH=14 pOH=14-0
pOH= 14
Document Outline
Wyszukiwarka
Podobne podstrony:
prezentacja2 11
Prezentacja 11 okres poniemowlęcy i przedszkolny
PZ, prezentacja 11
PREZENTACJA 11
prezentacje, PZ prezentacja 11
Prezentacja 11 Fundusze inwestycyjne
Epidemiologia prezentacja 11
Prezentacja 11 03 id 390070 Nieznany
Prezentacja (11)
prezentacja2 11
OCHRONA ŚRODOWISKA prezentacja 11
prezentacja 11
neuro prezentacja 11 niebieska
prezentacja 11
Prezentacja1 11
więcej podobnych podstron