
Węglowodory
aromatyczne
alkohole
Alifatyczne węglowodory
cykliczne
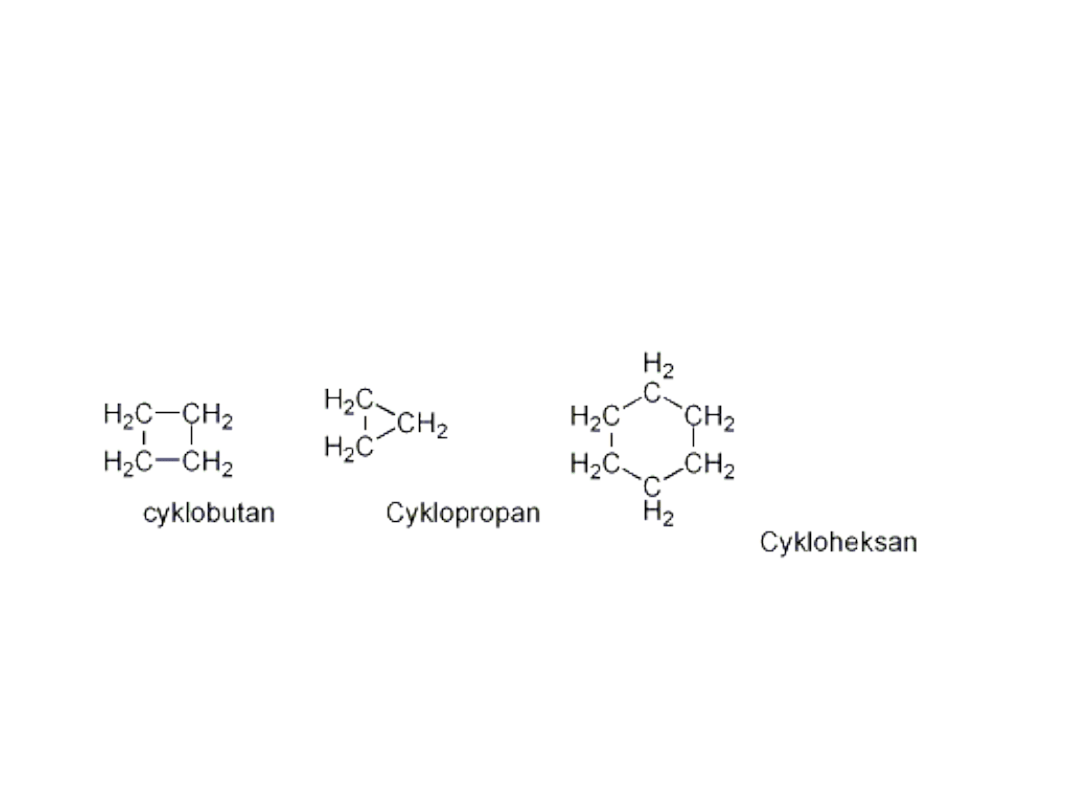
• Przykłady związków cyklicznych
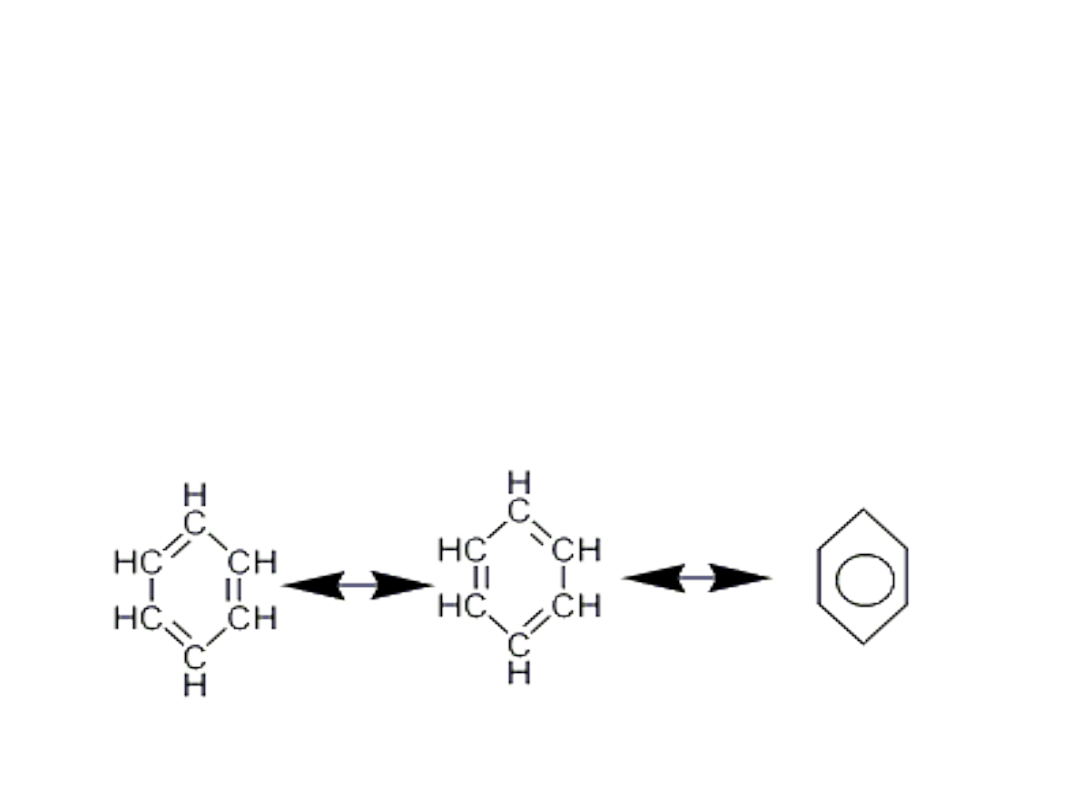
Budowa cząsteczki benzenu
• Benzen należy do grupy węglowodorów
aromatycznych
• Wzór sumaryczny C
6
H
6
• Struktury rezonansowe benzenu – wzory
Kekulego

• Benzen jest hybrydą struktur I i II, długość wiązań między
atomami węgla jest taka sama, w cząsteczce benzenu nie
występują na przemian 3 wiązania pojedyncze i 3
podwójne. Wiązanie C-C ma charakter wiązań
półtorakrotnych. Wszystkie wiązania w benzenie są
równocenne
• W benzenie atomy węgla wykazują hybrydyzację sp
2
–
cząsteczka jest płaska, a kąt między atomami węgla wynosi
120º.
• C C H
Między atomami węgla występuje jedno wiązanie σ i jedno
wiązanie π, które powstaje w wyniku nałażenia bocznego
niezhybrydyzowanych orbitali p węgla. Następuje
delokalizacja elektronów π, które obejmują całą cząsteczkę
i w równym stopniu należą do każdego atomu węgla.
σ
σ

• Elektrony π są łatwo dostępne dla reagentów
poszukujących elektronów (elektrofilów), z powodu
stabilności pierścienia benzenowego, następuje
podstawienie (substytucja) czynnikiem
elektrofilowym i nie zostaje zakłóconych charakter
aromatyczny związku.
• Związek aromatyczny musi posiadać chmurę
zdelokalizowanych elektronów π poniżej i powyżej
płaszczyzny pierścienia ( cząsteczka musi być
płaska) oraz ilość zdelokalizowanych elektronów π
musi spełniać zasadę Hückla 4n + 2 ( n = 0,1,2….)
• Związki aromatycznych nie ulegają reakcjom
charakterystycznym dla węglowodorów
nienasyconych czyli addycji i eliminacji – nie
odbarwiają wody bromowej, nie ulegają hydrogenacji
• Związki aromatyczne ulegają reakcji substytucji
elektrofilowej
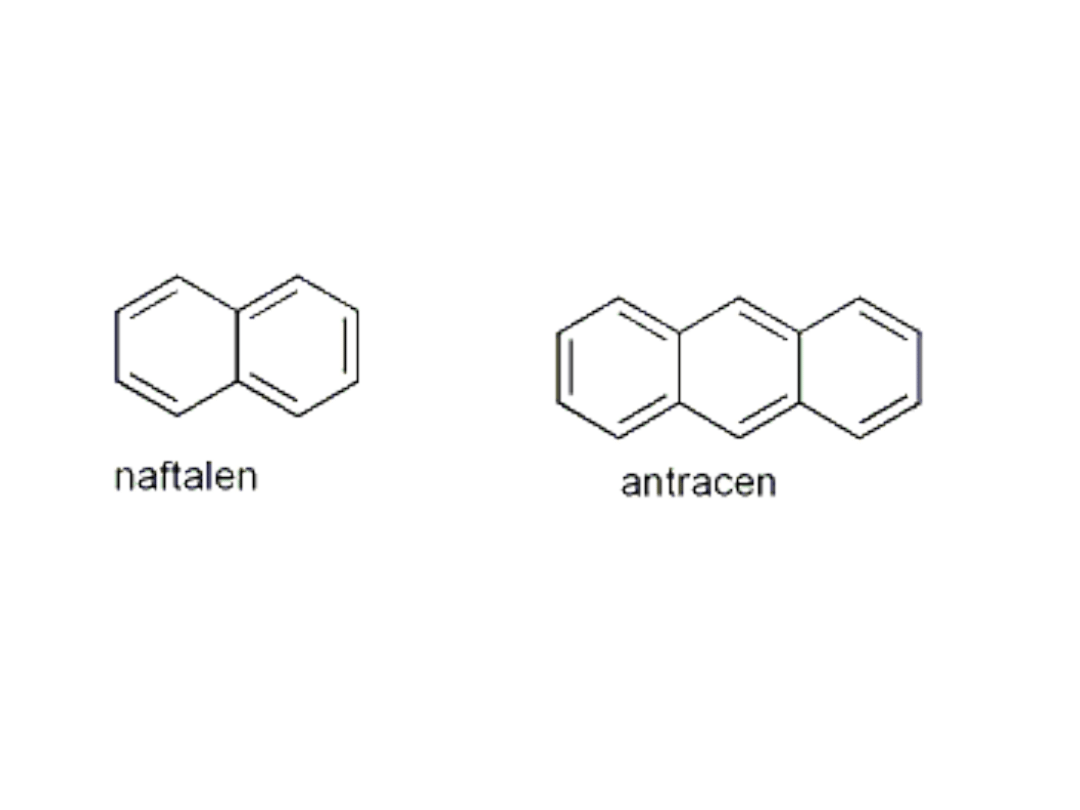
Przykłady innych związków aromatycznych
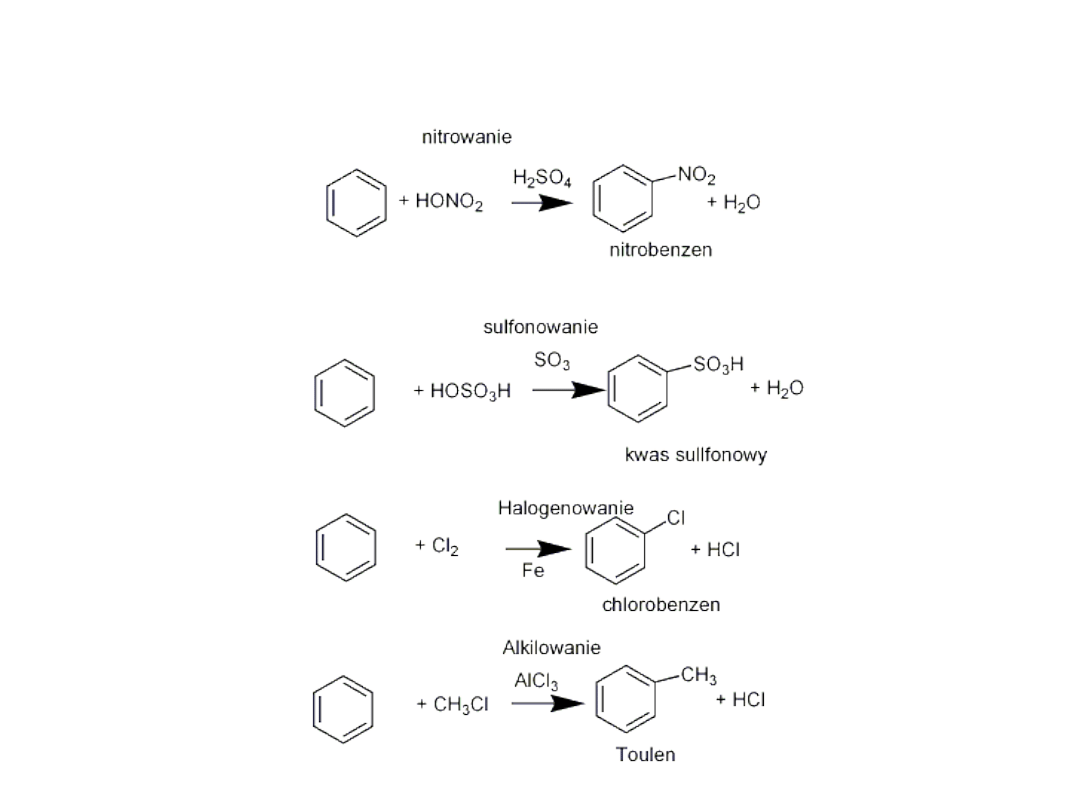
Przykłady reakcji substytucji elektrofilowej
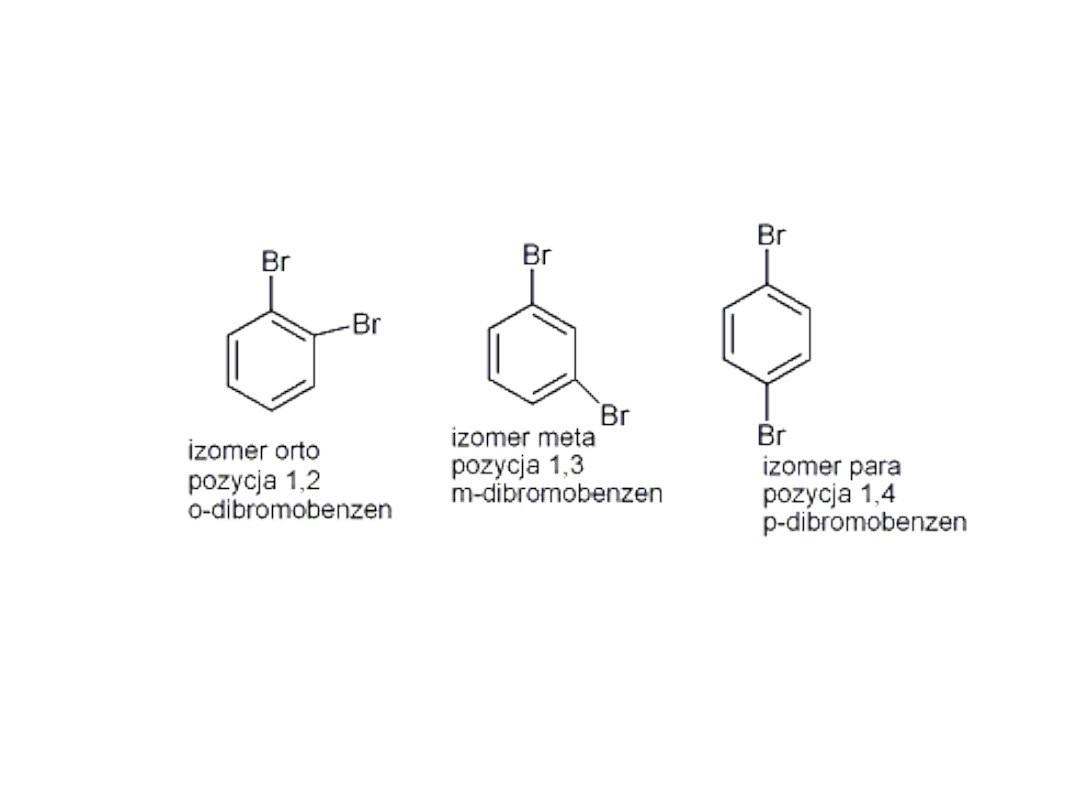
Izomery pochodnych benzenu
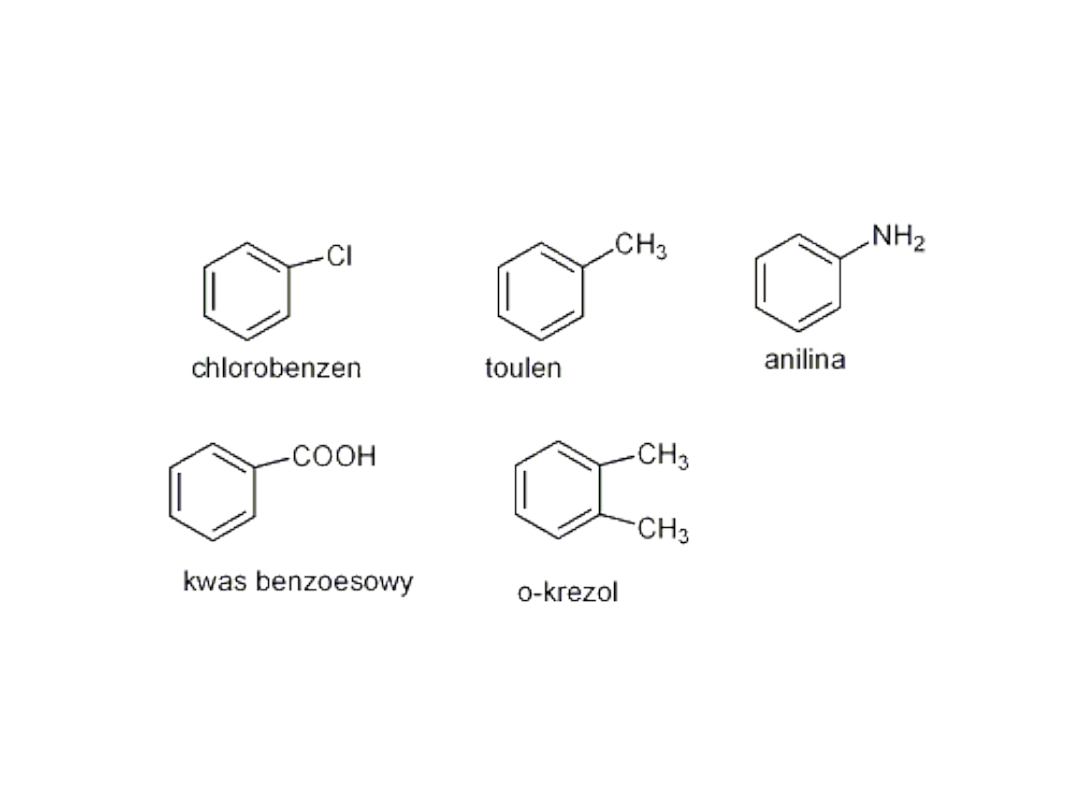
Nazewnictwo pochodnych
benzenu

Kierujący wpływ podstawników
• Grupa, która zwiększa reaktywność pierścienia
aromatycznego nazywa się grupą aktywującą
• Grupa, która obniża jego reaktywność to grupa
dezaktywująca.
• Grupy aktywujące i kierujące w położenie orto i
para - -OH; -CH
3
; -OCH
3
: -NH
2
• Grupy dezaktywujące i kierujące w położenie
orto i para - -F; -Cl; -Br; -I
• Grupy dezaktywujące i kierujące w położenie
meta - -NO
2
; -CN; -COOH; -CHO; - SO
3
H
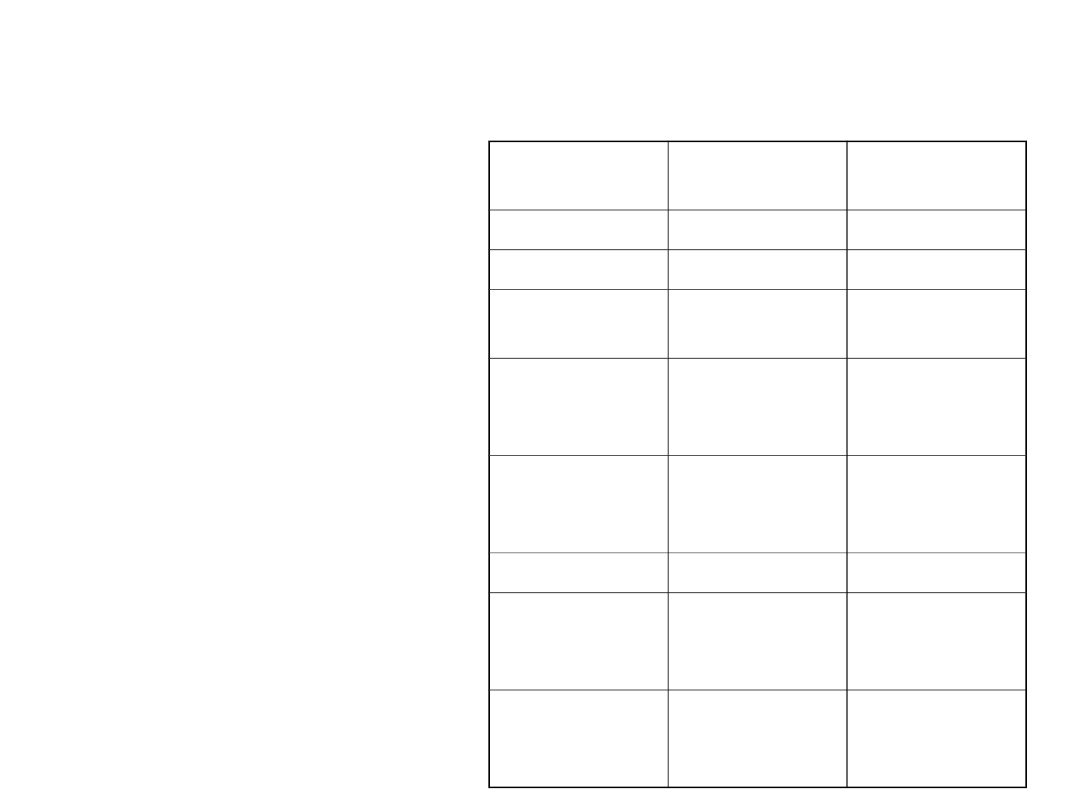
Destylacja i obróbka ropy naftowej
• Ropę naftową rozdziela się
na frakcję przy pomocy
destylacji
frakcja
Temperatura
ºC
Ilość at. C
Gaz
Poniżej 20
1-4
Eter naftowy 20-60
5-6
Lekka nafta
(ligroina)
60-100
6-7
Gazolina
(surowa
benzyna)
40-205
5-10 i
cykloalkany
nafta
175-325
12-18 i zw.
Aromatyczn
e
Olej gazowy
Poniżej 275
12 i wyższe
Olej surowy
Nielotna
ciecz
Rozgałęzion
e długie
łańcuchy
Asfalt i koks
Nielotne
ciało stałe
Struktury
polimeryczn
e

• Katalityczna izomeryzacja – powoduje przekształcenie
alkanów łańcuchowych w alkany rozgałęzione.
•
Proces krakowania powoduje rozpad wyższych
alkanów do niższych homologów oraz do alkenów – w
ten sposób zwiększa się ilość frakcji benzynowej.
• Kraking - inaczej piroliza – czyli rozpad związków pod
wpływem ciepła.
• Rodzaje krakingu:
- katalityczny – olej gazowy poddaje się rozkładowi w
temperaturze 450-550ºC pod niewielkim ciśnieniem
- termiczny alkany przepuszcza się przez ogrzewana
komorę.
•
Reforming katalityczny- alkany i cykloalkany zostają
przekształcone w węglowodory aromatyczne i w ten
sposób uzyskuje się surowce do syntezy przemysłowej
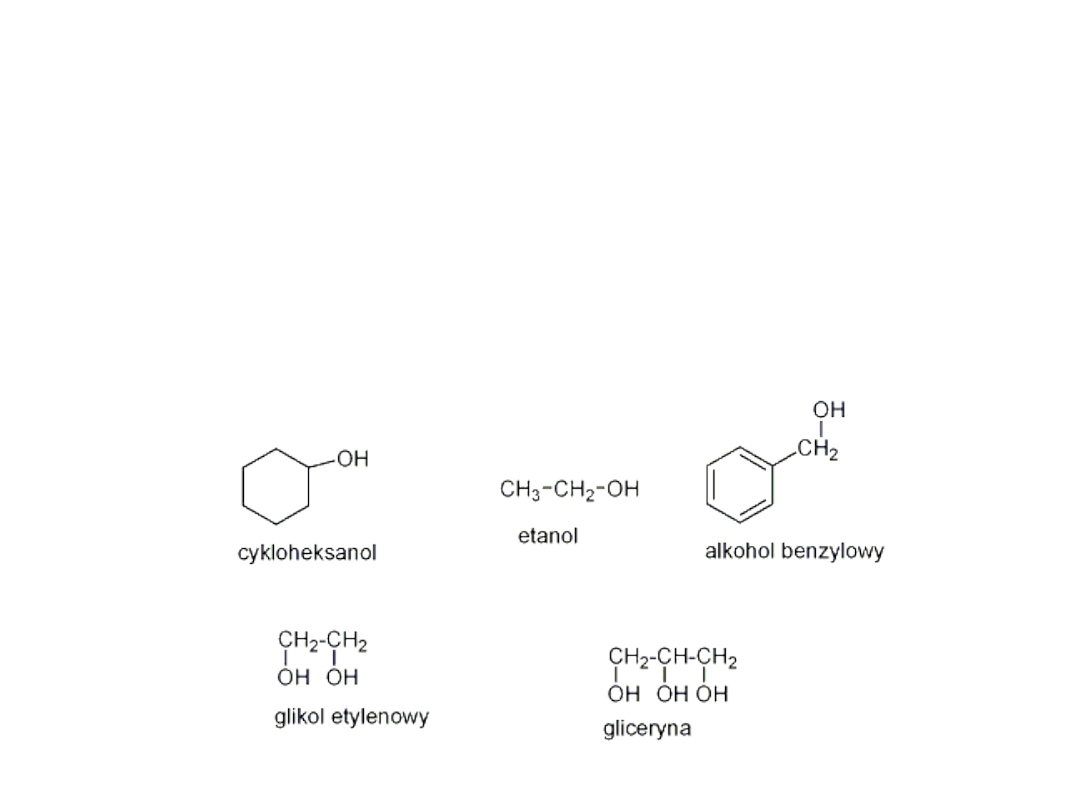
Alkohole
• Alkohole są związkami o wzorze ogólnym R- OH, gdzie
grupa -OH to grupa hydroksylowa –tzw. Grupa funkcyjna ,
decydująca o właściwościach fizycznych i chemicznych tej
grupy związków organicznych.
• Związki w których grupa hydroksylowa jest połączona z
pierścieniem aromatycznym nazywamy fenolami ( ze
względu na różnice we właściwościach chemicznych
omawiane będą oddzielnie).
• Alkohole podobnie jak węglowodory alifatyczne tworzą
szereg homologiczny
• Przykładowe alkohole
Nazewnictwo alkoholi
• Szukamy najdłuższego łańcucha z którym związana jest
grupa –OH, numerujemy atomy węgla w ten sposób aby
atom C związany z grupą hydroksylową miał najniższy
numer
• Do nazwy węglowodoru, który tworzy łańcuch alifatyczny
dodajemy końcówkę –ol (reszta zasad tak samo jak w
przypadku węglowodorów).
• EX. CH
3
-CH
2
-CH-CH
3
–
butan-2-ol
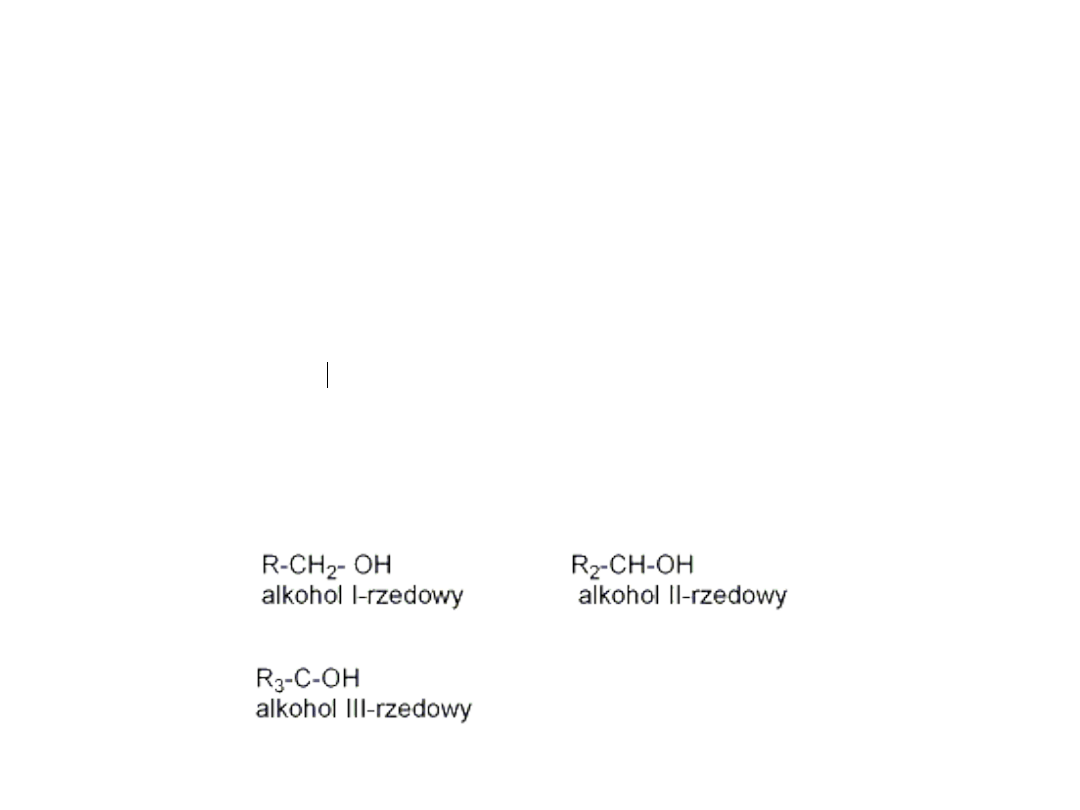
• Alkohole dzielą się na trzy klasy, przy czym podstawą
podziału jest liczba grup organicznych przyłączonych do
atomu C z grupą -OH
OH

Właściwości fizyczne
• Alkohole o małej masie cząsteczkowej są cieczami.
• Są to związki polarne bardzo dobrze rozpuszczające
się w wodzie ( od 4 do 5 atomów węgla)
• Tworzą wiązania wodorowe między sobą oraz z
cząsteczkami wody, przez co charakteryzują się
bardzo wysokimi temperaturami wrzenia ( analogia
do cząsteczek wody).
• Alkohole wielowodorotlenowe maja jeszcze wyższe
temp. wrzenia, ponieważ posiadają więcej niż jedno
centrum asocjacji.
R-O----H-O
H
R
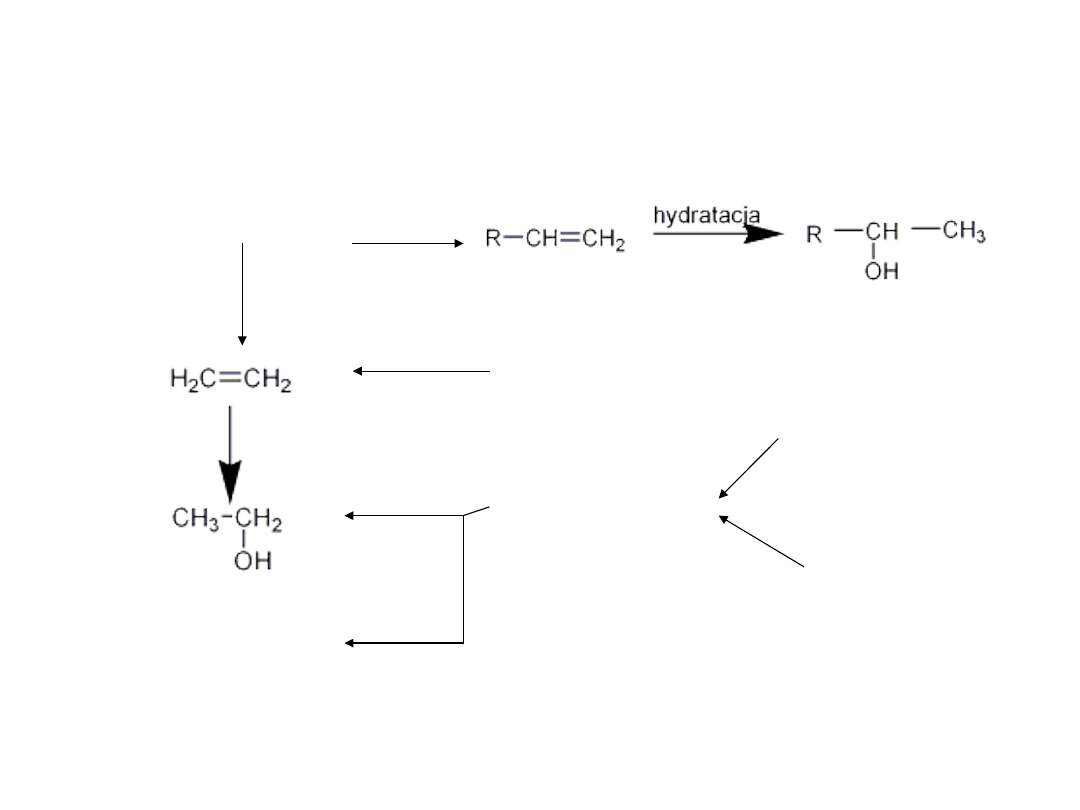
Otrzymywanie przemysłowe
alkoholi
• Alkohole można otrzymać z ropy naftowej
ropa naftowa
kraking
kraking
tłuszcze
fermentacja - cukry
skrobia
melasa
Olej
fuzlowy
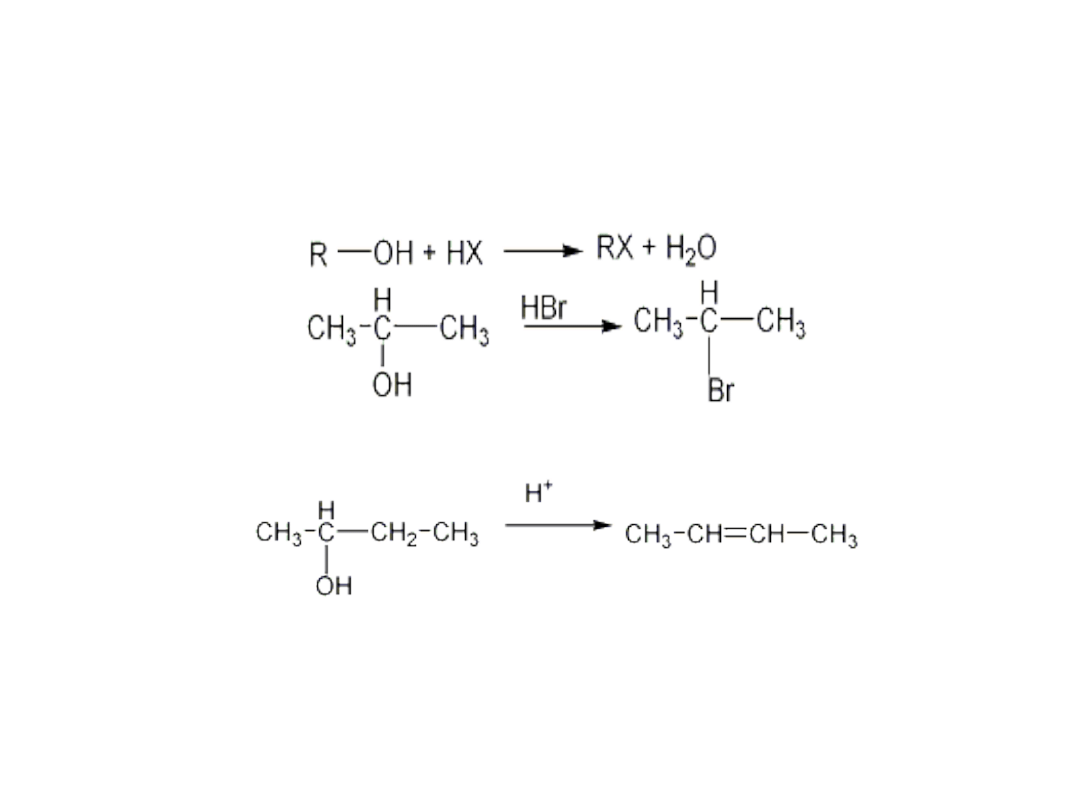
Właściwości chemiczne
• Reakcje alkoholi mogą polegać na rozerwaniu wiązania C-
OH lub O-H
• Reakcje polegające na rozerwaniu wiązania węgiel -grupa
hydroksylowa
• Reakcje dehydratacji
• W rekcjach dehydratacji najbardziej reaktywne są alkohole
III- rzędowe
+ H
2
O
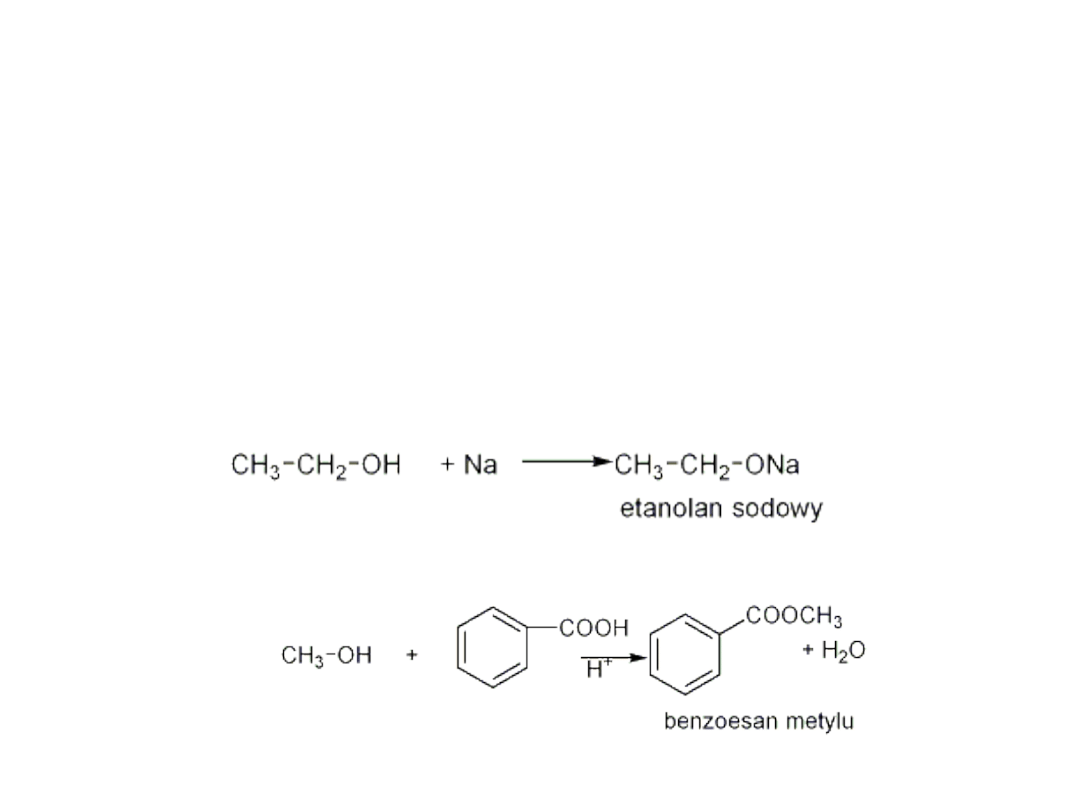
Rozerwanie wiązania O-H
-alkohole nie ulegają dysocjacji elektrolitycznej
( odczyn
roztworu jest obojętny)
- nie reagują z wodnymi roztworami
wodorotlenków np. NaOH
- reagują z reaktywnymi metalami Na, K, w
wyniku reakcji powstają alkoholany
- powstawanie estrów
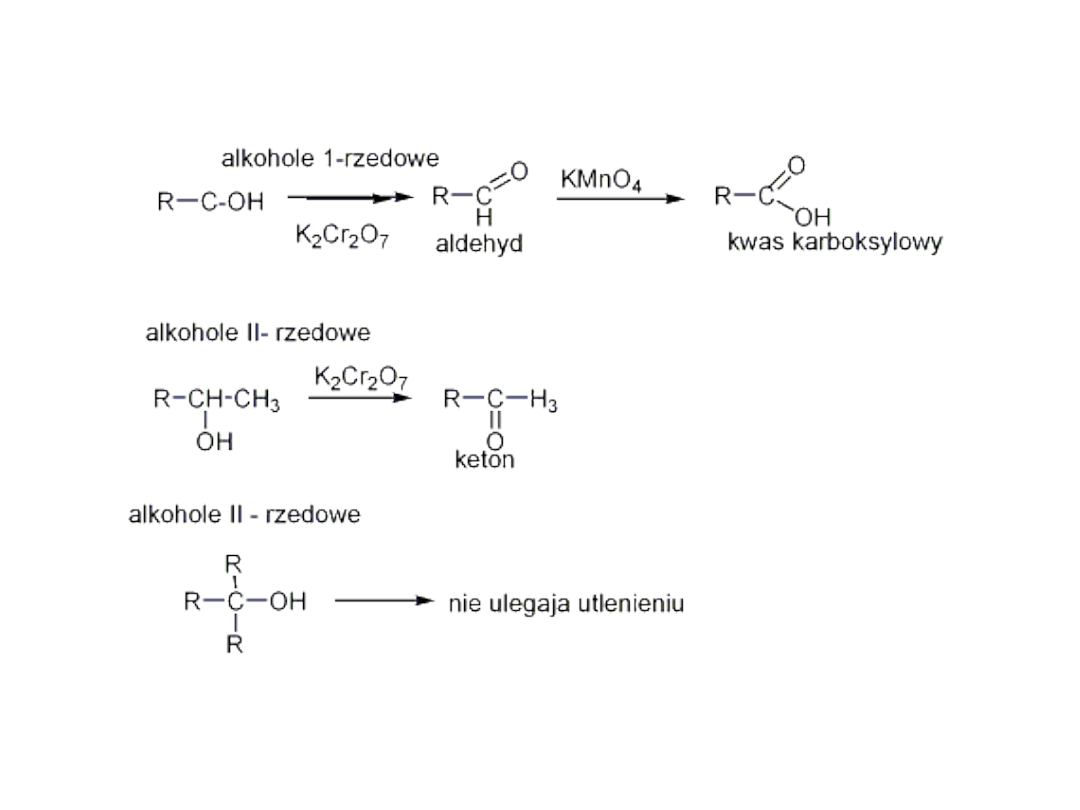
• Utlenianie
Fenole
• W fenolu grupa hydroksylowa jest połączona z
pierścieniem benzenowym.
• Fenol C
6
H
5
OH, jest białą, krystaliczną substancją stałą o
charakterystycznym zapachu, słabo rozpuszczają się w
wodzie.
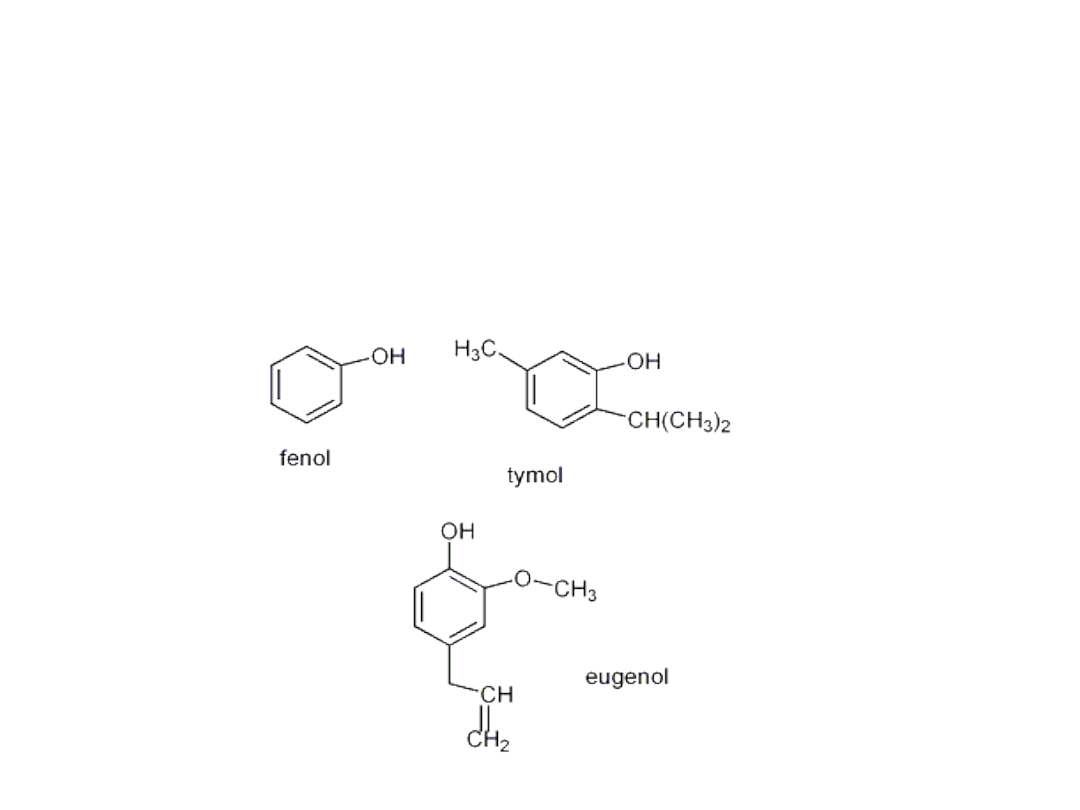
• Inne fenole są często składnikami olejków zapachowych
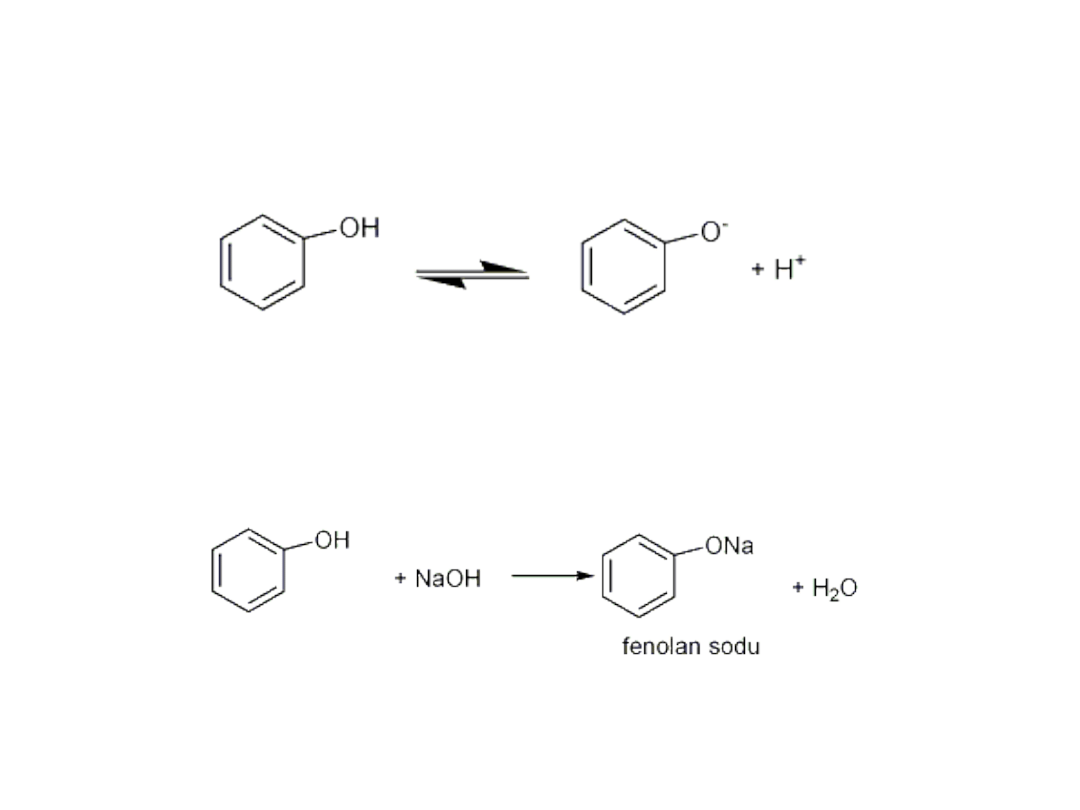
• Fenole różnią się od alkoholi tym, że są słabymi
kwasami, ulegają dysocjacji elektrolitycznej.
• Fenol reaguje z wodnymi roztworami
wodorotlenków, w wyniku czego powstają
fenolany.
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
Wyszukiwarka
Podobne podstrony:
wykład IX węglowodory aromatyczne, alkohole
wyk 4 węglow aromat
WĘGLOWODORY AROMATYCZNE
BT węglowodory aromatyczne (wykład III)
kl 2, kartkowka-benzen, Benzen - C6H6 Wzór Elektronowy - 6¬¬C KL 1H K Węglowodory Aromatyc
Oznaczanie wybranych węglowodorów aromatycznych przy zastosowaniu chromatografii gazowej(1)
Węglowodory aromatyczne (2) ppt
Weglowodory aromatyczne Areny
węglowodory aromatyczne
otrzymywanie-i-reakcje-weglowodorow-aromatycznych
Oznaczanie zawartości węglowodorów aromatycznych w paliwach dieslowych
10.Węglowodory aromatyczne, MATERIAŁY NA STUDIA, Chemia
16-WIELOPIERŚCIENIOWE WĘGLOWODORY AROMATYCZNE, kolo1
WĘGLOWODORY AROMATYCZNE
Węglowodory aromatyczne, chemia(2)
Biodegradacja węglowodorów aromatycznych, Naukowe PL, Biotechnologia, Enzymologia, Genetyka
otrzymywanie i reakcje weglowodorow aromatycznych
Reakcje węglowodorów aromatycznych
4 Węglowodory aromatyczne 07 11 2015
więcej podobnych podstron