
Michael Faraday 1825 „bicarburet of hydrogen” C : H 1 : 1
Eilhard Mitscherlich 1833 „benzin”
Auguste Laurent 1836 „phène”

anetol
O
Pimpinella anisum L

OH
O
eugenol
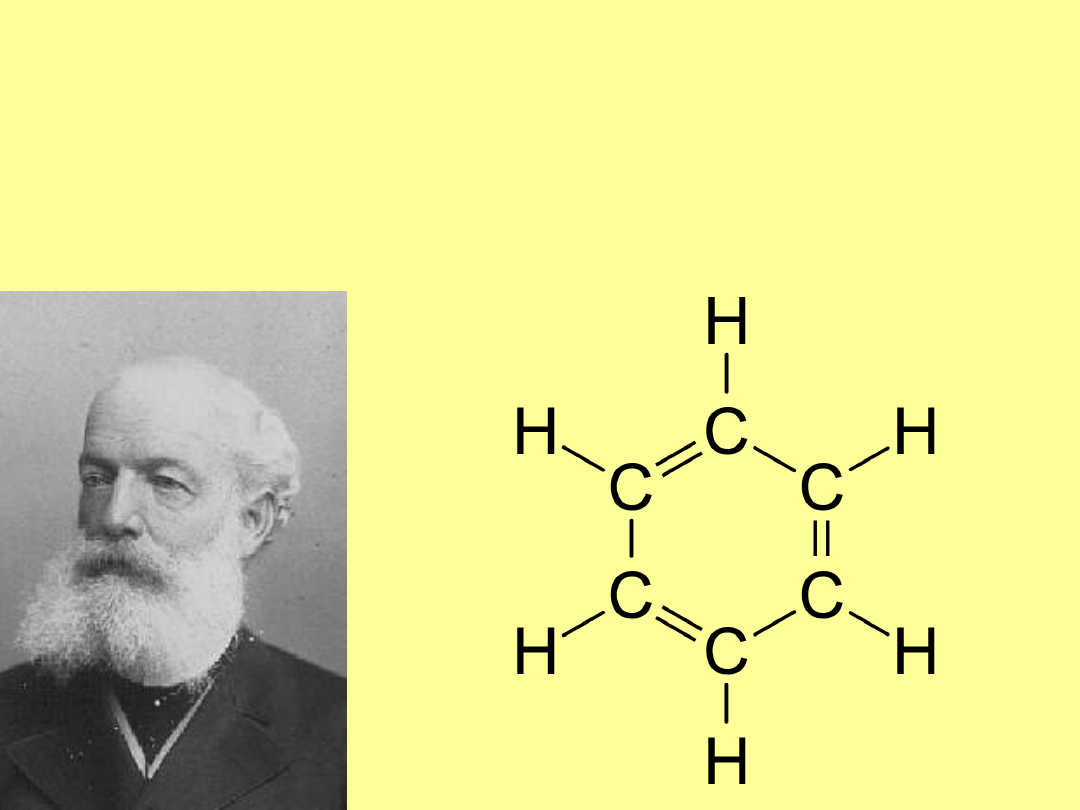
August Wilhelm von Hofmann 1855 „aromatic”
Friedrich August Kekulé von Stradonitz 1865

Węglowodory aromatyczne
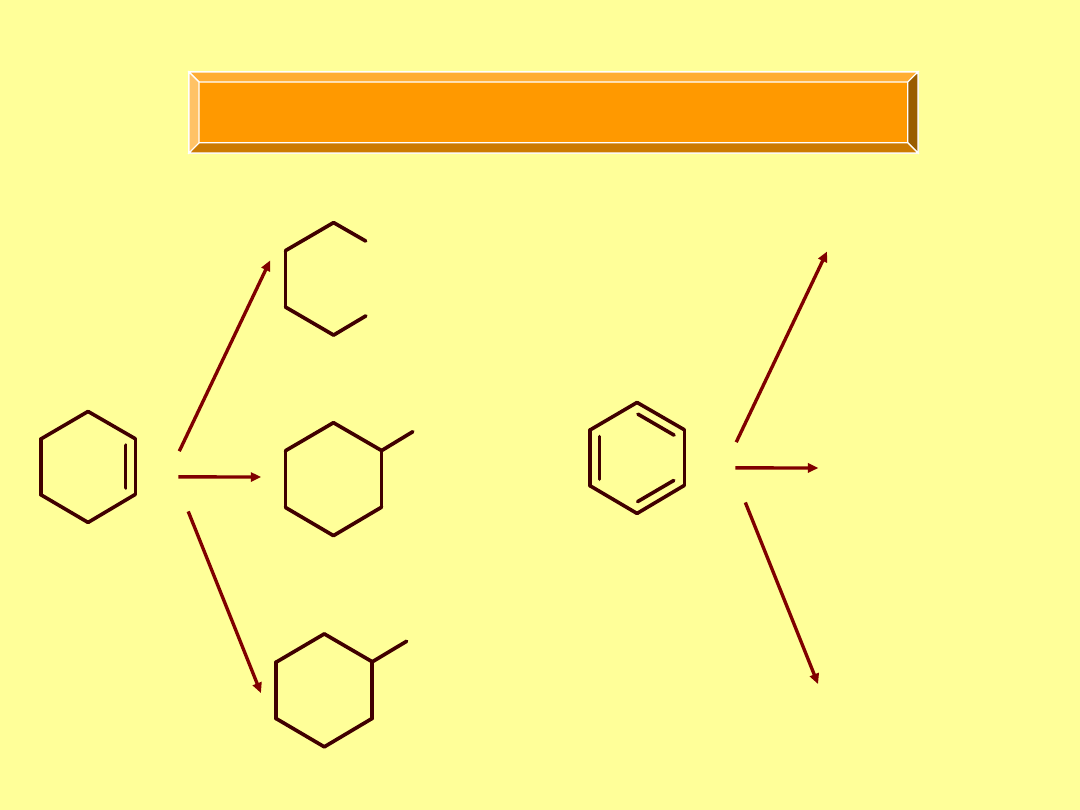
Trwałość cząsteczki benzenu
Br
HBr
OH
H
3
O
+
COOH
COOH
KMnO
4
KMnO
4
reakcja nie zachodzi
H
3
O
+
reakcja nie zachodzi
HBr
reakcja nie zachodzi
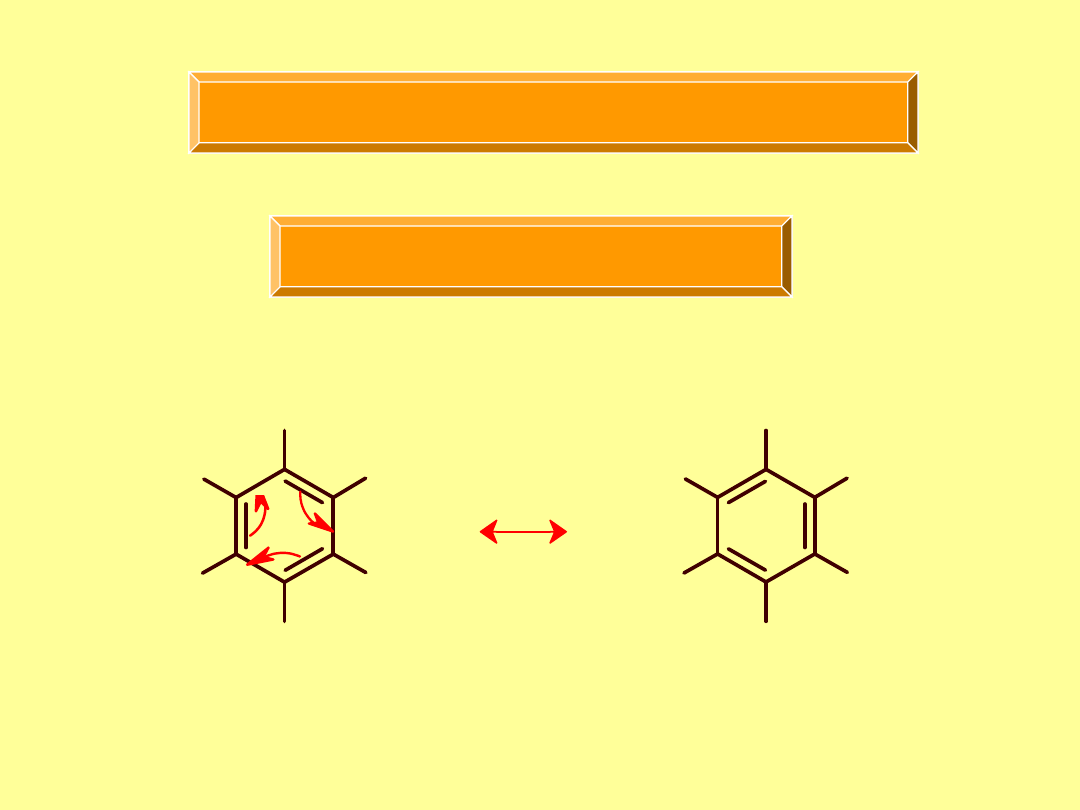
Węglowodory aromatyczne
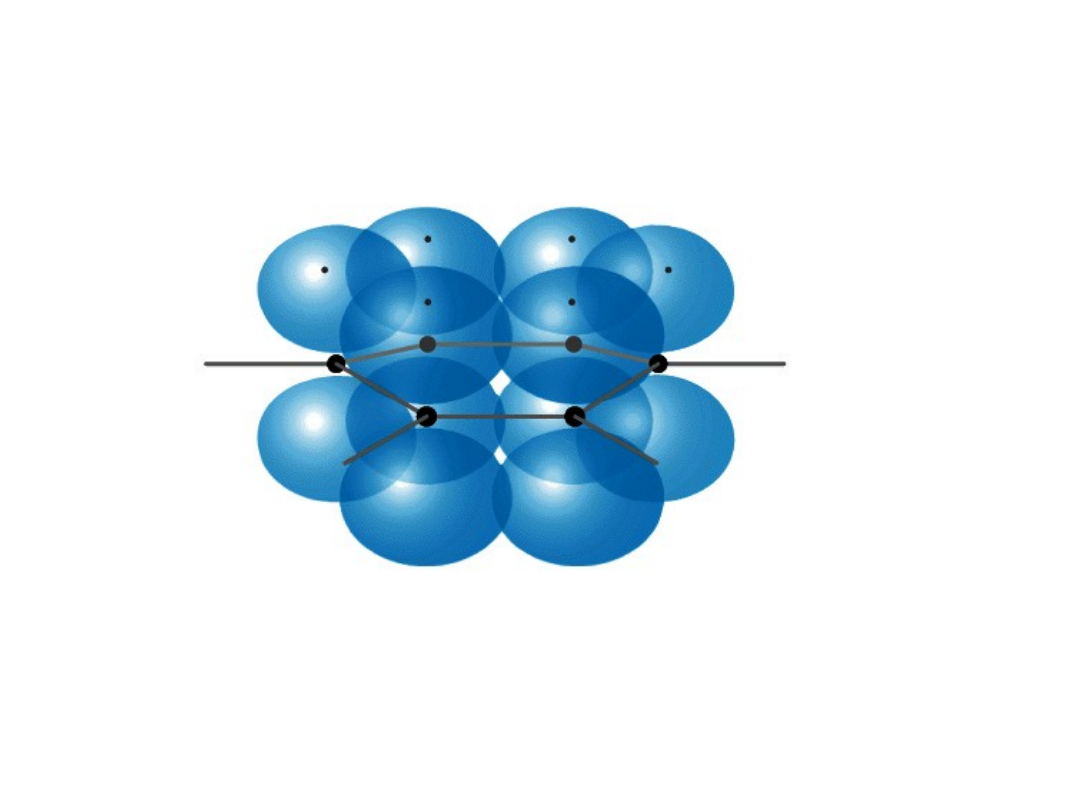
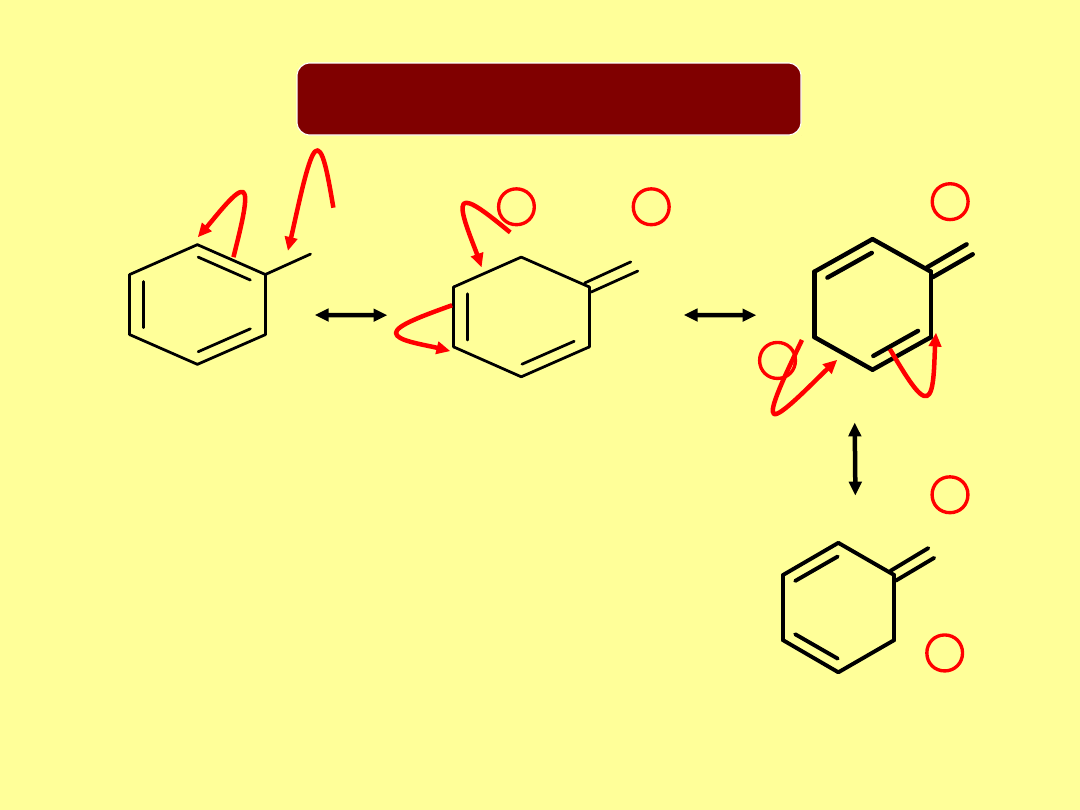
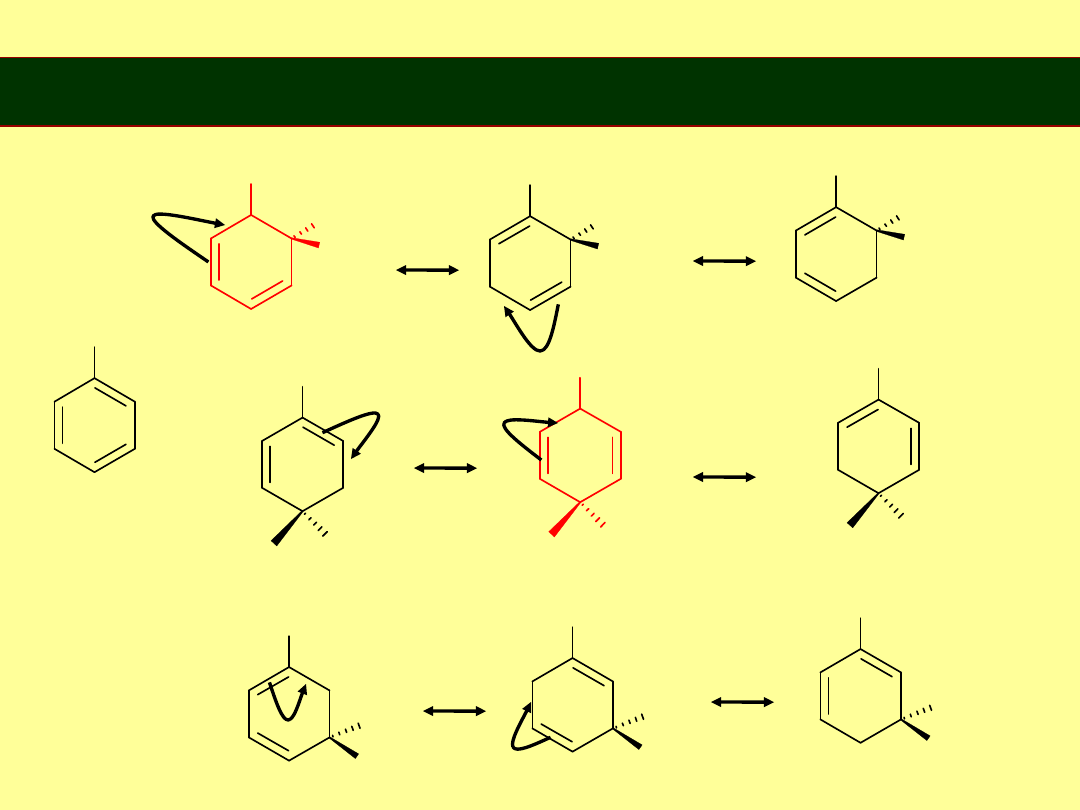
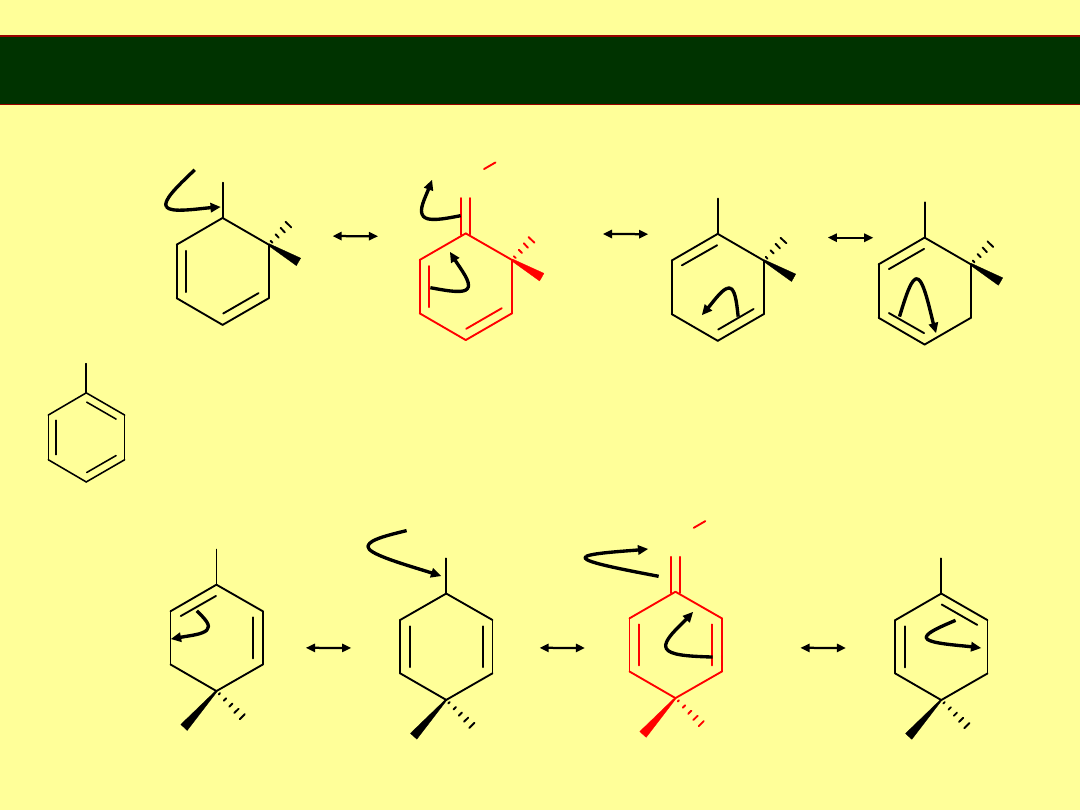
Rezonans
H
H
H
H
H
H
H
H
H
H
H
H
długość wiązania C-C w benzenie 1,39Å
„ „ podwójnego 1,34Å
„ „ pojedynczego 1,54Å
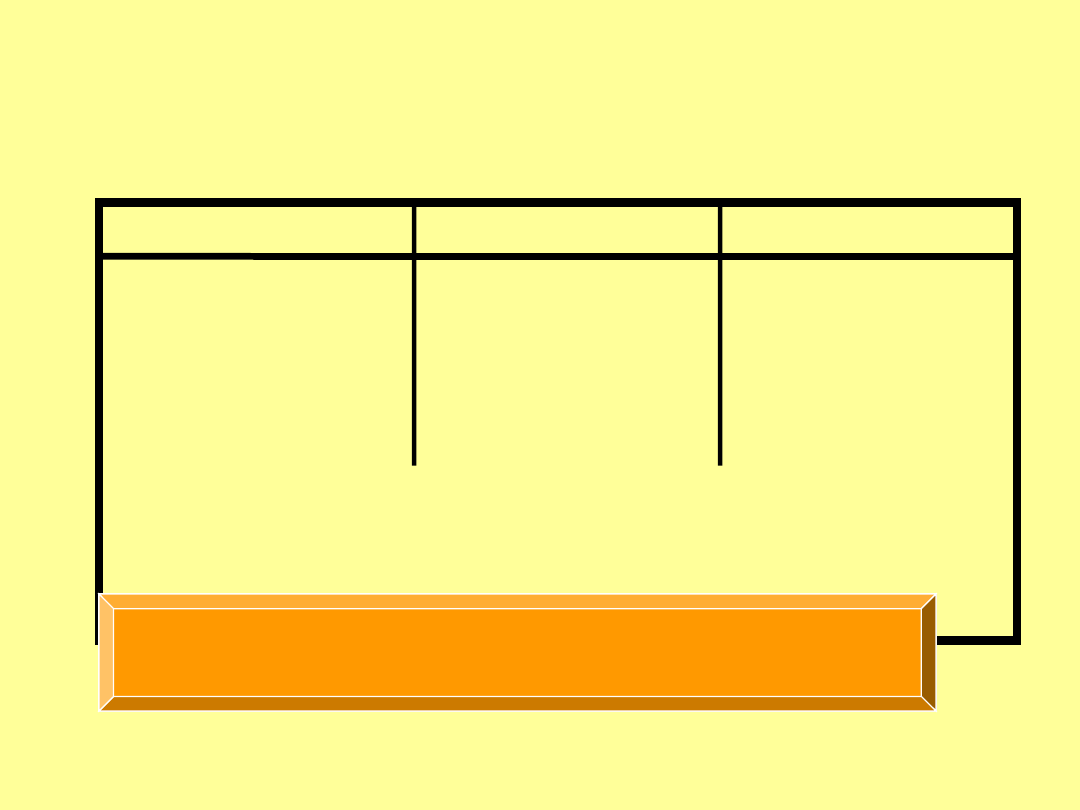
Substrat Produkt ΔH
0
[kJ/mol]
Cykloheksen
Cykloheksan
-
118
1,3-Cykloheksadien
Cykloheksan
-230
Benzen
Cykloheksan
-206
Ciepła uwodornienia
„cykloheksatrien” ~ -356kJ/mol
150 kJ/mol energia stabilizacji - rezonansu

Aromatyczn
ość
Reguła Hückla
Cząsteczki takich układów są stabilizowane przez rezonans
Płaska cząsteczka o skoniugowanym układzie wiązań podwójnych
posiadająca 4n + 2 elektronów π jest cząsteczką aromatyczną
Energia stabilizacji to różnica energii pomiędzy
rzeczywistą
cząsteczką a energią obliczoną dla najniżej
energetycznej
struktury rezonansowej
H
H
H
H
H
H
benzen
trzy wiązania podwójne
sześć elektronów π
4n + 2 = 6 n = 1
H
H
H
H
H
H
H
H
naftalen
Pięć wiązań podwójnych
10 elektronów π
4n + 2 = 10 n = 2
antracen
14 el. π 4n + 2, n = 3
fenantren
Węglowodory aromatyczne
Nomenklatura
C
H
H
H
H
H
H
CH
3
C
H
3
H
H
H
H
H
H
benzen
CH
3
H
H
H
H
H
toluen
(
metylo
benzen)
kumen
(2-
fenylo
propan)
H
H
H
H
H
grupa fenylowa (fenyl) Ph,
Φ
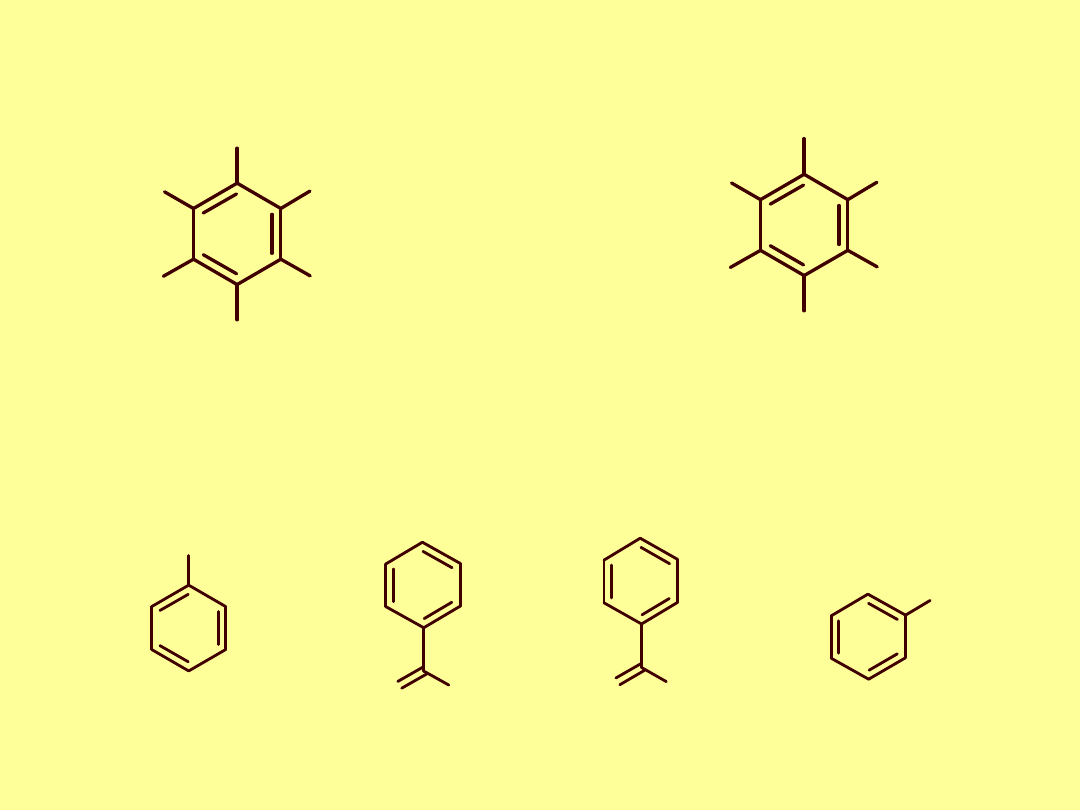
OH
H
H
H
H
H
fenol
H
H
H
H
H
OMe
anizol
NH
2
anilina
O
CH
3
acetofenon
O
H
benzaldehyd
COOH
kwas benzoesowy
CH
2
OH
alkohol benzylowy
CH
2
--
grupa benzylowa
Izomeria pochodnych benzenu
X
X
X
CH
3
CH
3
orto
orto
meta
meta
para
meta
-ksylen
m
-ksylen
1,3-dimetylobenzen
Br
Br
orto
-dibromobenzen
o
-dibromobenzen
1,2- dibromobenzen
CH
3
NO
2
para
-nitrotoluen
p
-nitrotoluen
1-
m
etylo-4-
n
itrobenzen
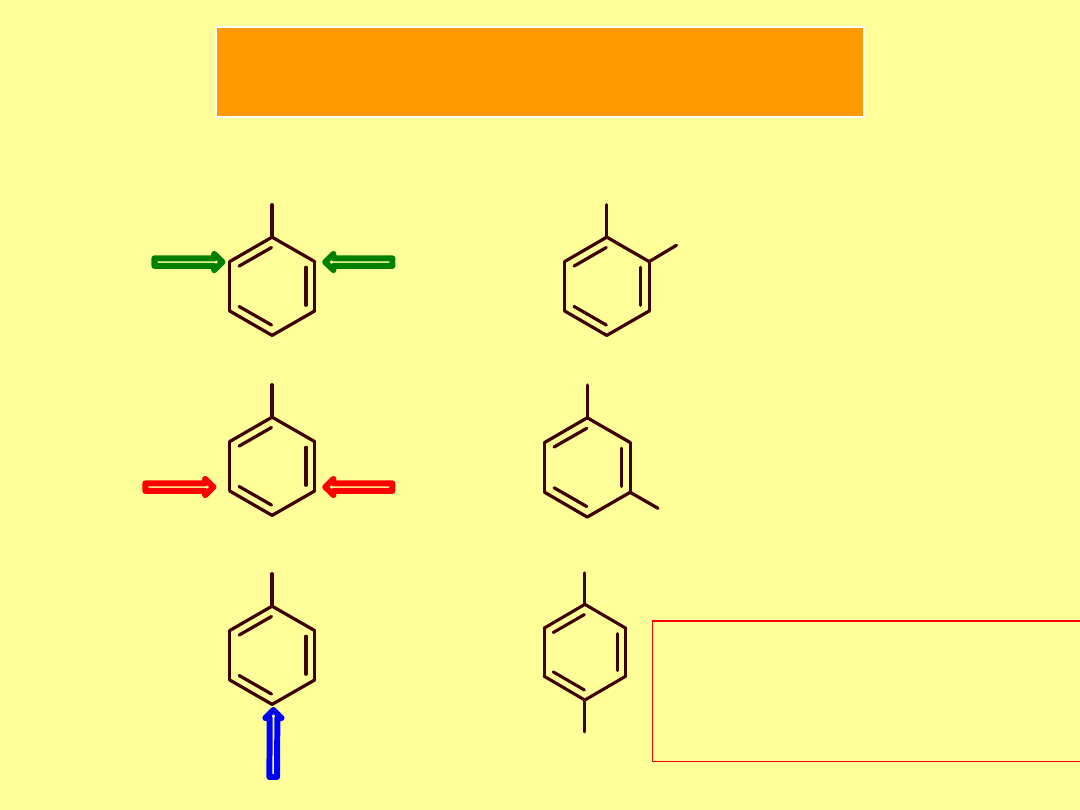
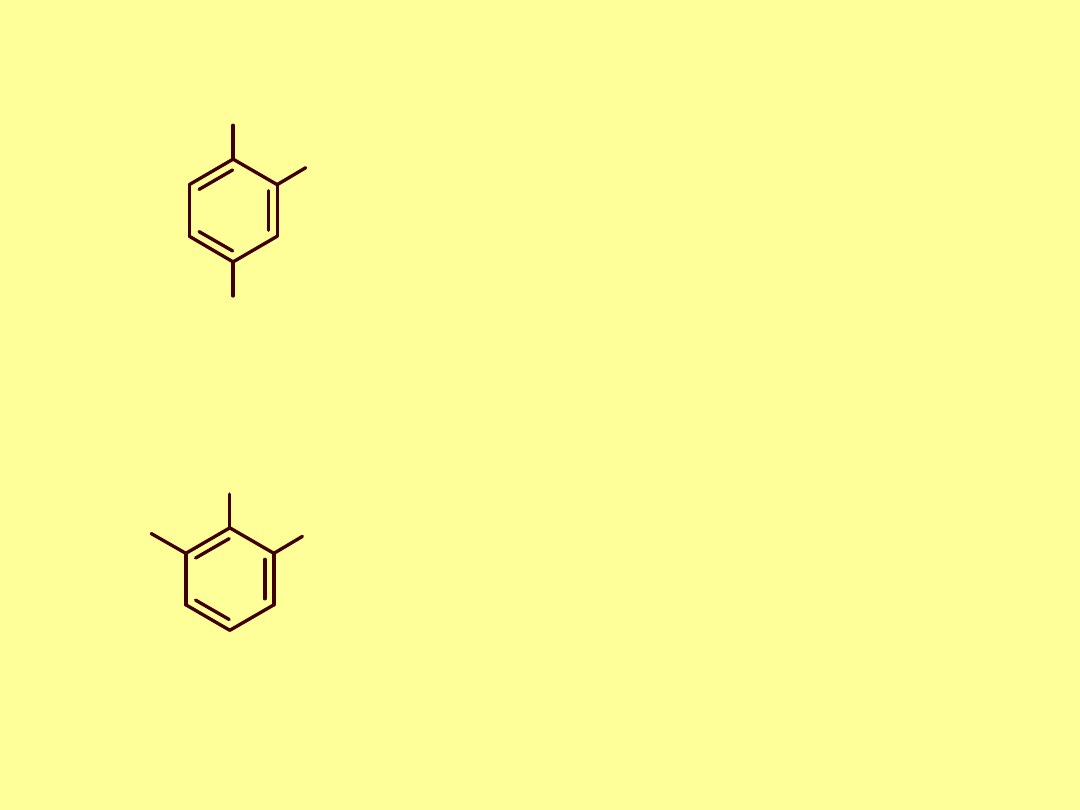
Nomenklatura wielopodstawnych benzenu
Numerujemy atomy węgla w pierścieniu tak
by indeksy liczbowe były miały jak najniższe
Podstawniki wymieniamy w porządku alfabetycznym
Jako pochodne benzenu
CH
3
NO
2
Br
benzen
1 2
3
4
2-bromo
-1-metylo
-4-nitro
CH
3
NO
2
Br
benzen
1 2
3
4
2-bromo
-1-metylo
-4-nitro
OH
Br
Br
1
fenol
2,6-dibromo
2
3
6
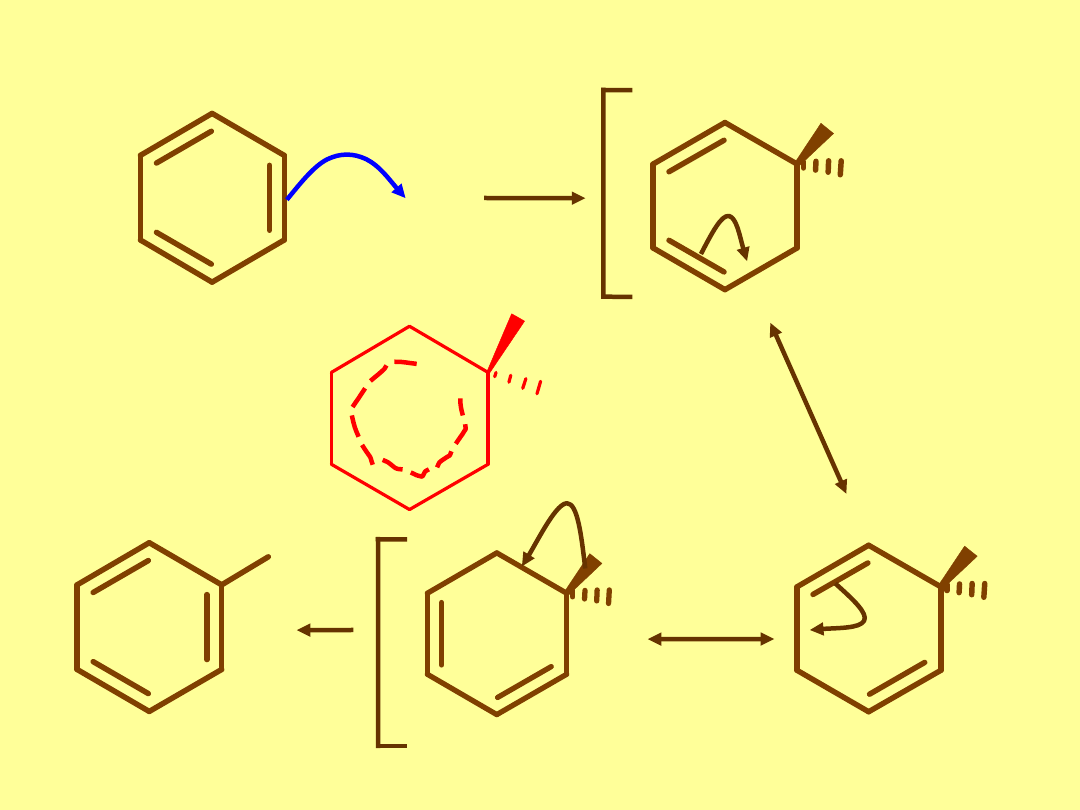
Reakcje aromatycznej substytucji elektrofilowej
H
H
H
H
H
H
+
El+
El
H
H
H
H
H
+ H
+
El
+
H
El
+
H
El
+
H
El
+
jon benzeniowy
El
-H
+
El
H
+
Cl
NO
2
SO
3
H
R
Br
R
O
Cl
2
FeCl
3
Br
2
Fe
Br
3
HNO
3
H
2
S
O
4
H
2
SO
4
RC
l
Al
Cl
3
H
2
SO
4
Cl
R
O
AlC
l
3
Reakcje
substytucj
i
elektrofilo
wej

Chlorowanie
węglowodorów
aromatycznych
Cl-Cl
+
FeCl
3
Cl
3
Fe
.....
Cl
.....
Cl
δ+
δ-
słaby elektrofil
mocny elektrofil
Br-Br
+
Br
3
Fe
.....
Br
.....
Br
δ+
δ-
FeBr
3
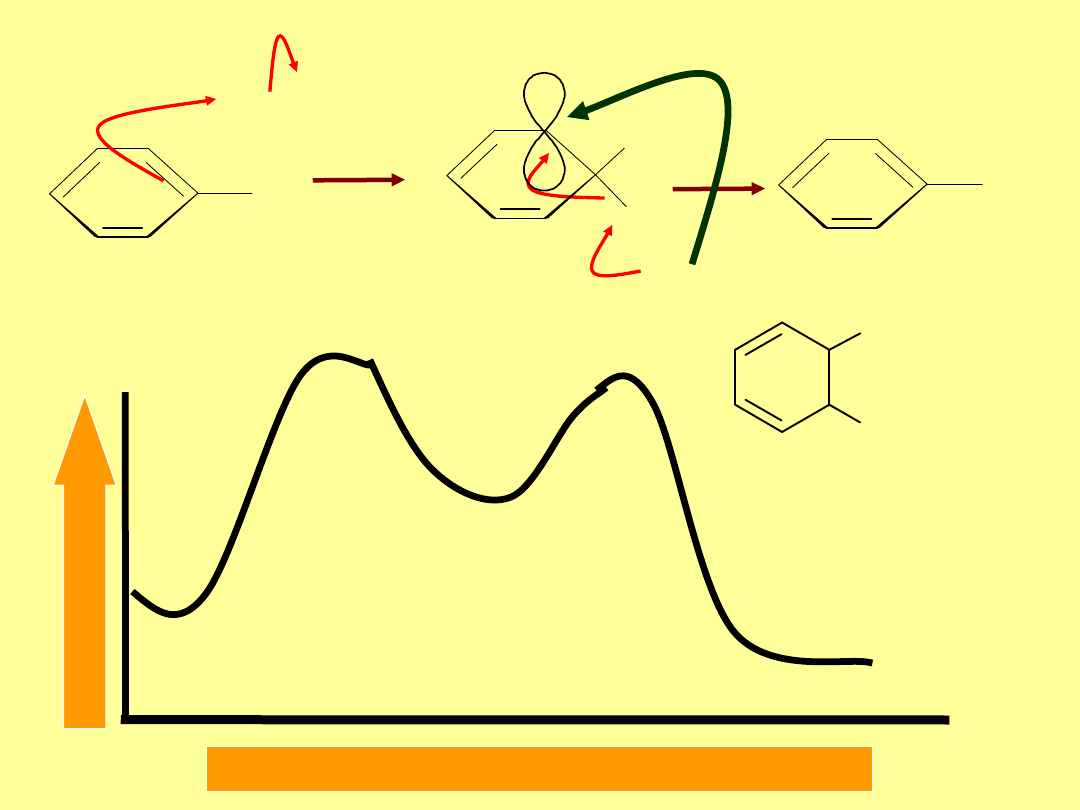
H
Br-Br
woln
o
Br
szybko
Br
-
E
n
e
rg
ia
Postęp reakcji
H
Br
+
Br
Br
Reakcja nitrowania związków aromatycznych
Elektrofil:
NO
2+
jon nitroniowy
N
O
H
O
O
-
+
+
H
2
SO
4
N
O
H
O
O
H
-
+
+
N
O
H
O
O
H
-
+
+
H
2
O
+
NO
2
+
NO
2
benzen
mieszanina nitrująca
nitrobenzen
H
2
SO
4
+ HNO
3
Reakcja sulfonowania związków aromatycznych
Elektrofil:
HSO
3
+
SO
3
S O
O
O
+
H
2
SO
4
+
HSO
4
-
S O
O
O
H
+
SO
3
H
kwas benzenosulfonowy
+
H
2
SO
4
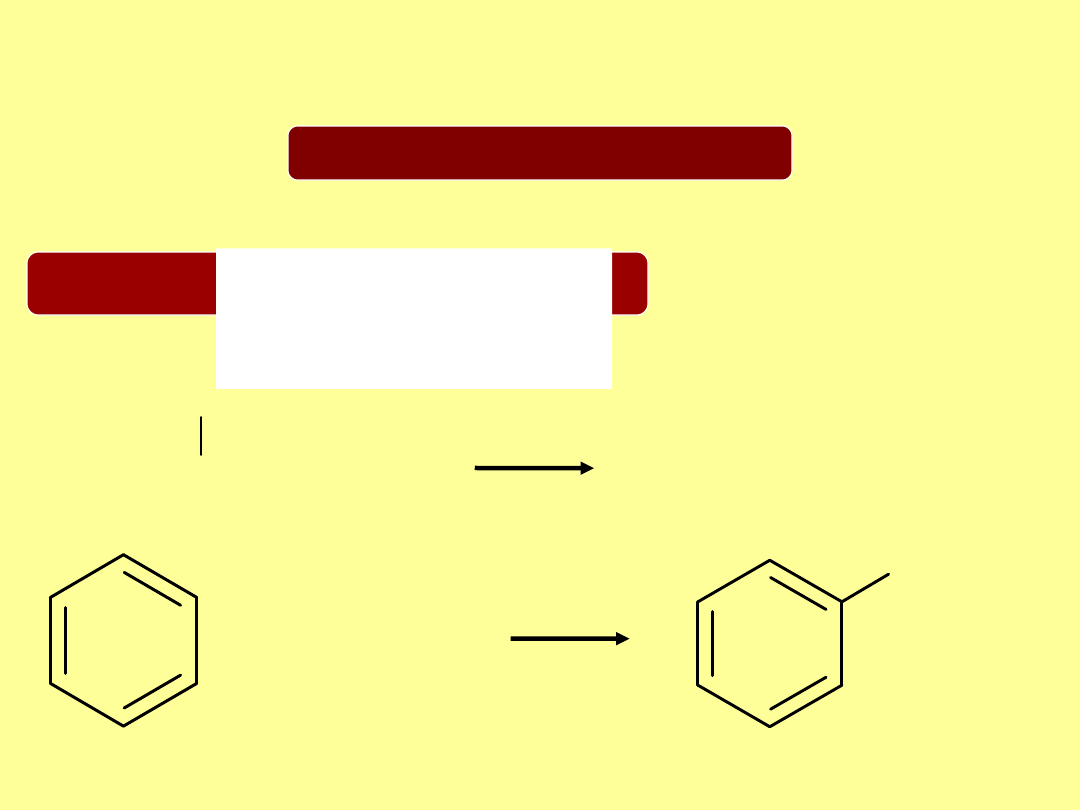
Reakcja alkilowania związków
aromatycznych
Reakcja Friedela-Craftsa
Elektrofil:
karbokation
R
+
CH
3
CHCH
3
Cl
+ AlCl
3
+ AlCl
4
-
CH
3
CHCH
3
+
+
RX
R
AlCl
3
benzen
halogenek aklilowy
X = F, Cl, Br, J
Alkilobenzen
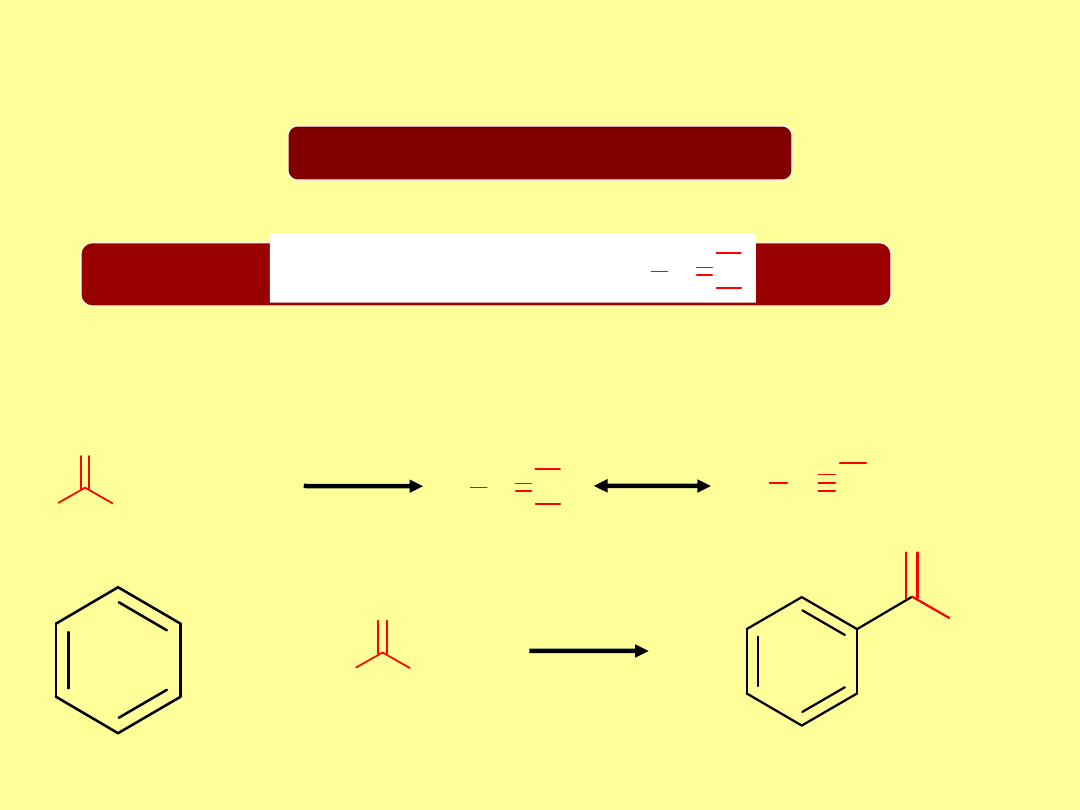
Reakcja alkilowania związków
aromatycznych
Reakcja Friedela-Craftsa
Elektrofil:
Kation acyliowy
R C O
+
R
Cl
O
+ AlCl
3
R C O
+
R C O
+
+ AlCl
4
-
+
R
O
AlCl
3
benzen
chlorek acylowy
Keton fenylowo alkilowy
R
Cl
O
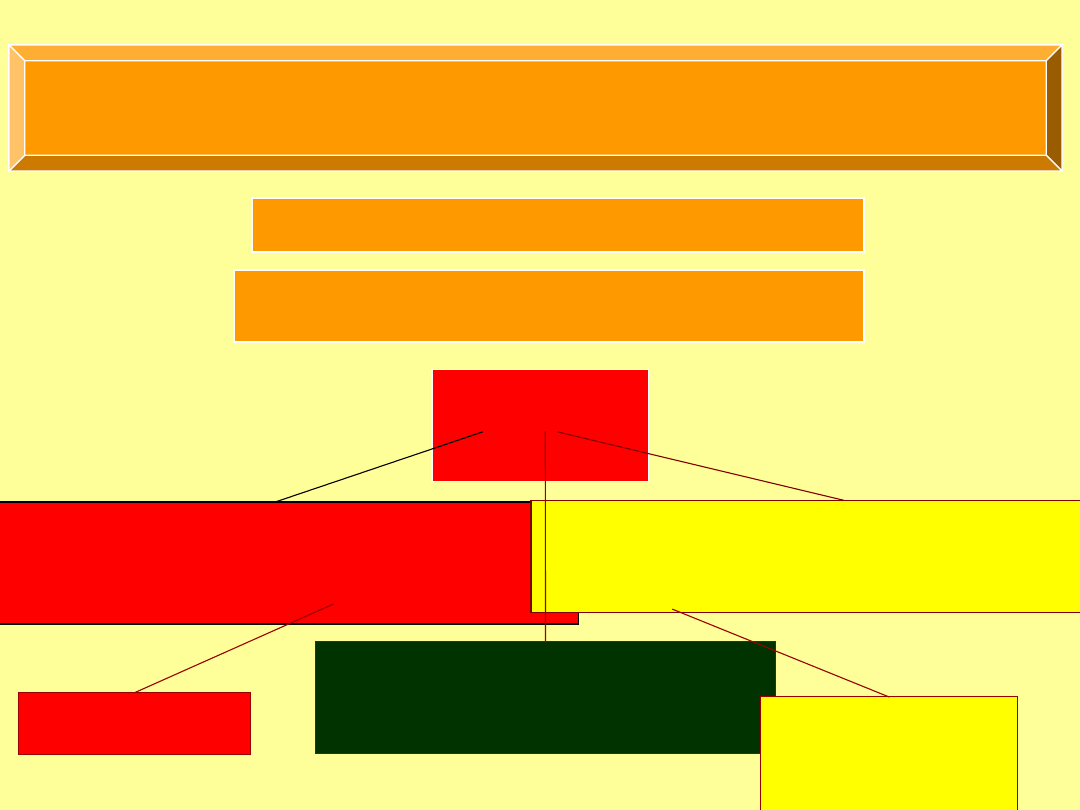
Wpływ podstawników na reaktywność układu aromatycznego
podstaw
nik
Aktywujący
(zwiększa szybkość reakcji)
Dezaktywujący
(zmniejsza szybkość reakcji)
Zwiększa lub zmniejsza szybkość reakcji
Wpływa na kierunek (orientację) reakcji
Kierujący
orto, para, lub meta
orto, para
meta
orto, para
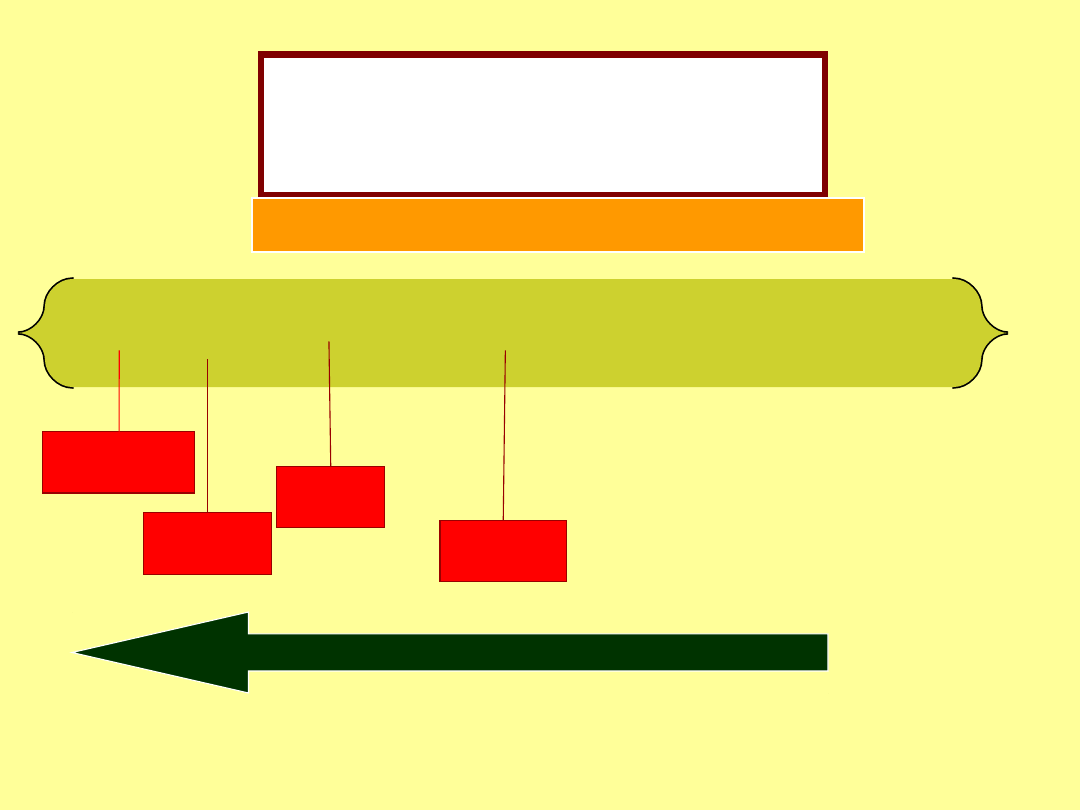
Podstawniki
aktywujące
-NH
2
,
-OH,
-OCH
3
,
-NHCOCH
3
, -CH
3
(alkil), fenyl
,
..
..
..
..
..
..
amina
fenol
eter
amid
Kierujące
orto
,
para
wzrost szybkości reakcji
..
..:
-Cl
..
..:
-Br
..
..:
-I
..
..:
-F
Podstawniki
dezaktywujące
Kierujące
orto
,
para
wzrost szybkości reakcji
Podstawniki
dezaktywujące
Kierujące
meta
wzrost szybkości reakcji
H
O
OR
O
OH
O
R
O
NO
2
Efekt indukcyjny
:
δ-
X
..
..
δ+
N
O
O
δ-
δ+
CH
3
Podstawniki przyłączone do pierścienia ze względu na
polaryzację wiązań
indukcyjnie
wyciągają elektrony
( zmniejszają gęstość elektronową)
Grupy alkilowe
indukcyjnie
dostarczają elektronów
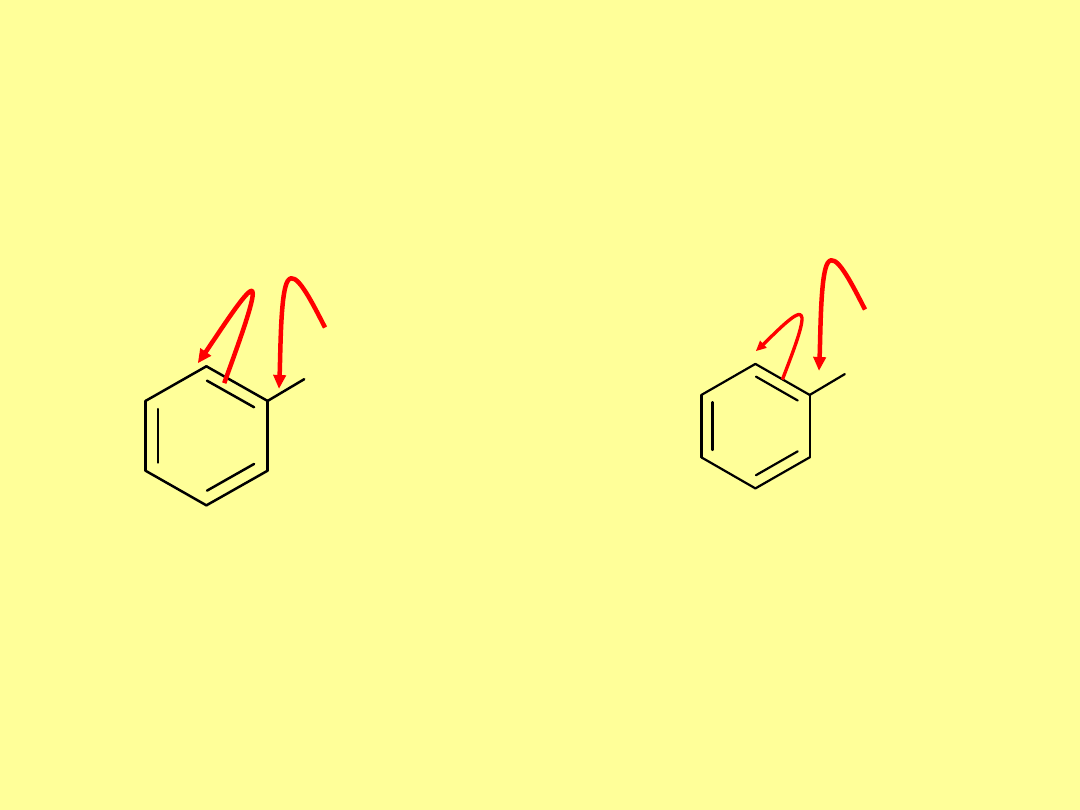
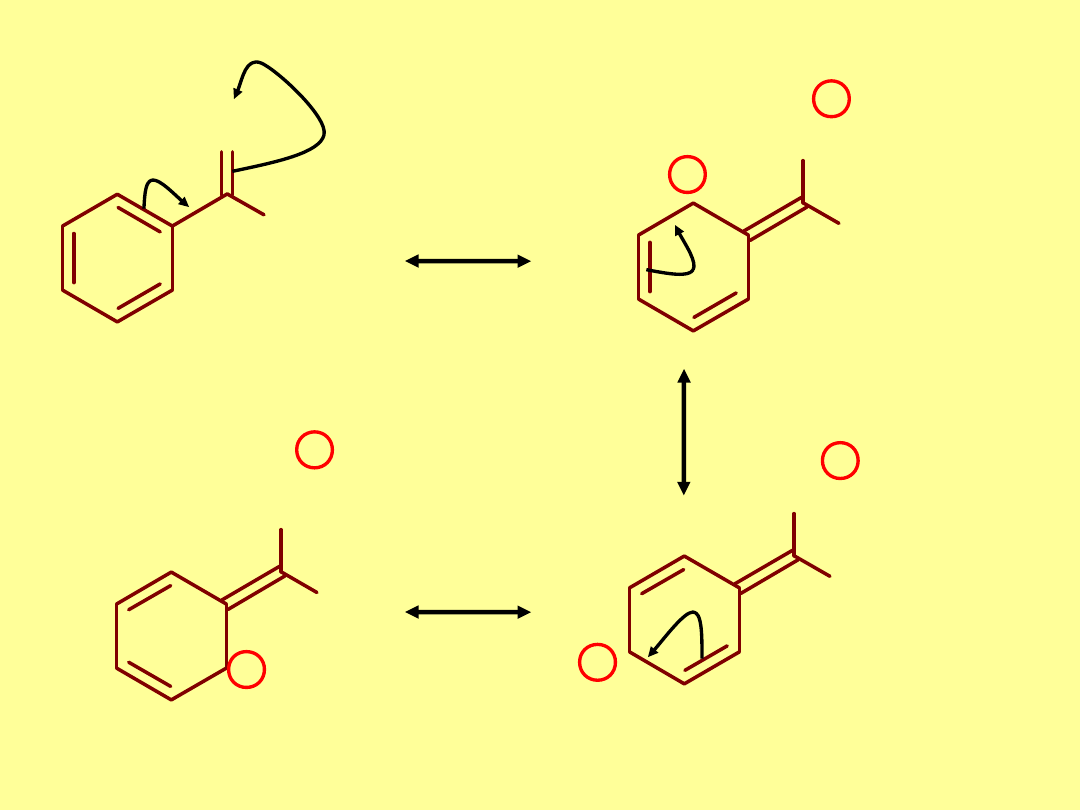
Efekty rezonansowe
:
X
..
..
X = F, Cl, Br, I
:
X
..
..
-
+
+
X
-
..
..
..
X
..
-
+
:
:
OH
..
..
NH
2
..
R
O
.. ..
R
O
..
.. ..
+
-
R
O
+
-
..
..
..
R
O
..
.. ..
+
-
Grupy aktywujące kierujące w położenia
orto
i
para
CH
3
CH
3
H
NO
2
+
CH
3
H
NO
2
+
CH
3
H
NO
2
+
CH
3
H
O
2
N
+
CH
3
H
O
2
N
+
CH
3
H
O
2
N
+
CH
3
H
NO
2
+
CH
3
H
NO
2
+
CH
3
H
NO
2
+
Grupy aktywujące kierujące w położenia
orto
i
para
OH
..
:
OH
H
NO
2
+
O
H
NO
2
H
..
+
..
:
OH
H
NO
2
+
OH
H
NO
2
..
:
+
OH
H
O
2
N
..
:
+
OH
H
O
2
N
..
:
+
O
H
O
2
N
H
..
+
OH
H
O
2
N
..
:
+
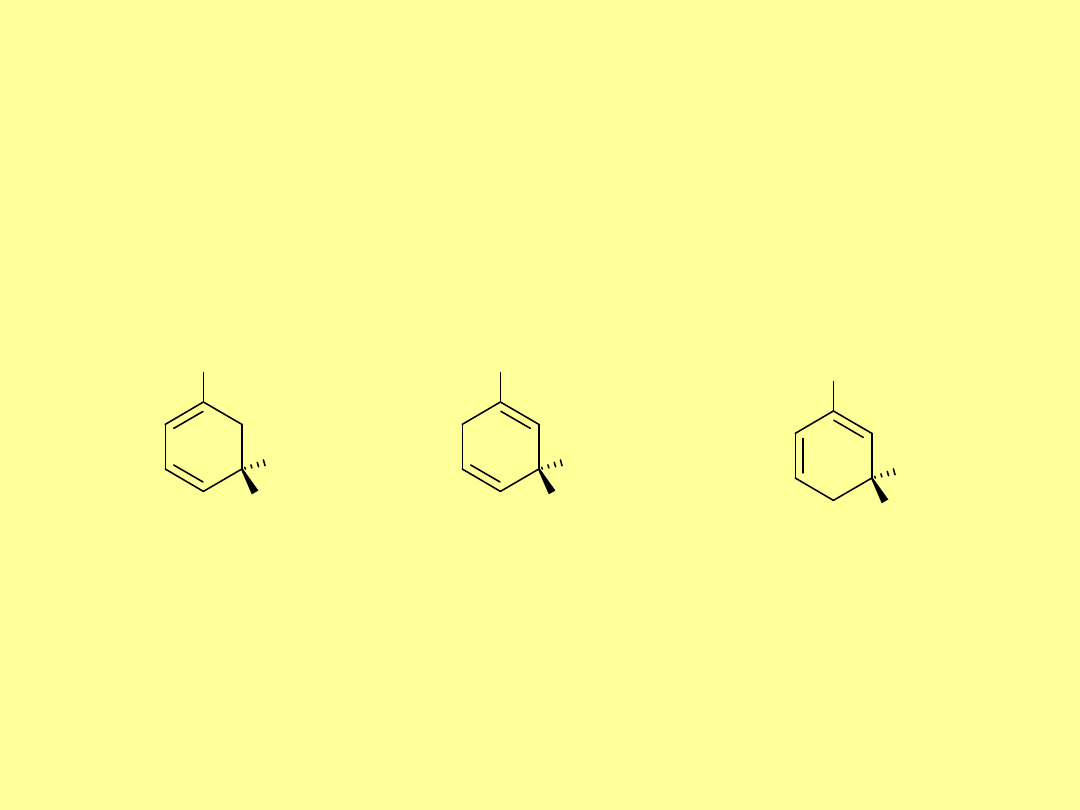
OH
H
NO
2
OH
H
NO
2
OH
H
NO
2
+
+
+
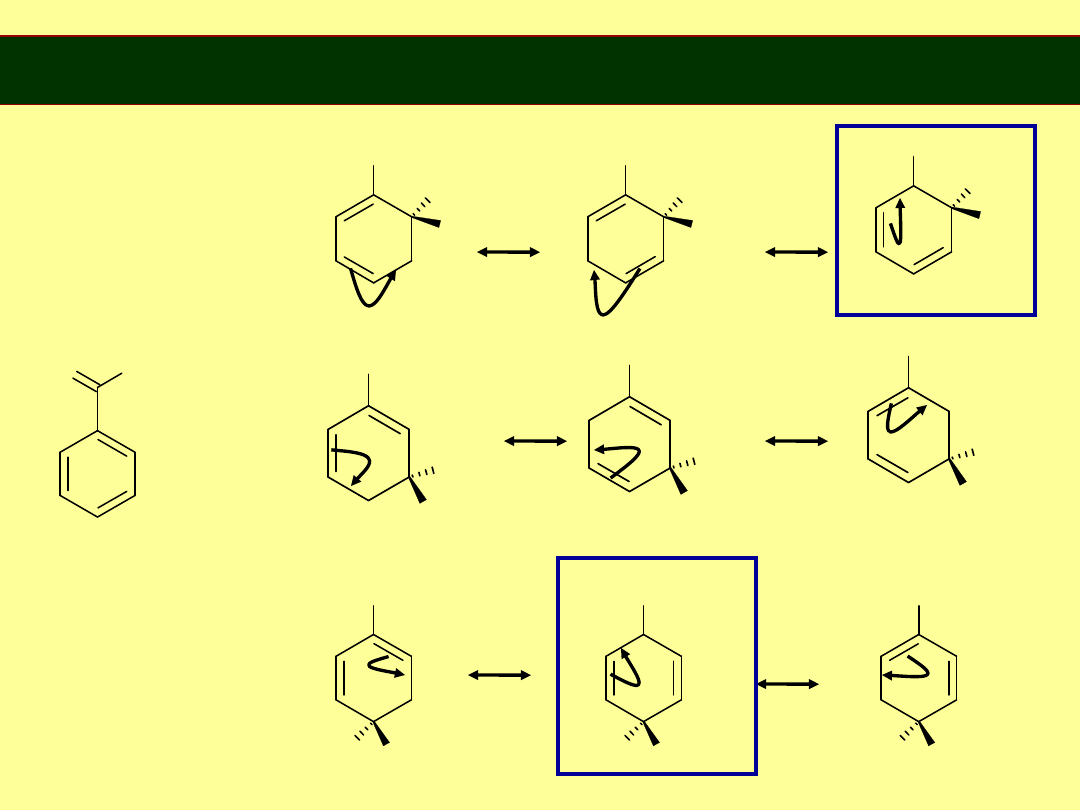
Grupy dezaktywujące kierujące w położenia
meta
H
O
δ-
δ+
Cl
H
CHO
+
Cl
H
CHO
+
Cl
H
CHO
+
H
Cl
CHO
+
H
Cl
CHO
+
H
Cl
CHO
+
CHO
H Cl
+
CHO
H Cl
+
CHO
H Cl
+
Efekty podstawników w reakcjach substytucji elektrofilowej
Efekty podstawników w reakcjach substytucji elektrofilowej
CH
3
REAKTYWNOŚĆ ORIENTACJA EFEKT INDUKCYJNY EFEKT
REZONANSOWY
aktywacja
orto
para
słaby
dostarcza elektronów
brak
OH
NH
2
aktywacja
orto
para
słaby
wyciąga elektrony
silny
dostarcza elektronów
X
NO
2
orto
para
silny
wyciąga elektrony
słaby
dostarcza elektronów
dez-
aktywacja
dez-
aktywacja
meta
silny
wyciąga elektrony
silny
wyciąga elektrony

Efekty podstawników w reakcjach substytucji elektrofilowej
Efekty podstawników w reakcjach substytucji elektrofilowej
REAKTYWNOŚĆ ORIENTACJA EFEKT INDUKCYJNY EFEKT
REZONANSOWY
CN
dez-
aktywacja
meta
silny
wyciąga elektrony
silny
wyciąga elektrony
CHO
dez-
aktywacja
meta
silny
wyciąga elektrony
silny
wyciąga elektrony
COCH
3
dez-
aktywacja
meta
silny
wyciąga elektrony
silny
wyciąga elektrony
itd
dez-
aktywacja
meta
silny
wyciąga elektrony
silny
wyciąga elektrony

H
O
CH
3
OH
Cl
orto
meta
para
1%
35%
64%
19%
72%
9%
34%
3%
63%
50%
0%
50%
chlorowanie
nitrowanie
nitrowanie
nitrowanie
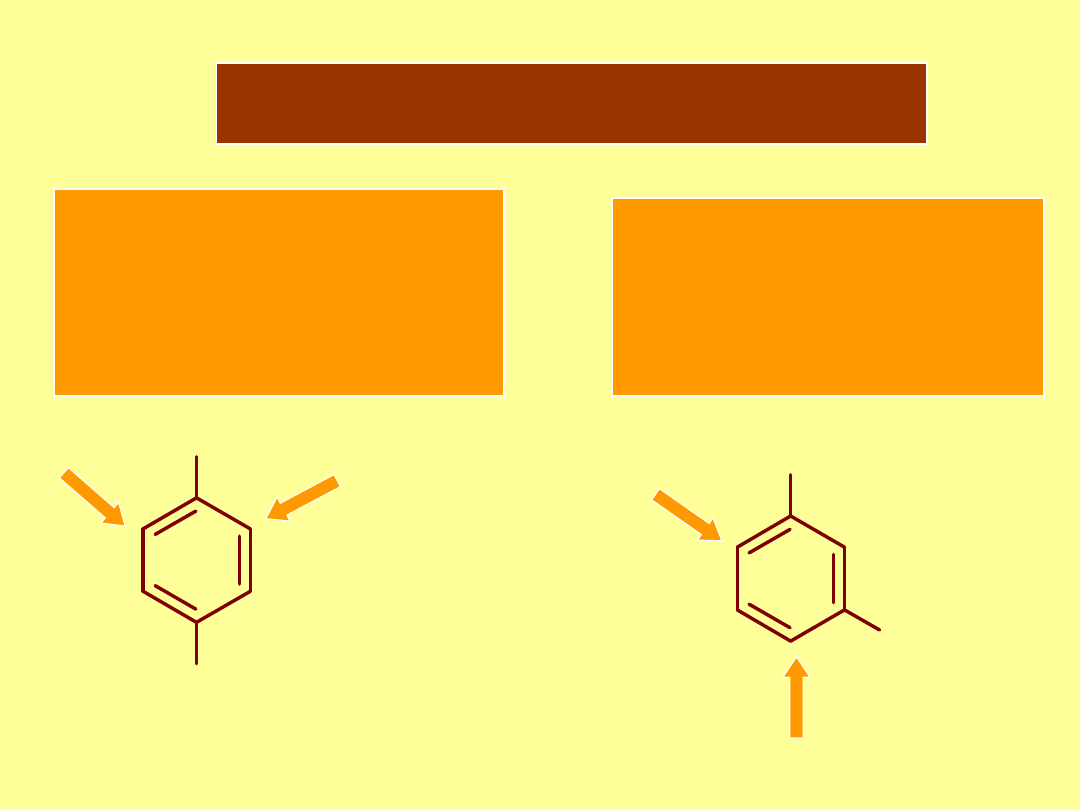
Addytywność efektów
Jeśli efekty dwu
grup są przeciwne
silniejsza grupa
aktywująca dominuje
OH
CH
3
OH
Br
Podstawienie pomiędzy
dwoma grupami jest
utrudnione ze względów
sterycznych
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
- Slide 41
- Slide 42
- Slide 43
- Slide 44
Wyszukiwarka
Podobne podstrony:
wyk 4 węglow aromat
WĘGLOWODORY AROMATYCZNE
BT węglowodory aromatyczne (wykład III)
kl 2, kartkowka-benzen, Benzen - C6H6 Wzór Elektronowy - 6¬¬C KL 1H K Węglowodory Aromatyc
Oznaczanie wybranych węglowodorów aromatycznych przy zastosowaniu chromatografii gazowej(1)
Węglowodory aromatyczne (2) ppt
Weglowodory aromatyczne Areny
otrzymywanie-i-reakcje-weglowodorow-aromatycznych
Oznaczanie zawartości węglowodorów aromatycznych w paliwach dieslowych
10.Węglowodory aromatyczne, MATERIAŁY NA STUDIA, Chemia
16-WIELOPIERŚCIENIOWE WĘGLOWODORY AROMATYCZNE, kolo1
WĘGLOWODORY AROMATYCZNE
Węglowodory aromatyczne, chemia(2)
Biodegradacja węglowodorów aromatycznych, Naukowe PL, Biotechnologia, Enzymologia, Genetyka
otrzymywanie i reakcje weglowodorow aromatycznych
Reakcje węglowodorów aromatycznych
Węglowodory aromatyczne i alkohole
4 Węglowodory aromatyczne 07 11 2015
Oznaczanie wybranych węglowodorów aromatycznych przy zastosowaniu chromatografii gazowej
więcej podobnych podstron