
Maria Cioch
POSTĘPY W DIAGNOSTYCE
I LECZENIU CHORYCH
NA ZESPOŁY
MIELODYSPLASTYCZNE
Klinika Hematoonkologii i Transplantacji Szpiku
Uniwersytetu Medycznego w Lublinie

ZESPOŁY
MIELODYSPLASTYCZNE
Myelodysplastic Syndromes – MDS
- klonalne zaburzenia hematopoetycznej komórki
macierzystej charakteryzujące się jedno-, dwu-, lub
trójukładową cytopenią, najczęściej
bogatokomórkowym
szpikiem wykazującym morfologiczne cechy
dyshematopoezy (nieefektywnej hematopoezy) i
dużym
ryzykiem transformacji w ostrą białaczkę (śr. 30%).

NAZWY HISTORYCZNE
MDS
• Niedokrwistość oporna na leczenie
• Idiopatyczna niedokrwistość sideroblastyczna
• Niedokrwistość dysmielopoetyczna
• Stan przedbiałaczkowy
• Oligoleukemia
• Preleukemia
• Białaczka tląca
• Białaczka podostra

EPIDEMIOLOGIA MDS
• Najczęstsza choroba rozrostowa szpiku.
• Częstość występowania (Dűsseldorf): 4,4/100000/rok
• Wiek: 80% chorych w momencie ustalania diagnozy
ma
ponad 60 lat
• Płeć: M:K/3,5:1,4
• Czynniki epidemiologiczne: ekspozycja na
promieniowanie jonizujące, benzen, rozpuszczalniki
organiczne, pestycydy, leki alkilujące,
podofilotoksyny,
infekcje wirusowe

DIAGNOSTYKA MDS
• Badanie fizyczne: brak znaczących zmian narządowych
• Morfologia krwi: jedno-, dwu- lub trójukładowa cytopenia
• Badanie cytologiczne szpiku: utkanie najczęściej
bogatokomórkowe
z cechami dyshematopoezy (ocena 500 komórek) i
ewentualnie
pierścieniowatymi sideroblastami
• Badanie hist-pat szpiku: hipoplazja, włóknienie, zaburzenie
architektoniki, ALIP, nacieczenie blastami
• Badanie cytometryczne: dyssynchronia w ekspresji antygenów,
zwiększona ekspresja CD34
• Badanie cytogenetyczne: typowe dla MDS aberracje
• Badanie molekularne

MDS: różnicowanie
• Niedobór witaminy B12
• Niedobór kwasu foliowego
• Zatrucie metalami ciężkimi
• Działanie niepożądane leków (antybiotyki, leki
immunosupresyjne)
• Infekcje wirusowe (HIV)
• Przewlekłe choroby zapalne (wątroby)
• Choroby nowotworowe
• Niedokrwistość aplastyczna
• Zwłóknienie szpiku

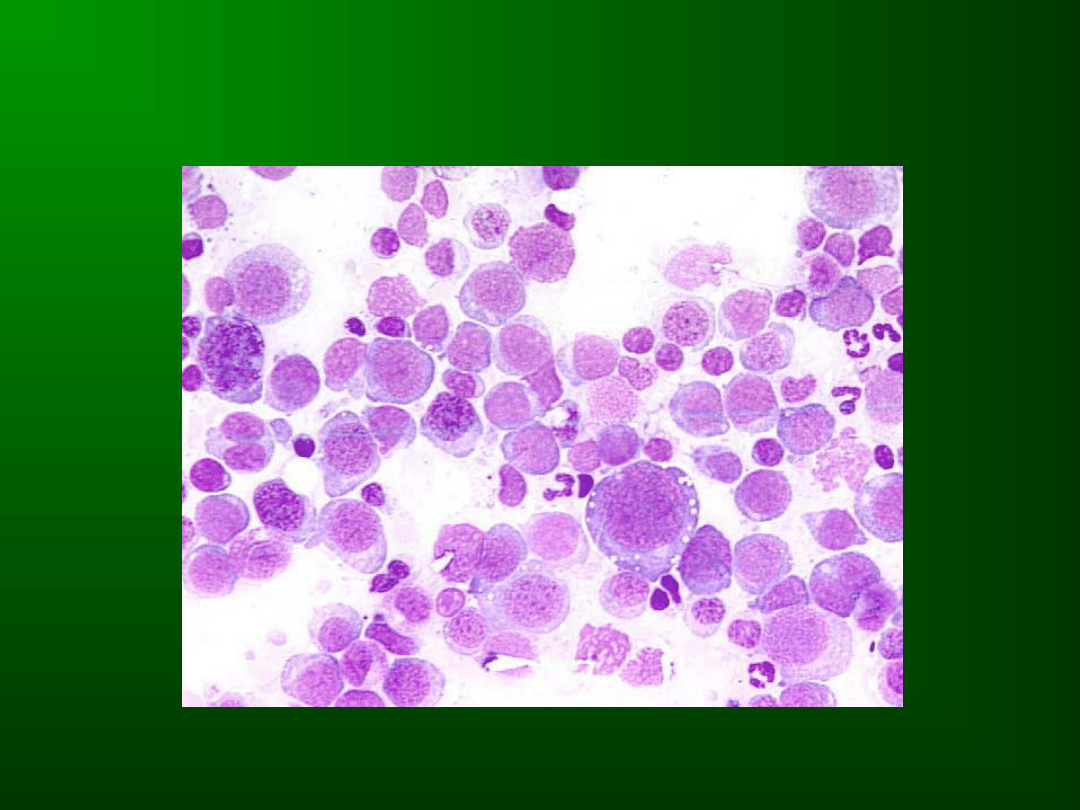
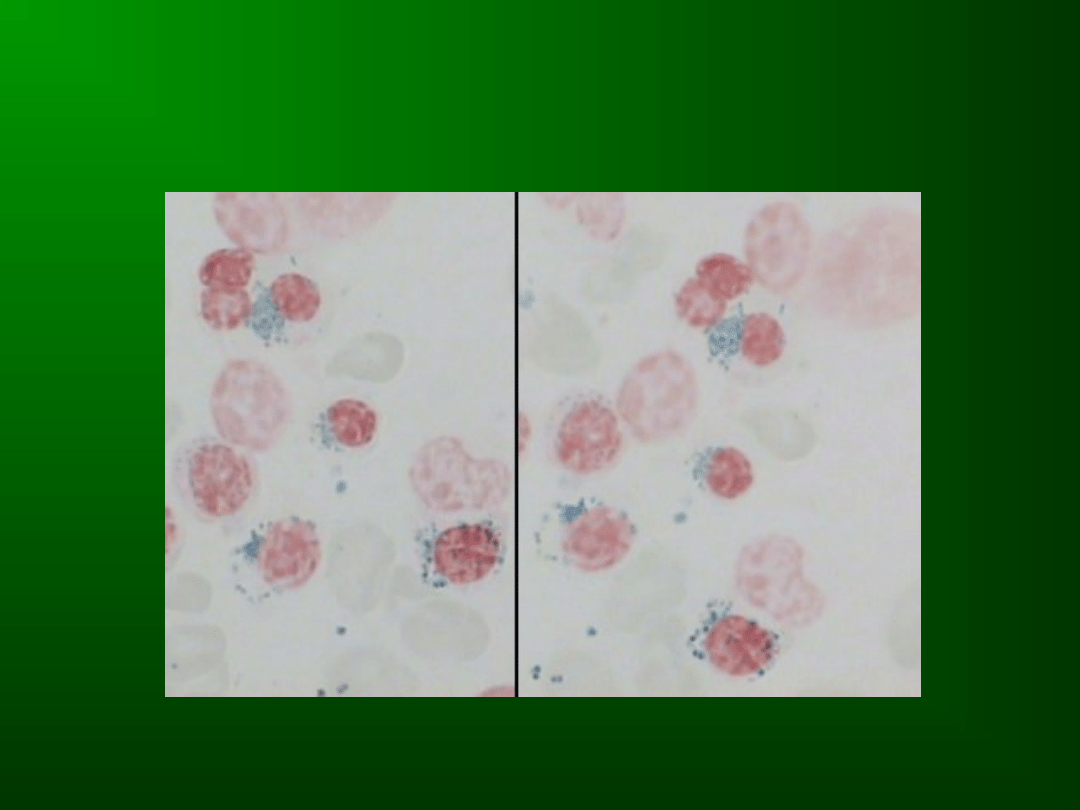
DYSHEMATOPOEZA W
MDS
Dyserytropoeza
(co najmniej 10%
linii erytroidalnej)
Odnowa
megaloidalna,
nierównomierne
wybarwienie
cytoplazmy,
jej
wakuolizacja,
nieregularne obrysy jąder, ich fragmentacja,
erytroblasty
wielojądrzaste,
sideroblasty
pierścieniowate
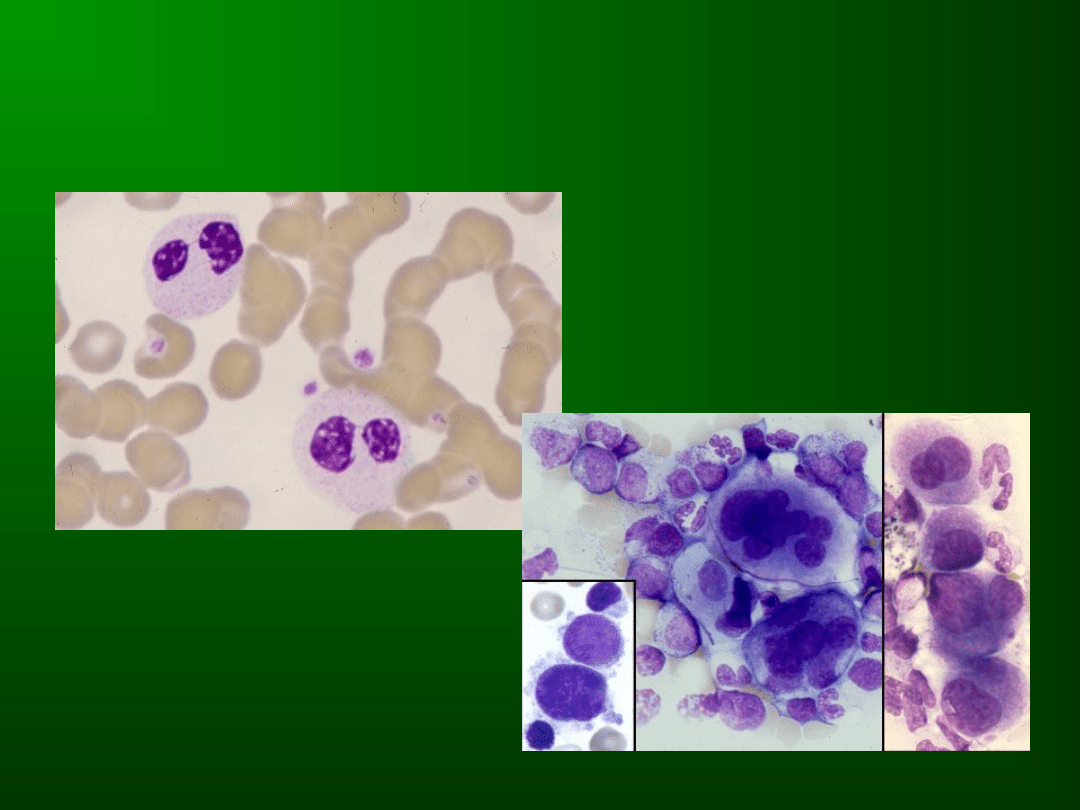
Dysgranulopoez
a
(co najmniej 10%
linii
granulocytarnej)
Odnowa megaloidalna, hipo-, hipergranulacja
cytoplazmy, hipo-, hipersegmentacja jąder,
jądra
dwupłatowe
(anomalia
pseudopelgerowska)
Dysmegakariop
oeza
(co najmniej 10%
linii
megakariocytarnej)
Hipogranulacja
cytoplazmy,
mikromegakariocyty
(śr.
ok.
20
m),
megakariocyty
olbrzymie,
jądra
niesegmentowane, dwupłatowe lub nadmiernie
segmentowane, megakariocyty wielojądrzaste
CECHY DYSHEMATOPOEZY W MDS
CECHY DYHEMATOPOEZY W MDS
CECHY DYHEMATOPOEZY W MDS

ZMIANY
CYTOGENETYCZNE W
MDS
Częstość występowania: 50% pierwotnych MDS,
80% wtórnych
I. ROKOWANIE KORZYSTNE
Kariotyp prawidłowy, 5q-, 20q-, -Y
II. ROKOWANIE POŚREDNIE
+8, pojedyncze aberracje inne niż w 1 i 3, dwie
aberracje
III. ROKOWANIE NIEKORZYSTNE
Złożone aberracje (3), różne aberracje
chromosomu 7

KLASYFIKACJA FAB MDS
(1982)
Typ MDS
k.bl. w
szpiku
p.sb. w
szpiku
k.bl. we
krwi
mn. we
krwi
RA
5 %
15 %
1 %
RARS
5 %
15 %
1 %
RAEB
5-20 %
5 %
CMML
20 %
5 %
1x10^9/l
RAEBt
20 – 30 %
5 %
k.bl. – komórki blastyczne; p.sb. – pierścieniowate sideroblasty; mn. – monocyty
RA – Refractory Anemia (niedokrwistość oporna na leczenie)
RARS - Refractory Anemia with Ringed Sideroblasts (niedokrwistość oporna na leczenie z
pierścieniowatymi sideroblastami)
RAEB - Refractory Anemia with Excess of Blasts (niedokrwistość oporna na leczenie z
nadmiarem blastów)
CMML – Chronic Myelomonocytic Leukemia (przewlekła białaczka mielomonocytowa)
RAEBt - Refractory Anemia with Excess of Blasts in transformation (niedokrwistość oporna na
leczenie z nadmiarem blastów
w stadium transformacji)

KLASYFIKACJA WHO
MDS (2001)
1. RA (Refractory anemia)
2. RARS (Refractory anemia with ring sideroblasts)
3. RCMD (Refractory cytopenia with multilineage
dysplasia)
4. RCMD-RS (Refractory cytopenia with multilinege
dysplasia with ring sideroblasts)
5. 5q- syndrome
6. RAEB (Refractory anemia with excess of blasts)
I (blasty 5-9%)
II (blasty 10-19%)
7. MDSu (Myelodysplastic syndrome unclassifiable )

ZMIANY W
KLASYFIKACJI MDS -
WHO 2008
RCUD (Refractory Cytopenia with
Unilineage Dysplasia)
- RA (Refractory Anemia)
- RN (Refractory Neutropenia)
- RT (Refractory Thrombocytopenia)

ZESPÓŁ 5q-
• Głównie starsze kobiety
• Niedokrwistość makrocytarna
• Prawidłowa lub nieco zmniejszona liczba
granulocytów
• Prawidłowa lub nieco zwiększona liczba trombocytów
• W szpiku: duże „jednopłatowe” megakariocyty z
ekscentrycznie
położonym jądrem
• Liczba blastów < 5%
• Izolowana delecja 5q
• Rzadka transformacja w ostrą białaczkę (10%)
• Dość długie przeżycie (śr. 107 mies.)

Nowotwory
mielodysplastyczno/mieloprolifer
acyjne (MDS/MPN)
1. Przewlekła białaczka mielomonocytowa (Chronic myelomonocytic
leukemia – CMML)
- monocytoza, <20 blastów monocytoidalnych w szpiku
2. Atypowa przewlekła białaczka szpikowa (Atypical
chronic myeloid leukemia – aCML)
- leukocytoza, neutrofilia, <20% blastów w szpiku, BCR/ABL (–)
3. Młodzieńcza białaczka mielomonoctowa (Juvenile
myelomonocytic leukemia – JMML)
4. MDS/MPN niesklasyfikowana (unclassifiable – MDS/MPNu)
5. Niedokrwistość oporna na leczenie z pierścieniowatymi
sideroblastami i trombocytozą (Refractory Anemia with Ringed
Sideroblasts Associated with Marked Thrombocytosis – RARS-T)
- RARS z trombocytozą
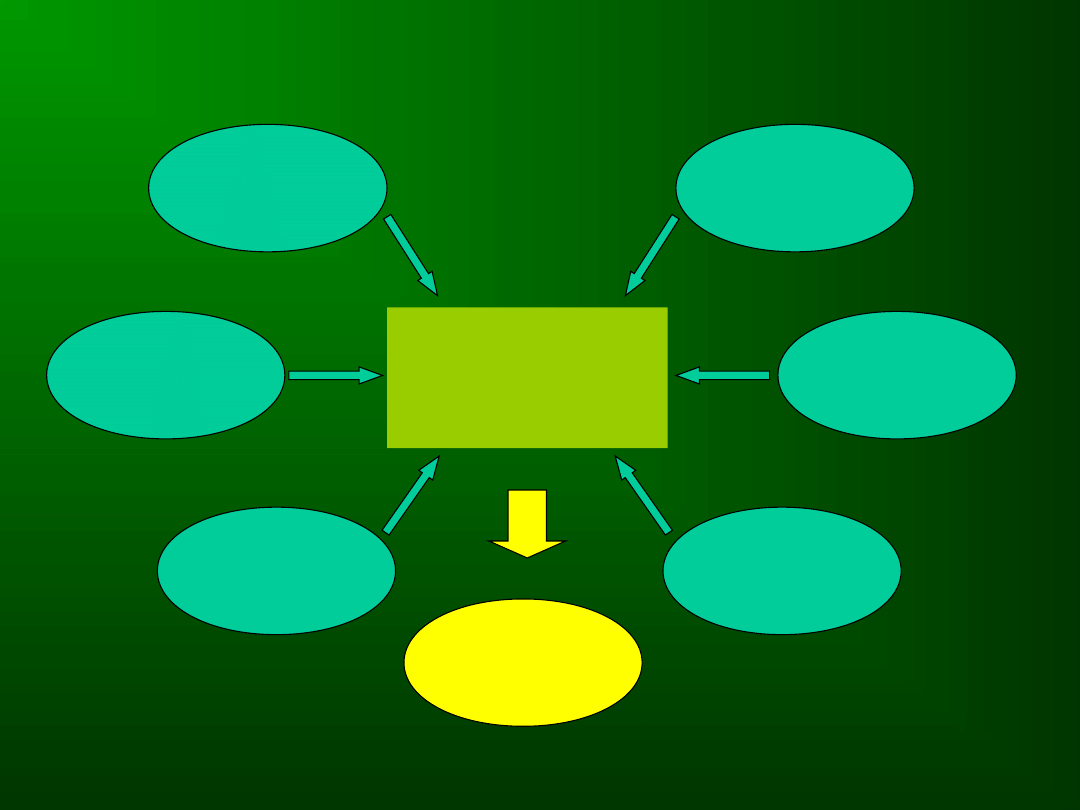
Uszkodzenie
komórki
macierzystej
Apoptoza
Różnicowani
e
Angiogenez
a
Czynniki
immunologiczne
Mikrośrodowis
ko
Zmiany
genetyczne
MDS
PATOGENEZA MDS

ZMIANY GENETYCZNE
W MDS
I. Aberracje chromosomowe
II. Mutacje w pojedynczych genach
III. Zmiany epigenetyczne -
„wyciszenie”
(silencing) genów, głównie
supresorowych przez
hipermetylację
lub deacetylację DNA

ZMIANY MOLEKULARNE
W MDS
„WYCISZENIE” GENÓW
Hipermetylacja
Wzrost aktywności metyltransferaz DNA
(DNMTs)
Osłabienie acetylacji histonowej
Wzrost aktywności deacetylaz histonowych
(HDACs)

APOPTOZA W MDS
Nasilenie apoptozy w typach z małą blastozą
w szpiku
(RA, RARS, RCMD), jej osłabienie w miarę
progresji
MDS i transformacji w AML
· Szlak mitochondrialny
· Szlak zewnątrzmitochondrialny

TYPY EWOLUCJI MDS
1. Stałość obrazu hematologicznego połączona ze stabilną
morfologią szpiku i kariotypem
2. Spontaniczna kliniczna i cytogenetyczna remisja
3. Zniknięcie nieprawidłowości genetycznych bez
równoczesnej
poprawy obrazu hematologicznego
4. Pojawienie się niezależnych od wyjściowych, wtórnych
zmian
w kariotypie, z równoczesnym wzrostem odsetka blastów
w szpiku
5. Stabilny przebieg do momentu nagłej transformacji w
ostrą
białaczkę
6. Stopniowy, wolny wzrost odsetka blastów w szpiku, przy
stabilnym
kariotypie, aż do osiągnięcia 20%

TYPY TRANSFORMACJI
BIAŁACZKOWEJ MDS
AML t. M1 i M2 - 54% MDS
AML t. M4 – 25%
AML t. M5 – 7%
AML t. M6 – 5%
Pojedyncze przypadki transformacji w ostrą
białaczkę
bifenotypową, biklonalną lub limfoblastyczną
Beris i wsp.

PRZYCZYNY ZGONÓW
CHORYCH NA MDS
• Infekcje 24% - 45%
• Transformacja w ostrą białaczkę 12% -
33%
• Masywne krwawienie 8% - 25%
• Inne: uszkodzenie serca, wątroby
(hemochromatoza)

MIEDZYNARODOWY WSKAŹNIK
PROGNOSTYCZNY W MDS
(International Prognostic Scoring
System - IPSS)
Wskaźnik
0
0,5
1
1,5
2
Blasty w
szpiku (%)
5
5 - 10
-
11 - 20
21 - 30
Kariotyp
korzystny
pośredni
niekorzyst
ny
Cytopenia
brak/jedn
o
liniowa
dwu/trzy
liniowa
Rokowanie oraz czas przeżycia w zależności
od IPSS
Grupa ryzyka
Punkty „score”
Czas przeż./Rozwój AL
(lata)
Małe ryzyko (LR)
0
5,7/9,4
Pośrednie I (IR-I)
0,5 – 1
3,5/3,3
Pośrednie II (IR-II)
1,5 – 2
1,2/1,1
Duże (HR)
2
0,4/0,2

WSKAŹNIK PROGNOSTYCZNY ZWIĄZANY
Z KLASYFIKACJĄ WHO
(WHO Classification-Based Prognostic Scoring
System - WPSS)
0
1
2
3
Typ WHO
RA, RARS,
5q-
RCMD,
RCMD-RS
RAEB-1
RAEB-2
Kariotyp
Korzystny
Pośredni
Niekorzystny
-
Zależność od
transfuzji
Nie
Tak*
-
-
* Zależność od transfuzji: co najmniej jedna transfuzja co 8 tyg. w ciągu 4 mies.
GRUPY RYZYKA
Bardzo małe (VL: score 0)
Małe (L: score 1)
Pośrednie (I: score 2)
Duże (H: score 3-4)
Bardzo duże: (VH: score 5-6)

LECZENIE MDS
• W grupie chorych młodszych ( do 55 - 65 r.ż.)
leczeniem z wyboru jest AlloHSCT
(z mieloablacyjnym kondycjonowaniem
lub kondycjonowaniem o zredukowanej
intensywności)
• W przypadku braku dawcy lub braku zgody na
ten typ leczenia:
- próba AutoHSCT
- leczenie zachowawcze

ALLO HSCT W MDS
Zasada: Transplantacja jak najszybciej,
bez poprzedzającego leczenia
cytostatycznego
• Wyniki zależne od IPSS
• 5-letnie DFS:
LR i IR-1: 60%
IR-2: 36%
HR: 28%

LECZENIE MDS
Pacjenci starsi/w złym stanie biologicznym
z małym IPSS (LR, IR-I)
• Leczenie objawowe:
KKCZ (leki chelatujące żelazo), KKP,
małe dawki
kortykosteroidów, steroidy anaboliczne
(Danazol),
profilaktyka i leczenie infekcji
• Retynoidy:
Tretynoina (ATRA, Vesanoid)
• Cytokiny:
rhuEPO
, G-CSF
• Amifostyna (Ethyol)
• Talidomid, lenalidomid
• Surowica antylimfocytarna, antytymocytarna
• Inhibitory HDAC (kwas walproinowy, worinostat)

WSKAZANIA DO LECZENIA
CHELATUJĄCEGO ŻELAZO W
MDS
• IPSS: LR, IR-1 i czas przeżycia ≥ 5 lat
i
• ferrytyna ≥ 2000 ug/L
lub
• liczba przetoczonych jednostek KKCZ ≥ 20
lub
• kliniczne i/lub bioptyczne dowody na
spichrzanie żelaza
LEKI:
• deferoksamina (Desferal) 20-40 mg/kg sc co 12 godz, 5-7
dni w tyg. do osiągnięcia poziomu ferrytyny < 1000 ug/L
• deferasiroks (Exjade) 20 mg/kg/dobę 1x dz po
tabl 125, 250 i 500 mg

LECZENIE MDS
Pacjenci starsi z dużym IPSS (IR-II,
HR)
• Małe dawki cytarabiny
+ ATRA, + etopozyd, + mitoksantron
• Trójtlenek arsenu
• Analogi pirymidynowe o działaniu hipometylującym DNA
5-azacytydyna
5-aza-2’-deoksycytydyna

LEKI
HIPOMETYLUJĄCE
Analogi pirymidynowe – inhibitory metyltransferazy
DNA
5 azacytydyna (Vidaza)
Schemat CALGB
75 mg/m
2
/dobę sc 1 – 7, co 28 dni; TR (CR+PR+HI) 60%
5-aza-2’-deoksycytydyna (Decitabine, Dacogen)
Schemat Wijermansa i wsp.
45 mg/m
2
/dobę, w ciągłej infuzji iv, 1 – 3, TR 49%
Badane dawki: 5-120mg/ m
2
/dobę przez 3-15 dni

GŁÓWNE ZASADY
DIAGNOSTYKI I LECZENIA
MDS: podsumowanie
• Wykonanie trepanobiopsji i ocena histologiczna szpiku
(czynniki prognostyczne)
• Określenie stopnia dyshematopoezy (sideroblasty)
i liczby blastów (500 komórek)
• Badanie cytogenetyczne
• Rozpoznanie typu MDS wg WHO
• Określenie IPSS/WPSS
• Poszukiwanie dawcy szpiku dla młodszego pacjenta
• Wybór optymalnego sposobu leczenia w przypadku braku
zgody/dawcy oraz dla pacjenta starszego z
uwzględnieniem
IPSS/WPSS
• Niwelowanie ubocznych skutków leczenia (preparaty
chelatujące
żelazo)
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
Wyszukiwarka
Podobne podstrony:
KURS ETYKI
Choroba hemolityczna p odu na kurs
zapotrzebowanie ustroju na skladniki odzywcze 12 01 2009 kurs dla pielegniarek (2)
kurs
wady postawy kurs
ostre białaczki 24 11 2008 (kurs)
AT kurs analityka giełdowego 3
Pielęgniarki kurs wersja 6 V 01
Kurs 03 Dynamika
Kurs anemia2012
Stany zagrożenia życia pielęgniarki kurs[1]
DOKUMENTOWANIE GEOTECHNICZNE kurs
kurs html rozdział II
Kurs usability
Kurs rysunku Manga NR 12
więcej podobnych podstron