
Hormony a gospodarka
lipidowa
INSULINA:
1)
hamuje uwalnianie WKT
z tk. tłuszczowej
do osocza (hamuje lipazę wrażliwą na
hormon) - WKT i glicerolu w osoczu,
2)
wzmaga lipogenezę i syntezę
acyloglicerolu
• Wzmaga aktywność
dehydrogenazy
pirogronianowej, karboksylazy acetylo CoA,
acylotransferazy glicerolo-3-fosforanowej

Antylipolityczne działanie
insuliny
• hamowaniu cyklazy adenylanowej poprzez
białko Gi,
• pobudzaniu fosfodiesterazy,
• pobudzaniu fosfatazy lipazy, która
inaktywuje lipazę wrażliwą na hormon,
• hamowanie lipazy TG adipocytów, wrażliwą
na hh lipolityczne
Lipolizę hamują, oprócz insuliny, kwas nikotynowy,
PGE1,\
glukoza, <WKT

Lipogenetyczne działanie
insuliny
• Aktywacji
lipazy
lipoproteinowej
śródbłonków włośniczek
• Stymulacji
wnikania
glukozy do kk,
gdzie jest żródłem alfa
glicerofosforanu (do syntezy TG) i
NADPH (do syntezy de novo kwasów
tłuszczowych)
• Stymulacji syntezy TG z glukozy
• Hamowaniu
lipolizy

Hormony pobudzające
lipolizę
• Adrenalina, noradrenalina, glukagon, ACTH,
MSH, GH, TSH, wazopresyna, hh tarczycy
cAMP
- pobudzenie kinazy białkowej zależnej od
cAMP -
aktywacja lipazy triacyloglicerolowej
wrażliwej na hormon
• Metyloksantyny (kofeina, teofilina) - inhibitory
fosfodiesterazy
cAMP stężenie WKT w
osoczu.
Glikokortykosterydy
pobudzają lipolizę
poprzez
syntezy de novo białka lipazy (niezależnie od cAMP)

wydzielany
przez komórki A trzustki
wydzielanie pobudza
:
•
niskie
stężenie glukozy we krwi
• arginina, lizyna i treonina - pobudzają przy niskin
stężeniu glukozy
• kortyzol i hormony przewodu pokarmowego
• katecholaminy po zwiazaniu z receptorem -
adrenergicznym
wydzielanie hamuje
• wzrost glukozy powyżej wartości na czczo
• kwasy tłuszczowe i związki ketonowe
• insulina i somatomedyna - parakrynnie
• insulina także hamuje transkrypcję proglukagonu
• katecholaminy po związaniu się z receptorem -
adrenergicznym
działa
głównie na
wątrobę
i
tkankę tłuszczową

Receptory
- adipocyty i hepatocyty
GR2
- wiąże się przy wysokim stężeniu - aktywacja
cyklazy
adenylanowej
cAMP
GR1
- przy niskim
kaskada
inozytolowa

GŁÓWNY HORMON POBUDZAJĄCY UWALNIANIE KWASÓW
TŁUSZCZOWYCH Z TKANKI TŁUSZCZOWEJ W OKRESIE
MIĘDZYTRAWIENNYM
szybkość
uwalniania FA regulowana jednocześnie przez:
•Przyśpieszanie
syntezy oraz aktywacji
lipazy
hormonowrażliwej
: kortyzol, glukagon, katecholaminy i GH
•hamuje
: insulina przez hamowanie cyklazy adenylowej i
aktywację
fosfodiesterazy cAMP
Stężenie FA w osoczu szczególnie w tkankach
insulinozależnych
-oksydacja
W OKRESIE MIĘDZYTRAWIENNYM TKANKI
OSZCZEDZAJĄ GLUKOZĘ !

Ilość FA w osoczu zależy od pobierania przez
wątrobę
•Glukagon w
wątrobie
przyspiesza -oksydację i
ketogenezę
Działanie ketogenne glukagonu
• ograniczenie szybkości syntezy cytrynianu w
mitochondriach
• w
mitochondrium
pirogronian do syntezy
szczawiooctanu
cyklu Krebsa
• acetylo-CoA do syntezy ciał ketonowych
• w
cytoplazmie
zahamowanie
karboksylazy
acetylo-
CoA
(aktywana „defosfo”)
ustaje synteza FA
• niska synteza cholesterolu
hamuje fosfatazę
defosforylującą reduktazę HMG-CoA,
aktywuje kinazę

• w
cukrzycy
- mimo podwyższonego stężenia
glukozy
we krwi
• nie ma jej w komórkach A i zachowują się jak w
hipoglikemii
(insulina konieczna do transportu glukozy do
komórek A)
• wzmożona sekrecja glukagonu

• Przedni płat przysadki
• aktywacja cyklazy adenylowej
• ułatwia pobieranie LDL z osocza przez komórki kory
nadnerczy stymulując syntezę i transport
receptorów B-100/E
• aktywuje esterazę cholesterolową (fosforylacja)
• aktywuje mitochondrialne enzymy biorące udział w
biosyntezie
kortyzolu

• Po posiłkach wpływ minimalny
• Istotny w okresie międzytrawiennym
W
tkance tłuszczowej
- pobudzenie
lipolizy
;
przyspiesza transkrypcję lipazy oraz białka
potrzebnego do jej aktywacji
Funkcja
przyzwalająca
dla glukagonu, katecholamin i
GH uwrażliwiając adipocyty na te hormony
• wzrost cAMP - lipaza „fosfo”
W
wątrobie
- przyzwolenie dla glukagonu
Reguluje stosunek
insulina-glukagon
- hamuje
uwalnianie
insuliny
, pobudza glukagonu
W
tkankach
insulinowrażliwych
hamuje szybkość
syntezy
receptorów
insuliny
W rdzeniu nadnerczy zwiększa syntezę enzymów
wytwarzających
katecholaminy

Rdzeń nadnerczy oraz zakończenia pozazwojowe
włókien nerwowych układu synaptycznego; z
tyrozyny
• Uwalnianie
pobudzane na drodze cholinergicznej
(stres)
• Receptory
- 1 i 2 oraz 1 i 2
Dla przemiany lipidowej istotne
R1
- aktywacja
cyklazy adenylowej lipolizy
• Utrudniają
wiązanie insuliny z receptorem
w błonie
adipocytów
Mechanizm - hamowanie
kinazy
tyrozynowej
podjednostki beta receptora
insulinowego

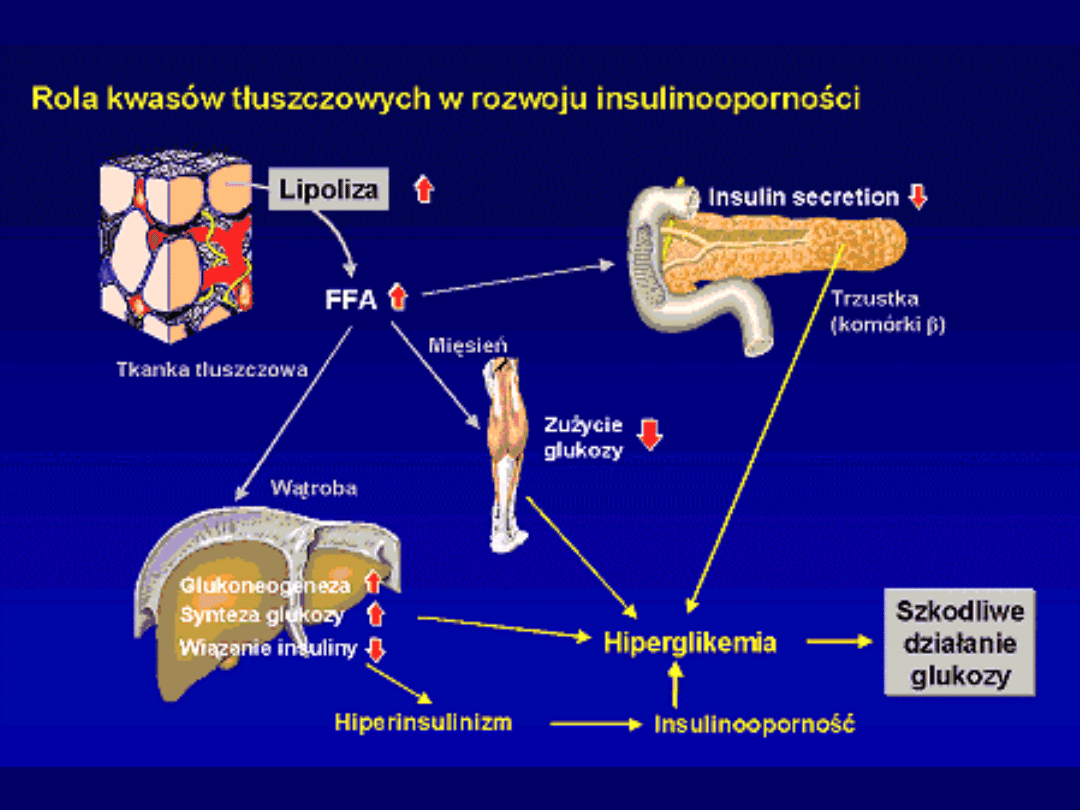
Wpływ zwiększonego stężenia kwasów tłuszczowych
na metabolizm komórki mięśniowej
Mięśnie nie mają receptorów dla
glukgonu
ale glukagon wpływa
pośrednio na metabolizm mięśni
Hemostaza
glukozy we krwi utrzymywana jest przez:
• stymulacja glukoneogenezy i glikogenolizy
• ograniczenie zużycia
W mięśniach tylko
wolniejsze
wykorzystywanie
Ograniczenie zużycia glukozy w mięśniach jako
skutek zmian metabolicznych w
tkance
tłuszczowej
Mięśnie jako źródło energii wykorzystują:
glukozę
,
kwasy
tłuszczowe
i
ciała
ketonowe

Wpływ zwiększonego stężenia kwasów tłuszczowych
na metabolizm komórki mięśniowej
Ciała
ketonowe
jako dobrze rozpuszczalne
• łatwo przenikają przez błonę komórkową i mitochondrialną
• w mitochondriach aktywacja acetoacetylo-CoA
transferaza sukcynylo-CoA: acetooctan
acetylo-CoA spalenie NADH i ATP
•
nagromadzenie
acetylo-CoA, NADH i ATP
fosforylacja dehydrogenazy pirogronianowej (nieaktywna)
co chroni pirogronian przed utlenieniem do acetylo-CoA
mleczan wątroba glukoneogeneza glukoza
czyli tzw. „oszczędne wykorzystywanie pirogronianu
w tkankach obwodowych”
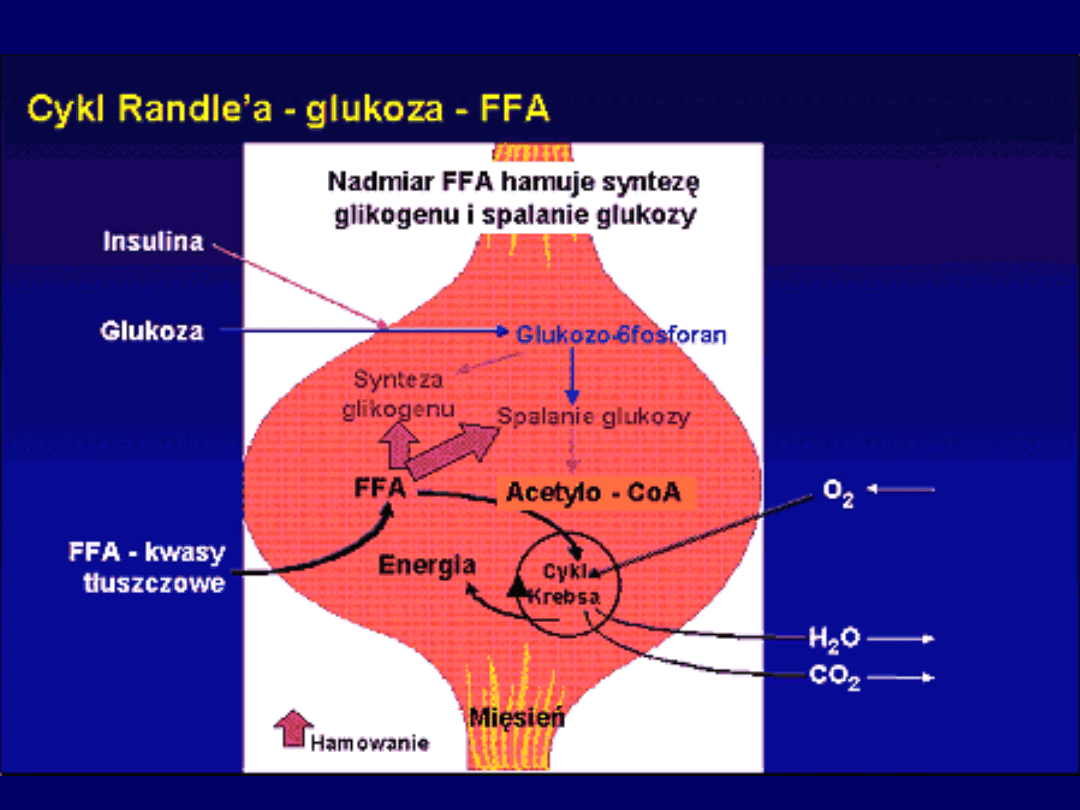
Wpływ zwiększonego stężenia kwasów tłuszczowych
na metabolizm
komórki
mięśniowej
Kwasy
tłuszczowe
•aktywacja w cytozolu
acylo-CoA mitochondrium
acylotransferaza karnitynowa + nośnik błonowy
• proces wydajny gdy w mitochondriach dużo wolnego CoA i
niskie stężenie malonylo-CoA
• ciała ketonowe są lepszym substratem niż kwasy tłuszczowe
• gdy niskie stężenie ciał ketonowych beta-oksydacja

Wpływ zwiększonego stężenia kwasów tłuszczowych
na metabolizm
komórki
mięśniowej
Acetylo
-
CoA
cykl Krebsa
NADH i ATP
•fosforylacja
dehydrogenazy pirogronianowej
(nieaktywna)
•hamowanie
dehydrogenazy izocytrynianowej
nagromadzanie cytrynianu cytozol
w cytozolu cytrynianu i ATP
obniża
fosfofruktokinazę
1 (PFK1)
nagromadzenie fruktozo-6-P i glukozo-6-P
inhibicja heksokinazy = fosforylacji glukozy

Wpływ zwiększonego stężenia kwasów tłuszczowych
na metabolizm
komórki
mięśniowej
W tych warunkach w
wątrobie
• wzrost
glukoneogenezy
i
glikogenolizy
• wzrost stężenia glukozy we krwi
ponieważ
• cała dostępna glukoza nie jest wykorzystywana w mięśniach
jako substrat energetyczny bo są FA
bo
glukagon
tkanka tłuszczowa cAMP fosforylacja
lipaz wzrost we krwi
FA
dostępnych dla wątroby i mięśni

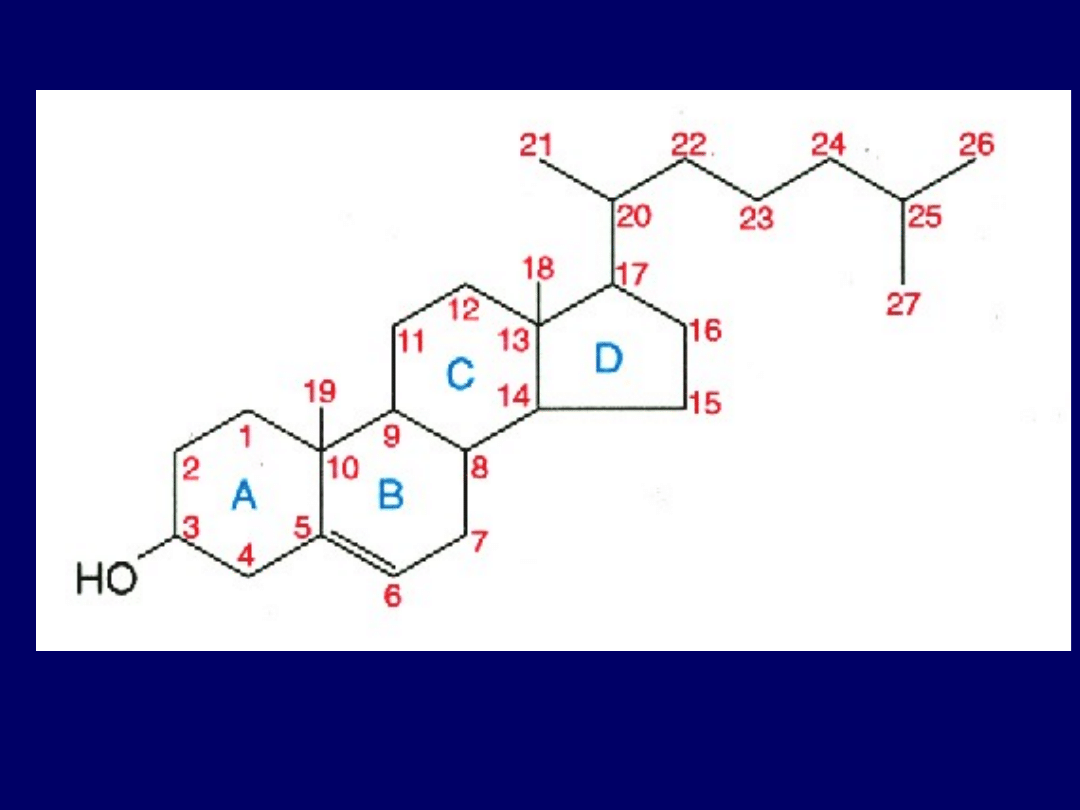
sterole z grupami
funkcyjnymi zawierającymi
tlen
• ŻRÓDŁA:
1)
dieta
2)
oksydacja
endogenna
A) autooksydacja
B) swoiste monooksygenazy (hydroksylacja
7, 20 , 22, 23 , 25, 26, 27)
C) enzymatyczna lub nieenzymatyczna
peroksydacja lipidów

DIETA
• produkty
świeże
- niewiele
• procesy technologiczne (termiczna
obróbka) i nie
właściwe
przechowywanie
• suszone
żółtka
jaj 20 różnych
oksysteroli
(25-
hydroksycholesterol, cholestan-triol)
•handlowy preparat żółtek
przechowywany przez rok ok. 137 g/g
suchej masy
• w
maśle
po smażeniu
• w
mleku
skondensowanym
i w
proszku
głównie 5, 6

DIETA
Oksysterole z pożywienia - wchłaniane -
transportowane przez
LIPOPROTEINY
VLDL
- 5-cholestan-3,5,6-triol, 7-
ketocholesterol, 7 i 7 -
hydroksycholesterol
LDL
- 25-hydroksycholesterol
HDL
- śladowe ilości

Powstawanie in vivo
•
wolne
rodniki
- szczególnie rodnik
hydroksylowy
OH
utlenia cholesterol;
•
anionorodnik ponadtlenkowy - (nie) mała
moc
•
enzymatyczna
hydroksylacja
cholestrolu w pozycji 7, 20, 22, 23 i 25,
26 i 27
•
epoksydacja
w pozycji 5 i 6
•
w wątrobie powstaje 7-
hydroksycholestrol, 25- i 26-
hydroksycholestrol
biosynteza
kwasów
żółciowych
•
20-hydroksycholesterol - związek
pośredni w
biosyntezie
hormonów
sterydowych
LDL
CHOLESTER
OL
PL, TG, CE
CW CE
Kwasy
tłuszczowe
18:2 - 30%, 6%,
64%
20:4 - 68%, 7%,
25%
OksyLDL
OksyFA
Oksysterole
Wodoronadtlenki
kwasów tłuszczowych,
aldehydy (MDA)

OKSYSTEROLE pierścieni
Ai B
• 7alfa OH CH - 4-165 g/L (krew)
• 7beta OHCH - 0-265
• 7-ketoCH - 0-373
• 5,6 alfa epoksyCH
• 5,6 beta epoksyCH
• Cholestantriol

OKSYSTEROLE
ŁAŃCUCHA BOCZNEGO
• 24 OH CH 3-43 g/l (krew)
• 25 OH CH < 7,5
• 26 OH CH 30-351

EFEKTY DZIAŁANIA
OKSYSTEROLI
•
cytotoksyczne
- są inhibitorami
wzrostu lub powodują śmierć komórek
in
vitro
•
immunosupresyjne
•
hamują
biosyntezę
DNA
oraz
biosyntezę
cholesterolu
•
są inhibitorami
kalmoduliny
•
wpływają na strukturę i funkcję
błony
komórkowej

EFEKTY DZIAŁANIA
OKSYSTEROLI
ZAHAMOWANIE WZROSTU I ŚMIERĆ
KOMÓREK (zwłaszcza szybko proliferujących)
•
7 OH CH (M) podobnie jak cyklofosfamid czy
5-fluorouracyl
•
Cytotoksyczny dla hepatoma, limphoma,
astrocytoma
•
25-, 27-OH CH hamowanie proliferacji VSMC
HAMOWANIE CHOLESTEROLOGENEZY

• IMMUNOSUPRESJA
Hamowanie proliferacji i transformacji
limfocytów
• DZIAŁANIE MUTAGENNE DLA
MIKROORGANIZMÓW
EFEKTY DZIAŁANIA
OKSYSTEROLI

EFEKTY DZIAŁANIA
OKSYSTEROLI
Rola w patogenezie miażdżycy
??
Badania epidemiologiczne
• emigranci hinduscy na Trinidadzie - w
diecie
tłuszcz ghe; w 1g ghe jest 2,1
mg
cholesterolu w tym 12,5%
to oksysterole -
wzrost miażdżycy
w tej
populacji
• w 1 g świeżego masła jest 2,5 mg
cholesterolu
i praktycznie brak
oksysteroli

EFEKTY DZIAŁANIA
OKSYSTEROLI
Rola w patogenezie miażdżycy
??
Stężenie
26-hydroksycholesterolu w osoczu
u osób starszych z miażdżycą
u osób z hipercholesterolemią
Raczej
mieszanina
oksysteroli
, a nie sam
utleniony cholesterol ma działanie
aterogenne
•największe ma
5 -cholestan-3,5,6-
triol
polarne oksysterole
-
wykrywa się w zmienionej
miażdżycowo ścianie tętnicy; są to głównie
oksysterole powstające podczas przechowywania i
przetwarzania nabiału

EFEKTY DZIAŁANIA
OKSYSTEROLI
Rola w patogenezie miażdżycy
??
Niektóre (26-hydroksycholestrol) działanie
antyaterogenne
- inhibitory reduktazy
HMG-CoA czego wynikiem syntezy
wewnątrzkomórkowej cholesterolu
E. Bartnikowska, Aktywność biologiczna oksysteroli, Żywienie człowieka i metabolizm, 1995,
22/1, 78-88

• DZIAŁANIE ATEROGENNE
Apoptoza EC, VSMC (hamowanie
cholesterologenezy: supresja
transkrypcji
genu RHMGCoA, degradacja
enzymu)
Indukcja ekspresji genów
uczestniczących w morfogenezie
kości -kostnienie ścian tętnic
EFEKTY DZIAŁANIA
OKSYSTEROLI

RODZINA RECEPTORA
LDL
• LDLR, apoB/E, wysokiego
powinowactwa
• LRP (LDL-receptor-related protein)
• gp330 (megalina)
• VLDLR 1 i 2
• OVR

Podobieństwo struktury
receptorów rodziny LDLR
STRUKTURA WIELODOMENOWA
• domena wiążąca ligand
• domena podobna do EGF
• glikoproteinowa (z wiązaniem O-
glikozydowym
LDLR, VLDLR2
)
• przezbłonowa
• cytoplazmatyczna
• powtórzenia podobne do dopełniacza

LIGANDY MODULUJĄCE
WIĄZANIE RECEPTORÓW
RODZINY LDL Z LIGANDAMI
• RAP (receptor associated lipoprotein)
blokuje miejsca wiązania ligandów w
receptorach rodziny LDLR (hamuje ich
aktywność)
Powinowactwo RAP do receptorów rodziny
LDLR: RLDL<LRP<gp330<RVLDL
• LPL i HTGL
wiązanie receptorów z ligandami
(remnantami lipoprotein).
Pośredniczą w ich wiązaniu z proteoglikanami
na powierzchni hepatocytów

LDLR
ligandy:
• lipoproteiny/apoB100,
• lipoproteiny/apoE,
• RAP (receptor associated
lipoprotein)

FUNKCJE LDLR
• KOMÓRKI POZAWĄTROBOWE:
pobieranie wyłącznie LDL
• HEPATOCYTY:
pobieranie również innych LP,
zawierających apo B100 i E

VLDLR1 i VLDLR2
• Lokalizacja:
różne kk z wyjątkiem wątroby i jelita
cienkiego
• Rola:
wychwyt lipoprotein bogatych w TG, udział w ich
katabolizmie
• ligandy:
VLDL, IDL, LDL,
RAP, LPL, uPA-PAI
LPL > wiązanie lipoprotein z receptorami
rodziny
LDL. Dodatkowymi wzmacniaczami tego
efektu
są proteoglikany

LRP = 2MR
• RECEPTOR REMNANTÓW: CHYLOMIKRONÓW I
VLDL
• Lokalizacja:
• na powierzchni komórek - hepatocyty, kk kory
nadnerczy
• w całej komórce - fibroblasty, makrofagi, SMC

Rola LRP
1. Udział w metabolizmie rCHYL i rVLDL (LP
bogatych w TG, przenoszonych z jelit i
wątroby do
innych tkanek, np. mięśni),
2. Regulacja aktywności proteinaz [wiązanie
i internalizacja proteinaz (np. serynowych)
i kompleksów proteinaza/inhibitor (np.
2M proteinaza, 1 antytrypsyna itp)]

3. Regulacja metabolizmu cytokin i
hormonów (wiązanie kompleksów 2M z
cytokinami, hormonami),
4. Regulacja fibrynolizy (wiązanie tPA, uPA,
tPA-PAI1, uPA-PAI1),
5. Udział w katabolizmie białek macierzy
Rola LRP

Ligandy LRP
• apoE, apoE/remnanty lipoprotein
• LPL
• RAP
2M-proteinazy, elastaza- 1antytrypsyna
• tPA, uPA, tPA-PAI-1, uPA-PAI-1
• niektóre rhinowirusy
• trombospondyna
• TFPI, kurza witelogenina, leki
wielozasadowe

Gp 330
(megalina)
• (600kDa)
• największe białko błon plazmatycznych
kręgowców
LOKALIZACJA:
• nabłonek kanalików nerkowych,
pneumocyty, ciałko rzęskowe oka,
siatkówka, gruczoł łzowy, tarczyca,
przytarczyce, macica, łożysko, jelito,
pęcherzyk żółtkowy

Ligandy
megaliny
• apoE, H, J (HDL), LPL, RAP, laktoferyna,
tPA-PAI1, uPA-PAI1, tPA, uPA, CSP
• Funkcja
: regulacja metabolizmu
lipoprotein

Receptory
scavenger
LIGANDY:
• LP zmodyfikowane chemicznie
(oksydowane, glikowane,
acetylowane, karbamylowane),
• polirybonukleotydy,
• naturalne i zmodyfikowane
polisacharydy, fosfolipidy anionowe,
• inne molekuły (endotoksyny, azbest,
siarczan poliwinylu)

LOKALIZACJA:
• GŁÓWNIE EC, MAKROFAGI, KK KUPFERA
!! NIE PODLEGAJĄ REGULACJI
aktywność nie zależy od stężenia cholesterolu w
komórce
SR-B1- klasa B, typ 1-
hepatocyty, tkanki, w
których
zachodzi synteza hh sterydowych
,
pośredniczy w przekazywaniu estrów cholesterolu z
HDL2 (bez internalizacji i degradacji HDL). HDL
nie wchodzi do komórki, jedynie oczyszcza się z
estrów
)
Receptory
scavenger

Receptory w
metabolizmie HDL
• SR-B1
• KUBILINA
- 460kDa, nerki, jelito,
łożysko, pęcherzyk żółtkowy.
• LIGANDY:
HDL (wyłapywanie całych cząstek poprzez apo
A-I). Prawdopodobnie kubilina w nerkach
bierze udział w katabolizmie apo-A1 i jej
wydaleniu),
wit B
12
, łańcuchy lekkie IgG
.
U gryzoni koekspresja kubiliny z megaliną

• CERP -
cholesterol efflux regulatory
protein.
Uczestniczą w pobieraniu wolnego cholesterolu i
fosfolipi-dów z komórek przez prekursory HDL
(nie wiadomo czy za pośrednictwem apo A1).
• Produkt genu ABC1 (z rodziny
ABCs - ATP
binding cassette transporters
).
• Geny te kodują białka błonowe, które
wykorzystują ATP jako źródło energii do
transportu różnych związków przez błony
plazmatyczne.
Receptory w
metabolizmie HDL

Białka w metabolizmie
lipoprotein
• LPL - na powierzchni EC, zakotwiczony do
EC
proteoglikanem siarczanu heparanu.
Substraty
: TG chylomikronów i VLDL
Produkty
: WKT i glicerol
Aktywator
:
apo CII,
Inhibitor
: apo CIII
LPL związana z rVLDL i remnantów chylomikronów może
pośredniczyć w ich wychwytywaniu przez
LDLR i LRP
w
wątrobie przez wiązanie lipoprotein z proteoglikanem
siarczanu heparanu na powierzchni hepatocyta

Białka w metabolizmie lipoprotein
:
lipaza wątrobowa
• HL - na powierzchni EC w sinusoidach
wątroby, zakotwiczony do EC
proteoglikanem siarczanu heparanu.
Substraty
: TG i PL w rVLDL i HDL2
Produkty
: LDL i HDL3

Rola lipazy wątrobowej
• Hydroliza TG i PL rVLDL i HDL2
• Wyłapywanie rchyl. i rVLDL przez LDLR i LRP
w wątrobie, przez wiązanie lipoprotein z
proteoglikanami na powierzchni hepatocyta
(
nieczynna enzymatycznie HL, podobnie jak
LPL
)
• Pobieranie estrów cholesterolu z HDL przez
hepatocyty

LCAT - acylotransferaza
lecytyna:cholesterol
• Synteza w wątrobie, uwalniana do krążenia
z lipoproteinami
• ROLA
:
Estryfikuje cholesterol w HDL, przenosi kwas
tłuszczowy z lecytyny na wolny cholesterol
• PRODUKTY
: cholesterol zestryfikowany i
lizolecytyna
• AKTYWATOR
: apo A1 w HDL

ACAT - acylotransferaza
acylo CoA:cholesterol
• Estryfikacja cholesterolu w
komórkach (wątroba, jelita, ściana
tętnic).

CETP - białko przenoszące
estry cholesterolu
• ROLA
:
Transport estrów cholesterolu z HDL2
(rola w przemianie HDL2 do HDL3),
a także LDL, na VLDL, chylomikrony,
remnantów w zamian za TG
PLTP - białko przenoszące
fosfolipidy
• ROLA
:
Transport fosfolipidów (i wolnego
cholesterolu), uwalnianych podczas
lipolizy lipoprotein bogatych w TG na
HDL
Lipoproteiny
bogate w
TG
HD
L
PL,
Chol
PLTP

FABP - fatty acid binding
protein
• 14-15kDa, wielogenowa rodzina, 12
członków (98r), istnieją też różne
izoformy (skutek przyłączenia liganda,
postranslacyjnej tiolacji)
• Transport kwasów tłuszczowych
wewnątrz komórki
, zewnątrz
-albuminy
• Decydują o szybkości pobierania WKT z
osocza przez różne tkanki

FABP - fatty acid binding
protein
• E-FABP (epidermalny), L-FABP -wątrobowy, H-
sercowy, T-jądrowy, B- mózgowy, I (intestinal,
ileal) jelitowy, A- adipocytowy, M-mielinowy
• Zaangażowane w transport proliferatorów
peroksysomów z cytozolu do jądra, gdzie
wchodzą w interakcje z PPARs.
• Struktura beta harmonijki i alfa heliksu, domena
helikalna wiążąca ligand, w E-FABP wiązanie S-S
między Cys 120 i 127 (nietypowe dla tych białek)
• 1 cząsteczka FABP wiąże 2 cząsteczki kwasu
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
- Slide 41
- Slide 42
- Slide 43
- Slide 44
- Slide 45
- Slide 46
- Slide 47
- Slide 48
- Slide 49
- Slide 50
- Slide 51
- Slide 52
- Slide 53
- Slide 54
- Slide 55
- Slide 56
- Slide 57
- Slide 58
- Slide 59
Wyszukiwarka
Podobne podstrony:
Rola ekspresji receptorów hormonów płciowych, prostaglandyn i czynników angiogenezy w patogenezie ra
Antagoniści i agoniści receptorów dla hormonów płciowych
Steroid hormone receptors
TEMAT 9 hormony a odporność
HORMONY NADNERCZY
W 8 Hormony 2010 2011
78 Hormony wysp trzustki
Hormony kory nadnerczy 4
prezentacja ścieżki sygnalizacyjne z udziałem receptora błonowego
hormony nadnerczy
Receptura zbiorczy GWSH 2
Antagoniści receptora histaminowego H1
więcej podobnych podstron