
Ścieżki sygnalizacyjne z
udziałem receptora
błonowego

Zapoczątkowanie sygnału
W zapoczątkowaniu sygnału biorą udział:
hormony peptydowe
czynniki wzrostu
neurotransmitery
tlenek azotu

Hormony peptydowe
Do najbardziej znanych należą hormony wytwarzane przez
tylny płat przysadki mózgowej:
oksytocyna (pobudzająca skurcze macicy oraz gruczoły
mleczne)
wazopresyna (regulująca wydalanie wody przez nerki).
Następne to:
insulina (wytwarzana przez trzustkę i wpływająca na
obniżenie poziomu cukru we krwi)
kortykotropina (ACTH, wytwarzana przez przedni płat
przysadki mózgowej i pobudzająca wzrost kory nadnercza i
wydzielanie kortykosterydów)
sekretyna (hormon tkankowy pobudzający trzustkę do
produkcji soku trawiennego wytwarzana w przewodzie
pokarmowym)
angiotensyna (hormon tkankowy regulujący ciśnienie krwi i
skurcze mięśni gładkich).

Czynniki wzrostu
rodzina czynników VEGF (czynniki wzrostu śródbłonka
naczyniowego)
PDGF – płytkowy czynnik wzrostu
EGF – nabłonkowy czynnik wzrostu
NGF – czynnik wzrostu nerwów
FGF – czynnik wzrostu fibroblastów
TGF-β - transformujący czynnik wzrostu

Neurotransmitery
neurotransmiter- związek chemiczny, którego cząsteczki
przenoszą sygnały pomiędzy neuronami (komórkami
nerwowymi) poprzez synapsy, a także z komórek nerwowych
do mięśniowych lub gruczołowych. Najbardziej
rozpowszechnionymi neuroprzekaźnikami są:
glutaminian
GABA
Acetylocholina
noradrenalina
dopamina
serotonina

Tlenek azotu
U ssaków, w tym ludzi, NO jest ważną komórkową cząsteczką
sygnałową biorącą udział w wielu procesach fizjologicznych
i patologicznych. Jest to silny środek rozszerzający naczynia
z krótkim okresem półtrwania (kilka sekund we krwi).
Dawniej znane farmaceutyki jak nitrogliceryny i azotany
amylu odkryto ponad sto lat po ich pierwszym użyciu w
medycynie.
Receptory oddziałujące z białkami
G

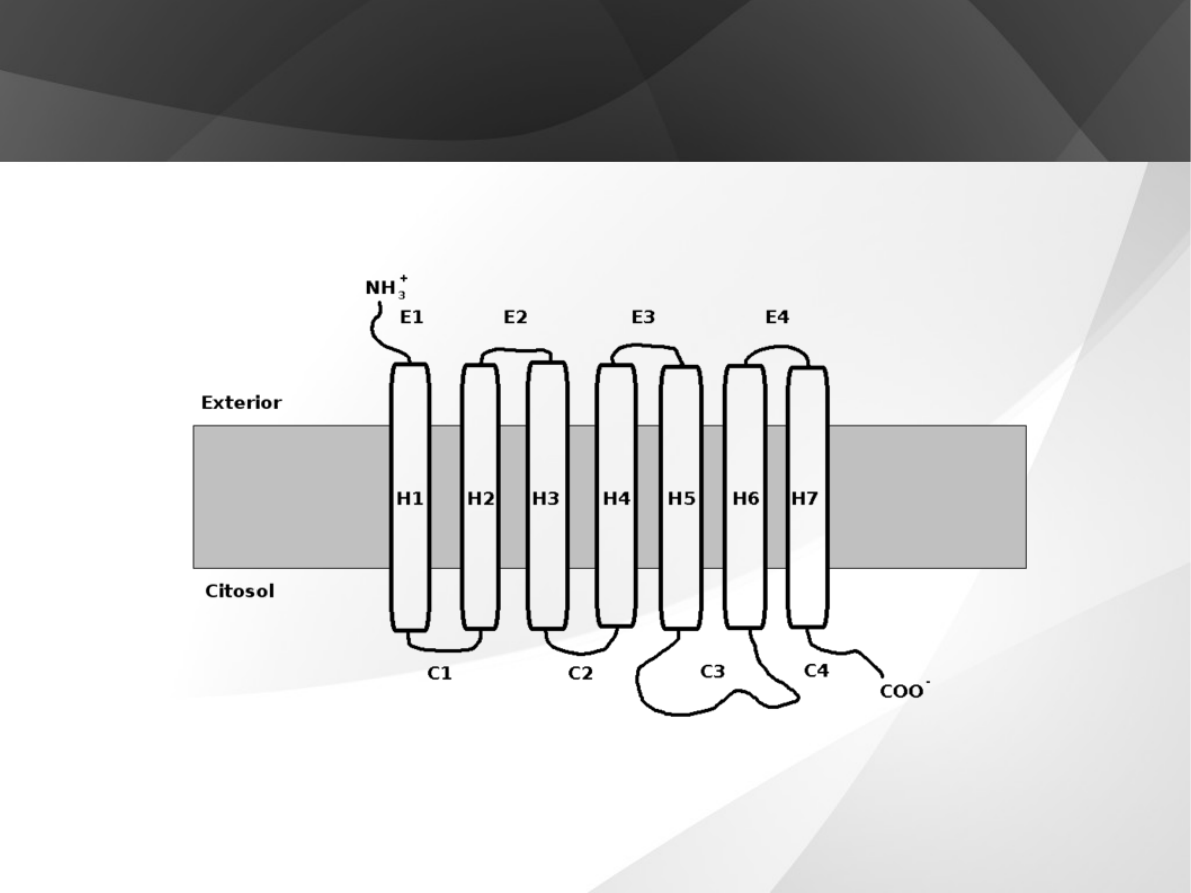
Receptory GPCR są zbudowane z pojedynczego polipeptydu
(łańcucha aminokwasowego) o strukturze α-helikalnej.
Cząsteczki receptora są silnie sfałdowane i zanurzone w
błonie komórkowej. Łańcuch polipeptydowy przechodzi
przez błonę lipidową komórki siedmiokrotnie, tworząc
hydrofobową domenę transmembranową (7TM), stąd nazwa
"siedmiohelikalne transmembranowe receptory
komórkowe". Koniec karboksylowy (-COOH) polipeptydu
znajduje się zawsze wewnątrz, a koniec aminowy (-NH2)
zawsze na zewnątrz komórki.
Główną funkcją GPCR jest przyłączenie liganda oraz
sprzężenie z białkiem G.

białka G
Gs - stymulujące
dołącza się do receptora Rs
podjednostka αs wiąże nukleotyd guanylanowy i ma aktywność
GTPazy; pobudza cyklazę adenylanową zwiększając tworzenie cAMP
podjednostki β i γ tworzą kompleks do którego przyłącza się
podjednostka α po oddaniu GMP
Gi - inhibitorowe
podjednostka αi wiąże kompleks guanylanowy i ma aktywność
GTPazy; hamuje działanie cyklazy adenylowej zmniejszając
wytwarzanie cAMP
podjednostki β i γ są takie same jak w Gs
receptory o aktywności kinazy fosforylującej białka na resztach
tyrozynowych
receptory o aktywności fosfatazy białkowej
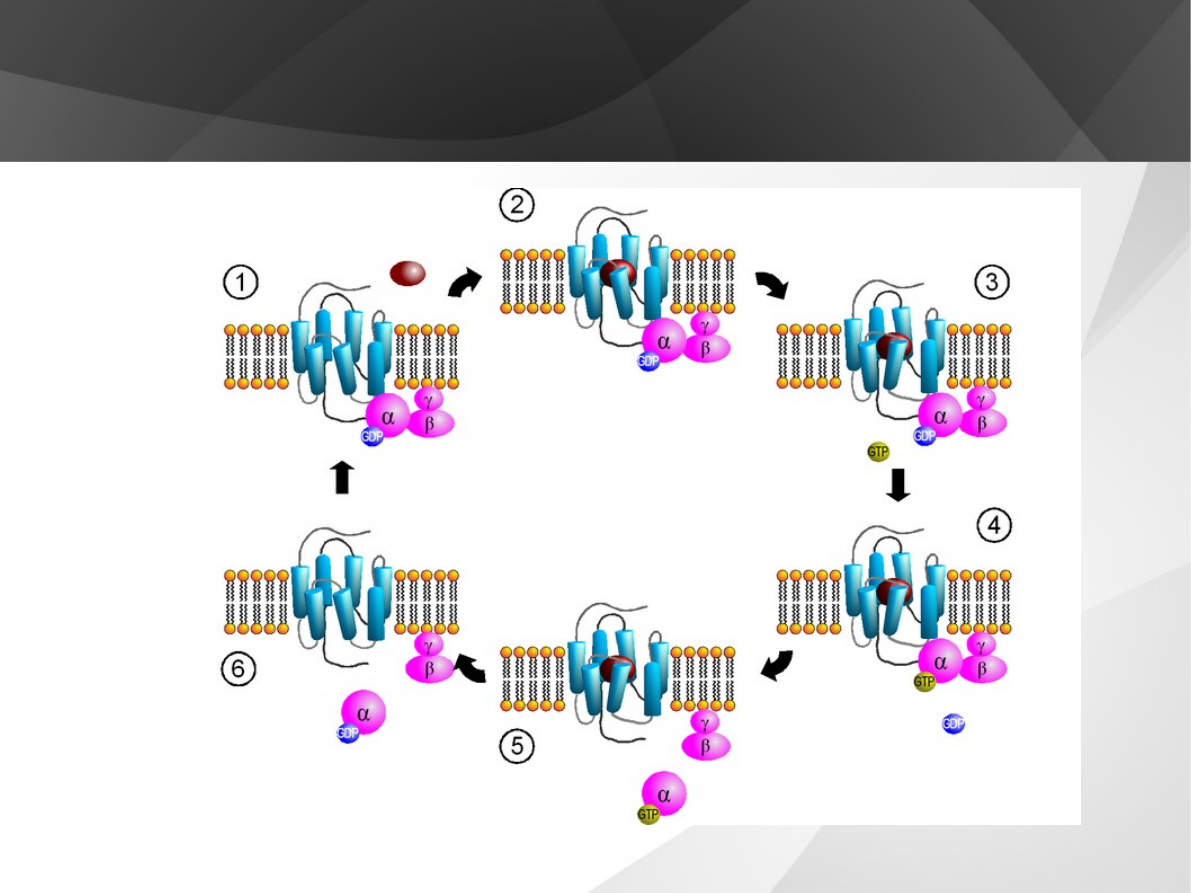
Działanie

Do zmienionej przez ligand zewnętrzny konformacji części wewnętrznej receptora
metabotropowego przyłącza się podjednostka α, co powoduje aktywację białka G,
czego efekty są następujące:
GDP związany z podjednostką α zostaje wymieniony na GTP, po czym
podjednostka α oddysocjowuje od heterotrimerycznego kompleksu i tworzy
zaktywowaną podjednostkę α;
'osamotniony' heterodimer - kompleks βγ również staje się aktywny;
Obydwie aktywowane części rozpadłego Białka G napotykają specyficzne dla siebie
białka efektorowe uaktywniając je. Zaktywowana podjednostka α po przyłączeniu
się do efektora, poprzez swoją aktywność GTP-azy hydrolizuje GTP i w efekcie:
powstaje GDP;
podjednostka α staje się nieaktywna i:
przyłącza napotkany kompleks βγ, deaktywując go;
Odtworzone, nieaktywne białko G jest gotowe do związania się z częścią wewnętrzną
receptora metabotropowego i rozpoczęcia kolejnego cyklu przekazywania
sygnału.

Sygnałowe enzymy efektorowe
Oprócz receptorów związanych z białkami G wyróżniamy grupę
receptorów związanych w sposób mniej lub bardziej
bezpośredni z enzymami. Opisuje się pięć klas tychże
receptorów:
nadrodzina receptorów o aktywności kinazy tyrozynowej,
receptory związane z kinazą tyrozynową,
receptorowe kinazy serynowo-treoninowe,
receptor o aktywności fosfatazy tyrozynowej,
cyklaza guanylowa

Nadrodzina receptorów o
aktywności kinazy tyrozynowej
Typowymi ligandami dla tych receptorów są czynniki wzrostu (nabłonkowy-EGF,
nerwowy-NGF, płytkowy-PDGF, fibroblastów-FGF, śródbłonkowy-VEGF,
hepatocytów-HGF), oraz również zaliczana do tej grupy insulina (IGF
1
).
Receptory te pod względem budowy są (z wyjątkiem receptora dla insuliny)
pojedynczymi białkami transbłonowymi, które w odróżnieniu np. od receptorów
związanych z białkami G przebijają błonę komórkową tylko jeden raz.
Po połączeniu się białka posiadającego domenę SH2 do receptora następuje
aktywacja tego białka lub przyłączenie do niego innego białka za pomocą
domeny SH3. Rozpoznająca zgrupowania proliny domena SH3 może zostać
wyeksponowana na białku łączącym się z receptorem poprzez ugrupowanie SH2.
Nie ma tu wtórnych przekaźników - przekaz jest na zasadzie kontaktu. Najczęściej
do ufosforylowanego receptora przyłączają się (ulegają aktywacji) następujące
białka-efektory:
fosfolipaza C - jest izoformą fosfolipazy aktywowanej przez receptory związane z
białkami G. Jej funkcja i tutaj polega na uwalnianiu IP3
kinaza 3-fosfatydyloinozytoli jest enzymem katalizującym ufosforylowanie 2-
fosfatydy-loinozytolu co zwiększa powinowactwo błony komórkowej do białek
cytoplazmatycznych.
białko Ras podobnie jak białko G i Rho jest GTPazą. Jest ono monomeryczne
(analogiczne do podjednostki białka G). Białko Ras jest regulowane przez 2 inne
białka:
aktywujące Ras - stymulujące wymianę GDPGTP (białko GnRP)
dezaktywujące Ras - zwiększające aktywność GTPazową (białko GAP).

Receptory związane z kinazą
tyrozynową
Same receptory nie posiadają aktywności enzymatycznej.
Dimeryzując przyłączają związaną z błoną kinzę
tyrozynową, która fosforyluje odcinki cytoplazmatyczne
receptora. Wyróżnia się 2 rodziny kinaz , które mogą zostać
przyłączone przez receptor:
Src (8 różnych kinaz),
Jak (3 kinazy).
Mamy więc tutaj doczynienia z dwuskładnikowym systemem
transdukcji. W przypadku kinaz z grupy Jak następnym
ogniwem w lancuchu przekazu są białka STAT.

Receptorowe kinazy serynowo-
treoninowe
W receptorach tego typu część cytoplazmatyczna jest
enzymem katalizującym fosforylację przy Ser lub Thr (np.
receptory dla TGF - stanowią 90% tych kinaz). W przekazie
sygnału do jądra uczestniczą białka Smad.

Receptory o aktywności fosfatazy
tyrozynowej
Reprezentują również jednoskładnikowy system
transdukcji. Obszar cytoplazmatyczny receptora
odszczepia grupę fosforanową od odpowiedniej kinazy przez
co powoduje jej aktywację. Działa dokładnie na odwrót jak
wcześniejsze receptory - defosforyluje. Jest to bardzo rzadki
wśród receptorów sposób aktywacji kinaz. Receptory tego
typu występują np. na limfocytach (receptory CD45).

Cyklaza guanylowa
Występuje w formie receptora błonowego lub
cytoplazmatycznego. Katalizuje reakcję GTPcGMP
Błonowa: występuje w komórkach:
aparatu przykłębuszkowego nerki
strefie kłębuszkowatej nadnerczy
komórkach mięśni. gładkich naczyń.
Jest receptorem dla ANF (atrial natiuretic factor).
Cytozolowa cyklaza guanylowa pobudzana jest przez
endotelialny czynnik powodujący relaksację naczyń ( EDRF,
NO).

Nieenzymatyczne
cytoplazmatyczne przekaźniki
wtórne
Na PIP2 działają enzymy aby go zdegradować.
Pierwszy efektor to fosfolipaza C – PLC. Do tej pory bieg
wydarzeń był taki:
cząsteczka sygnałowa -> zmiana konformacji receptora ->
aktywacja białka G -> aktywowane białko G -> aktywacja
fosfolipazy C
Fosfolipaza działając na PIP2 powoduje jego hydrolizę. W
błonie pozostaje pierwszy produkt tej hydrolizy –
diacyloglicerol (DAG) – jest on związkiem nierozpuszczalnym
w wodzie.
Drugi związek – 1,4,5,-trifosforanoinozytol, jest dobrze
rozpuszczalny w wodzie i znajduje się w wodzie. Obydwa
związki są wtórnymi przekaźnikami. Jednak ich losy są
odmienne.

Diacyloglicerol
Diacyloglicerol ma kilka dróg działania.
aktywuje kinazę białkową C
ulega fosforylacji i powstaje kwas fosfatydowy
ulega cyklowi lipidowemu celem odtworzenia PIP2
Diacyloglicerol jest aktywatorem kinazy białkowej C. Jednym z
najważniejszych efektów kinazy białkowej C jest otwarcie
antyportu Na/H. Efektem jest usunięcie z cytoplazmy jonów
wodorowych a napływ jonów Na. Pod względem ładunku –
nie zmienia się on, natomiast przez usunięcie jonów
wodorowych dochodzi do alkalizacji cytoplazmy, co jest
warunkiem wejścia komórki w fazę podziału.
DAG może ulegać fosforylacji do kwasu fosfatydowego który
jest również wtórnym przekaźnikiem.

IP3
IP3 – ma swoje receptory w retikulum endoplazmatycznym oraz
w kalciosomach. Jest to kanał typu ROC. Miejsca receptorowe
dla IP3 są zlokalizowane na zewnątrz tego kanału, następuje
jego otwarcie, a ponieważ gradient jonów Ca jest skierowany
do wnętrza cytozolu od strony retikulum następuje napływm
jonów wapnia do cytozolu.
IP3 może ulegać fosforylacjom (czyli kolejne kinazy na niego
działają)
IP3 może ulegać cyklowi inozytolowemu który wspólnie z
cyklem lipidowym odtwarza PIP2
IP3 – może ulec fosforylacji do IP4 – jest on również wtórnym
przekaźnikiem. Może ulec również przekształceniom do
forum pięcio- i sześcioufosforylowanych – funkcja nie jest
dokładnie poznana a tego typu procesy zachodzą w OUN.

IP4
IP4 oraz kwas fosfatydowy są mediatorami które otwierają
kanały SMOC. W przeciwieństwie do ROC w których cześć
receptorowa znajduje się na zewnątrz błony, tutaj ligand w
SMOC działa wewnątrzkomórkowo. Tego typu kanały
występują w błonie komórkowej -> efektem jest otwarcie
kanału i napływ jonów Ca do wnętrza komórki ale z
przestrzeni zewnątrzkomórkowej (pod wpływem IP3
następowało otwarcie kanałów w ER). Stężenie jonów Ca w
płynie zewnątrzkomórkowym jest znacznie większe niż w
cytozolu.

Fosfolipaza D
Fosfolipaza D - uruchomienie jej generuje przemianę fosfolipidów
błonowych zarówno należących do fosfoinozytydów, ale nie tylko –
również fostatydyloseryna, fosfatydylocholina i
fosfatydyloetanoloamina są substratami do zadziałania fosfolipazy
D.
W wyniku zadziałania PLD uwalnia się wtórny przekaźnik, mianowicie
kwas fosfatydowy – działa jako wtórny przekaźnik, otwierający
kanały typu SMOC (generuje dokomórkowy prąd wapniowy). Na
kwas fosfatydowy może zadziałać fosfataza, która zamieni go w
DAG a ten jest aktywatorem kinazy białkowej C.
Konsekwencją uruchomienia fosfolipazy D jest:
wzrost stężenia jonów wapniowych w cytozolu (-> aktywacja układu
kalmodulina-Ca, aktywacja kinaz wapniozależnych -> może
powstawać DAG czyli aktywacja kinazy białkowej C z fosforylacją
białek enzymatycznych/nieenzymatycznych)
uruchomienie antyportu Na/H -> alkalizacja cytozolu i podział
komórki)

Jądrowe transaktywatory
Tat (Transaktywator transkrypcji) zawiera od 86 do 101
aminokwasów, zależnie od podtypu. W dziedzinie biologii
molekularnej, Tat jest białkiem, które jest kodowane przez
gen TAT w HIV -1. TAT jest regulacyjnym białkiem
drastycznie zwiększającym skuteczność transkrypcji
wirusa.
Sugeruje się, że inhibitory Tat mogą być użyteczne w leczeniu
zakażeń HIV.
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
Wyszukiwarka
Podobne podstrony:
Ścieżki sygnalizacyjne z udziałem receptora cytoplazmatycznego
przesyłanie sygnału przez receptory fcgamma
receptory błonowe histologia
Prezentacja z wskażników zadłużenia,udziału kapitału i zobowiązań firmy
Opracowana prezentacja sygnały
Receptory klasyfikacja, budowa i szlaki tworzenia sygnałów ( 10 2010
Recepta na kariere prezentacja
Receptory histaminowepart prezentacja 5
Polimorfizm enzymów, receptorów i innych białek biorących udział w mechanizmie działania leków
prezentacja finanse ludnosci
prezentacja mikro Kubska 2
Religia Mezopotamii prezentacja
Prezentacja konsument ostateczna
Strategie marketingowe prezentacje wykład
motumbo www prezentacje org
lab5 prezentacja
Prezentacja 18
więcej podobnych podstron