
Kwantowa teoria budowy
powłok elektronowych
dr inż. Katarzyna Kozłowska

Odpowiedź na pytanie
W jaki sposób połączone są między sobą elementarne składniki
atomu (protony, neutrony i elektrony) oraz dlaczego elektrony
są rozmieszczone w takich ilościach na
poszczególnych powłokach elektronowych?

Kwantowa teoria atomu wodoru
1911 roku Rutherford – model budowy atomu
Masywny ładunek dodatni ograniczony do mikroskopijnego
obszaru w środku - elektrony krążą wokół tego ładunku w
odległej chmurze a ilość elektronów jest równa ilości
ładunków dodatnich
Rutherford założy, że:
o elektron stoi nieruchomo,
o elektron krąży wokół jądra - jak Ziemia wokół Słońca

Co z tego wynika
Założenie 1
-
elektron stoi nieruchomo
- elektron spadłby na jądro
Założenie 2
- elektron krąży wokół jądra
:
zgodnie z teorią Maxwella elektron krążący wokół ładunku
dodatniego, tworząc w ten sposób naładowany układ słoneczny,
powinien promieniować światło o częstości równej jego
częstości obrotów wokół jądra
Wypromieniowując to światło elektron traciłby energię
Tracąc energię poruszając się po spirali bliżej dodatniego
ładunku promieniując więcej i więcej światła, aż w końcu
osiągnąłby dodatnie centrum
Czas, jaki zabiera elektronowi spadnięcie po spirali z typowej
orbity na jądro jest bardzo krótki (rzędu jednej miliardowej
sekundy)
Promieniowanie, które byłoby emitowane przy takim spadaniu
byłoby ciągłe, przy czym częstość wzrastałaby przy maleniu
promienia

Wniosek
Widmo promieniowania byłoby ciągłym pasmem barw w
przeciwieństwie do obserwowanych dyskretnych linii -
charakteryzujących indywidualne atomy – przykład - linie
widma wodoru atomowego

Założenia teorii Bohra
o Ze wszystkich możliwych klasycznych orbit kołowych tylko
niektóre są dozwolone
o Kiedy elektron znajduje się na jednej z dozwolonych orbit,
nie promieniuje energii, w przeciwieństwie do teorii
Maxwella
o Elektron promieniuje energię podczas przechodzenia z
jednej orbity na drugą

Hipoteza Planka
Światło jest emitowane porcjami a ilość energii w każdej porcji
związana jest z częstością wzorem:
E = h
h - stała Plancka

Emisja światła
• Tylko pewne z możliwych orbit mogą być dozwolone
• Światło o określonej częstotliwości nie jest emitowane ani
absorbowane przez materię w dowolnie małych ilościach,
lecz tylko w postaci kwantów energii h * .
gdzie: h - stała Plancka, - częstotliwość

Kiedy elektron promieniuje energię
elektromagnetyczną?
o Tylko wtedy, gdy przechodzi z jednej dozwolonej orbity na
drugą
o Ilość wypromieniowanej energii jest opisana zależnością:
E' - E'' = h
o Energia wypromieniowanego światła jest równa różnicy
energii dwóch poziomów między którymi przeskoczył
elektron

Modele atomów wodoru -
porównania
Model atomu Bohra:
Poprawnie tłumaczył obserwacje doświadczalne jedynie dla atomu
wodoru
Był niewystarczający dla pierwiastków o bardziej złożonej budowie
Elektron krąży wokół jądra po torze zamkniętym, jednak nie
dowolnym, lecz ściśle określonym energetycznie, nazywanym orbitą
w tym stanie elektron nie pobiera ani nie oddaje energii
elektron może zmienić orbitę, gdy pobierze lub odda energię
energia może być pobierana lub oddawana wyłącznie w postaci
porcji nazywanych kwantami

Modele atomów wodoru -
porównania
Model atomu Schrodingera
W świecie atomów nie obowiązują prawa mechaniki klasycznej
Wszystkie obiekty mają naturę dualistyczną, tj. zachowują się
jak cząstka materialna czyli korpuskuła - mająca masę, i jak fala
elektromagnetyczna
stan elektronu w atomie opisuje funkcja falowa - nazwana
orbitalem
kwadrat tej funkcji daje prawdopodobieństwo znalezienia
elektronu w danym obszarze wokół jądra
energia elektronów jest kwantowana a geometryczne kształty
orbitali wskazują na przestrzenny rozkład prawdopodobieństwa
znalezienia elektronu opisanego danym orbitalem
znane orbitale to orbital s, p, d i f
każdy stan kwantowy elektronu jest opisany za pomocą czterech
liczb kwantowych, tj. główna liczba kwantowa - n, poboczna
liczba kwantowa -l, magnetyczna liczba kwantowa - m i spinowa
liczba kwantowa - s
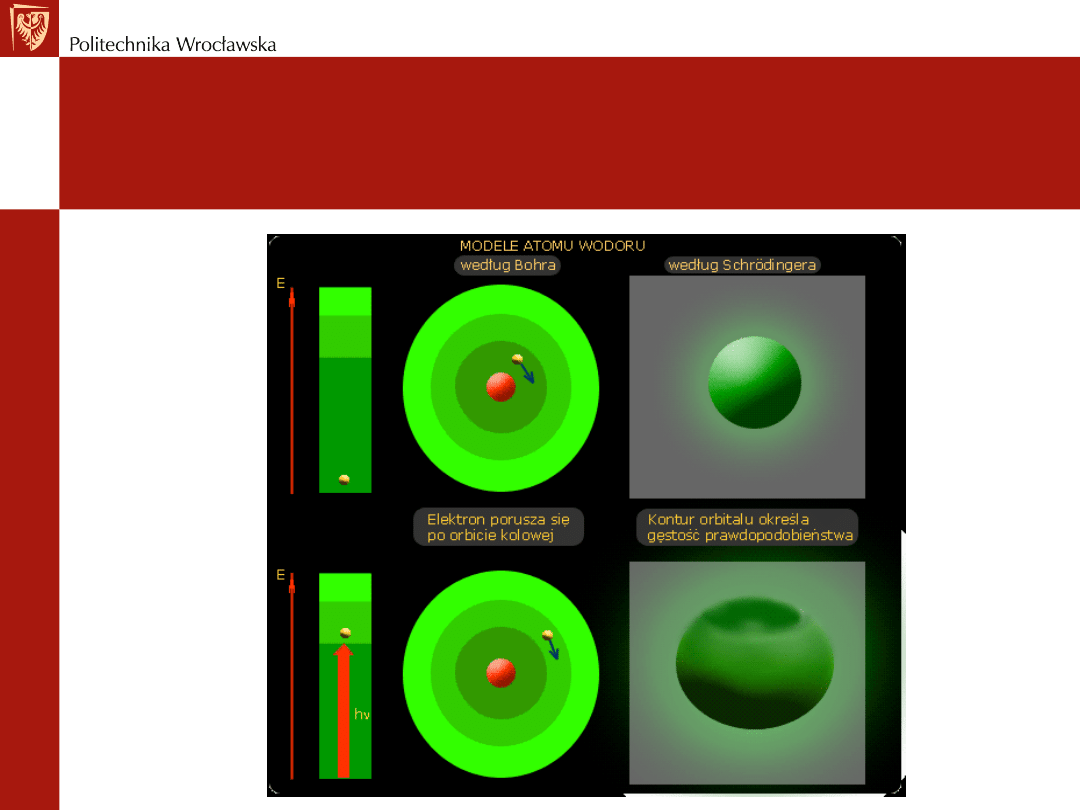
Model budowy atomu wodoru
według Bohra i Schrodingera
Document Outline
Wyszukiwarka
Podobne podstrony:
3 kwantowa teoria promieniowania
swiat kwantowy a teoria wzglednosci, Przydatne
Kwantowa teoria materii
pytania, kwantowa teoria informacji, Głupie pytanie
Kwantowa teoria budowy powlok elektronowych, Notatki i materiały dodatkowe, Chemia, materiały dodatk
Kwantowa teoria atomów
Teoria kwantowa kl 3 spr 6
PRZEMYŚLENIA W ZWIĄZKU Z TEORIĄ KWANTÓW
Teoria kwantowa kl 3 spr 6
Harry Potter i spaczona teoria fizyki kwantowej
teoria bledow 2
sroda teoria organizacji i zarzadzania
W10b Teoria Ja tozsamosc
Teoria organizacji i kierowania w adm publ prezentacja czesc o konflikcie i zespolach dw1
więcej podobnych podstron