
Ksenobiotyki
Ksenobiotyki
xenos (obcy)
związki egzogenne występujące w organizmie, który
ani go nie produkuje ani też w normalnych warunkach
nie przyjmuje z pożywieniem. Inaczej jest to
substancja chemiczna nie będąca naturalnym
składnikiem żywego organizmu.
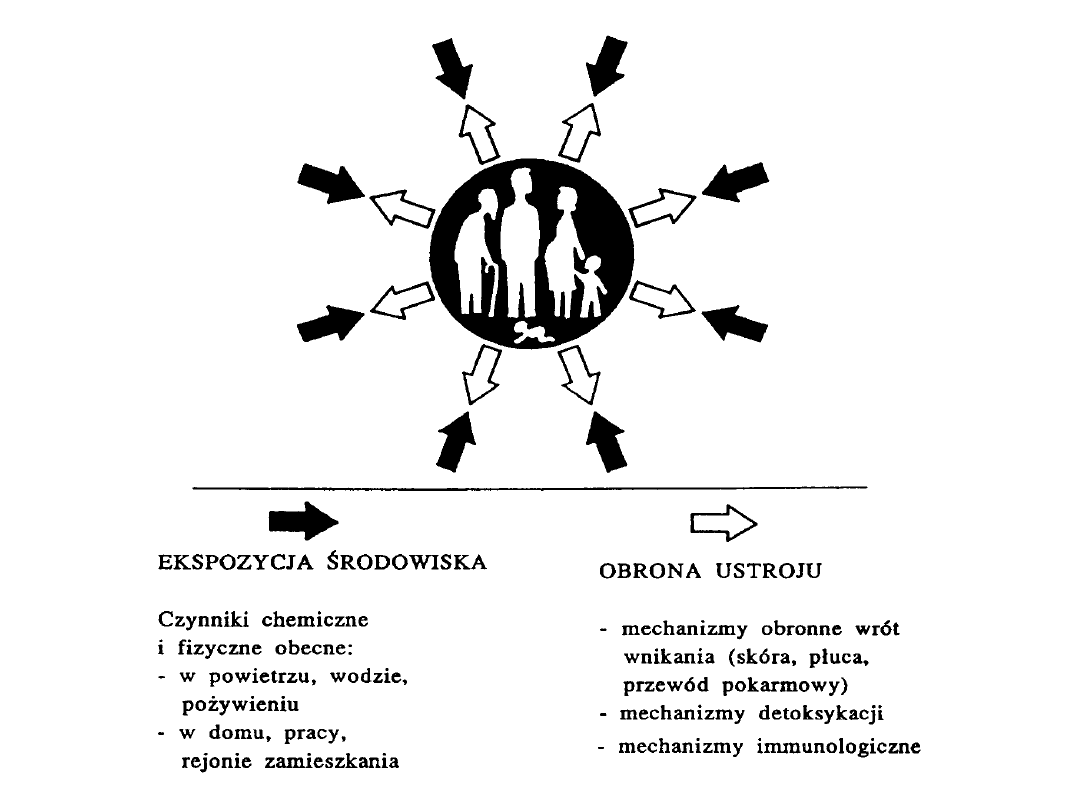

Główne grupy substancji obcych dla
człowieka to:
- leki,
- pestycydy,
- niektóre substancje celowo dodane do
żywności,
- zanieczyszczenia środowiska
zewnętrznego
pochodzenia zawodowego i
komunalnego,
wewnątrzdomowe i zewnątrzdomowe
pochodzenia chemicznego i
organicznego.

Metabolizm ksenobiotyków
Metabolizm ksenobiotyków
w organizmie obejmuje
w organizmie obejmuje
:
:
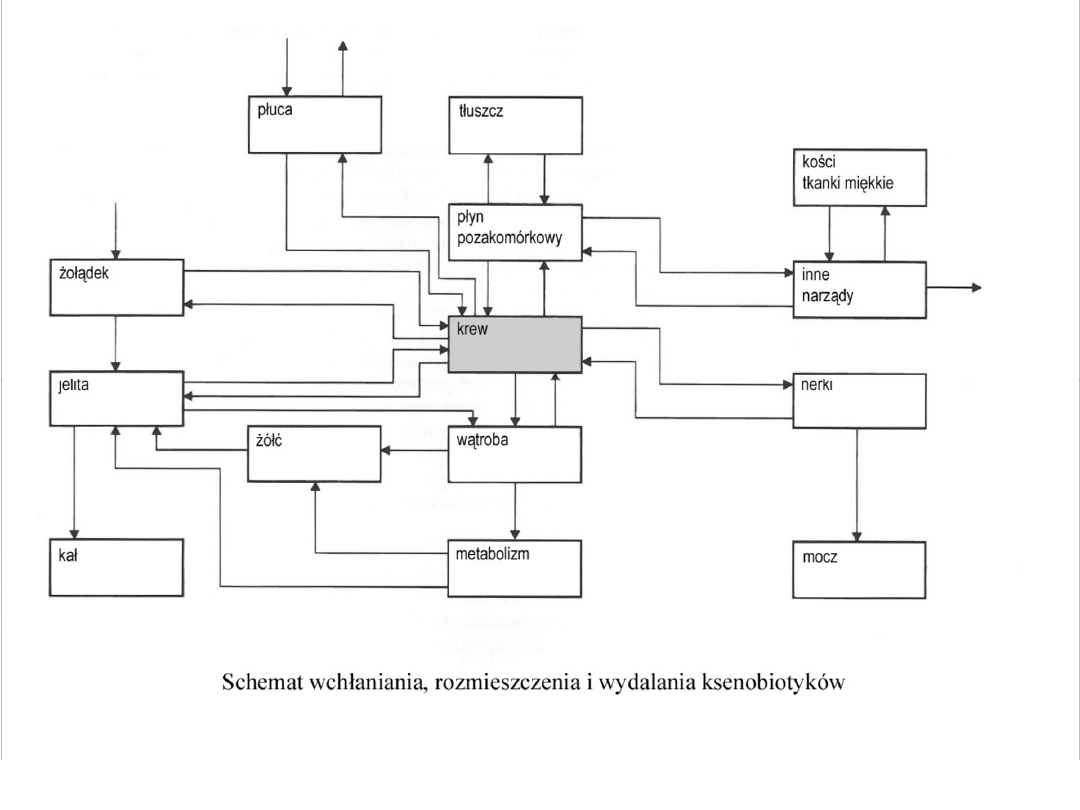
• wchłanianie (absorbcja)
• rozmieszczenie (dystrybucja)
• przemiany biochemiczne
( biotransformacja)
• wydalanie
Toksykokinetyka jest dziedziną nauki zajmującą się losami
ksenobiotyków w organizmie


Drogi wchłaniania trucizn
Drogi wchłaniania trucizn
Trucizna = Toksyna = Ksenobiotyk
Egzogenne substancje toksyczne
wchłaniane są do organizmu trzema
głównymi drogami:
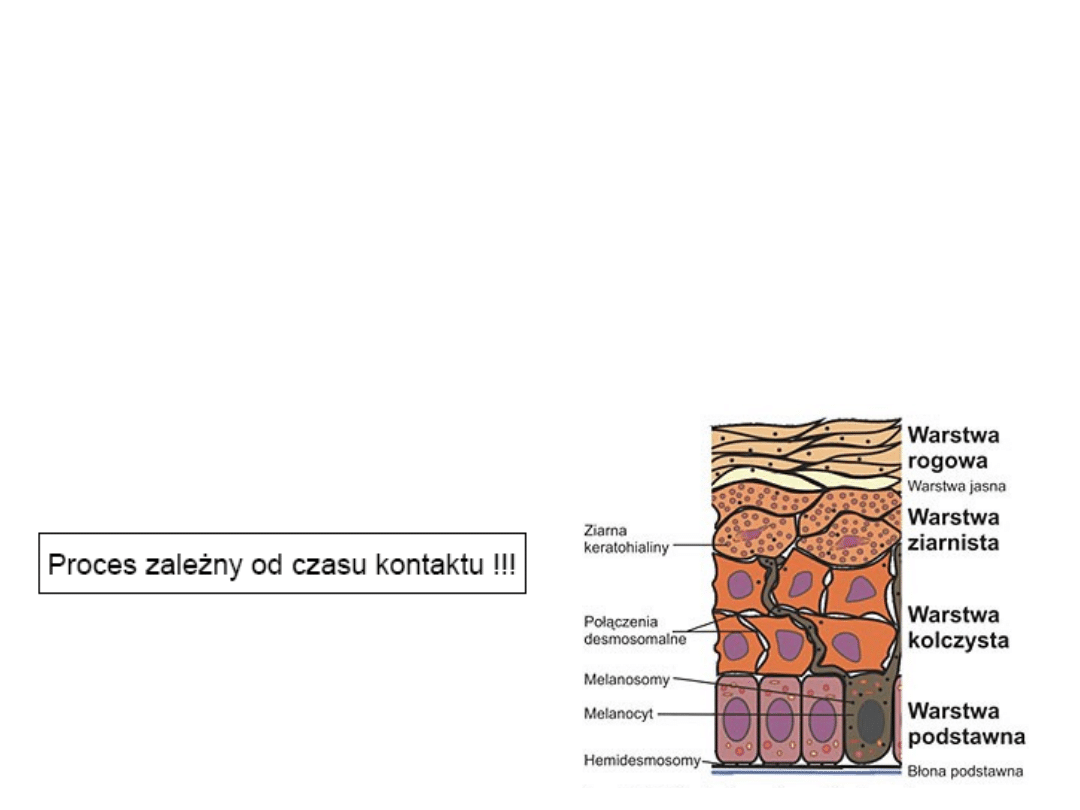
• Przenikanie przez skórę
• Układ oddechowy
• Układ pokarmowy

Substancje chemiczne do tkanek i narządów dostają się po
przeniknięciu przez błony biologiczne na zasadzie transportu:
- biernego
- nośnikowego
- aktywnego
Zostają wówczas pokonane bariery nabłonkowe
poszczególnych układów oraz błony białkowo-lipidowe
oddzielające różne tkanki od płynów ustrojowych.
Związki silnie polarne np. kwasy sulfonowe lub aminy
czwartorzędowe, czy też substancje bardzo lotne np. eter
etylowy
NIE ULEGAJĄ PRZEMIANOM METABOLICZNYM
w
ustroju człowieka. Wydalane są w swej pierwotnej formie.
Substancje:
• polarne - przez włókna białkowe
• niepolarne - przez obszary lipidowe
• lipofilowe łatwo przenikają przez skórę
Drogi wchłaniania trucizn przez organizm
Przenikanie przez skórę
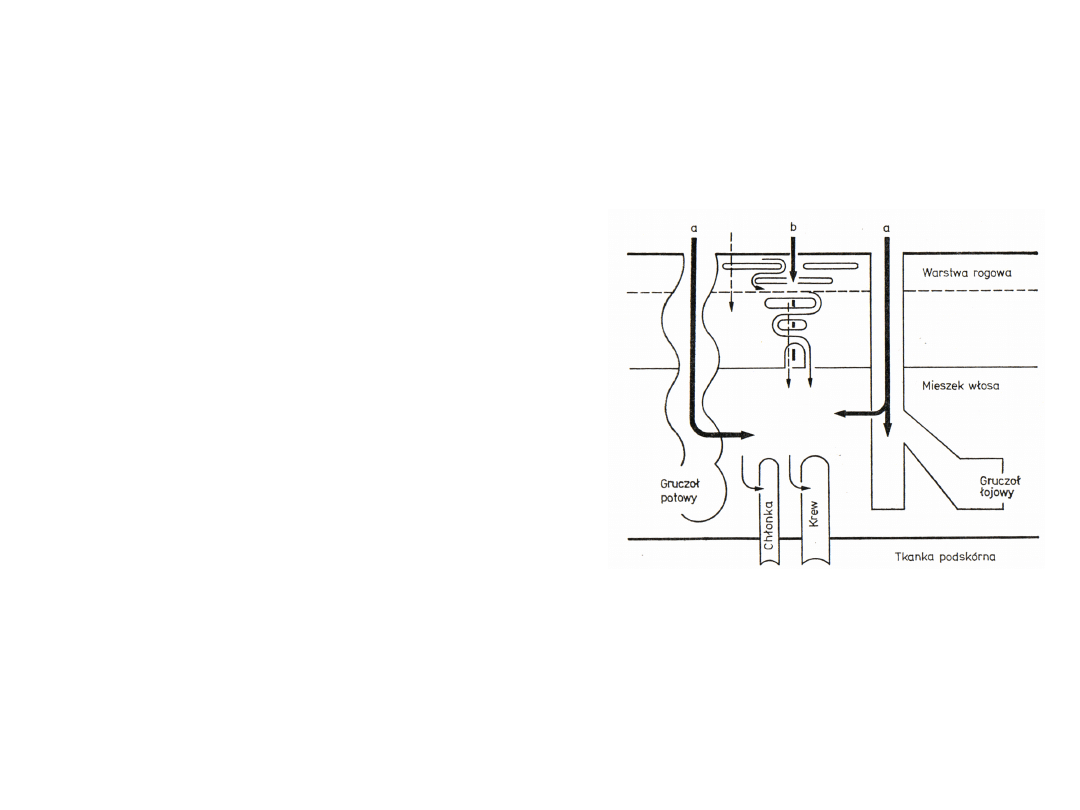
Drogi wchłaniania trucizn przez organizm
Przenikanie przez skórę
Wnikanie substancji poprzez:
szczeliny przy torebkach
włosowych
kanaliki potowe
Dyfuzja przez naskórek - pasywne
wnikanie ksenobiotyków przez
szereg warstw komórek.
Substancje polarne wnikają do
wnętrza komórki przez włókna
białkowe
Substancje niepolarne wnikają przez
matryce lipidowe
Uwodnienie naskórka poprawia
przenikanie substancji polarnych
Substancje lipofilowe łatwo
przenikające przez warstwę
zewnętrzną naskórka
5
a – transport transfolikularny
b – transport transepidermalny
sk
ó
ra
w
ła
śc
iw
a
n
a
sk
ó
re
k

Oddychanie – czynność automatyczna
• Czynniki warunkujące wchłanianie
gazów
– Rozpuszczalność w wodzie
– Reaktywność chemiczna
(stężenie gazu
reaktywnego w przestrzeni dróg oddechowych gwałtownie
spada w miarę przechodzenia przez warstwę śluzu i
komórek nabłonkowych, gdzie jest wiązany, w konsekwencji
niewiele dostaje się go do krwi)
– Areozole
(wielkość ziaren od 1-5 μm zatrzymują się
głównie w górnych drogach oddechowych)
Drogi wchłaniania trucizn przez
Drogi wchłaniania trucizn przez
organizm
organizm
Przenikanie przez układ oddechowy
Przenikanie przez układ oddechowy

Drogi wchłaniania trucizn przez
Drogi wchłaniania trucizn przez
organizm
organizm
Przenikanie przez układ oddechowy
Przenikanie przez układ oddechowy
Naczynia krwionośne są w bezpośrednim kontakcie
z komórkami nabłonka oddechowego
wyściełającego pęcherzyki płucne.
Może zachodzić swobodna dyfuzja gazów oraz
substancji w nich rozpuszczonych
Wdychane ksenobiotyki mogą powodować:
niszczenie tkanki układu oddechowego
zatrucie całego organizmu w wyniku wniknięcia do
układu krwionośnego.
ilość trucizny wprowadzonej do płuc (gaz, aerozol,
małe cząsteczki) zależy od stężenia substancji
toksycznej w powietrzu oraz tzw. minutowej
objętości oddychania (minutowa objętość oddychania
jest iloczynem objętości wdechu – około 500 ml oraz
liczby oddechów na minutę – ok.15).
6

Wchłanianie drogą pokarmową
Wchłanianie drogą pokarmową
• Jama ustna – ominięcie krążenia
wątrobowego powoduje długie pozostawanie
w tkankach w biologicznie czynnej postaci
• Żołądek – możliwa zmiana toksyczności
dzięki enzymom trawiennym, kwasowi
żołądkowemu
• Jelita – wielkość powierzchni wchłaniania
(200-300 m
2
), ksenobiotyki wchłonięte w
jelitach przed dotarciem do krwioobiegu
trafiają do wątroby, gdzie zachodzą procesy
biotransformacji

Drogi wchłaniania trucizn przez
Drogi wchłaniania trucizn przez
organizm
organizm
Przenikanie przez układ pokarmowy
Przenikanie przez układ pokarmowy
Absorpcja związków chemicznych wprowadzonych doustnie zachodzi na
całej długości przewodu pokarmowego.
Zawarte w układzie pokarmowym substancje mogą zmieniać toksyczność
związku.
Istnieją ilościowe różnice w toksyczności związku w zależności od tego, czy
został podany z pokarmem, czy został wprowadzony do pustego żołądka.
Część ksenobiotyków wchłania się, na drodze podobnej jak substancje
pokarmowe, w jelicie cienkim.
Rozpuszczalne kwasy i zasady organiczne są absorbowane w formie
niezjonizowanej na drodze dyfuzji pasywnej.
Cząsteczki większe, o średnicy kilku nanometrów mogą być absorbowane z
układu żołądkowo-jelitowego w procesie pinocytozy

Dystrybucja ksenobiotyków
Dystrybucja ksenobiotyków
• Obcy związek przenika od miejsca
wchłaniania do tkanki, skąd na drodze
dyfuzji dostaje się do krwi
• We krwi ksenobiotyk wiązany jest przez
krwinki lub białka osocza i dalej jest
transportowany do tkanek, w których ulega
przemianie, wywierając toksyczne
działanie
• Metabolity substancji mogą wrócić do krwi
i zostać wydalone

Większość ksenobiotyków ulega
BIOTRANSFORMACJI
Wydalane są z ustroju w postaci metabolitów.
1. Metabolity są mniej toksyczne w stosunku do
substratu,
lub wręcz stają się nietoksyczne –
DETOKSYKACJA
2. Metabolity te mogą stawać się bardziej
toksyczne niż
dostarczony do organizmu substrat.
W związku z tym na określenie przemian
wewnątrzustrojowych ksenobiotyków używany jest
termin “biotransformacja”.

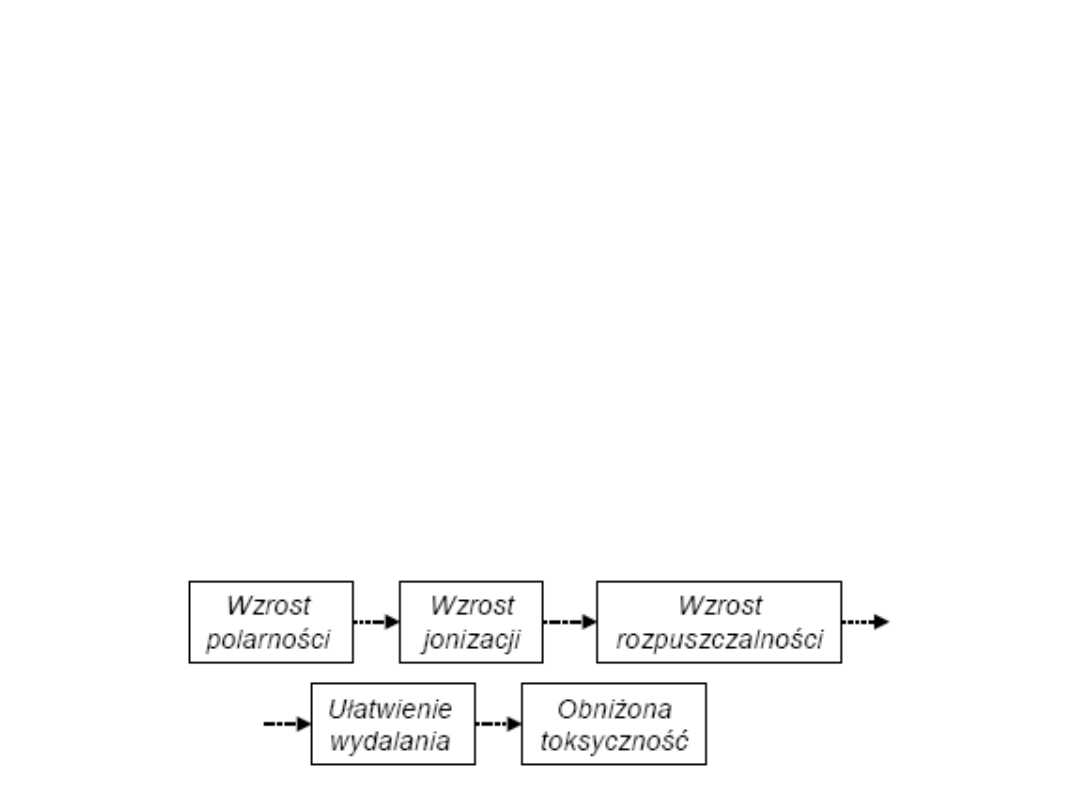
Celem biotransformacji ksenobiotyków jest
zwiększenie ich rozpuszczalności w wodzie
(czyli zwiększenie ich polarności) dzięki czemu
ułatwione jest ich wydalanie z ustroju.
Bardzo silnie hydrofobowe ksenobiotyki mogłyby
przebywać
w tkance tłuszczowej niezmiernie długo.
* Monitoring biologiczny - systematyczny pomiar stężeń
substancji toksycznych lub ich metabolitów w tkankach,
wydzielinach lub wydalinach, oddzielnie lub łącznie, mający na
celu ocenę wielkości narażenia oraz ryzyka dla zdrowia, przy
przyjęciu za podstawę oceny odpowiednich danych
interpretacyjnych.
Metabolizm ksenobiotyków
Metabolizm ksenobiotyków
• rozpuszczalne w wodzie (hydrofilowe)
są wydalane w pierwotnej postaci (bez
metabolizmu)
• lipofilowe są usuwane pod wpływem
soków trawiennych lub mogą ulec
metabolizmowi (wg schematu)
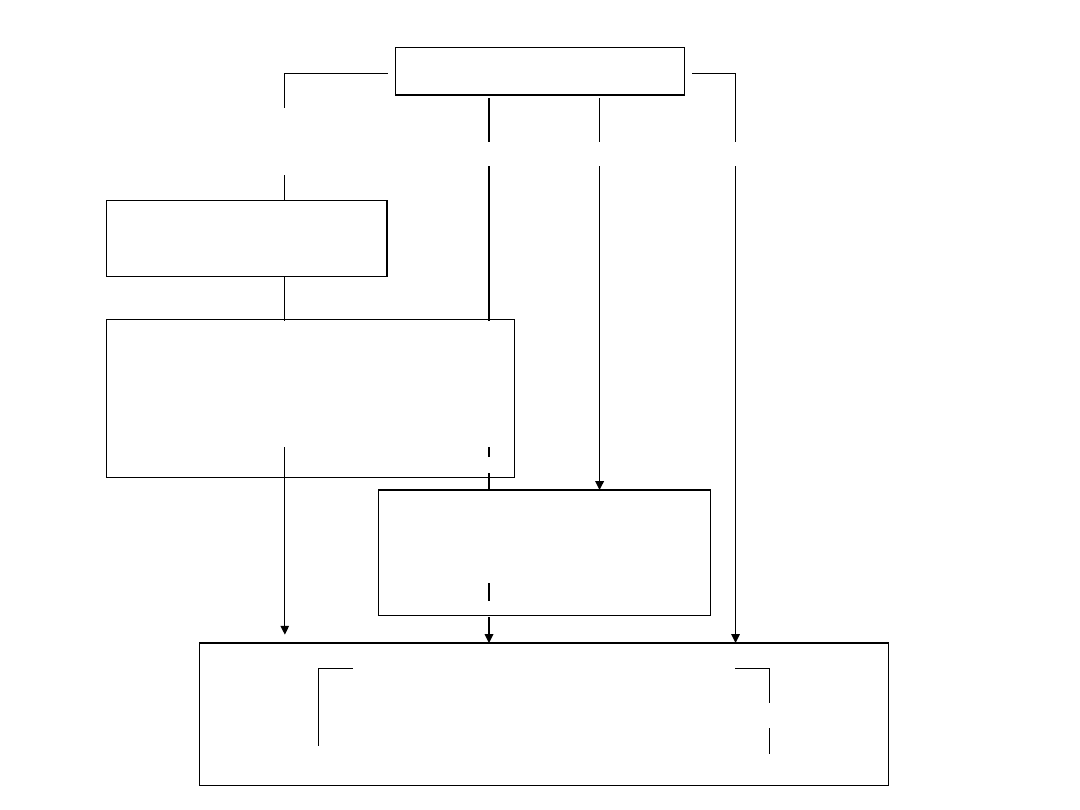
KSENOBIOTYK
KSENOBIOTYK
akumulacja w
tkance tłuszczowej
Faza I
Faza I
bioaktywacja lub
inaktywacja utlenianie,
redukcja hydroliza
Faza II
Faza II
inaktywacja,
sprzęganie
Przemieszczanie poza komórką
wydalanie z żółcią
wydalanie z moczem
silnie lipofilny, trudno
ulegający przemianom
lipofilny polarny hydrofilny
polarny
hydrofilny
osocze

Metabolizm lipofilowych ksenobiotyków
można podzielić na dwie fazy:
• w I fazie do ksenobiotyku
wprowadzana jest polarna, reaktywna
grupa funkcyjna
• w II fazie (reakcja koniugacji) do
reaktywnej grupy funkcyjnej przyłącza
się endogenny substrat, rozpuszczalny
w wodzie
Metabolizm ksenobiotyków
Metabolizm ksenobiotyków

Reakcje metabolizmu I fazy :
1. Utleniania
a) epoksydacja
b) hydroksylacja
c) deaminacja
d) desulfuracja
2.Redukcji
a) aldehydy i ketony
b) aromatyczne zw. nitrowe
c) związki siarki
3. Degradacji
a) hydroliza
b) dealkilacja
c) degradacja pierścienia
FAZA PIERWSZA
FAZA PIERWSZA

Sumaryczne procesy reakcji
fazy I

FAZA PIERWSZA
FAZA PIERWSZA
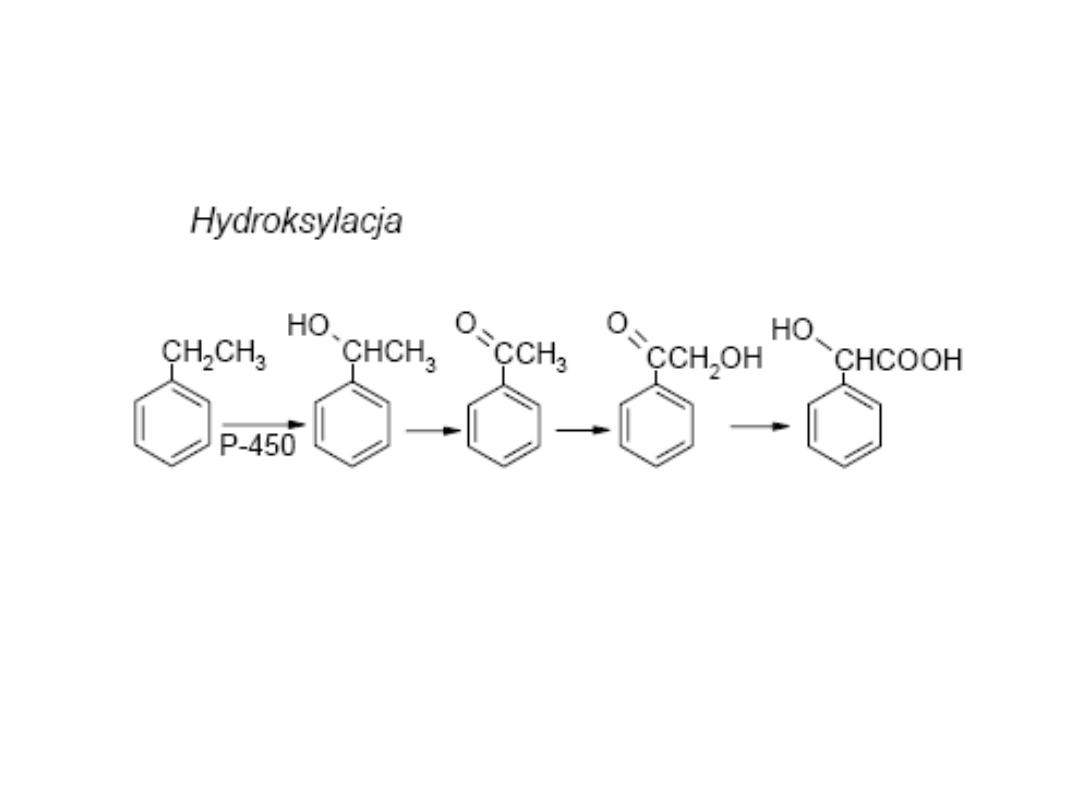
1. hydroksylacja - podstawienie grupy hydroksylowej do
łańcuchów bocznych węglowodorów aromatycznych i
barbituranów
2. epoksydacja - przyłączenie do podwójnego wiązania atomu
tlenu z utworzeniem pierścienia trójczłonowego:
(wielopierścieniowe węglowodory aromatyczne) metabolity
epoksydowe mogą wykazywać działanie mutagenne i
rakotwórcze
3. oksydatywna dezaminacja - utlenienie amin endogennych
(aminy katecholowe, poliaminy, histamina) -> do ketonów pod
wpływem oksydazy aminowej w obecności NADPH i tlenu
cząsteczkowego
4. desulfurylacja - podstawienie tlenu w miejsce siarki
(insektycydy fosfororganiczne, tiobarbiturany) -> ulegają
biotransformacji do metabolitów z reguły bardziej toksycznych
5. redukcja związków nitrowych - odpowiednie reduktazy w
warunkach beztlenowych przekształcają aromatyczne związki
nitrowe i azozwiązki (nitrobenzen, chloramfenikol) do amin
pierwszorzędowych.
Metabolizm ksenobiotyków
Metabolizm ksenobiotyków
Hydroksylacja jest główną reakcja zachodzącą w fazie I. Jest
ona katalizowana przez enzymy zwane monooksygenazami
lub enzymami grupy cytochromu P-450
RH + O
2
+ NADPH + H
+
→ R-OH + H
2
O + NADP

• W fazie II związki hydroksylowane lub
zmienione w inny sposób w fazie pierwszej
ulegają przekształceniom przez swoiste
enzymy do różnych metabolitów polarnych
przez sprzęganie z:
– kwasem glukuronowym
– kwasem siarkowym
– kwasem octowym
– z pewnymi aminokwasami
– przez metylację
FAZA DRUGA
FAZA DRUGA
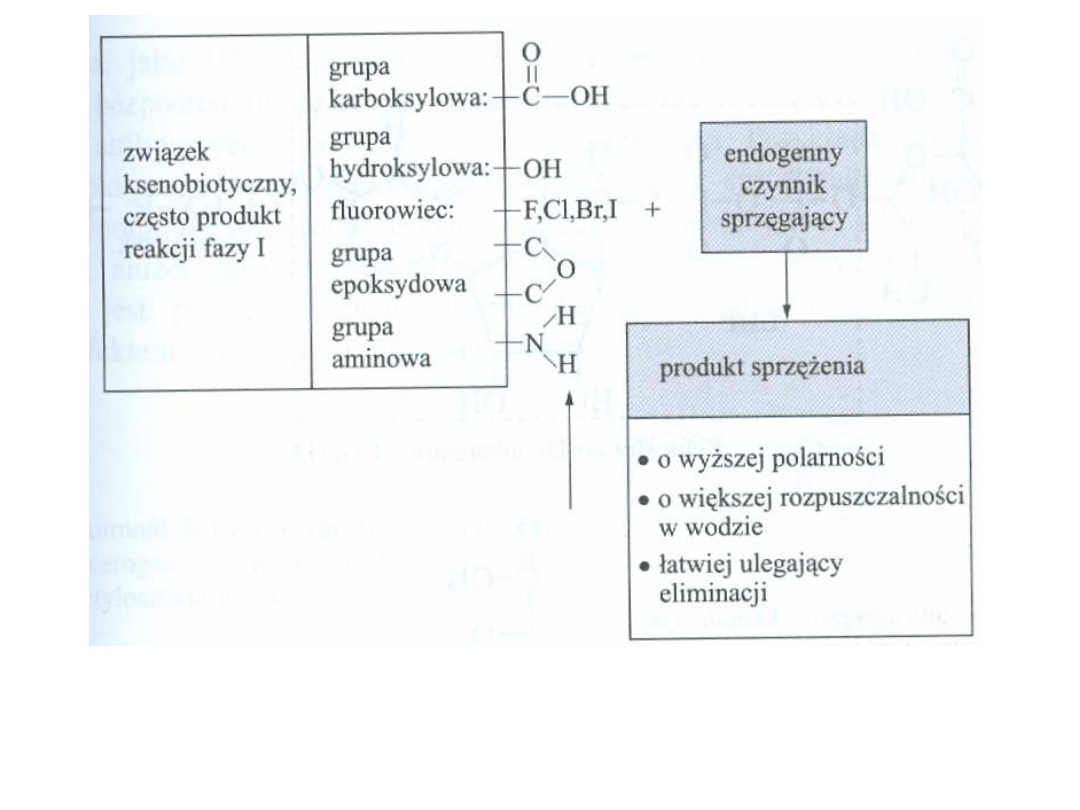
Sumaryczny proces sprzęgania, di jakiego dochodzi w
reakcjach fazy II

FAZA DRUGA
Glukuronidacja – reszta glukuronidowa z kwasu UDP-glukuronowego przy udziale
enzymów -transferaz glukuronylowych - ulega związaniu przez tlen, azot lub grupę
siarkową z substancjami, które posiadają grupy wodorotlenowe, karboksylowe,
aminowe i sulfhydrolowe.
Wiele związków np. fenole, sterole, alanina, kwas benzoesowy wydalane są pod
postacią glukuronidów.
Sprzęganie z siarką i siarczanami (sulfatacja)
- fenole, alkohole pierwszo-i drugorzędowe, aminozwiązki alifatyczne i aromatyczne
po reakcji sprzęgania z siarczanem przechodzą w estry siarkowe, cyjanowodór i
cyjanki przechodzą w rodanki (izotiocyjaniany), niektóre metale przechodzą w
siarczki.
Sprzęganie z glutationem
Sprzęganie substratu z aktywną grupą glutationu (reszta sulfhydrylowa SH cysteiny).
Koniugaty glutationowe ulegają dalszym przemianom: odszczepienie grupy
glutamylowej i glicynowej, przyłączenie grupy aminowej.
Metylowanie i acetylowanie - reakcje te mają dużą rolę w przemianach endogennych
np. adrenalina jest metylowana do noradrenaliny, natomiast w metabolizowaniu
obcych związków organicznych zachodzą rzadziej.

Reakcje II fazy
Reakcje II fazy
(reakcje sprzęgania)
Sprzężenie elektrofilowe:
R-X: +
+
Y:Z
-
R-X-Y + :Z
Ksenobiotyk elektrofilowy
nukleofilowy czynnik sprz.
X = atom O, N lub S
• Czynnik elektrofilowy - atom lub grupa atomów
„lubiąca” elektrony.
• Czynnik nukleofilowy - atom lub grupa atomów
„lubiąca” jądra atomowe

Rodzaje reakcji II fazy
Rodzaje reakcji II fazy
• Glukuronidacja
Donorem reszty glukuronylowej jest kwas
UDP-glukuronowy, a enzymami –
transferazy glukuronylowe występujące w
siateczce śródplazmatycznej i cytoplazmie
Glukuronidacja jest najczęściej spotykana
reakcją sprzęgania
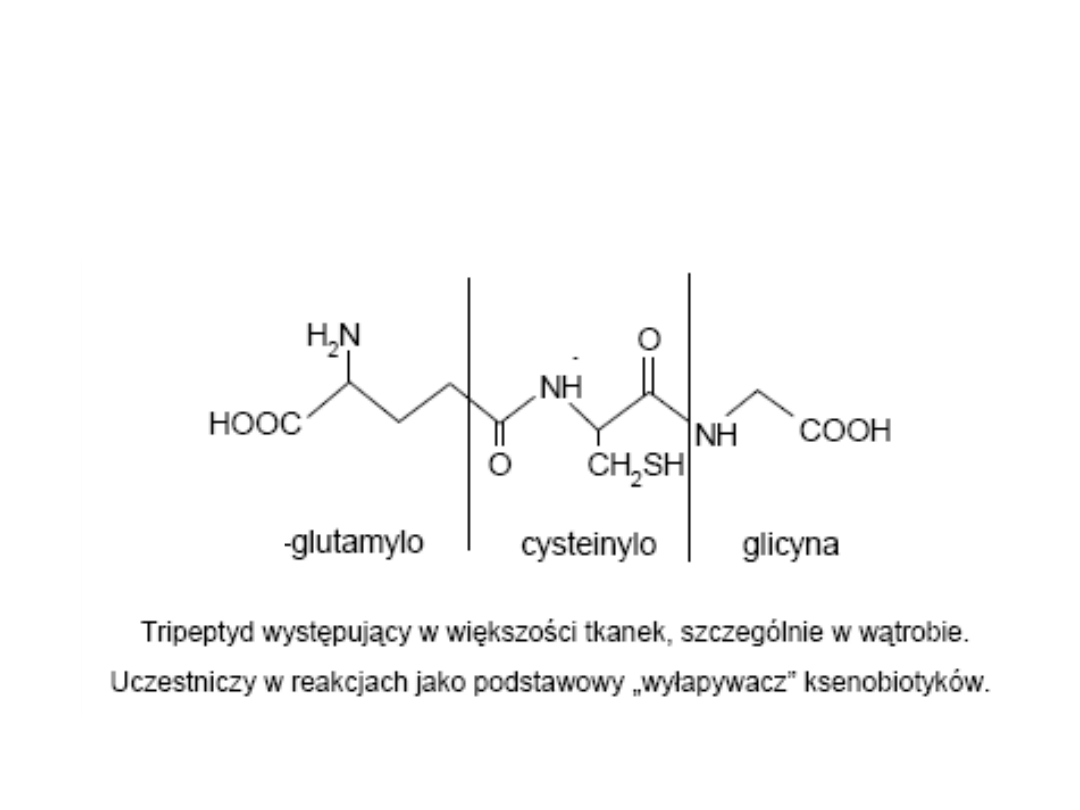
Sprzęganie z glutationem
Rodzaje reakcji II fazy
Rodzaje reakcji II fazy
γ
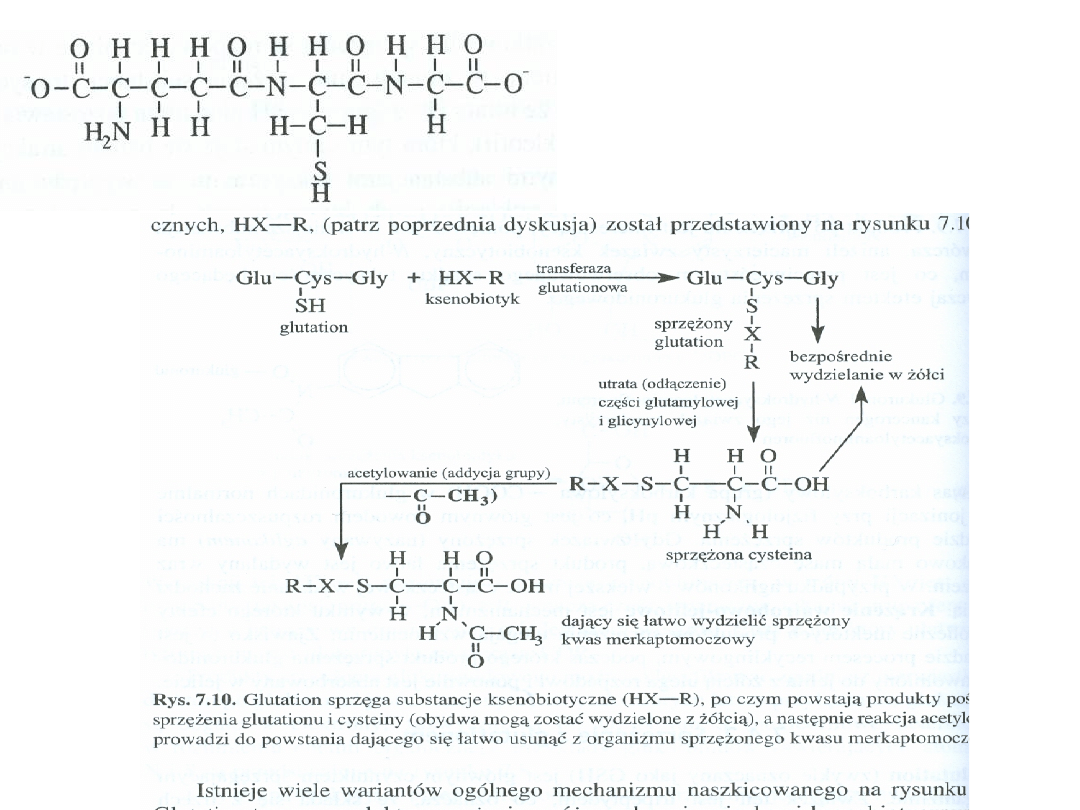
Sprzężenie z
glutationem

• Sprzęganie z siarczanem (sulfatacja)
-
niektóre alkohole, aminy aromatyczne i fenole.
Donorem reszty siarczanowej jest
3’-fosfoadenozyno-5’fosfosiarczan
(PAPS)
• Acetylacja
donorem aktywnego octanu jest acetylo-CoA.
Reakcje te są katalizowane przez
acetylotransferazy występujące w cytoplazmie
różnych tkanek, szczególnie wątroby.
• Metylacja
Rodzaje reakcji II fazy
Rodzaje reakcji II fazy
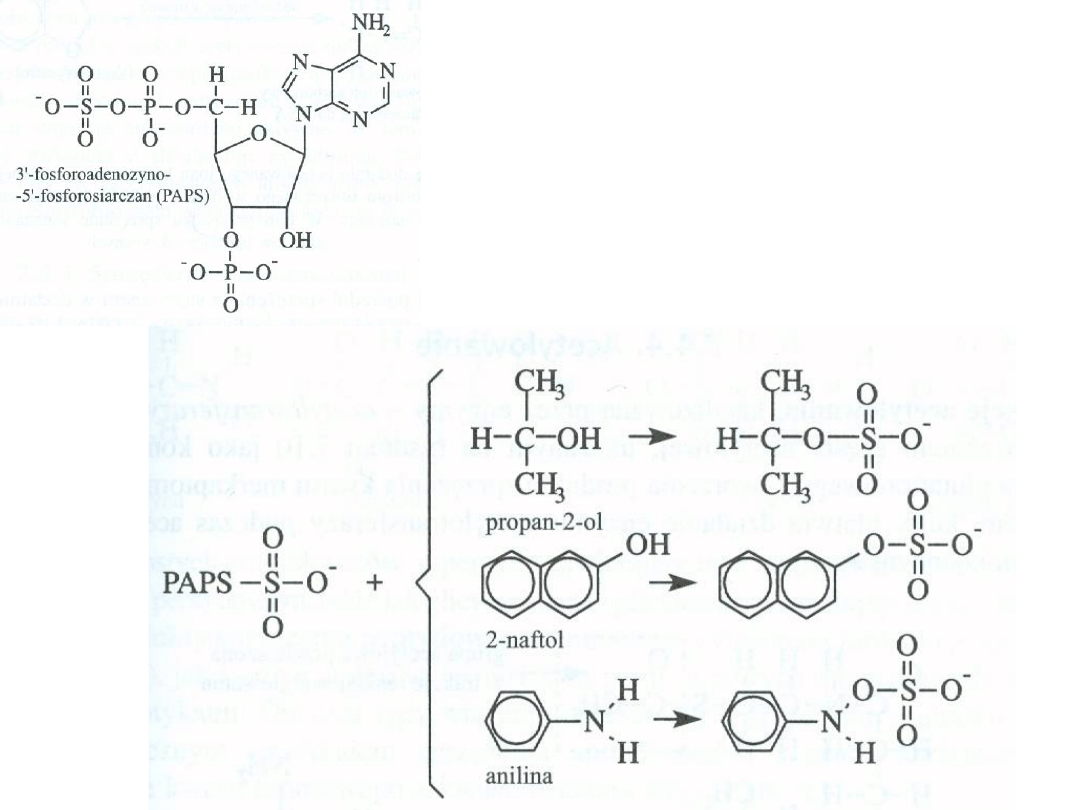
Sprzęganie z siarczanem alkoholi,
fenoli i amin aromatycznych

• Głównym celem obu faz przemiany
ksenobiotyków jest zwiększenie ich
zwiększenie ich
rozpuszczalności w wodzie
rozpuszczalności w wodzie
(zwiększenie polarności) dzięki czemu
ułatwione jest ich wydalanie z ustroju
• Silnie hydrofobowe ksenobiotyki
mogłyby przebywać w tkance
tłuszczowej nieograniczenie długo

Cytochrom P-450 uważany jest za najbardziej
wszechstronny ze znanych biokatalizatorów
Cytochrom P450
Cytochrom P450
to rodzina enzymów wykazujących aktywność
monooksygenazy
Występują powszechnie w niemal wszystkich
tkankach, największą aktywność wykazując jednak w
wątrobie i rdzeniu nadnerczy. Nie stwierdzono ich
obecności w dojrzałych erytrocytach i mięśniach
szkieletowych.
Cytochrom P-450 są to transbłonowe białka o masie
cząsteczkowej 50-55 kDa. Zawierają hem jako grupę
prostetyczną.

…
…
i jeszcze o cytochromie
i jeszcze o cytochromie
• CYP450 jest związany z błoną retikulum
endoplazmatycznego oraz wewnętrzną błoną
mitiochondrium, co stawia substratom
warunek lipofilności
• Produkty są hydrofilne, co ułatwia ich
usuwanie z organizmu
• Bierze udział w metabolizmie kwasów
tłuszczowych i ksensobiotyków oraz syntezie
cholesterolu
• Silnie dezaktywowany przez cyjanki oraz CO
• Bierze udział w metabolizmie amfetaminy
(oksydacyjna deaminacja) oraz detoksykacji
alkoholowej (obok dehydrogenazy alkoholowej)

Centrum aktywne cytochromu P-450 stanowi grupa
hemowa, w której Fe
3+
jest związane czterema
wiązaniami kowalencyjnymi z pierścieniami
pirolowymi porfiryny. Po przyłączeniu elektronu atom
Fe ulega przemianie z formy żelazowej (Fe III) do
formy żelazawej (Fe II).

• Oksydaza cytochromowa odbiera elektrony od
cytochromu c (utlenia go) i przekazuje te
elektrony na jeden atom tlenu w cząsteczce
O
2
. Do tlenu cząsteczkowego dołączane są
dwa elektrony z cytochromu c i dwa protony
ze środowiska wodnego, redukując go do H
2
O.
• Drugi atom tlenu jest włączany w substrat
Cytochrom P450 jest końcowym
Cytochrom P450 jest końcowym
elementem łańcucha przekazu
elementem łańcucha przekazu
elektronów, pełni rolę końcowej
elektronów, pełni rolę końcowej
oksydazy tego łańcucha
oksydazy tego łańcucha

Metabolizm ksenobiotyków
Metabolizm ksenobiotyków
Podstawowe reakcje katalizowane
przez enzymy współdziałające z
cytochromem P-450 wiążą się z
wprowadzaniem tlenu do cząsteczki
(katalizuje reakcję hydroksylacji)
RH
+ O
2
+ NADPH + H
+
ROH
+ H
2
O +
NADP
+
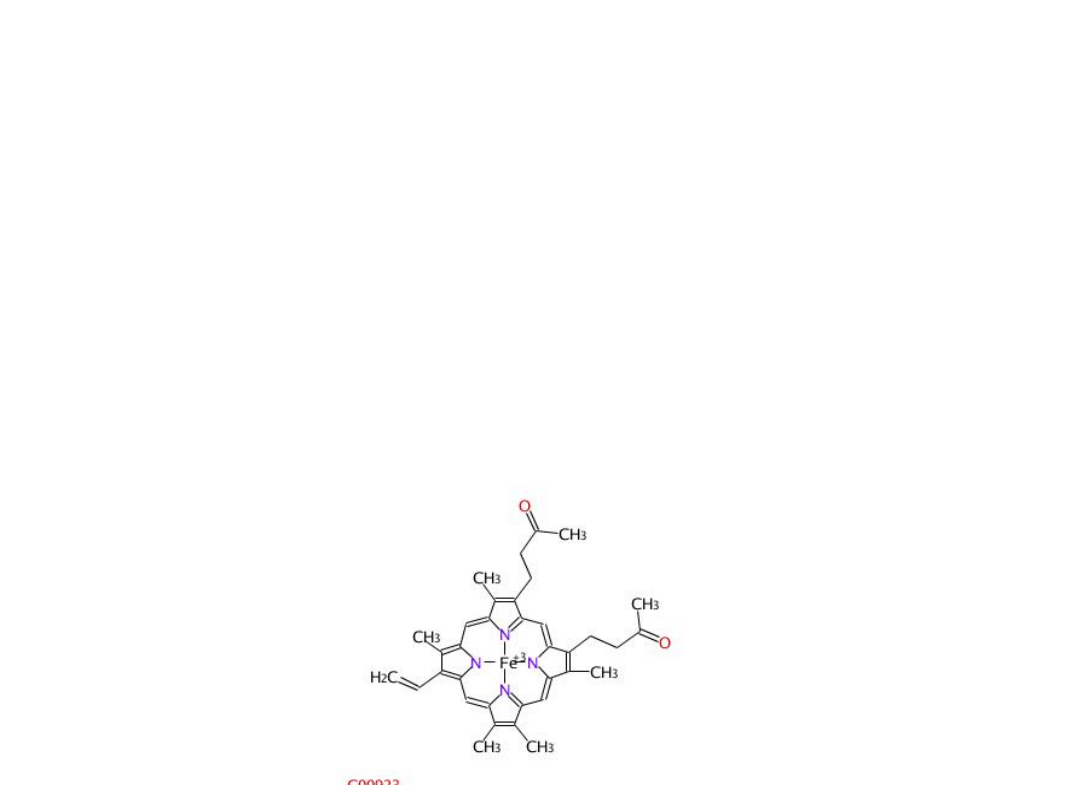
Po związaniu substratu z grupą hemową, przyjmuje ona elektron
z NADPH, czemu towarzyszy redukcja Fe
3+
do Fe
2+
, co umożliwia
związanie cząsteczki O
2
. Następuje przyjęcie drugiego elektronu
i przegrupowanie ładunku, wskutek czego żelazo zyskuje
stopień utlenienia +3, a tlen -2. Następnie jeden atom z
cząsteczki tlenu ulega redukcji do H
2
O, a drugi atom – rodnik O
-
, przypuszcza atak na cząsteczkę substratu dla utworzenia np.
grupy hydroksylowej.
Końcowym etapem cyklu przemian jest odłączenie cząsteczki
produktu i odtworzenie cząsteczki cytochromu.
Przebieg reakcji z udziałem cytochromu P-
450

RH + O
2
R-OH + H
2
O
Postać
zredukowana
cytochromu P-450
Postać utleniona
cytochromu P-450
Schemat reakcji katalizowanej przez
Schemat reakcji katalizowanej przez
cytochrom P-450
cytochrom P-450
Mechanizm działania cytochromu P-450 polega na tym,
że współpracując z NADPH i tlenem, wprowadza jeden
atom tlenu do substratu.
Cytochromu P-450 jest częścią kompleksu enzymatycznego, w
skład którego wchodzi także reduktaza NADPH-cytochrom P-450.
Reduktaza NADPH-cytochromu P-450 jest flawoproteiną
zawierającą cząsteczkę FMN i FAD. Zadaniem tego enzymu jest
przenoszenie elektronów z NADPH na cytochrom P-450.
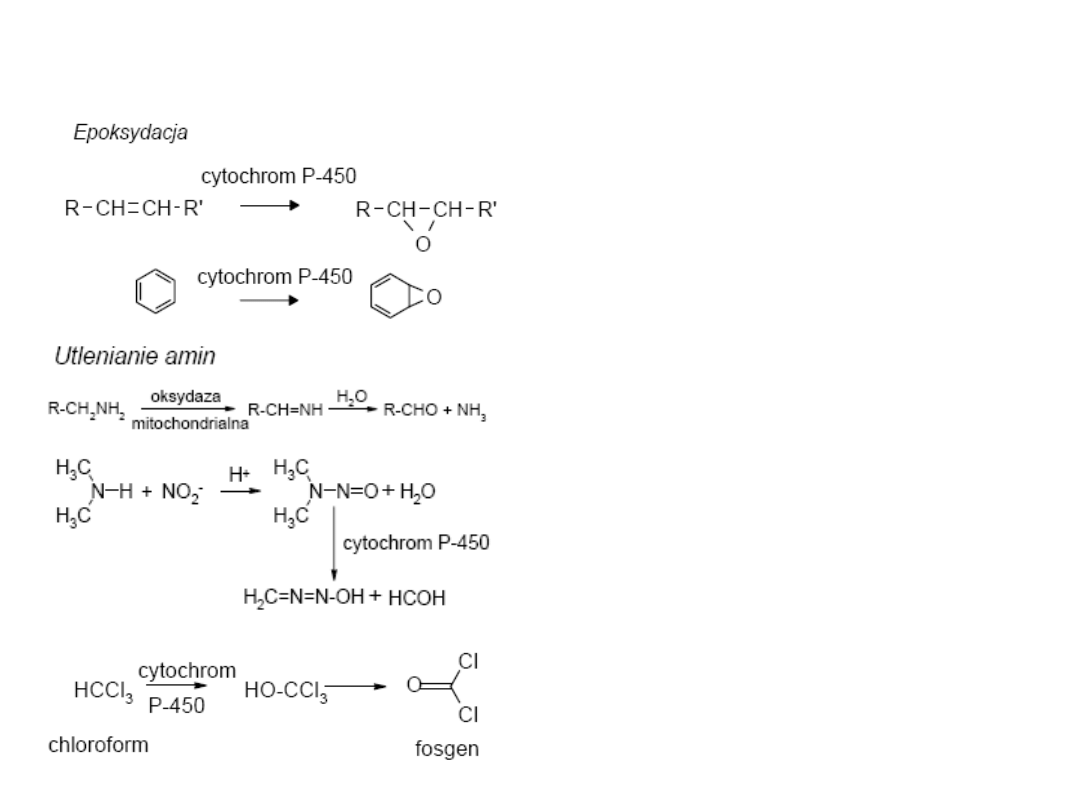
Metabolizm ksenobiotyków
W zależności od rodzaju
substratu oraz pozycji w
cząsteczce, do której zostaje
dołączony atom tlenu
cytochrom P-450 może
katalizować różne reakcje.
Oprócz reakcji hydroksylacji
katalizuje również
epoksydację, dealkilację,
oksydacyjną deaminację
(np. w metabolizmie
amfetaminy), N- oraz S-
oksydację,
desulfurację,
denitryfikację
i
dehalogenację.
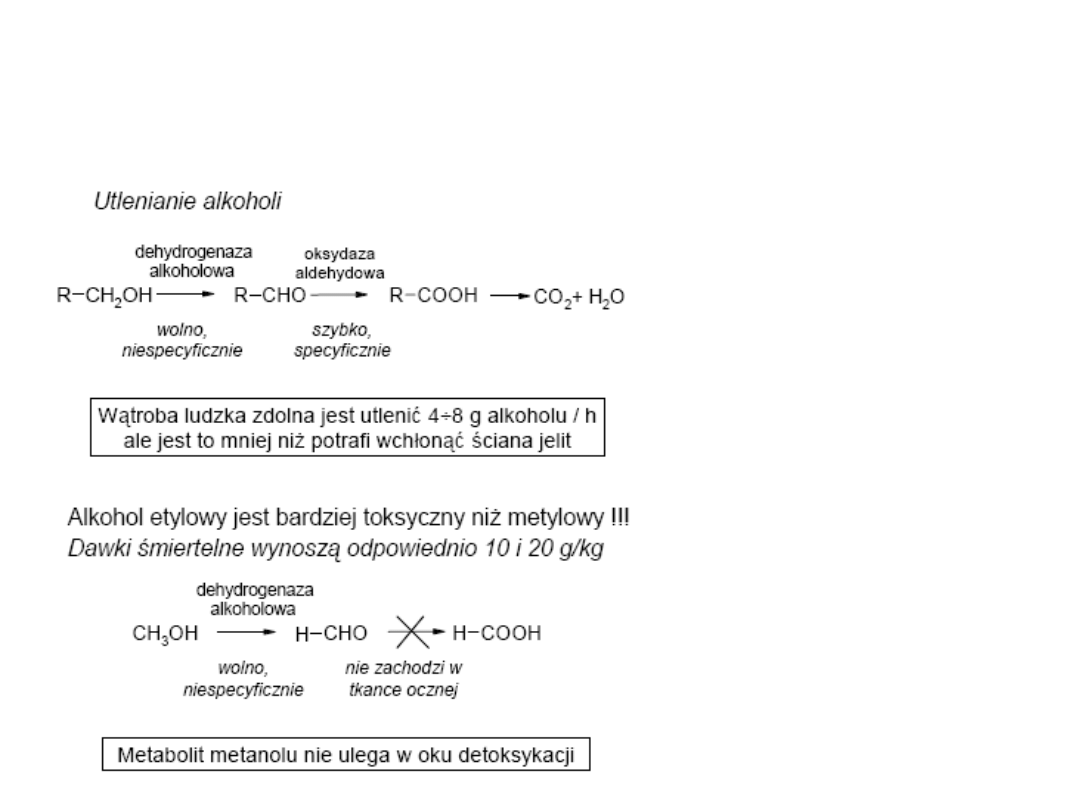
Metabolizm ksenobiotyków
Bierze również udział
(obok dehydrogenazy
alkoholowej) w
detoksykacji
alkoholowej.
Wszystkie te reakcje
wymagają obecności
tlenu i NADPH.

Metabolizm ksenobiotyków
Procesy I fazy uwalniają bardzo reaktywne związki:
• wolne rodniki
• substancje silnie elektrofilowe
• naprężone pierścienie trójczłonowe
Powodują w żywym organizmie:
• zmiany w strukturze DNA → błędne replikacje i
transkrypcje
• zmiany w strukturze RNA → synteza niepożądanych
białek → zmiana aktywności enzymatycznej

Cytochrom P-450 jest mieszaniną co najmniej 10
izoenzymów
Izoenzymy są enzymami o różnym składzie
chemicznym
ale spełniającymi te same funkcje katalityczne
(z różną reaktywnością do substratu)
Indukcja enzymatyczna -
ksenobiotyk wzmaga biosyntezę
enzymu
Inhibicja enzymatyczna -
ksenobiotyk osłabia biosyntezę
enzymu
Indukcja i inhibicja
Indukcja i inhibicja
cytochromu P-450
cytochromu P-450

Inne izoenzymy…
• CYP
2C19
(m.in. aktywacja proguanilu do cykloguanilu)
• CYP
2E1
katalizuje utlenianie wielu prokancerogenów –
chlorku winylu, benzenu, CCl
4
, chloroformu
Indukowany przez alkohol, aceton, długotrwały post
• CYP
1A1
hydrolizuje wiele węglowodorów aromatycznych
do kancerogennych półproduktów
• CYP
1A2
metabolizm m.in.
kofeiny, aflatoksyny B
1
CYP1A kontrolowane przez
AhR
(
polimorficzny receptor
węglowodorów aromatycznych
) o zróżnicowanym
powinowactwie do induktora
AhR czynnikiem transkrypcyjnym (ligandem dioksyna,
WWA, halogenowe WA)
ok. 10% rasy kaukaskiej ma
AhR o wysokim powinowactwie

Etanol
Etanol
nie jest mutagenem ani karcynogenem,
ale w pewnych warunkach może wykazywać
działanie komutagenne i kokarcynogenne.
Spożywany w ilościach ponad 80 g dziennie
zwiększa ryzyko zachorowania na raka
przełyku 18-krotnie, palenie papierosów 5-
krotnie a oba czynniki łącznie 44-krotnie
Toksyczne działanie etanolu jest spowodowane
aktywnością produktów powstających
podczas jego przemian w organizmie oraz
jego wpływem na szybkość metabolizmu
ksenobiotyków

• Utlenianie 1 g etanolu do CO
2
i H
2
O
dostarcza 30 kJ (7 kcal) energii czyli
spożycie 100-120g alkoholu może
zaspokoić połowę dobowego,
podstawowego zapotrzebowania na
energię
• Etanol utlenia się w wątrobie przy
współudziale cytosolu i mitochondriów
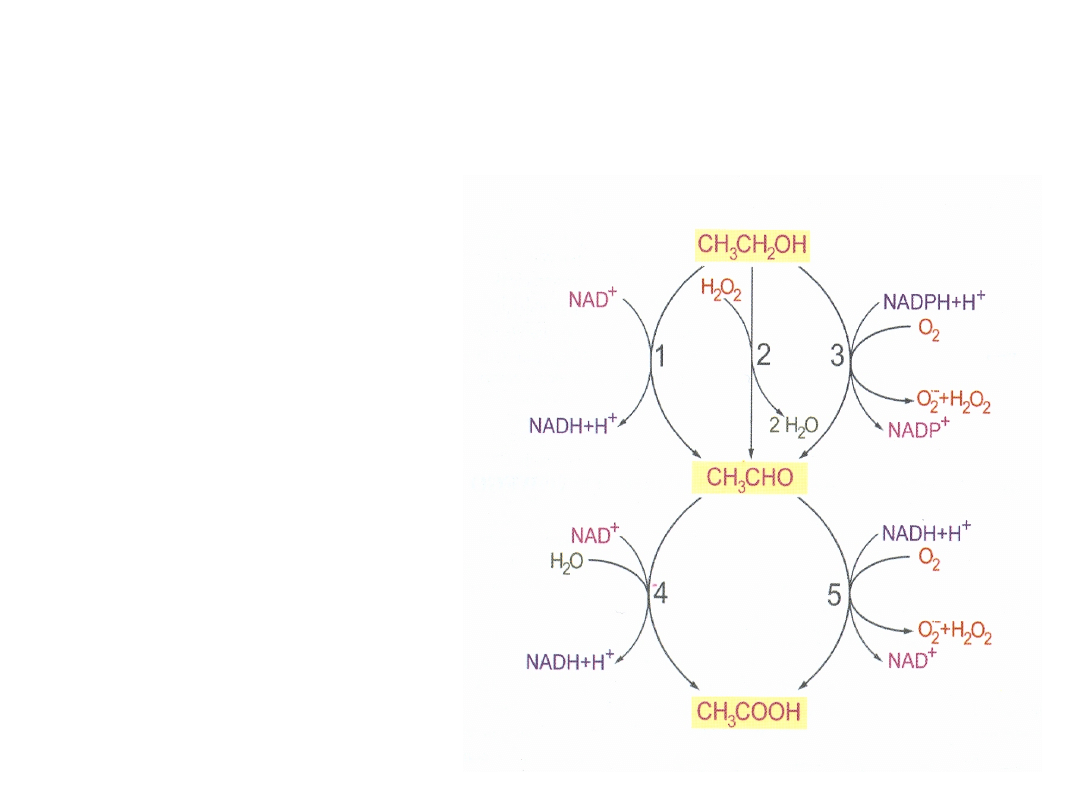
1. Dehydrogenaza
alkoholowa – największa
aktywność w wątrobie i
żołądku
2. Cytochromy – tworzenie
wolnych rodników
3. Katalaza utlenianie z
utworzeniem H
2
O
2
4. Dehydrogenaza
aldehydowa
5. Oksydazy, ksantynowa i
aldehydowa
Etanol jest metabolizowany do aldehydu octowego, który
ulega przemianie do kwasu octowego.
Etanol jest
przekształcany do aldehydu octowego przez trzy różne systemy
enzymatyczne.

• Powstały octan jest aktywowany przez
połączenie z CoA-SH powstaje acetylo~S-CoA
• Cykl Krebsa
– powstanie nadmiaru NADH
– niedobór GTP → ograniczone utlenianie octanu
Efekty
→ wzrost produkcji tłuszczów, zahamowanie
cyklu Krebsa, glikolizy i glukoneogenezy,
hipoglikemia
→ Octan przenika do krwi i jest transportowany
do różnych narządów, najintensywniej proces
utleniania przebiega w mięśniu sercowym

BIOMARKERY
Do oceny efektów działania substancji
chemicznych na organizm oraz określenia
interakcji między układem biologicznym a
zagrożeniem środowiskowym (chemicznym,
fizycznym i biologicznym) służą biomarkery.
Biomarker –wskaźnik procesów zachodzących w
organizmie, pozwalający na ocenę wielkości
narażenia na czynniki chemiczne i efektów
działania w postaci skutków zdrowotnych, jakie
te czynniki powoduję w eksponowanym
organizmie.

Najczęściej wyróżnia się trzy klasy biomarkerów:
biomarkery ekspozycji:
egzogenne substancje lub ich metabolity, a także produkty
interakcji między czynnikiem chemicznym (ksenobiotykiem)
i docelowymi cząsteczkami lub komórkami; są one obecne i
mierzone w wewnętrznych przedziałach organizmu
biomarkery skutków (efektu) –
mierzalne biochemiczne, fizjologiczne, behawioralne i inne
zmiany zachodzące wewnątrz organizmu, które mogą być
rozpoznane jako łączące się z:
- już obecnymi,
-mogącymi się pojawić zaburzeniami zdrowia
biomarkery wrażliwości –
wskaźniki wrodzonej lub nabytej zdolności organizmu do
odpowiedzi wywołanej ekspozycją na specyficzny
ksenobiotyk
Część związków chemicznych o charakterze ksenobiotyków
po dostaniu się do organizmu może ulegać:
1. bioakumulacji.
2. biotransformacji.
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
- Slide 41
- Slide 42
- Slide 43
- Slide 44
- Slide 45
- Slide 46
- Slide 47
- Slide 48
- Slide 49
- Slide 50
- Slide 51
- Slide 52
Wyszukiwarka
Podobne podstrony:
Ćw metabolizm ksenobiotyków 2015 16 OAM
Metabolizm ksenobiotyków
Metabolizm ksenobiotyków
Ćw metabolizm ksenobiotyków 2015 16 OAM
Metabolizm kkw tł stud
Metabolizm
(2,3) Działania nieporządane, toksytczne leków Metabolizm, czynniki wpływające na działanie substanc
metabolizm witaminy D3
Zespół metaboliczny tarczyca wykład8
Metabolizm AA 2003 2
Komponenty metaboliczne
Metabolizm aminokwasów
Zespó Metaboliczny w profilaktyce lekarza medycyny pracy 1
Bilirubin metabolism Applied ph Nieznany (2)
więcej podobnych podstron