
WPROWADZENIE DO
TOKSYKOLOGII
KLINICZNEJ.
dr Tomasz Wielkoszyński
Katedra i Zakład Chemii,
Śląska Akademia Medyczna w
Zabrzu

KSENOBIOTYK
(substancja obca dla
organizmu)
każda substancja nie będąca naturalnym
składnikiem żywego organizmu, który
się z nią styka – substancja egzogenna
lub materiał antropogenny o strukturze
nie występującej w przyrodzie, do
którego organizm nie przystosował się
na drodze ewolucyjnej.
xenos
(greckie)
- obcy

Rodzaje dawek
progowa/graniczna
-
taka ilość substancji,
która wywołuje pierwsze widoczne efekty
biologiczne w ustroju i poniżej tej dawki nie
obserwuje się żadnego wpływu trucizny lub
leku na ustrój;
lecznicza
-stosowana w odniesieni do leków:
wykazuje działanie farmakoterapeutyczne;
nie powoduje zaburzeń normalnych
procesów fizjologicznych w poważniejszym
stopniu;
toksyczna/trująca
-
wywołuje
objawy zatrucia;
śmiertelna
-
wywołuje śmierć wskutek
uszkodzenia ważnych dla życia ośrodków

Rodzaje zatruć
Rodzaje zatruć
•
Zatrucie ostre
Zatrucie ostre
•
Zatrucie podostre
Zatrucie podostre
•
Zatrucie przewlekłe
Zatrucie przewlekłe
•
Zatrucie rozmyślne (samobójcze,
Zatrucie rozmyślne (samobójcze,
demonstracyjne, inpulsywne,
demonstracyjne, inpulsywne,
zbrodnicze, egzekucje)
zbrodnicze, egzekucje)
•
Zatrucie przypadkowe (omyłkowe,
Zatrucie przypadkowe (omyłkowe,
zawodowe, powikłania
zawodowe, powikłania
farmakoterapii, zależności lekowe,
farmakoterapii, zależności lekowe,
upojenie alkoholowe)
upojenie alkoholowe)
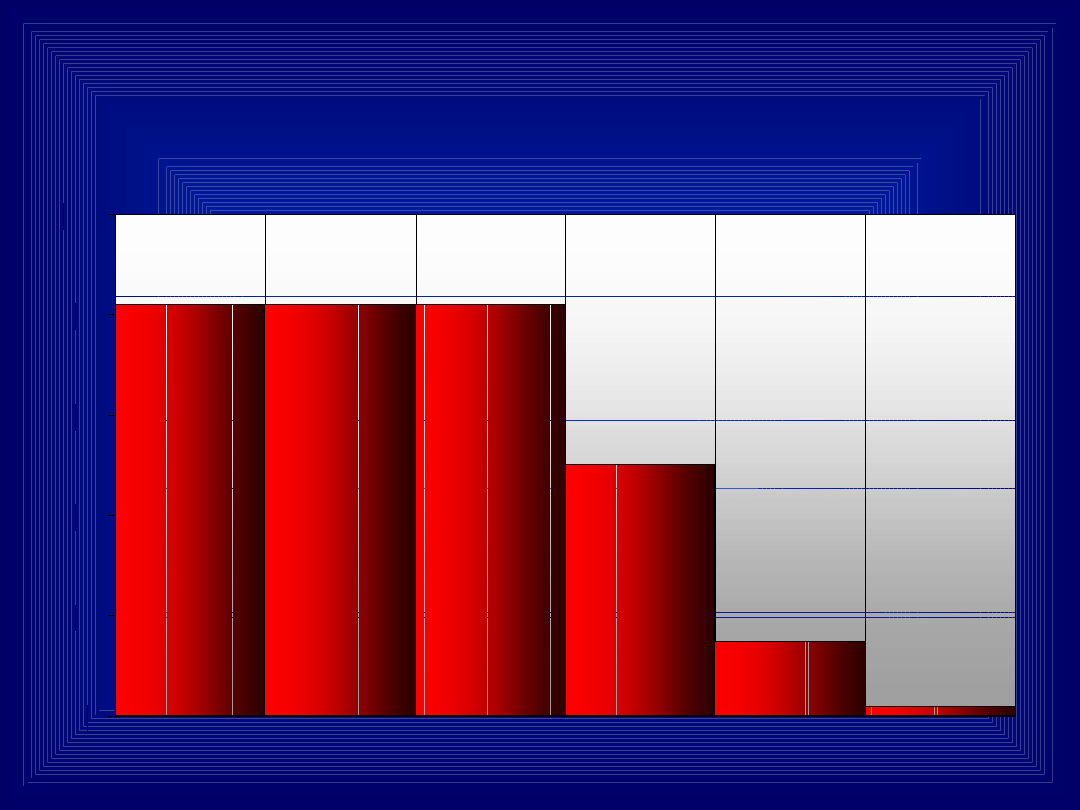
Śmiertelność w ostrych
Śmiertelność w ostrych
zatruciach
zatruciach
0
20
40
60
80
100
STAROŻYTNOŚĆ
ŚREDNIOWIECZE
WIEKI PÓŹNIEJSZE
1939 - 1945
II WOJNA
ŚWIATOWA
LECZENIE
WSTRZĄSU
1951
UTRZYMANIE
DROŻNOŚCI
DRÓG
ODDECHOWYCH I
ZAPOBIEGANIE
NIEDOTLENIENIU
1961
METODA
SKANDY-
NAWSKA
LECZENIE
ZATRUĆ BEZ
ŚRODKÓW
ANALEP-
TYCZNYCH
%
%

Główne przyczyny
Główne przyczyny
zatruć
zatruć
•
Trucizny środowiskowe
Trucizny środowiskowe
•
Żywność
Żywność
•
Leki i środki odurzające
Leki i środki odurzające
•
Tlenek węgla
Tlenek węgla
•
Alkohol etylowy i jego substytuty
Alkohol etylowy i jego substytuty
•
Zatrucia przemysłowe
Zatrucia przemysłowe
(zawodowe)
(zawodowe)

Struktura ostrych zatruć
Struktura ostrych zatruć
w Polsce
w Polsce
•
Alkohole (etanol i analogi)
Alkohole (etanol i analogi)
•
Leki
Leki
•
Tlenek węgla
Tlenek węgla
•
Grzyby
Grzyby
•
Pestycydy
Pestycydy
•
Rozpuszczalniki organiczne
Rozpuszczalniki organiczne
•
Substancje żrące
Substancje żrące
•
ZATRUCIA MIESZANE!!!!!
ZATRUCIA MIESZANE!!!!!
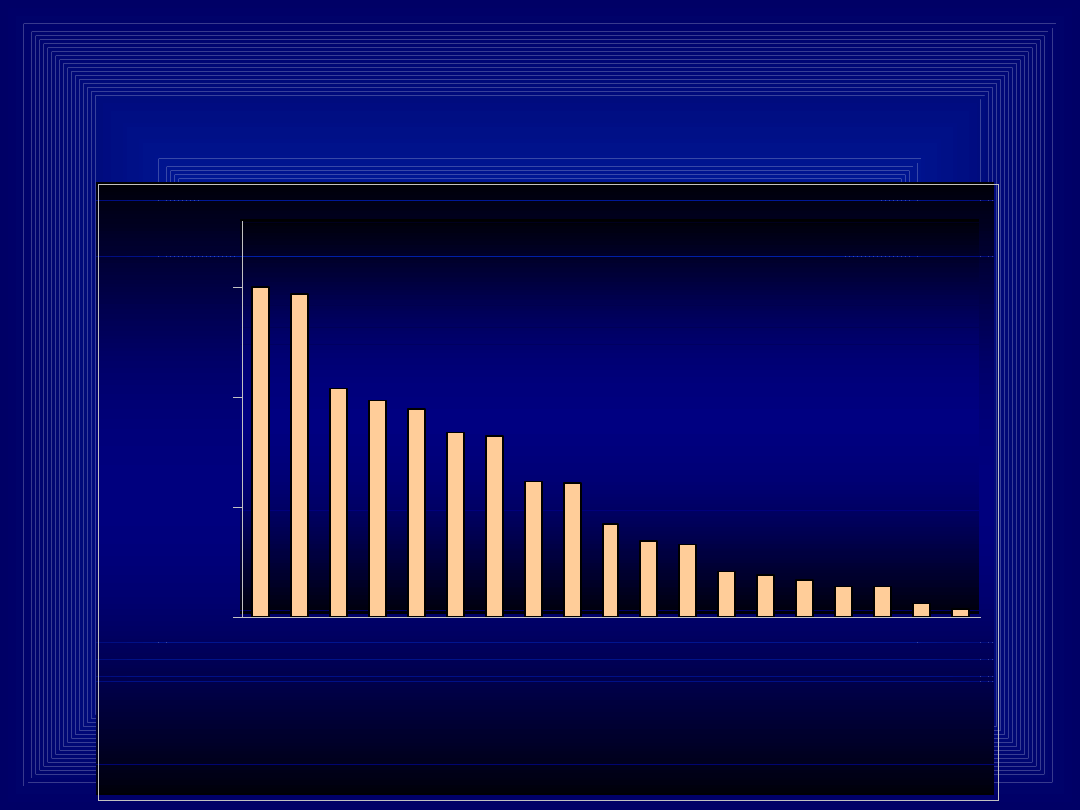
Profil oznaczeń
Profil oznaczeń
toksykologicznych
toksykologicznych
w Pracowni Toksykologii CM UJ
w Pracowni Toksykologii CM UJ
w Krakowie.
w Krakowie.
15021469
1041
982 948
835 822
619 608
424
344 332
209 191 168
142 142
62 42
0
500
1000
1500
E
ta
n
o
l
In
n
e
le
ki
A
m
fe
ta
m
in
a
B
e
n
zo
d
ia
ze
p
in
y
O
p
ia
ty
T
H
C
M
o
n
ito
ro
w
a
n
ie
H
b
C
O
F
en
o
tia
zy
n
y
B
a
rb
itu
ra
n
y
In
n
e
G
lik
o
l
M
e
ta
n
o
l
K
o
ka
in
a
S
a
lic
yl
a
n
y
a
m
o
ni
a
k
P
a
ra
ce
ta
m
o
l
A
C
h
E
M
e
ta
le
R
o
cz
n
a
lic
zb
a
o
zn
ac
ze
ń
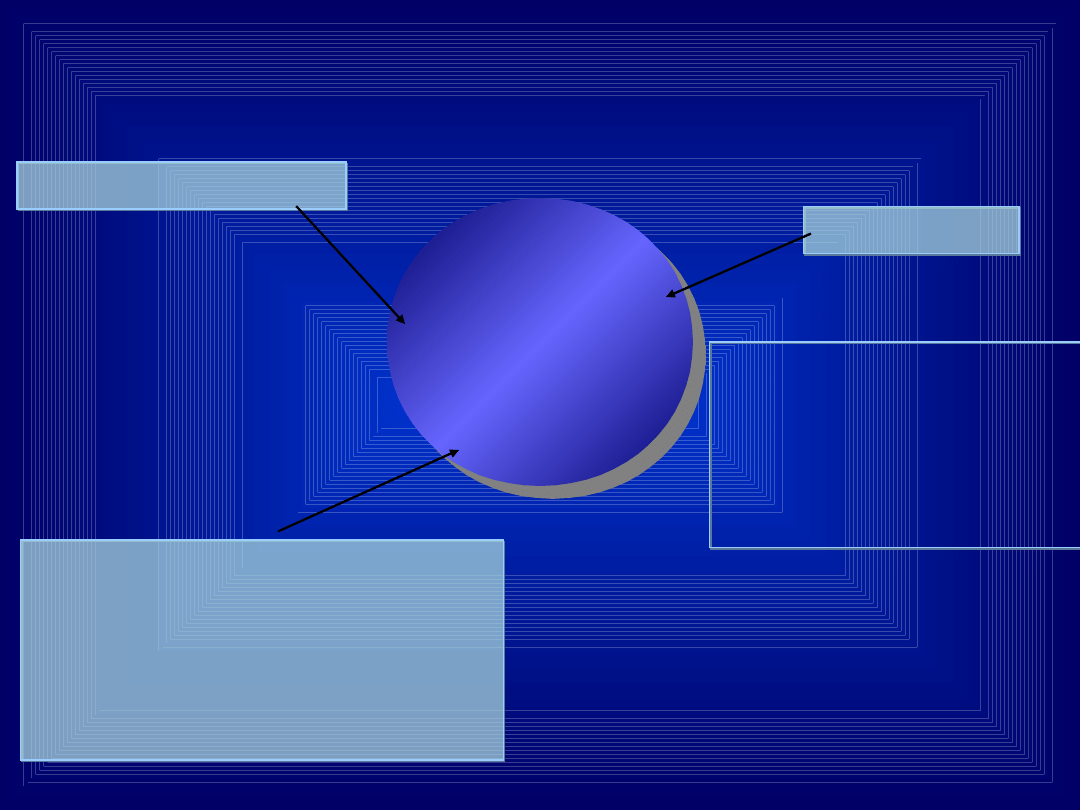
TOKSYKOLOGIA KLINICZNA
TOKSYKOLOGIA KLINICZNA
rozpoznanie
kliniczne
DROGI NARAŻENIA
• układ oddechowy
• przewód pokarmowy
• skóra
• inne
DROGI NARAŻENIA
• układ oddechowy
• przewód pokarmowy
• skóra
• inne
NARAŻENIE
NARAŻENIE
STĘŻENIE SUBSTRATU
W PŁYNACH USTROJOWYCH
STĘŻENIE METABOLITU
W PŁYNACH USTROJOWYCH
WSKAŹNIKI POŚREDNIE
STĘŻENIE SUBSTRATU
W PŁYNACH USTROJOWYCH
STĘŻENIE METABOLITU
W PŁYNACH USTROJOWYCH
WSKAŹNIKI POŚREDNIE
OBRAZ KLINICZNY
OBRAZ KLINICZNY

Biomarker
Biomarker
• Wskaźnik wykorzystywany do oceny
efektów działania substancji
chemicznych na organizm oraz do
ekstrapolacji międzygatunkowych
• Wskaźnik procesów zachodzących w
organizmie, pozwalających na ocenę
wielkości narażenia na czynniki
chemiczne i efektów działania.

•
EKSPOZYCJI (NARAŻENIA)
EKSPOZYCJI (NARAŻENIA)
•
EFEKTU (pośrednie
EFEKTU (pośrednie
wskaźniki zatrucia)
wskaźniki zatrucia)
•
WRAŻLIWOŚCI
WRAŻLIWOŚCI
•
Pomiary środowiskowe
Pomiary środowiskowe
Biomarkery
Biomarkery
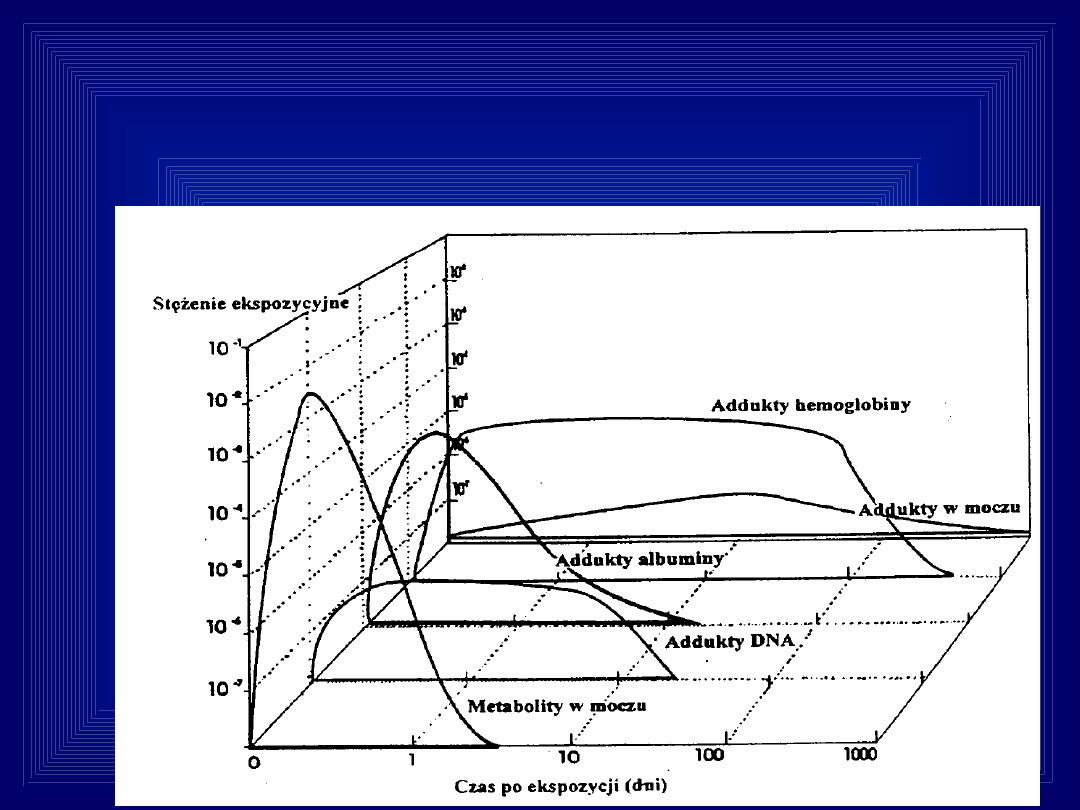
Hipotetyczne zależności między różnymi
Hipotetyczne zależności między różnymi
biomarkerami ekspozycji ze względu na
biomarkerami ekspozycji ze względu na
ich poziom i czas pojawiania się po
ich poziom i czas pojawiania się po
pojedynczej dawce substancji chemicznej
pojedynczej dawce substancji chemicznej

METABOLIZM
KSENOBIOTYKÓW.
dr Tomasz Wielkoszyński
Katedra i Zakład Chemii,
Śląska Akademia Medyczna w
Zabrzu

PODSTAWOWE GRUPY KSENOBIOTYKÓW:
Leki i używki (w tym subst.
uzależniające)
pestycydy
dodatki do żywności
zanieczyszczenia środowiskowe
Procesy jakim podlegają ksenobiotyki w
organizmie:
wchłanianie
(absorpcja)
przemieszczanie
(dystrybucja)
przemiany metaboliczne
(biotransformacja)
wydalanie
(eliminacja)
Wszystkie te etapy objęte są nazwą procesów
metabolizmu ksenobiotyków.

Wchłanianie jest to proces polegający
na przejściu ksenobiotyku ze
środowiska zewnętrznego do wnętrza
organizmu, a szczególnie do krążenia
ogólnego.
DROGI WCHŁANIANIA
KSENOBIOTYKÓW:
przez drogi oddechowe
(w fazie
gazowej, ciekłej
–
aerozole
, stałej
–
pyły
)
przez skórę
przez przewód pokarmowy

Biodostępność substancji gazowych zależy od ich
rozpuszczalności w wodzie –
gazy łatwo rozpuszczalne
wchłaniają się szybko i niemal całkowicie.
Pary substancji lipofilnych
(eter etylowy, etanol)
wchłaniają się również szybko i całkowicie.
Biodostępność aerozoli zależy od stopnia dyspersji
cząstek (ich średnicy) –
cząstki o średnicy < 1 m
wchłaniają się niemal natychmiast
(efekt jak po podaniu
dożylnym).
Cząstki o średnicy >2,5 m tylko w
niewielkim stopniu docierają do pęcherzyków płucnych.
Drogi oddechowe są głównym miejscem wchłaniania
substancji gazowych, ale również substancji stałych
zawartych np. w dymie tytoniowym
(związki ołowiu),
krzemionki, azbestu itd.
WCHŁANIANIE PRZEZ DROGI
ODDECHOWE

WCHŁANIANIE PRZEZ SKÓRĘ
Proces wchłaniania przez
nieuszkodzoną skórę zachodzi dla
większości substancji stosunkowo
wolno, jednak niektóre ksenobiotyki
cechują się znacznie większą
toksycznością po podaniu naskórnym
niż po podaniu per os.

MECHANIZMY PRZENIKANIA KSENOBIOTYKÓW
PRZEZ SKÓRĘ:
transport transepidermalny
–
jest to główny
sposób przenikania ksenobiotyków
– na
zasadzie dyfuzji biernej przez poszczególne
warstwy naskórka i skóry właściwej lub
absorpcji konwekcyjnej przez pory –
węglowodory aromatyczne i alifatyczne, aminy
aromatyczne, związki nitrowe, estry
fosforoorganiczne, tetraetyloołów, disiarczek
węgla.
transport transfolikularny
– przez gruczoły
łojowe i mieszki włosowe oraz częściowo przez
gruczoły potowe –
metale ciężkie i związki
metaloorganiczne
.

Efekty przezskórnej ekspozycji na
ksenobiotyki zależą m.in. ich od
lipofilności i charakteru chemicznego i
mogą polegać na:
miejscowym działaniu drażniącym na
powierzchni skóry
(podrażnienia,
oparzenia, stany zapalne),
tworzeniu połączeń z białkami (
działanie
alergizujące),
wchłanianiu i ogólnym działaniu
toksycznym

INNE CZYNNIKI WPŁYWAJĄCE NA
BIODOSTĘPNOŚĆ KSENOBIOTYKU PRZY
PODANIU NA SKÓRĘ:
grubość naskórka, obecność pęknięć,
wcześniejszych podrażnień i stanów
zapalnych,
wilgotność skóry i stopień jej
natłuszczenia,
lokalizacja miejsca ekspozycji,
wilgotność powietrza i jego
temperatura,
obecność substancji ułatwiających
wchłanianie
(tłuszcze, detergenty,
rozpuszczalniki)

WCHŁANIANIE PRZEZ PRZEWÓD
POKARMOWY
Pochodzenie ksenobiotyków
wchłanianych przez przewód
pokarmowy:
»
brudne ręce,
»
skażone pożywienie,
»
skażona woda pitna i inne napoje,
»
palenie tytoniu,
»
zatrucia samobójcze,
»
Leki i używki,
»
ekspozycja zawodowa
(przemysł)
.

Wchłanianie może następować w różnych
odcinkach przewodu pokarmowego:
w jamie ustnej – nitrogliceryna, alkohol,
nikotyna, kokaina, cyjanki
w żołądku – substancje o charakterze
kwasów – kwas salicylowy, benzoesowy,
fenole oraz niedysocjujace substancje
lipofilne np. alkohole i bardzo słabe zasady
organiczne (kofeina, teofilina)
w jelicie cienkim – substancje o charakterze
słabych zasad – alkaloidy, jony metali
ciężkich, związki lipofilne i niedysocjujace.
Wchłanianie może następować w różnych
odcinkach przewodu pokarmowego:
w jamie ustnej –
nitrogliceryna, alkohol,
nikotyna, kokaina, cyjanki
w żołądku – substancje o charakterze
kwasów –
kwas salicylowy, benzoesowy,
fenole oraz
niedysocjujace substancje
lipofilne
np. alkohole i
bardzo słabe zasady
organiczne
(kofeina, teofilina)
w jelicie cienkim – substancje o charakterze
słabych zasad –
alkaloidy, jony metali
ciężkich, związki lipofilne i niedysocjujace.
Obecność pokarmu może modyfikować
biodostępność ksenobiotyków !

Substancje lipofilne mogą dostawać się do
krążenia ogólnego z pominięciem krążenia
wrotnego (niezmetabolizowane) przez transport
drogami chłonnymi.
Przenikanie ksenobiotyków przez ścianę przewodu
pokarmowego może następować na drodze:
1. transportu czynnego
(niektóre jony, analogi
substancji naturalnych),
2. dyfuzji biernej
(większość ksenobiotyków)
INNE DROGI PODANIA KSENOBIOTYKÓW:
pozajelitowa –
dożylna, dotętnicza, podskórna,
domięśniowa, dootrzewnową, śródskórną,
dordzeniową
do jamy ciała –
dospojówkowa, donosowa,
doodbytnicza, dopochwowa...

OGÓLNE CZYNNIKI DECYDUJĄCE O
BIODOSTĘPNOŚCI KSENOBIOTYKU:
masa cząsteczkowa,
konfiguracja przestrzenna,
rozpuszczalność w wodzie i lipidach,
stopień jonizacji,
rozdrobnienie,
stężenie,
powierzchnia wchłaniania,
ukrwienie miejsca podania.

DYSTRYBUCJA KSENOBIOTYKÓW
Czynniki wpływające na toksykokinetykę
ksenobiotyku w organizmie:
• czynniki fizjologiczne
(np. przepływ krwi przez
poszczególne narządy)
• właściwości fizykochemiczne związku
Wielkością ilościowo charakteryzującą
zachowanie się ksenobiotyku w organizmie jest
tzw.
pozorna objętość dystrybucji
Vd
= całkowita ilość substancji w organizmie /
stężenie substancji w osoczu

Objętość dystrybucji –
hipotetyczna objętość
płynów ustrojowych, w których substancja, po
równomiernym rozmieszczeniu
(faza
stacjonarna)
mogłaby mieć takie stężenie jak w
osoczu krwi
Jeśli ksenobiotyk ulega intensywnemu
wiązaniu
(kumulacji)
w tkankach to objętość
dystrybucji może wielokrotnie przekraczać
objętość wody organizmu.
Po pierwszym etapie intensywnej
dystrybucji ksenobiotyk może podlegać zjawisku
redystrybucji
(np. do tkanek słabiej ukrwionych).

Czynniki wpływające na
toksykokinetykę danego związku:
zdolność do przenikania bariery naczyniowej
(też łożyskowej, krew-mózg, krew-jądro),
wiązanie przez białka osocza,
wiązanie z błonami erytrocytami,
wiązanie przez białka narządów,
kumulacja w tkance tłuszczowej,
kumulacja w tkance kostnej
Biologiczny okres półtrwania –
informuje o czasie pozostawania
danej substancji w organizmie.

Wydalanie trucizn
Ksenobiotyki są wydalane jako:
macierzyste substancje
(niezmetabolizowane)
metabolity
(wolne lub sprzężone)
Drogi eliminacji trucizn:
z moczem
z żółcią (z kałem)
z powietrzem wydychanym
ze śliną, potem, mlekiem, przez jelito

WYDALANIE Z MOCZEM:
wydalanie do moczu pierwotnego,
zjawisko resorpcji zwrotnej w kanaliku
nerkowym na drodze dyfuzji biernej lub
transportu czynnego,
resorpcji zwrotnej nie podlegają substancje
silnie zjonizowane i silnie hydrofilne,
zjawisko wydzielania kanalikowego

WYDALANIE Z ŻÓŁCIĄ
mechanizm wydalania ksenobiotyków o
dużej masie cząsteczkowej
(M > 300 – 500)
i
ich metabolitów
wydzielanie do żółci na drodze transportu
aktywnego
zjawisko krążenia jelitowo-wątrobowego
Tak wydalane są m.in. insektycydy
polichlorowane, PCB, WWA, węglowodory
aromatyczne, hormony steroidowe, wiele leków
oraz połączenia wielu substancji z kwasem
glukuronowym, siarkowym, glicyną i
glutationem.

WYDALANIE Z POWIETRZEM
wydalanie substancji lotnych o dużym
współczynniku podziału powietrze-woda
wydalanie na drodze dyfuzji biernej
wydalanie zależy od rozpuszczalności
związku w wodzie
biotransformacja do nielotnych metabolitów
ogranicza wydalanie tą drogą
Tak wydalane są środki znieczulenia ogólnego,
alkohole, rozpuszczalniki organiczne, olejki
eteryczne oraz metabolity nielotnych związków
chemicznych np. disiarczek węgla z
ditiokarbaminianów).

BIOTRANSFORMACJA
KSENOBIOTYKÓW

BIOTRANSFORMACJA KSENOBIOTYKÓW
Reakcje biotransformacji –
przemiany
ksenobiotyków na drodze enzymatycznej (lub
nieenzymatycznej) prowadzące do powstania
metabolitów
Reakcje pierwszej fazy –
modyfikują strukturę
ksenobiotyku – np. utlenianie, redukcja, hydroliza
Reakcje drugiej fazy –
reakcje sprzęgania ze
związkami endogennymi (kwasem glukuronowym,
siarkowym, glutationem, glicyną).

NIE PODLEGAJĄ BIOTRANFORMACJI:
związki silnie polarne –
kwas ftalowy, szczawiowy,
kwasy sulfonowe, czwartorzędowe zasady amoniowe
– wydalane z moczem
substancje bardzo lotne –
eter etylowy,
cyklopropan, krótkołańcuchowe alkany
– wydalane
przez płuca
związki silnie lipofilne –
PCB
– kumulują się w
tkance tłuszczowej
Enzymatyczna biotransformacja ksenobiotyków
zachodzi w wątrobie, nerkach, płucach, jelicie
cienkim, łożysku, jądrach, jajnikach, siatkówce
oka, skórze i osoczu krwi.

Mikrosomy –
fragmenty siateczki
endplazmatycznej gładkiej zawierające
tzw.
enzymy mikrosomalne.
enzymy mikrosomalne biorą udział w reakcjach
utleniania, redukcji, hydrolizy i sprzęgania
zaliczane są do monooksygenaz (dawniejsza
nazwa: oksydazy o funkcji mieszanej)
RH + O
2
+ NADPH + H
+
ROH + H
2
O +
NADP
reakcje utleniania zachodzą przy udziale tlenu
cząsteczkowego i donora wodoru (NADH lub
NADPH)
reakcje redukcji wymagają tylko obecności
równoważników redukcyjnych

monoksygenazy są enzymami o małej
aktywności właściwej ale o dużym stężeniu w
tkankach (
w hepatocytach stanowią ok. 20%
białka całkowitego)
warunkiem aktywności wobec danego
substratu jest jego duża lipofilność
główne enzymy mikrosomalne – enzymy grupy
cytochromu P-450 –
cytochrom P-450,
reduktaza NADP-cytochrom P450 i czynnik
lipidowy
Cytochrom P-450
wiele izoenzymów o szerokiej specyficzności
substratowej
polimorfizm genetyczny cytochromów
P-450
różna lokalizacja narządowa

Inne enzymy uczestniczące w
biotransformacji ksenobiotyków:
• oksydaza aminowa
• syntaza prostaglandynowa (
aktywacja
metaboliczna prokancerogenów w tkankach o
niskiej aktywności monooksygenaz)
• laktoperoksydaza
• mieloperoksydaza
• enzymy frakcji mitochondrialnej,
cytoplazmatycznej i jądrowej
hepatocytów

REAKCJE BIOTRANSFORMACJI
PROWADZĄ DO POWSTANIA:
metabolitów o mniejszej toksyczności lub
nieczynnych biologicznie –
detoksykacja
metabolitów o wybitnym działaniu toksycznym
ze związków pozbawionych toksyczności lub o
niskiej toksyczności –
aktywacja metaboliczna
Grupy związków niebezpiecznych ze względu
na dużą reaktywność chemiczną:
•
związki karbonylowe (aldehydy i ketony),
•
chinony i chinonoiminy,
•
chlorki acylowe,
•
epoksydy,
•
wolne rodniki
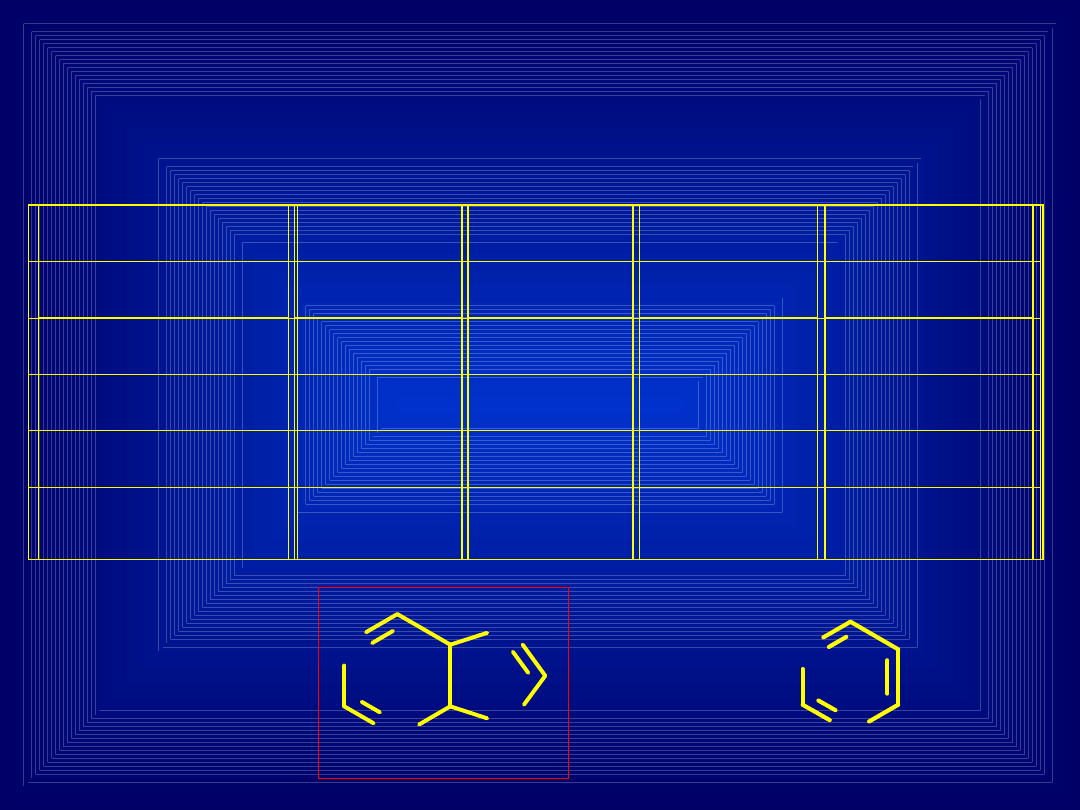
KANCEROGENEZA CHEMICZNA
Związek chemiczny
(Promutagen lub
prokancerogen)
Aktywacja
metaboliczna pod
wpływem enzymów
(cytochrom P
450 w
wątrobie)
epoksydy,
dihydroksy związki
(MUTA-,
KANCEROGENY)
zasady
DNA
ADDUKTY z
DNA
Pozycja
N-1
N-3
N-7
C-8
Atomy
egzocyklicz
ne
guanin
a
+
+
+
+
N-2, O-
6
adenin
a
+
+
+
+
N-6
cytozyn
a
-
+
-
-
O-2, N-
4
tymina
-
+
-
-
O-4
1
N
N
N
N
H
2
3
4
5
6
7
8
9
1
N
N
2
3
4
5
6
Podatność DNA na ataki nukleofilowe
wynika z dużej zawartości heteroatomów (azotu
i tlenu), mających wolne pary elektronowe.
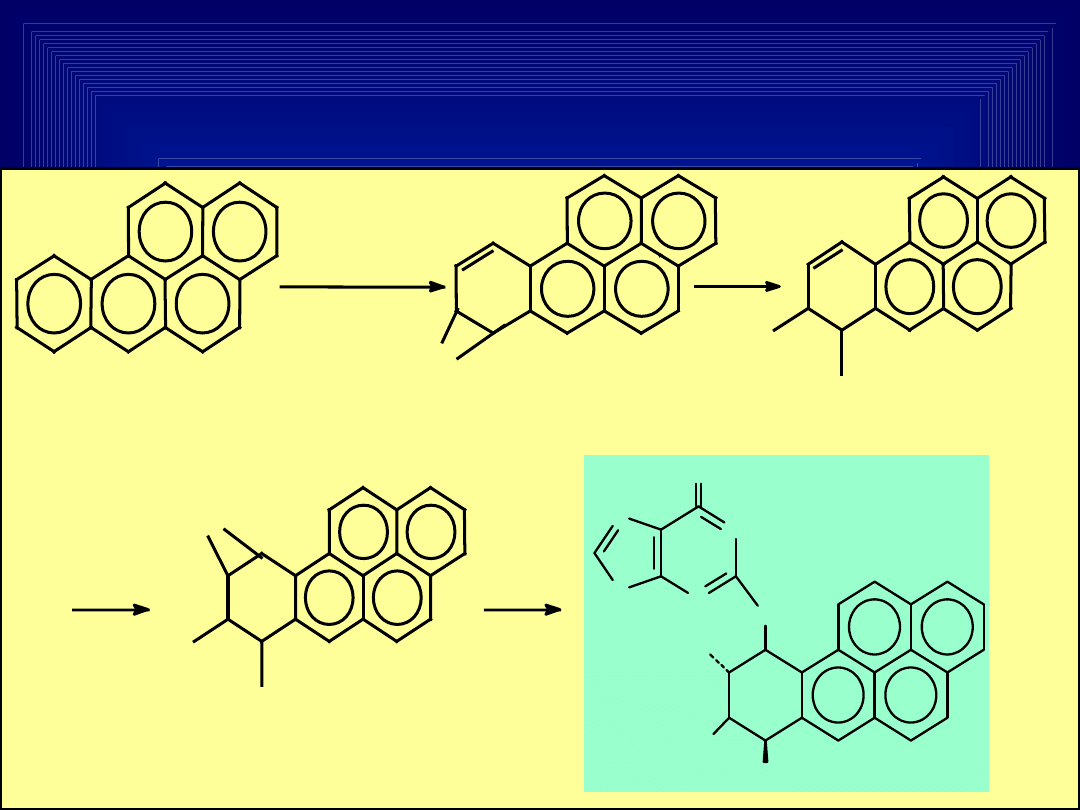
AKTYWACJA METABOLICZNA
BENZO(A)PIRENU W ORGANIZMACH
ŻYWYCH
BaP
monooksygen
azy
cytochrom
P
-
450
O
7,8-epoksy BaP
OH
OH
7,8-dihydro-diol BaP
OH
OH
O
7,8-dihydro-diol
9,10-epoksy BaP
HO
OH
HO
NH
N
NH
N
N
O
ADDUK
T
O
O
OCH
3
O
O
O
O
+DNA
O
O
OCH
3
HO
O
O
O
NH
N
N
N
O
H
2
N
cukier
O
O
O
NH
N
N
NH
O
H
2
N
C
H
O
O
OCH
3
HO
O
cukier
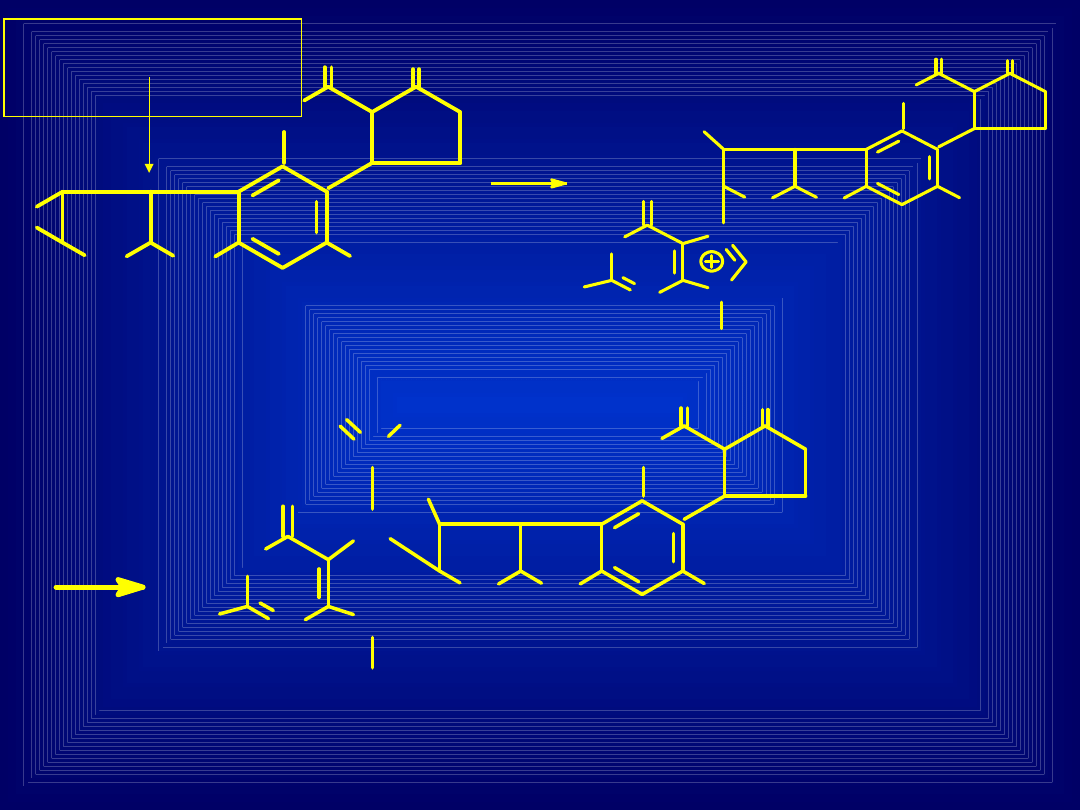
AKTYWACJA METABOLICZNA AFLATOKSYNY B1
Epoksyd
aflatoksyny
Addukt
nietrwały
Addukt
trwały
AFLATOKSYN
A
Cyt. P450
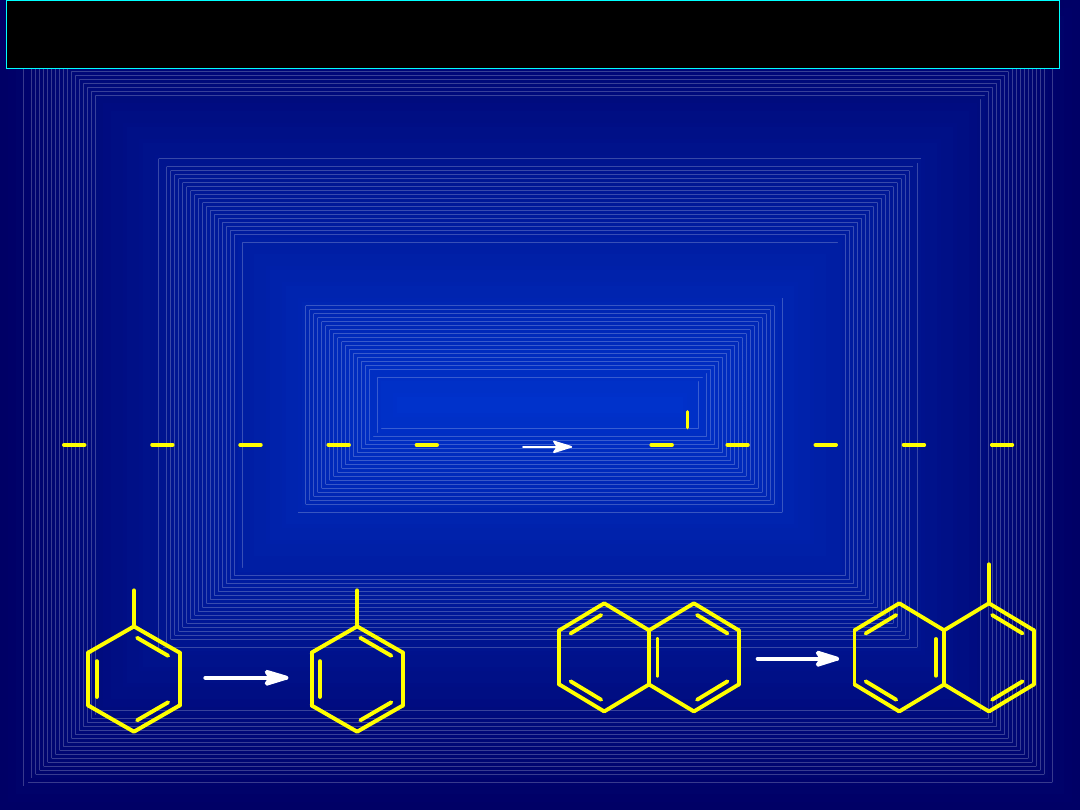
REAKCE PIERWSZEJ FAZY
I. MIKROSOMALNE REAKCJE REDOKS
HYDROKSYLACJA WĘGLOWODORÓW
Wprowadzenie do cząsteczki ksenobiotyku grupy
–OH
(ew. –COOH)
CH
3
CH
2
CH
2
CH
2
CH
2
CH
3
O
CH
3
CH CH
2
CH
2
CH
2
CH
3
OH
CH
3
O
COOH
O
OH
HEKSAN
HEKSAN-2-OL
TOLUEN
Kw.BENZOESOWY
NAFTALEN
1-NAFTOL
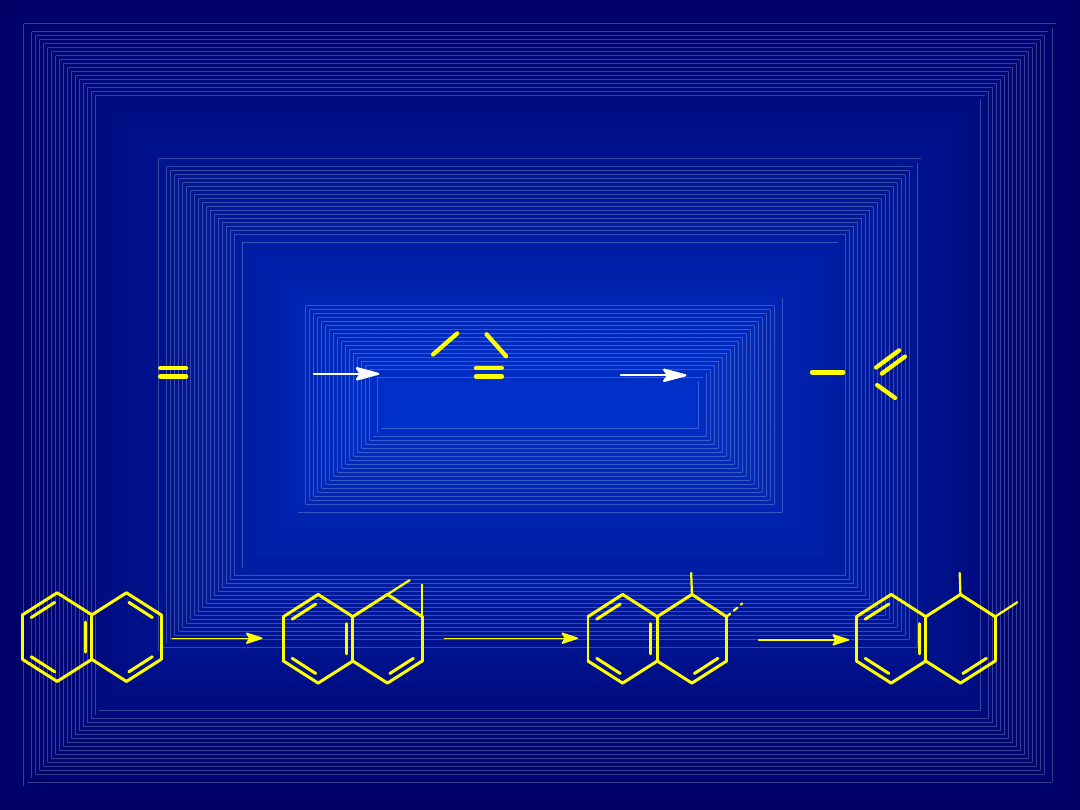
EPOKSYDACJA
Przyłączenie do podwójnego wiązania w
cząsteczce ksenobiotyku
tlenu
– powstają
związki o silnym działaniu mutagennym i
rakotwórczym
CH
2
CHCl
CH
2
CHCl
O
CH
2
Cl C
H
O
O
O
hydrolaza
epoksydowa
OH
OH
O
NADPH
O
NADPH
OH
OH
Chlorek
winylu
Tlenek
chloroetyle
nu
Aldehyd
chloroocto
wy
Naftalen
1,2-
Epoksynaftalen
1,2-Dihydro-
naftaleno-1,2-
diol
1,2-Dihydroksy-
naftalen
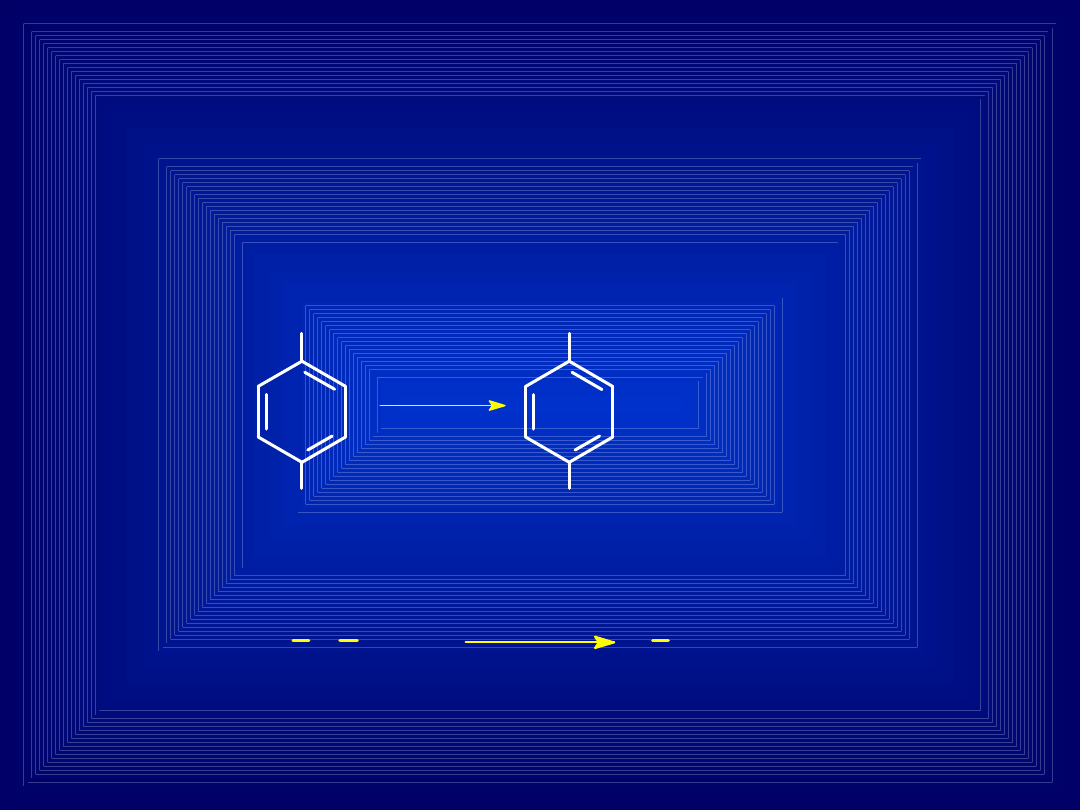
DEALKILACJA
Reakcje odłączenia grup alkilowych od atomów
azotu, tlenu lub siarki w cząsteczce ksenobiotyku –
powstają aminy, fenole lub merkaptany z
jednoczesnym odłączeniem aldehydu
NHCOCH
3
OC
2
H
5
NHCOCH
3
OH
O
-
CH
3
CHO
R S CH
3
O
-
HCHO
R S
H
Fenacetyna
PARACETMO
L
Tioeter
Merkaptan

OKSYDATYWNA DEAMINACJA
Utlenianie amin do ketonów
zachodzące przy
udziale oksydazy aminowej występujące w
siateczce endoplazmatycznej.
N-OKSYDACJA
Powstawanie tlenków amin z amin III-
rzędowych
katalizowane przez enzymy
mikrosomalne.
Tlenki amin są zazwyczaj bardziej toksyczne
od związków macierzystych.
(CH
3
)
3
N
O
(CH
3
)
3
N
O
Trimetyloami
na
N-Tlenek
trimetyloami
ny
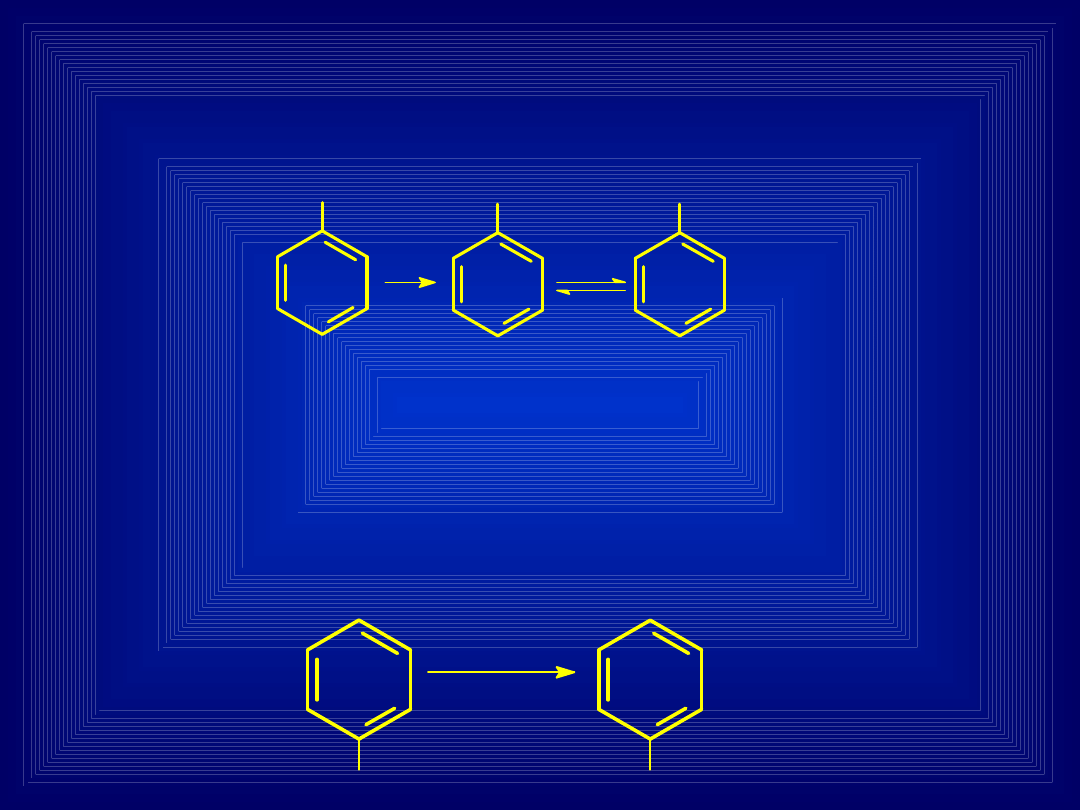
N-HYDROKSYLACJA
Tworzenie hydroksyloamin i związków nitrozowych
z amin I- i II-rzędowych
NH
2
NH
OH
O
N
O
REDUKCJA ZWIĄZKÓW NITROWYCH I AZOWYCH
Przebiegająca w warunkach beztlenowych
redukcja związków nitrowych do odpowiednich
amin
NO
2
NH
2
reduktaza
nitrowa
Anilina Fenylohydr
o-
ksyloamina
Nitrobenze
n
JEDNOELEKTRONOWE REAKCJE UTLENIANIA I
REDUKCJI
Jednoelektronowe utlenianie
– powstanie
kationorodnika
Jednoelektronowa redukcja
– powstanie
anionorodnika
Rozszczepienie homolityczne – powstanie dwóch
wolnych
rodników
CHCl
3
cytochrom P-450
CCl
4
-
Cl
+
e
CCl
3
+RH
-RH
CCl
3
COO
CCl
3 +
O
2

INNE TYPY REAKCJI BIOTRANFORMACJI
KSENOBIOTYKÓW ZACHODZĄCE PRZY
UDZIALE ENZYMÓW MIKROSOMALNYCH
S-oksydacja
Desulfuracja
Oksydatywna dahalogenacja
Redukcyjna dehalogenacja

II. POZAMIKROSOMALNE REAKCJE
REDOKS
UTLENIANIE ALKOHOLI
Dehydrogenaza alkoholowa – enzym cytozolowy
hepatocytów
CH
3
CH
2
OH
CH
3
CHO
+
NAD
ADH
+
NADH
+
H
W przemianach alkoholi uczestniczą również:
mikrosomalny układ utleniający etanol
(MEOS)
katalaza
Etanol
Aldehyd
octowy
UTLENIANIE ALDEHYDÓW
Dehydrogenaza aldehydowa
CH
3
CHO
CH
3
COOH
+
H
2
O
ALDH
+
NAD
+
NADH
+
H
III. REAKCJE HYDROLIZY
Dotyczą estrów, amidów, hydrazydów,
karbaminianów, nitryli i epoksydów.
Zachodzą przy udziale nieswoistych esteraz i
amidaz.
+
R COOR
`
H
2
O
esteraza
R COOH
+
R
`
OH
+
R COONH
2
H
2
O
amidaza
R
COOH
+
NH
3
Ester
Kwas
Alkoh
ol
Amid
Kwas

REAKCE DRUGIEJ FAZY- REAKCJE
SPRZĘGANIA
Ksenobiotyki lub ich metabolity powstałe w
reakcjach pierwszej fazy są sprzęgane z
substancjami endogennymi:
kwasem glukuronowym
kwasem siarkowym
aminokwasami
Reakcje sprzęgania mogą również
obejmować
:
reakcje metylacji
reakcje acetylacji
tworzenie kwasów merkapurowych
tworzenie tiocyjanianów

Reakcje sprzęgania zachodzą w dwóch
etapach
:
1. jeden z substratów (najczęściej endogenny)
jest aktywowany
(udział cząsteczek
wysokoenergetycznych – ATP, UTP)
2. grupa o wysokim potencjale energetycznym
zostaje przeniesiona na drugi substrat z
utworzeniem koniugatu
.
Katalizowane są przez enzymy z grupy
transferaz
SPRZĘGANIE Z KWASEM GLUKURONOWYM
W reakcji uczestniczy
„aktywny kwas
glukuronowy”
czyli kwas
urydynodifosfoglukuronowy
(UDPGA)
i UDP-
glukuronozylotransferaza.
O
COOH
HO
OH
OH
O P O P O CH
2
O
O
O
O
HN
N
O
O
O
OH OH
UDPGA
Powstające połączenia mają charakter eterów,
estrów (O-glukuronidy) lub też N-glukuronidów
czy S-glukuronidów.
Glukuronidy są znacznie lepiej rozpuszczalne w
wodzie niż macierzyste ksenobiotyki i w związku z
tym znacznie łatwiej (szybciej) wydalane są z
moczem lub żółcią.
W wielu tkankach może zachodzić
proces
deglukuronizacji
– uczestniczy w nim
-
glukuronidaza
– enzym lizosomalny.
Ar N
H
Glukuronid
pH<7
-glukuronidaza
Ar N
H
OH
OH
2
Ar N
H
pH<7
pH>7
-H
2
O
+H
2
O
Ar N
H
N-Glukuronid
aryloaminy
N-Hydroksylo-
aryloamina
Jon
arylonitreniow
y
Sprzęganie z kwasem siarkowym
Siateczka cytoplazmatyczna wątroby, nerek, jelit,
mózgu, nadnerczy, jąder i jajników –
enzymy z
grupy sulfotransferaz
Reakcja siarczanowania zachodzi pod wpływem
„aktywnego siarczanu” –
5’-fosfosiarczanu 3’-
fosfoadenozyny (PAPS)
O S O P O CH
2
O
O
O
O
O
O
OH
PO
3
H
-
N
N
N
N
NH
2
PAPS

METYLACJA
Donorem grupy metylowej jest S-
adenozylometionina (SAM).
Reakcje metylacji nie odgrywają większej roli w
metabolizmie ksenobiotyków –
nie wpływają na
zwiększenie rozpuszczalności związku, ani nie
przyśpieszają jego eliminacji
.

ACETYLACJA
Jest to najczęstsza reakcja sprzęgania amin
aromatycznych, sulfonamidów, hydrazydów i
niektórych amin alifatycznych
Czynnikiem acetylującym jest acetylo-CoA
Acetylacja może prowadzić do zmniejszenia
rozpuszczalności ksenobiotyku w wodzie!
Polimorfizm genetyczny warunkujący zmienną
szybkość acetylacji u ludzi może decydować o
skuteczności niektórych leków, toksyczności
ksenobiotyków lub ich działaniu rakotwórczym.
Równocześnie z acetylacją ksenobiotku może
zachaodzić jego deacetylacja (hydroliza)
enzymatyczna.

SPRZĘGANIE Z
AMINOKWASAMI
• Sprzęganiu ulegają aromatyczne i
heterocykliczne kwasy karboksylowe oraz
kwasy arylooctowe
• Sprzęganie zachodzi najczęściej z glicyną
• Aktywacji ulega ksenobiotyk – powstaje
pochodna CoA (np.. Arylo-CoA)
Kwas benzoesowy + glicyna kwas
hipurowy
Oprócz glicyny do sprzęgania mogą
służyć glutamina, ornityna, seryna,
tauryna, arginina i lizyna.

SPRZĘGANIE Z GLUTATIONEM
• Glutation – tripeptyd – Cys- Gly- Glu
• Z glutationem tworzą połączenia: epoksydy
węglowodorów alifatycznych, aromatycznych
i alicyklicznych, nienasycone węglowdory
alifatyczne, halogenowe węglowodory
alifatyczne i aromatyczne, halogenowe
związki nitrowe
• W wyniku sprzęgania z glutationem tworzą
się tzw.
kwasy merkapturowe
– wydalane
głównie z żółcią
• W detoksykacyjnym działąniu glutationu
uczestniczy S-transferaza glutationowa (GST)

Tworzenie tiocyjanianów
• Reakcja detoksykacji cyjanków nieorganicznych
CN
-
+ S
2
O
3
2-
SCN
-
+ SO
3
2-
• Źródłem siarki są związki zawierające tzw. siarkę
sulfanową – tiosiarczany, tiosulfoniany, politioniany,
nadsiarczki
• Sprzęganie jest katalizowane przez
siarkotransferazę tiosiarczanową (rodanazę)
• Źródłem siarki może być też cysteina
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
- Slide 41
- Slide 42
- Slide 43
- Slide 44
- Slide 45
- Slide 46
- Slide 47
- Slide 48
- Slide 49
- Slide 50
- Slide 51
- Slide 52
- Slide 53
- Slide 54
- Slide 55
- Slide 56
- Slide 57
- Slide 58
- Slide 59
- Slide 60
- Slide 61
- Slide 62
Wyszukiwarka
Podobne podstrony:
Ćw metabolizm ksenobiotyków 2015 16 OAM
Metabolizm ksenobiotyków
metabolizm ksenobiotykow
Ćw metabolizm ksenobiotyków 2015 16 OAM
Metabolizm kkw tł stud
Metabolizm
(2,3) Działania nieporządane, toksytczne leków Metabolizm, czynniki wpływające na działanie substanc
metabolizm witaminy D3
Zespół metaboliczny tarczyca wykład8
Metabolizm AA 2003 2
Komponenty metaboliczne
Metabolizm aminokwasów
Zespó Metaboliczny w profilaktyce lekarza medycyny pracy 1
Bilirubin metabolism Applied ph Nieznany (2)
więcej podobnych podstron