
Pasma energetyczne
Bliskie odległości między atomami w ciałach stałych prowadzą
do zasadniczych zmian w obrazie struktury elektronowej.
Jak wiemy, strukturę elektronową izolowanego atomu określają
4 liczby kwantowe i zakaz Pauliego:
1. n = 1,2,3,...
2. 1 = 0,1,2, ..,n – 1 (n wartości).
3. m
l
= – l, – (l – 1),..., – 1,0,1,..,l – 1,l (2l + 1)
wartości.
4. m
s
= ½ .
Energia elektronu zależy od n i l:
E = E(n,l)
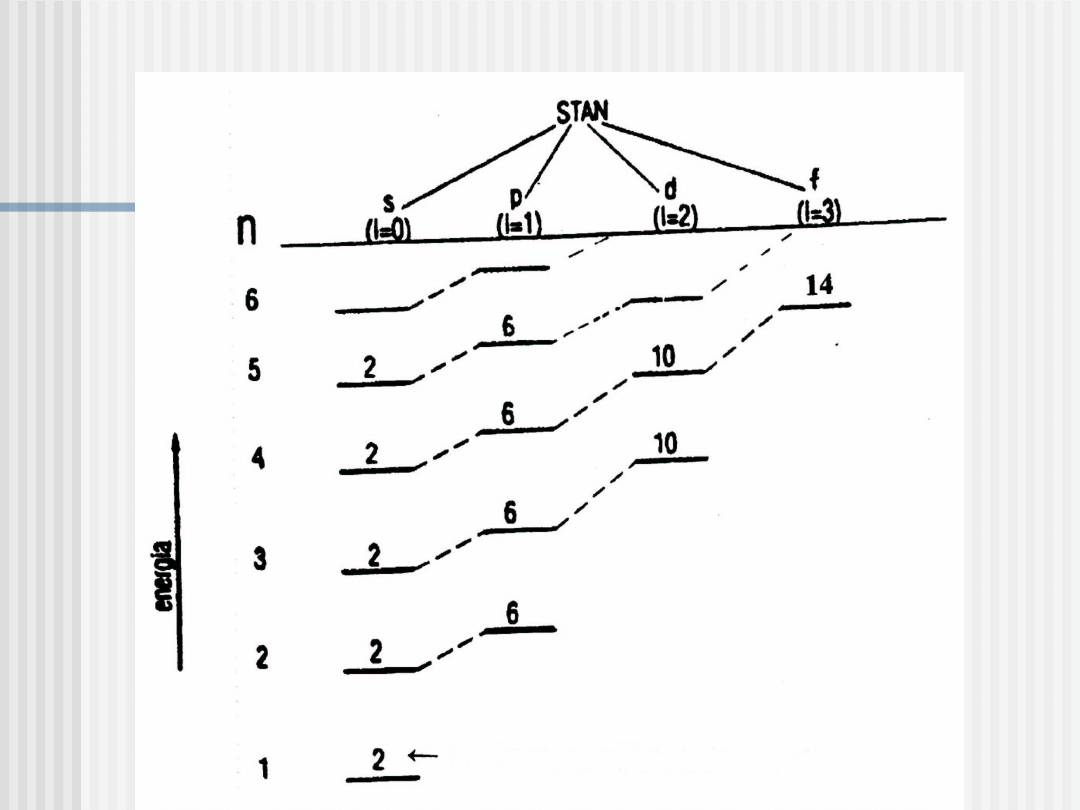
Sekwencja poziomów energetycznych E =
E(n,l)
liczba stanów

Pasma energetyczne
Jeżeli atomy są daleko od siebie, to elektrony zajmują dyskretne
poziomy energetyczne. Atomy, zbliżając się, oddziałują ze sobą,
poziomy energetyczne rozszczepiają się, tworząc pasma
energetyczne o szerokości rzędu kilku eV.
Pasmo energetyczne stanowi układ dyskretnych, jednak
leżących bardzo blisko siebie, podpoziomów energetycznych,
których liczba, choć bardzo duża, jest skończona i równa
iloczynowi liczby atomów N przez liczbę stanów kwantowych
odpowiadającą danej liczbie kwantowej l, która wynosi 2 • (2l
+1), czyli liczba stanów w paśmie = 2 •(2l + 1) • N.
Ponieważ koncentracja atomów w ciele stałym jest rzędu
10
22
/cm
3
, to odległość między podpoziomami w paśmie o
szerokości 1 eV będzie wynosiła ok. 10
-22
eV,
co pozwala traktować pasmo jako ciągłe, ale o skończonej
liczbie stanów.
Pasma energetyczne oznacza się w ten sam sposób, jak stan
kwantowy izolowanego atomu.
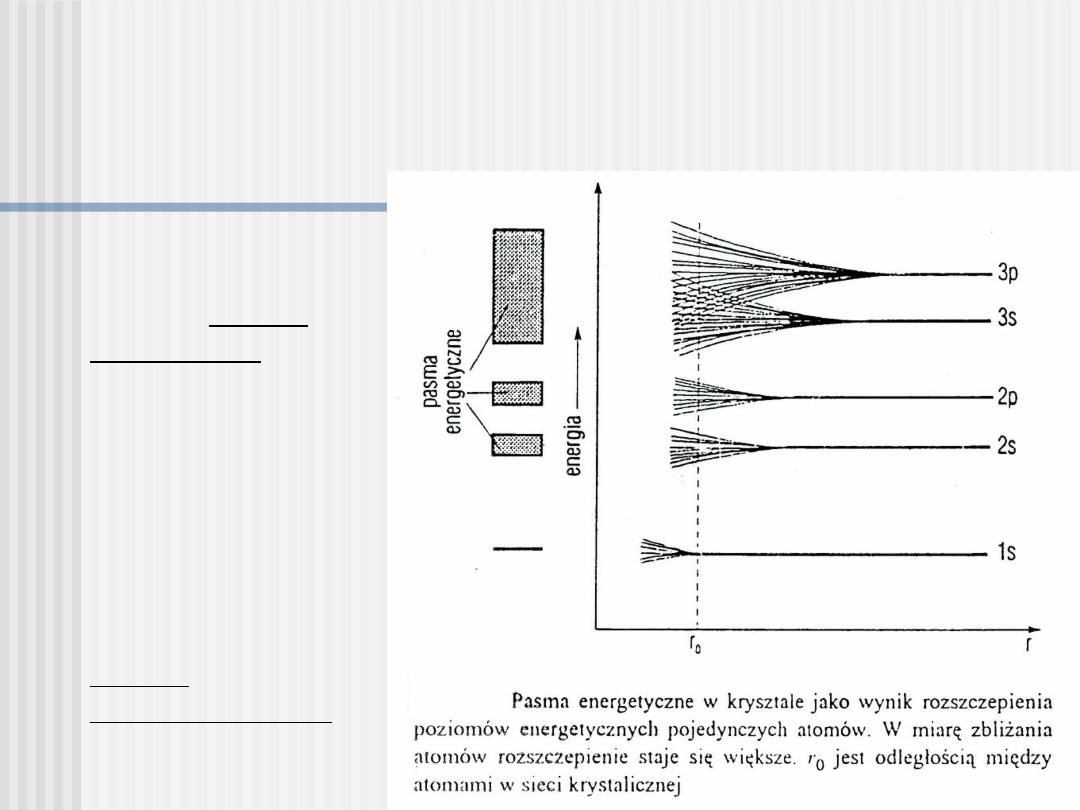
Pasma energetyczne
Najważniejszą
rolę odgrywają 2
pasma: pasmo
walencyjne,
odpowiadające
niewzbudzonym
elektronom
atomów i
najbliższe pasmo
stanów
zbudzonych,
noszące nazwę
pasma
przewodnictwa.
Przedział energii
zabronionej
między tymi
pasmami stanowi
przerwę
energetyczną

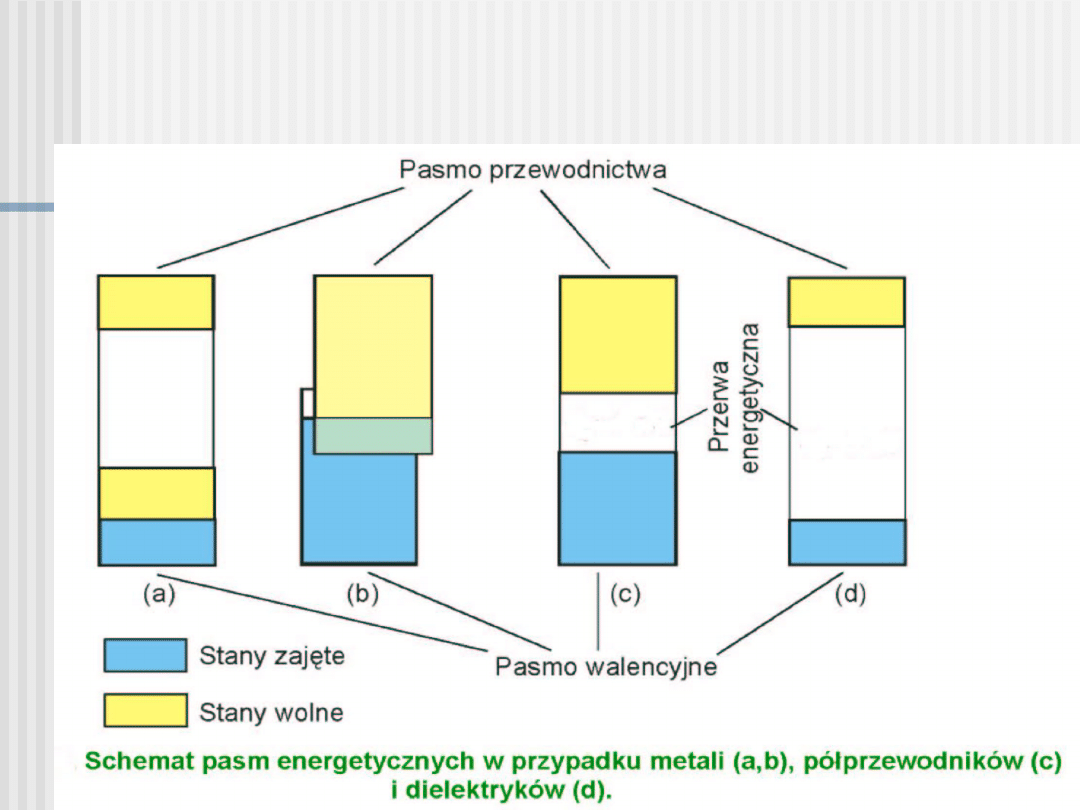
Przewodniki, półprzewodniki,
izolatory
Wzajemne ułożenie pasm energetycznych i ich
zapełnienie przez elektrony warunkują właściwości
elektryczne ciał stałych i są podstawą ich podziału
na:
• przewodniki (metale),
• półprzewodniki,
• izolatory (dielektryki).
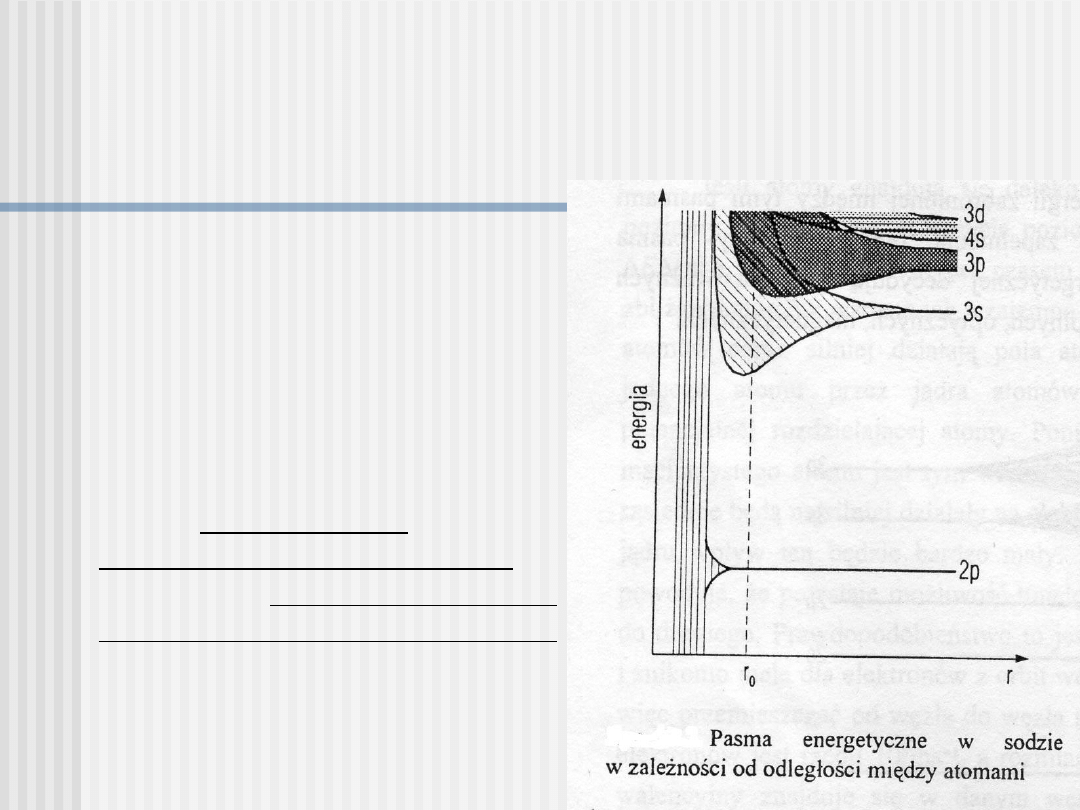
Metale jednowartościowe
Przykład: sód (Na), w którego
atomie na ostatniej powłoce
(walencyjnej) znajduje się 1
elektron 3s. Zatem w krysztale
sodu składającym się z N
atomów, istnieje w paśmie 3s
2N stanów do obsadzenia, a
liczba elektronów wynosi N;
zatem pasmo 3s jest
zapełnione tylko do połowy.
Ponadto, pasmo 3s zachodzi
na całkowicie puste pasmo 3p,
w którym jest 6N stanów. W
efekcie powstaje pasmo
częściowo wypełnione (w 1/8).
Podobnie jest w innych
metalach alkalicznych, tj. Li
(2s), K (4s), Rb (5s), Cs (6s),
które stanowią I grupę układu
okresowego.
W przypadku metali, istnieje pasmo energetyczne zapełnione tylko częściowo.
Poniżej, wszystkie pasma są zapełnione, a powyżej - wszystkie puste.
11
Na:
1s
2
2s
2
2p
6
3s
1
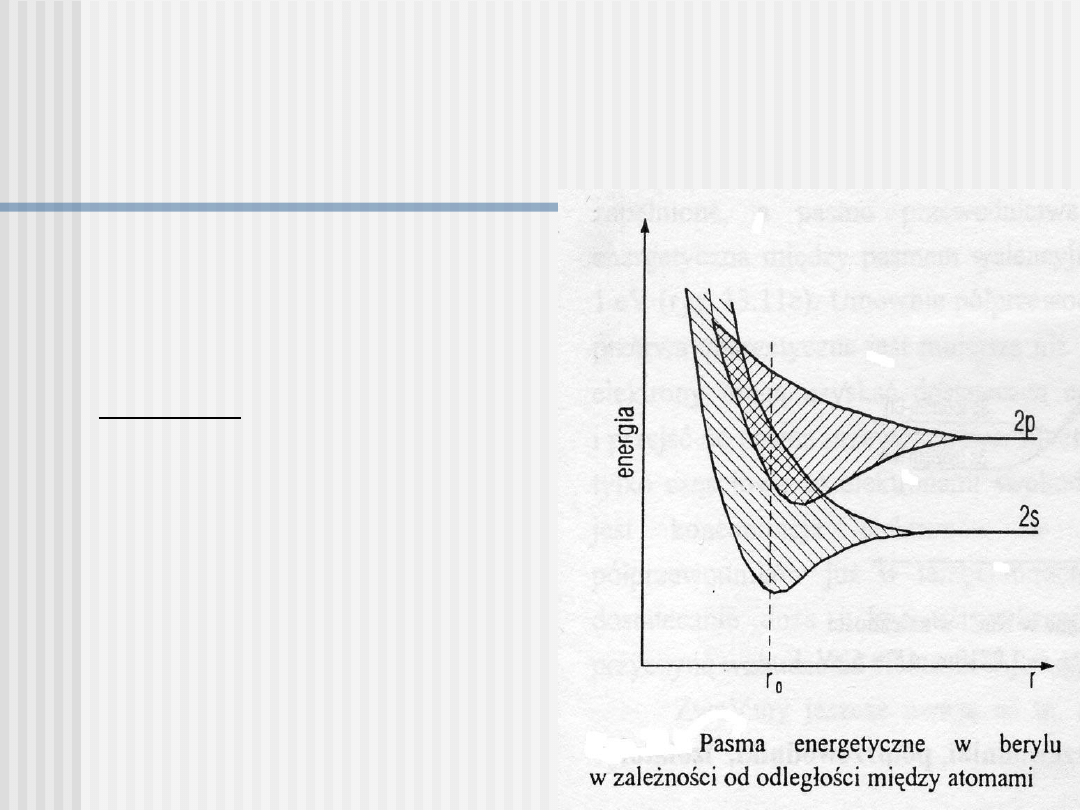
Metale dwuwartościowe
Sytuacja taka ma miejsce
w pierwiastkach II grupy
układu okresowego (Be,
Mg)
Przykład: beryl (Be), w
którego atomie, 2
elektrony walencyjne
całkowicie zapełniają stan
2s;
kolejny stan 2p jest
całkowicie pusty.
W krysztale, pasma s i p
przekrywają się (zachodzą
na siebie) i w efekcie
powstaje pasmo częściowo
wypełnione (w 1/4).
Pasmo zapełnione tylko częściowo może także powstać w
wyniku nałożenia się pasm całkowicie zapełnionych na pasma
puste.
4
Be:
1s
2
2s
2

Prąd elektryczny w metalach
W metalach, wewnątrz częściowo zapełnionego pasma,
elektrony mogą łatwo przechodzić do niezapełnionych stanów
pod wpływem zewnętrznego pola elektrycznego.
Pojawia się wtedy w metalu uporządkowany ruch elektronów -
prąd elektryczny i dlatego metale są dobrymi
przewodnikami prądu.

Półprzewodniki
Półprzewodnikami nazywamy takie ciała, w których, w 0 K,
pasmo walencyjne (i pasma niższe) są całkowicie
zapełnione, a pasmo przewodnictwa całkowicie puste, przy
czym przerwa energetyczna
jest mniejsza niż 3 eV.
Wraz ze wzrostem temperatury, niektóre elektrony mogą
uzyskać dostateczną energię potrzebną do pokonania
przerwy energetycznej
i przejść do pasma przewodnictwa umożliwiając tym
samym przepływ prądu elektrycznego.
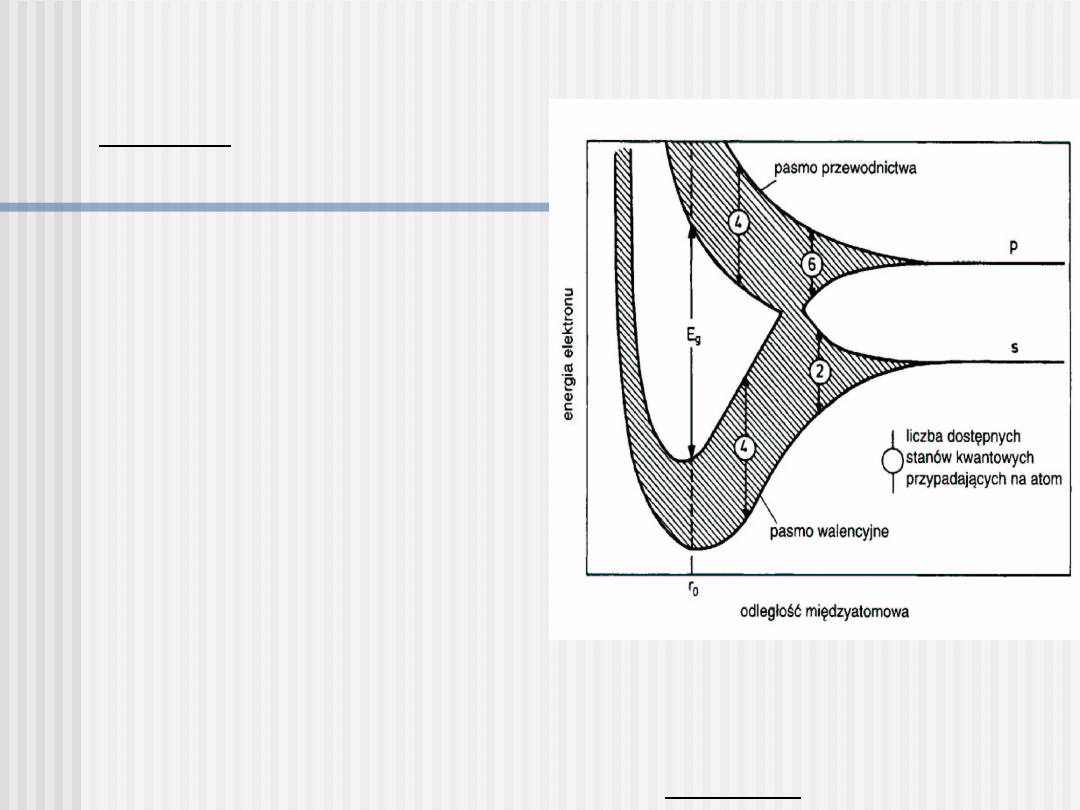
Półprzewodniki
14
Si:
1s
2
2s
2
2p
6
3s
2
3p
2
3
3
3
Pasma energetyczna w
krysztale krzemu [podobnie
dla C diamentu) i Ge]
powstają z pasm 3s i 3p,
które przy zbliżaniu się
atomów, najpierw się
nakładają (hybrydyzacja), po
czym, przy dalszym
zbliżaniu, następuje
ponowne rozszczepienie
na dwa pasma, w każdym z
których znajduje się 4N
stanów. Elektrony
walencyjne całkowicie
wypełniają pasmo dolne,
natomiast pasmo górne
pozostaje całkowicie puste,
a przerwa energetyczna (w
Si) wynosi E
g
= 1,1 eV.
Przykład: krzem (Si)
posiadający 4 elektrony
walencyjne
= 1,1
eV
Jeżeli przerwa energetyczna jest duża (E
g
> 3 eV), wzbudzenia termiczne
elektronów praktycznie nie występują i
ciało jest izolatorem.
Przykład: diament (C), dla którego E
g
=
5,6 eV.
Izolatory
E
g
= 6
eV
r
0
= 0,28 nm.
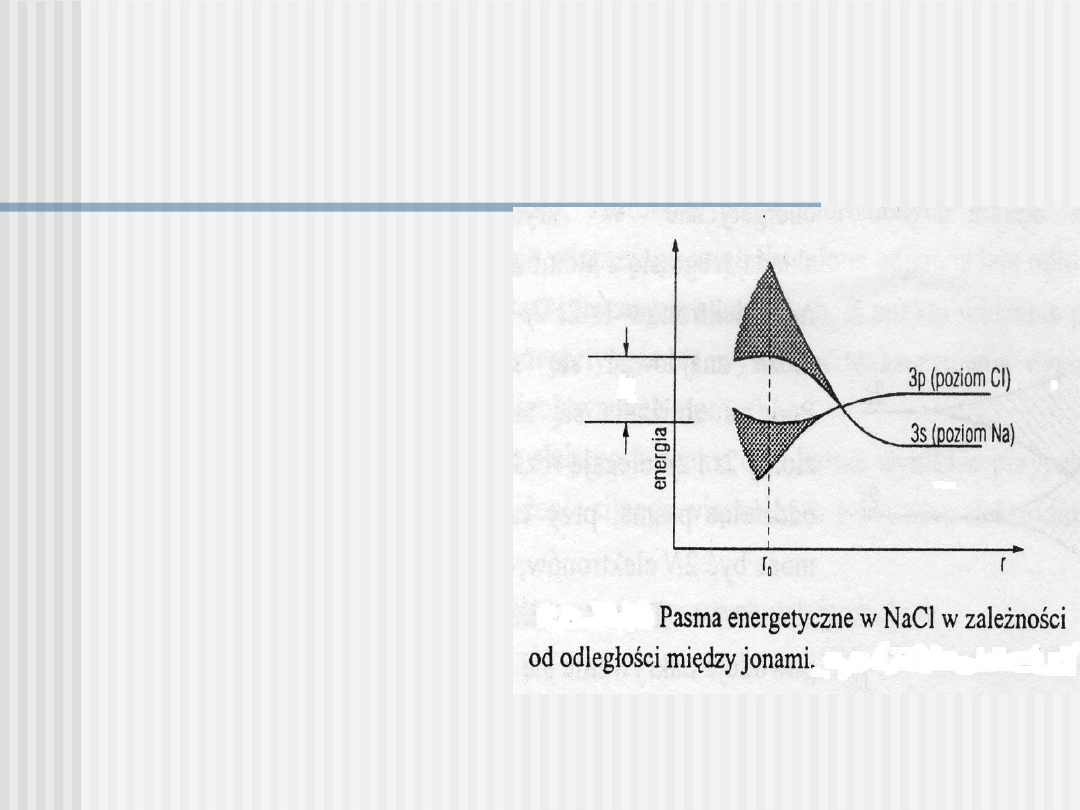
W izolowanych atomach,
poziom 3s
Na jest położony niżej niż
poziom
3p Cl.W wyniku zbliżenia
atomów,
poziom 3p Cl zajmuje
położenie niższe niż poziom
3s Na i elektrony
walencyjne Na przechodzą do
pasma 3p Cl, zapełniając
wszystkie wolne stany.
W ten sposób, pasmo 3p Cl
staje się całkowicie
zapełnionym pasmem
walencyjnym NaCl, natomiast
pasmo 3s sodu – całkowicie
pustym pasmem
przewodnictwa, przy czym
przerwa energetyczna NaCl
wynosi
E
g
= 6 eV.
Tworzenie się pasm w krysztale jonowym na przykładzie
NaCl
11
Na:
1s
2
2s
2
2p
6
3s
1
19
Cl:
1s
2
2s
2
2p
6
3s
2
3p
7
Przewodniki, półprzewodniki,
izolatory – porównanie struktur
pasmowych
eV
3
g
E
eV
3
g
E
eV
3
g
E
Meta
le
Półprzewodni
ki
Izolatory
jednowartościowe dwuwartościowe
Document Outline
Wyszukiwarka
Podobne podstrony:
Wykł 010L Struktura pasmowa ciał stałych
24 og, Studia, Pedagogika opiekuńcza i resocjalizacyjna - st. magisterskie, Pedagogika ogólna
Czynniki strukturotwórcze, STUDIA, WZR I st 2008-2011 zarządzanie jakością, Podstawy Zarzadzania
Sytuacja gospodarcza Polski przed przystąpieniem do UE(24 st PCPCMRK3MWJZG25SNBM27EBEU54KPLHIAX42LJI
PYTANIA 19. 24, st. Pedagogika ćwiczenia, pedagogika U P tematy do egzaminów 46 tematów
struktura hodów budżetu centralnego ostatnich 3 lat (6 st(1), Bankowość i Finanse
14525-zadania i struktura jednostek samorządu terytorialnego gminy powiatu województwa, st. Administ
351 Wykład SP Język strukturalny ST – Structured Text
strukturalne bariery transor i integ -24, 24
struktura-procesu-wychowania, st. Pedagogika ćwiczenia
struktury org, STUDIA, WZR I st 2008-2011 zarządzanie jakością, Podstawy Zarzadzania
Struktura społeczna i formy życia zbiorowego - St. Ossowski i J. Turowski, Teorie Społeczeństw i pr
CO TO JEST FILOZOFIA 24 ST, Inne
24 og, Studia, Pedagogika opiekuńcza i resocjalizacyjna - st. magisterskie, Pedagogika ogólna
~$st metrologia 24 pytania 13 06 06 doc
więcej podobnych podstron