W5: Obrona przed toksycznością
Mechanizmy obrony
organizmów przed
toksycznością
Paweł Brzuzan
Ekspozycja a biodostępność
Dla większości substancji chemicznych
dotarcie do krwiobiegu jest warunkiem ich
toksyczności
• drogi ekspozycji
• wnikanie do krwiobiegu
W5: Obrona przed toksycznością
Biodostępność toksykanta: wielkość jego
frakcji zdolna do wnikania do krwiobiegu
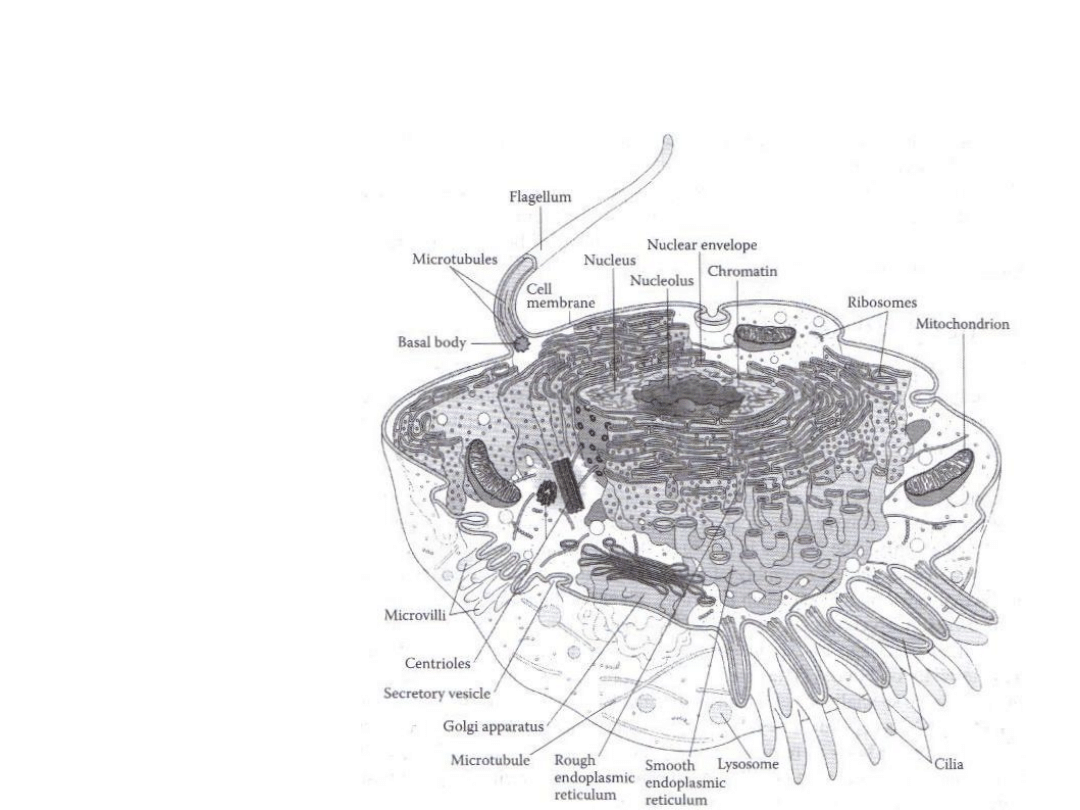
Błony komórkowe odgrywają główną rolę w
biodostępności toksykanta
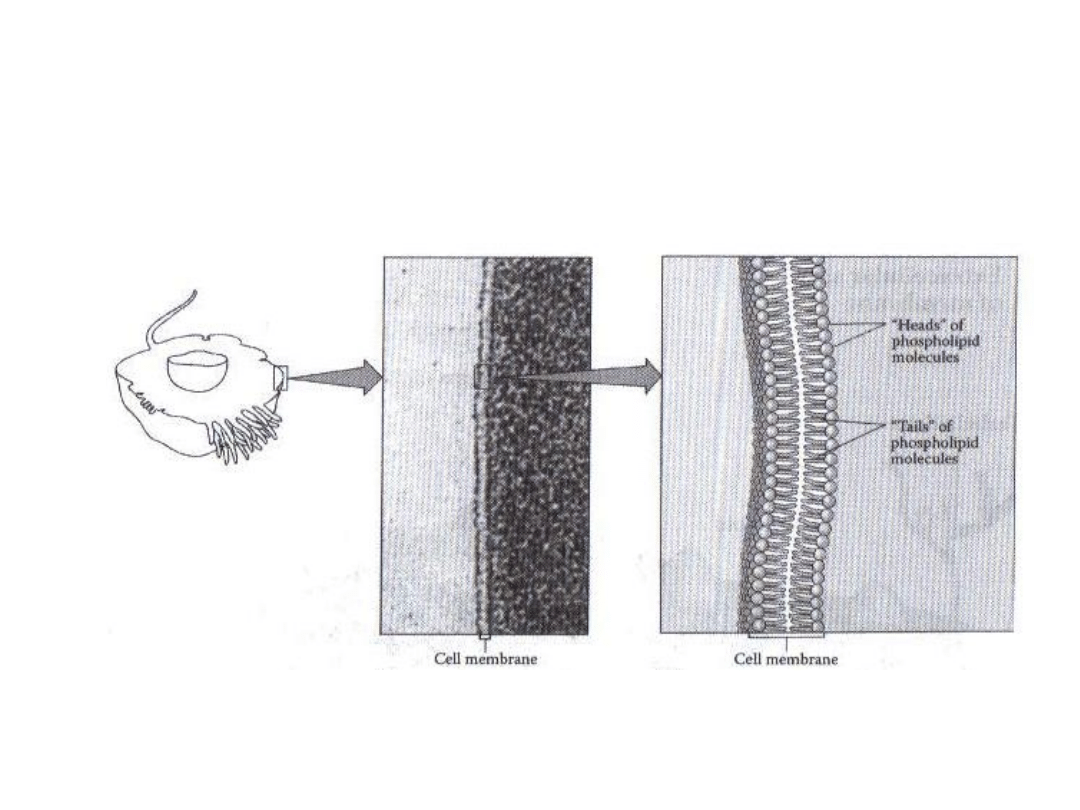
Błona komórkowa
W5: Obrona przed toksycznością
Brown 1996
Tylko molekuły małych rozmiarów (<600 Da),
pozbawione ładunku elektrycznego mogą przenikać
przez błony komórkowe
Błona komórkowa
W5: Obrona przed toksycznością
Brown 1996
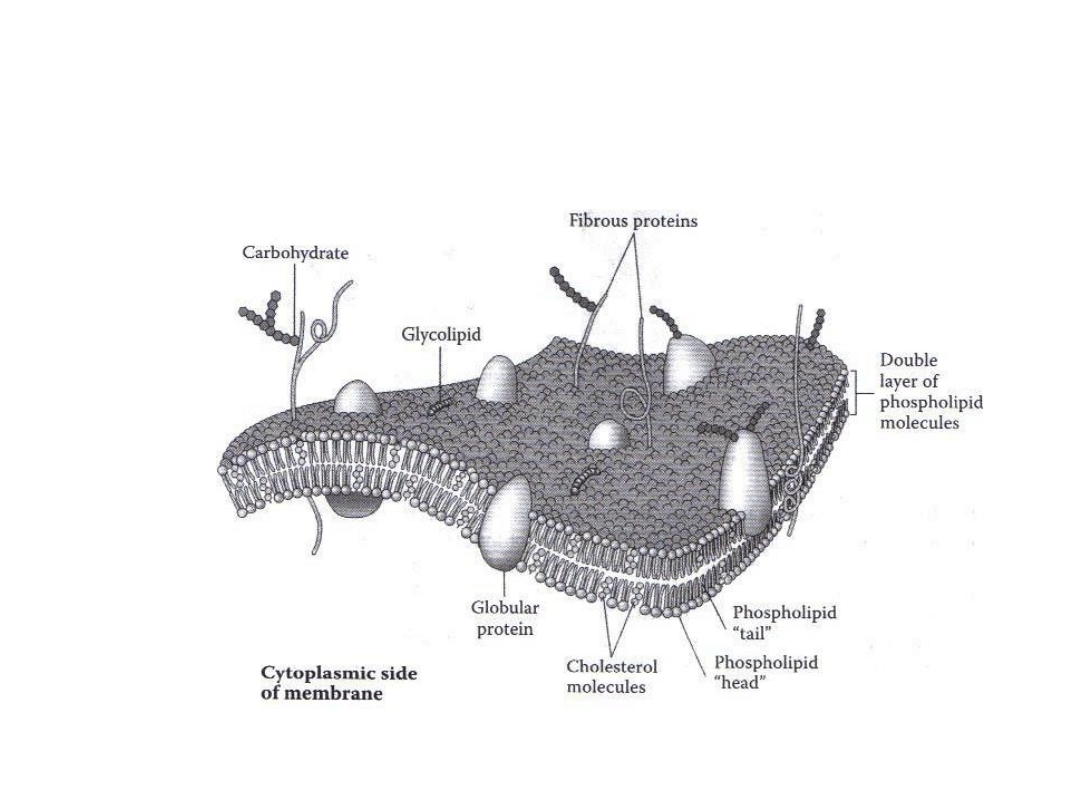
Błona komórkowa
W5: Obrona przed toksycznością
Brown 1996
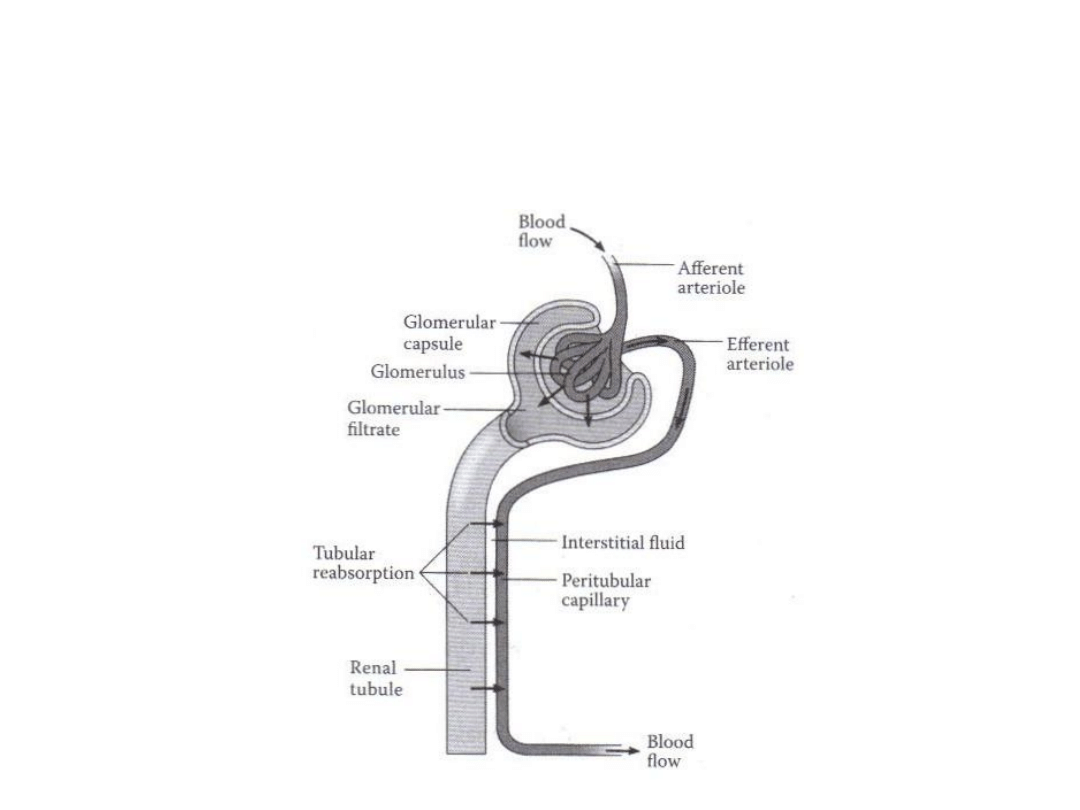
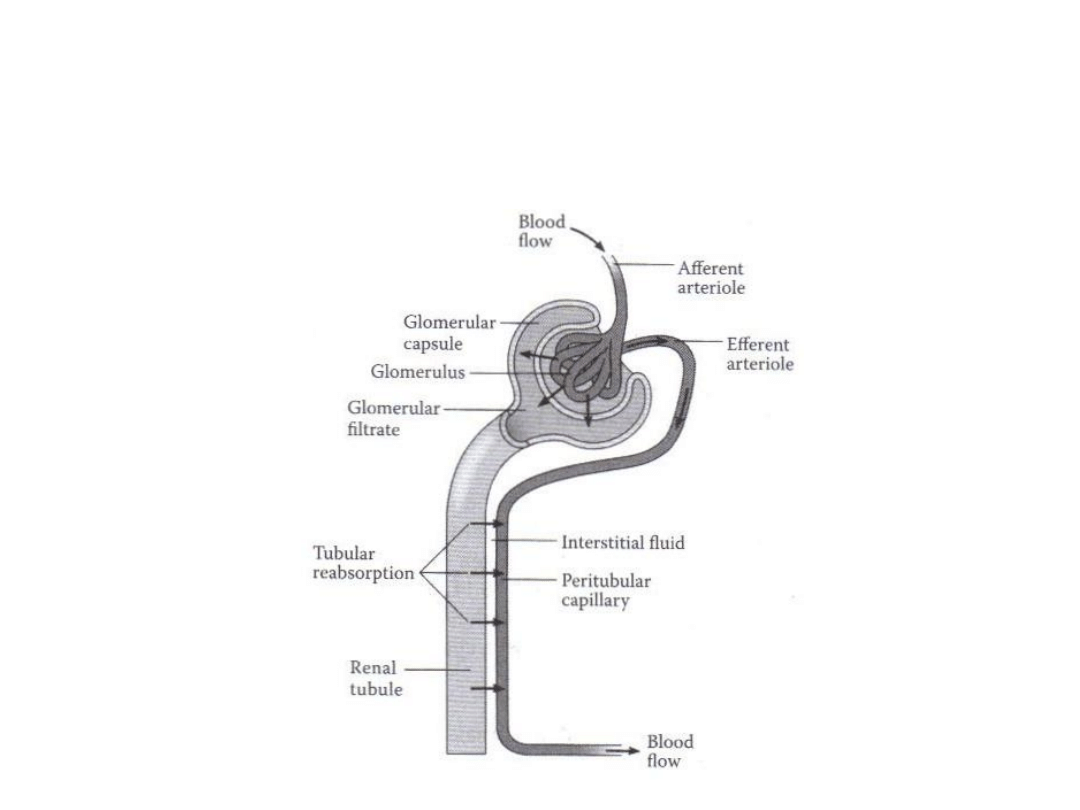
Eliminacja toksykanta przez nerki
W5: Obrona przed toksycznością
Brown 1996
Wydalanie, eliminacja , słabe zasady i
kwasy
W5: Obrona przed toksycznością
Słaby kwas łatwo traci proton, lub H
+
Słaba zasada, bez trudu przyjmuje H
+
pH to ujemny logarytm dziesiętny stężenia
H
+
Wydalanie, eliminacja , słabe zasady i
kwasy
W5: Obrona przed toksycznością
Protonacja
słabych kwasów i zasad
A
-
+ H
+
↔
AH
B + H
+
↔
BH
+
Środowisko mocno kwaśne
(niskie pH;
żołądek)
Środowisko bardziej zasadowe
(~pH=6,4;
jelita)
Deprotonacja
słabych kwasów i zasad
AH
↔
A
-
+ H
+
BH
+
↔
B + H
+
Wydalanie, eliminacja , słabe zasady i
kwasy
W5: Obrona przed toksycznością
Protonacja
słabych kwasów i zasad
A
-
+ H
+
↔
AH
B + H
+
↔
BH
+
Środowisko mocno kwaśne
(niskie pH;
żołądek)
Środowisko bardziej zasadowe
(~pH=6,4;
jelita)
Deprotonacja
słabych kwasów i zasad
AH
↔
A
-
+ H
+
BH
+
↔
B + H
+
Równanie Hendersona-Hasselbacha
log(H
+
/deH
+
)=pKa - pH
Wydalanie, eliminacja , słabe zasady i
kwasy
W5: Obrona przed toksycznością
Równanie Hendersona-Hasselbacha
log(H
+
/deH
+
)=pKa - pH
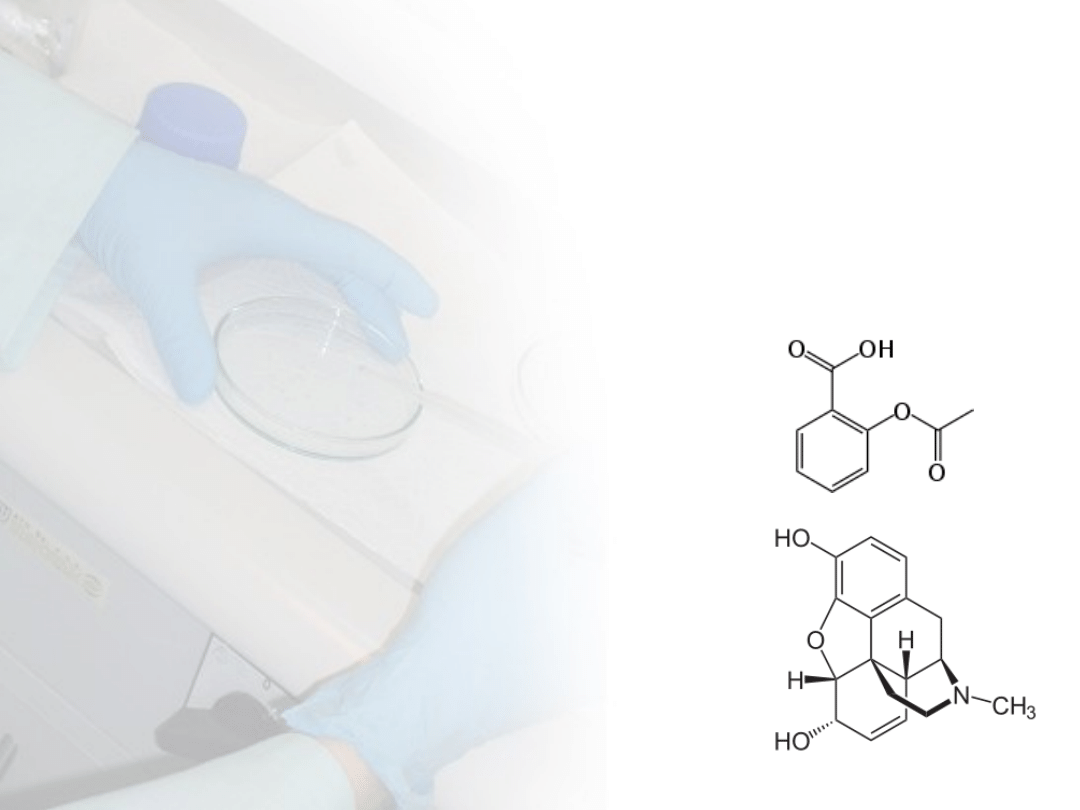
Aspiryna
jest słabym kwasem (pKa=3,5).
W żołądku (pH=1) protonowanych
molekuł kwasu salicylosiarkowego (AH)
jest 10
2,5
= 316 razy więcej niż
nieprotonowanych (A
-
).
Aspiryna
w
formie protonowanej jest wchłaniana z
żołądka.
Morfina
jest słabą zasadą (pKa=7,9). W
żołądku (pH=1) protonowanych)
molekuł morfiny (BH
+
) (z ładunkiem jest
10
6,9
= 7 943 282 razy więcej niż
nieprotonowanych, bez ładunku (B).
Morfina
nie jest dostępna z żołądka.
Gdy morfina dociera do jelita cienkiego
(pH=6,4) przewaga molekuł morfiny
protonowanej spada do 32 do 1.
Eliminacja toksykanta przez nerki
W5: Obrona przed toksycznością
Brown 1996
Protonacja morfiny
(chlorek amonu)
B + H
+
↔
BH
+
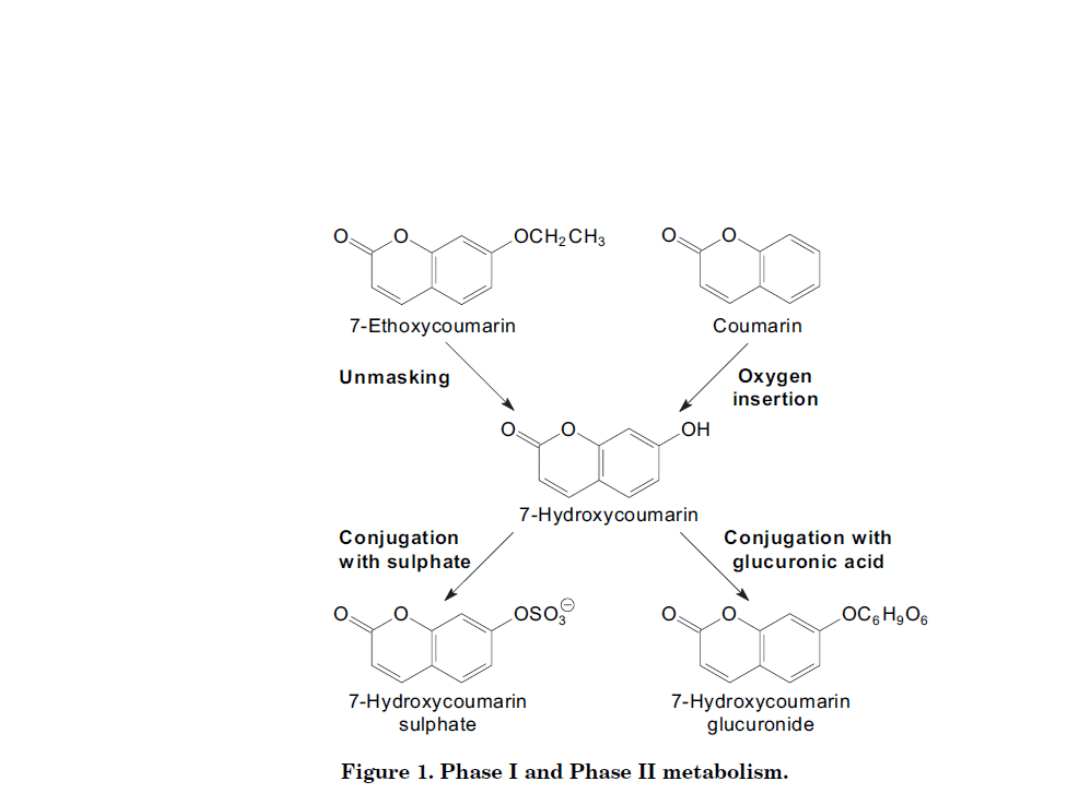
Biotransformacje
W5: Obrona przed toksycznością
Ioannides 2007
Biotransformacje
W5: Obrona przed toksycznością
Brown 1996
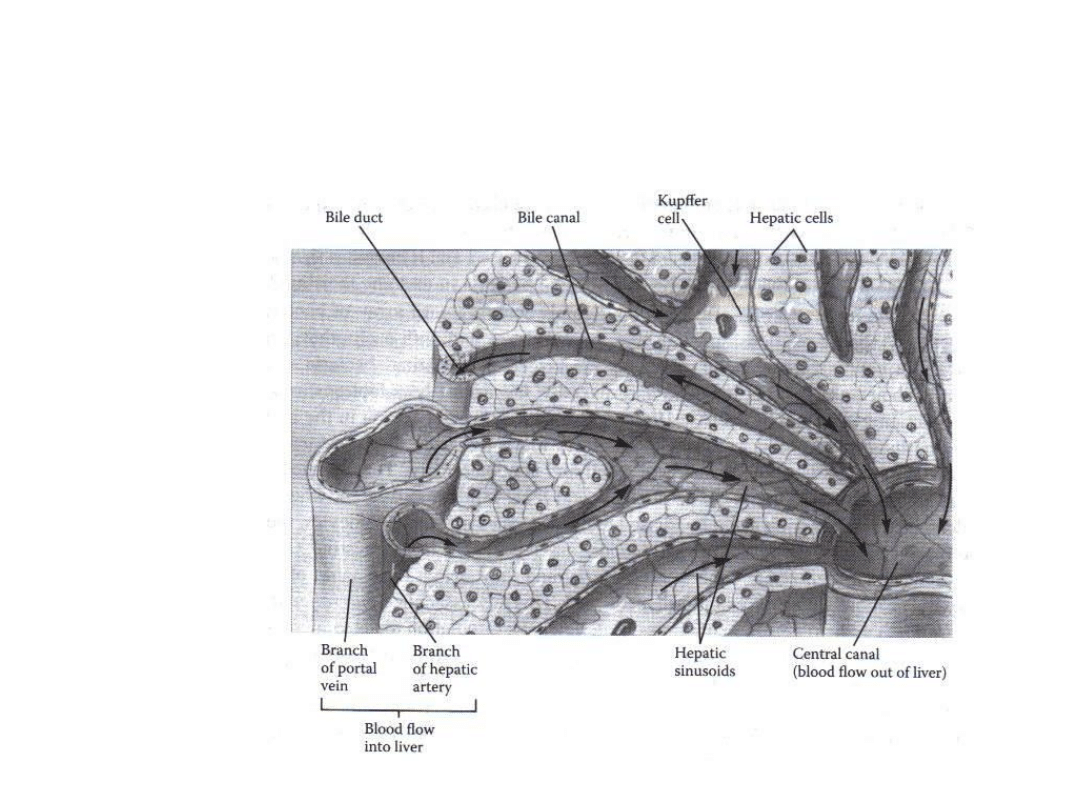
Biotransformacje
W5: Obrona przed toksycznością
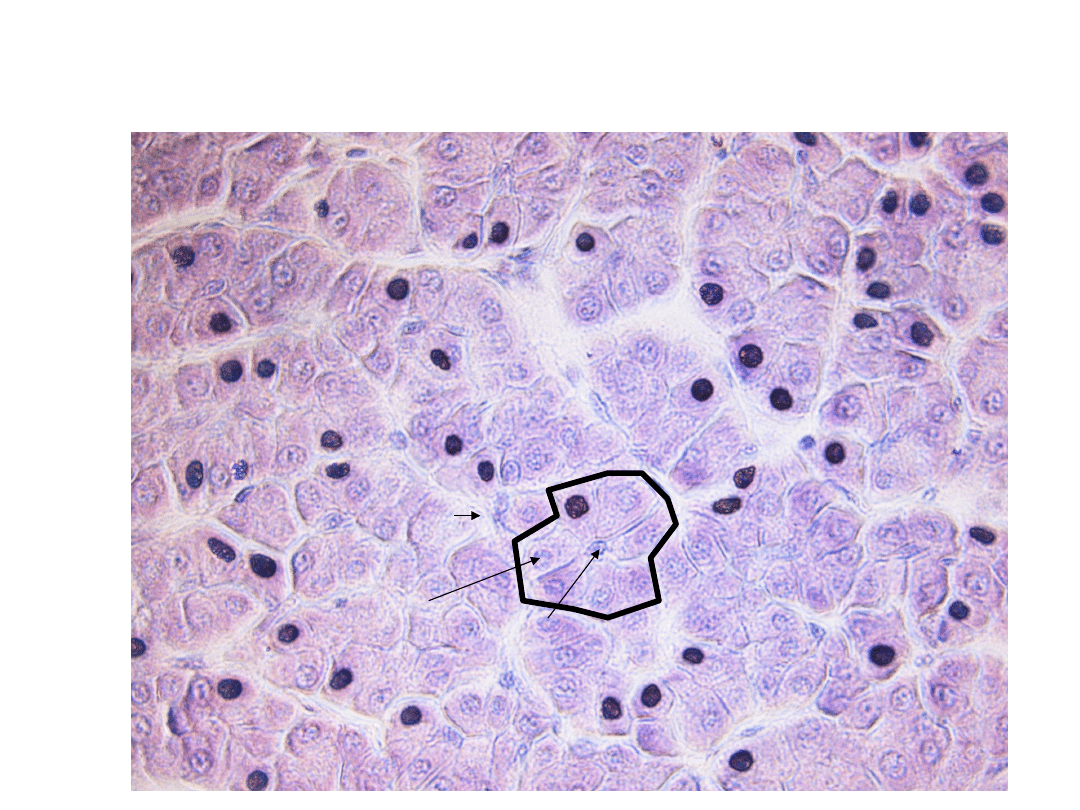
Wątroba pstrąga
tęczowego (H&E)
hepatocyt
kanalik żółciowy
sinusoida

Biotransformacje
W5: Obrona przed toksycznością
Liver Sieve Research Team
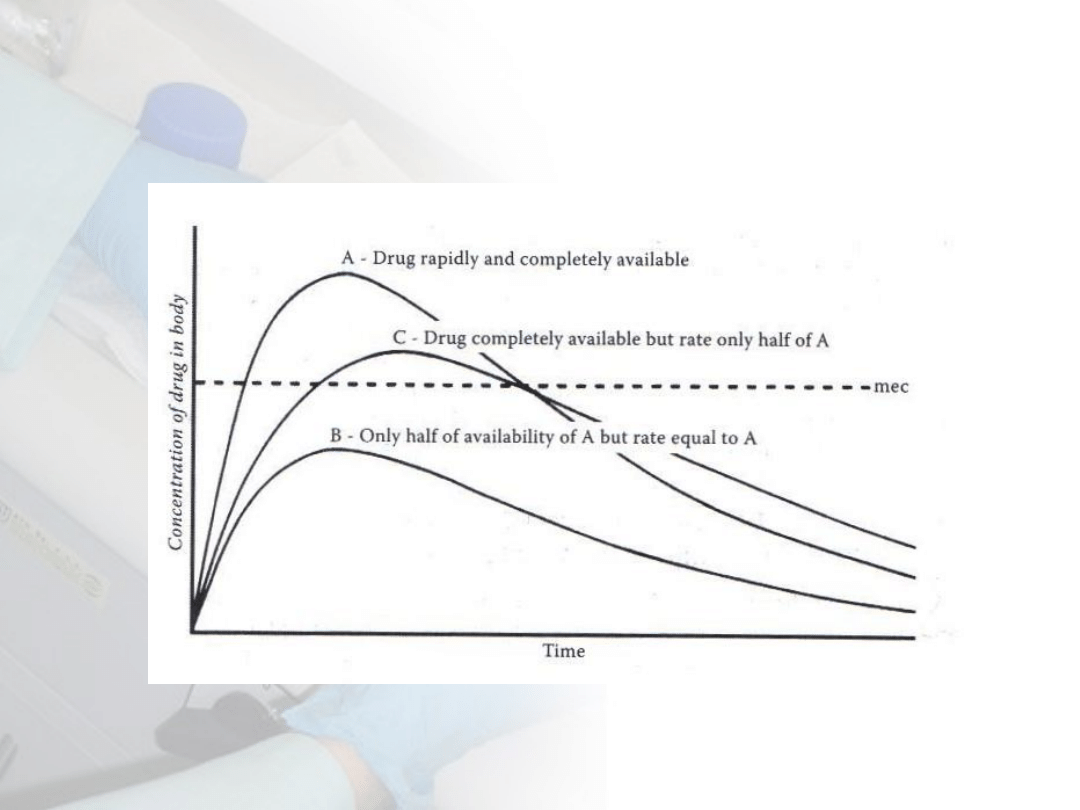
Kinetyka ekspozycji na 1 dawkę
toksykanta
W5: Obrona przed toksycznością
Katzung 1992
Kinetyka ekspozycji na 1 dawkę
toksykanta
W5: Obrona przed toksycznością
Katzung 1992
Koncentracja toksykanta zależy od
wielkości procesów pobierania,
dystrybucji i eliminacji
dystrybucja
eliminacja
pobieranie
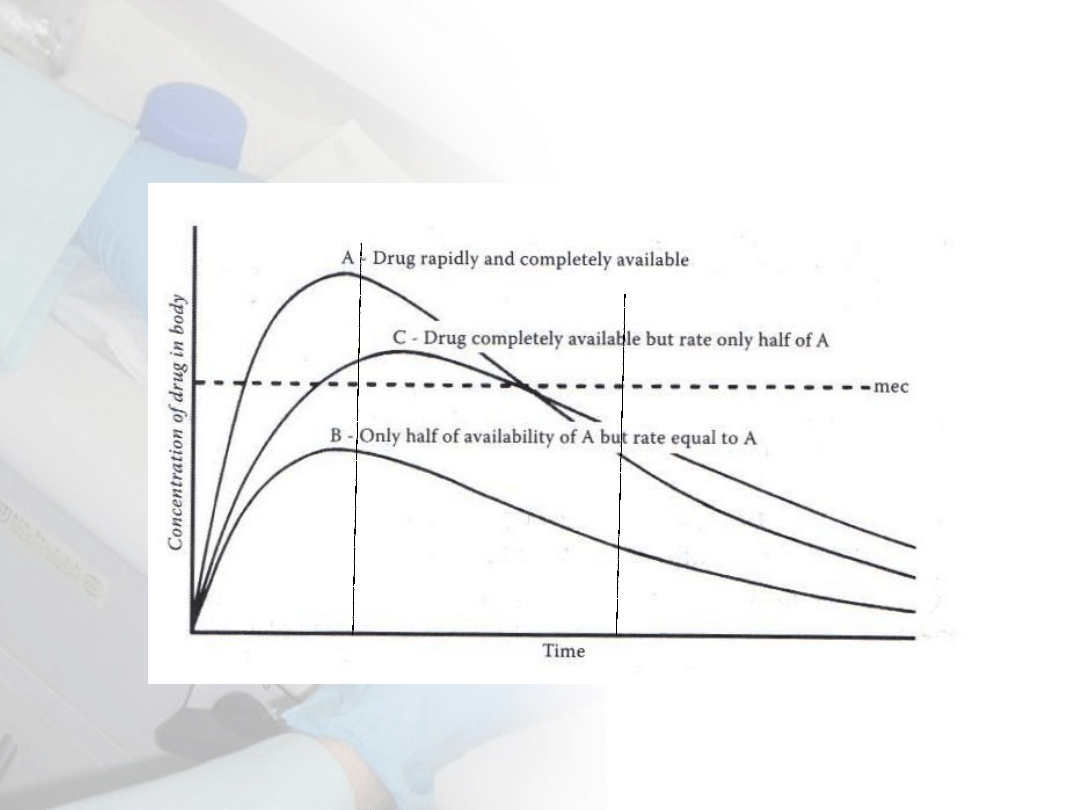
Kinetyka ekspozycji na 1 dawkę
toksykanta
W5: Obrona przed toksycznością
Katzung 1992
Chlordiazepoksyd
Kinetyka ekspozycji na 1 dawkę
toksykanta
W5: Obrona przed toksycznością
Katzung 1992
Chlordiazepoksyd
dystrybucja
elim
inac
ja
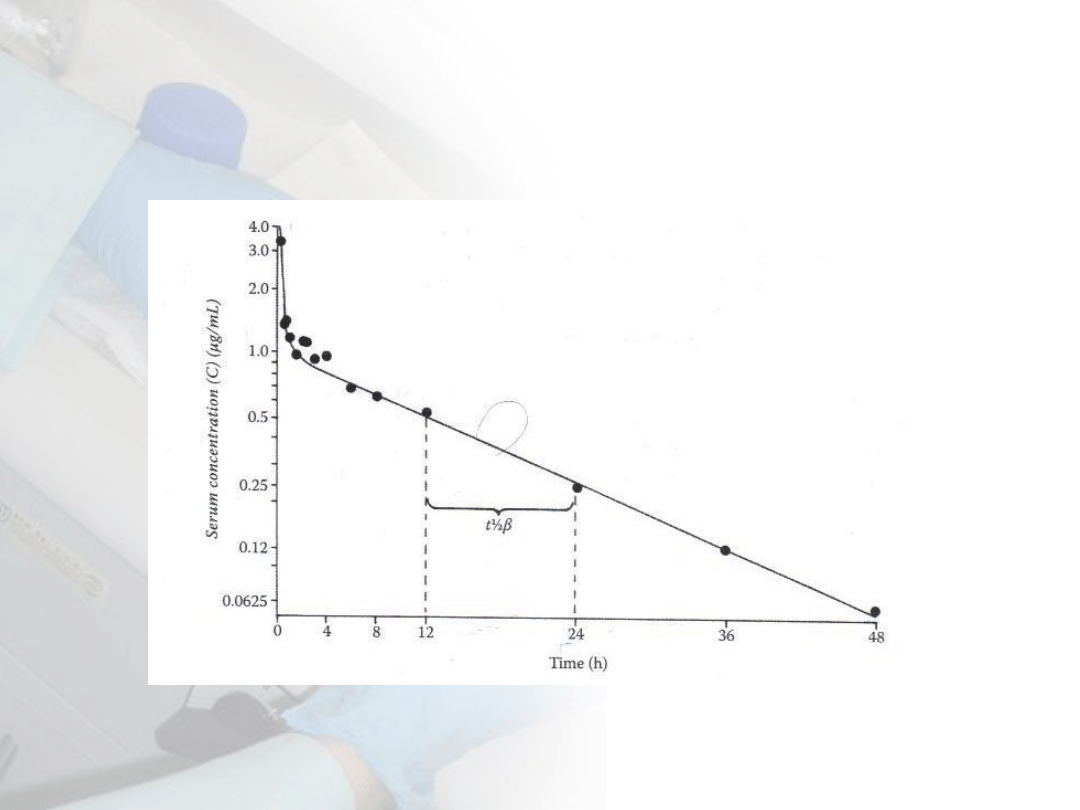
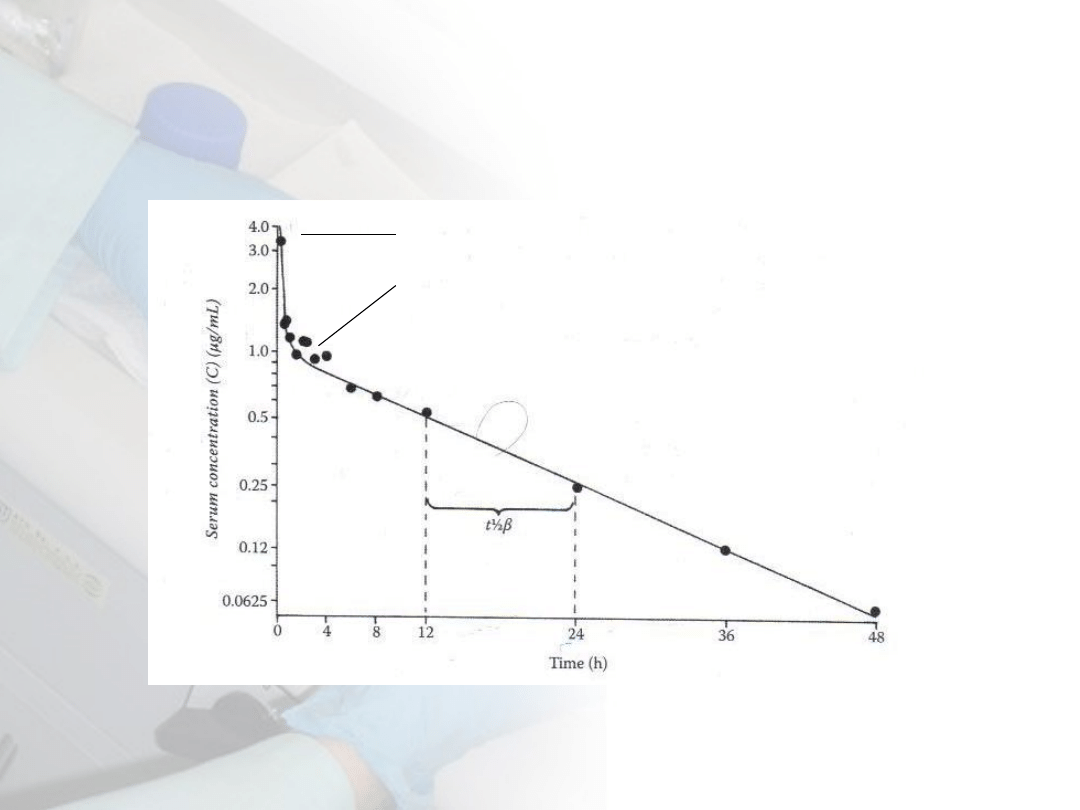
Tempo eliminacji toksykanta (kinetyka 1
rzędu)
C
t
=C
0
e
-kt
W5: Obrona przed toksycznością
C
t
/C
0
=e
-kt
lnC
t
/C
0
= -kt
ln0,5
= -kt
1/2
t
1/2
= 0,693/k
Pytania kontrolne
1. Zdefiniuj następujące określenia: droga ekspozycji,
biodostępność, eliminacja, wydalanie.
3. Jakie jest stężenie jonów wodorowych przy pH=4,3?
pH =8,7?
5. Jaka jest podstawowa cecha reakcji biotransformacji I
fazy? Jakie znasz głowne klasy enzymów uczestniczących
w reaklcjach I fazy biotransformacji? Gdzie są
zlokalizowane te enzymy? Na czym polagają reakcje
enzymatyczne II fazy biotransformacji i gdzie
przebiegają?
6. Stała eliminacji k dla toksykanta X k
x
=3,9/dzień, a dla
toksykanta Y k
y
=0,01/dzień. Ile wynoszą czasy
półtrwania w organizmie substancji X i Y?
4. Jaka część molekuł aspiryny występuje w formie bez
ładunku przy pH=7,5? Jak zmieni się proporcja przy
pH=8,5?
2. Opisz strukturę błony białkowo-lipidowej.
W5: Obrona przed toksycznością
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
Wyszukiwarka
Podobne podstrony:
Molecular Toxicology 8
Molecular Toxicology 12 13
Molecular Toxicology 14
Molecular Toxicology 11
Molecular Toxicology 9
Molecular Toxicology 4
Molecular Toxicology 3
Molecular Toxicology 2
Molecular Toxicology 6
Molecular Toxicology 1
Molecular Toxicology 7
Molecular Toxicology 10
Molecular Toxicology 8
Molecular Toxicology 12 13
Molecular evolution of FOXP2, Nature
[pub year] Dorne J L C M Fink Gremmels J Toxicol Appl Pharmacol
Molecular Self Assembly
2012 2 MAR Common Toxicologic Issues in Small Animals
Toxicology of Melatonin
więcej podobnych podstron