
1
Krystalizacja polimerów
POLITECHNIKA ŁÓDZKA
POLITECHNIKA ŁÓDZKA
WYDZIAŁ INŻYNIERII PROCESOWEJ I OCHRONY ŚRODOWISKA
WYDZIAŁ INŻYNIERII PROCESOWEJ I OCHRONY ŚRODOWISKA
Prof. dr hab. Maria Mucha
POLIMERY
8
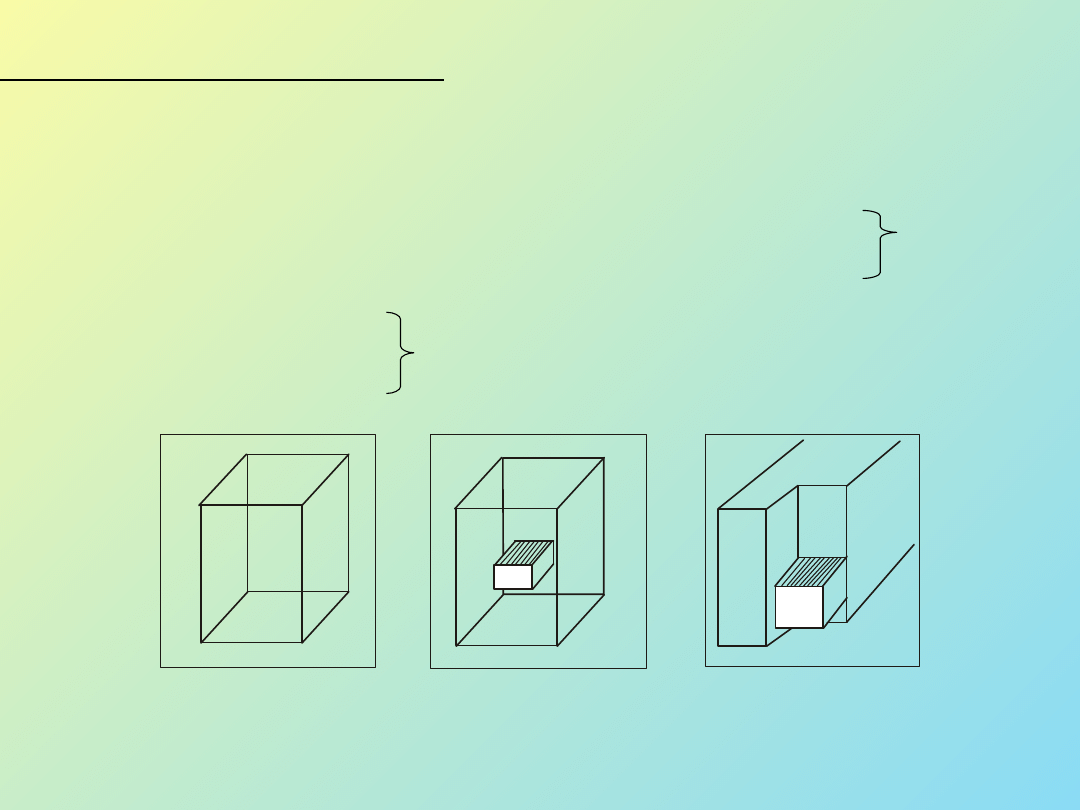
2
Krystalizacja polimerów:
1.Proces nukleacji - powstanie termodynamicznie stabilnych zarodków,
2.Proces wzrostu fazy krystalicznej.
Nukleacja homogeniczna (jednorodna);
I podział.
Nukleacja heterogeniczna (niejednorodna), (na domieszkach, granicach);
a) nukleacja pierwotna,
b) nukleacja wtórna,
II podział.
c) nukleacja trzeciorzędowa.
a )
b )
c )
a
b
l
a
b
l
a
b
l
Rys. 1 Graficzna prezentacja nukleacji
3
nukleacja termiczna, (zachodzi w czasie)
III podział.
nukleacja atermiczna, (wszystkie zarodki powstają natychmiast)
Krystalizacja to proces termodynamiczny:
w procesie krystalizacji następuje zmiana entalpii swobodnej G;
Entalpia swobodna:
– właściwa energia
powierzchniowa,
A – powierzchnia kryształu,
G
v
– objętościowa entalpia swobodna,
G = G
kr
– G
st
G = H - TS
G
kr
=G
v
+ A
w temperaturze topnienia Tm G =0
Proces krystalizacji zachodzi poniżej Tm G <0
G = G
v
+ A
zmiana entalpii w
zmiana entalpii związana
zmiana entalpii związana
procesie krystalizacji
z różnicą objętości
z powstaniem
zarodka
(tzw. objętościowa)
po wszystkich
powierzchniach
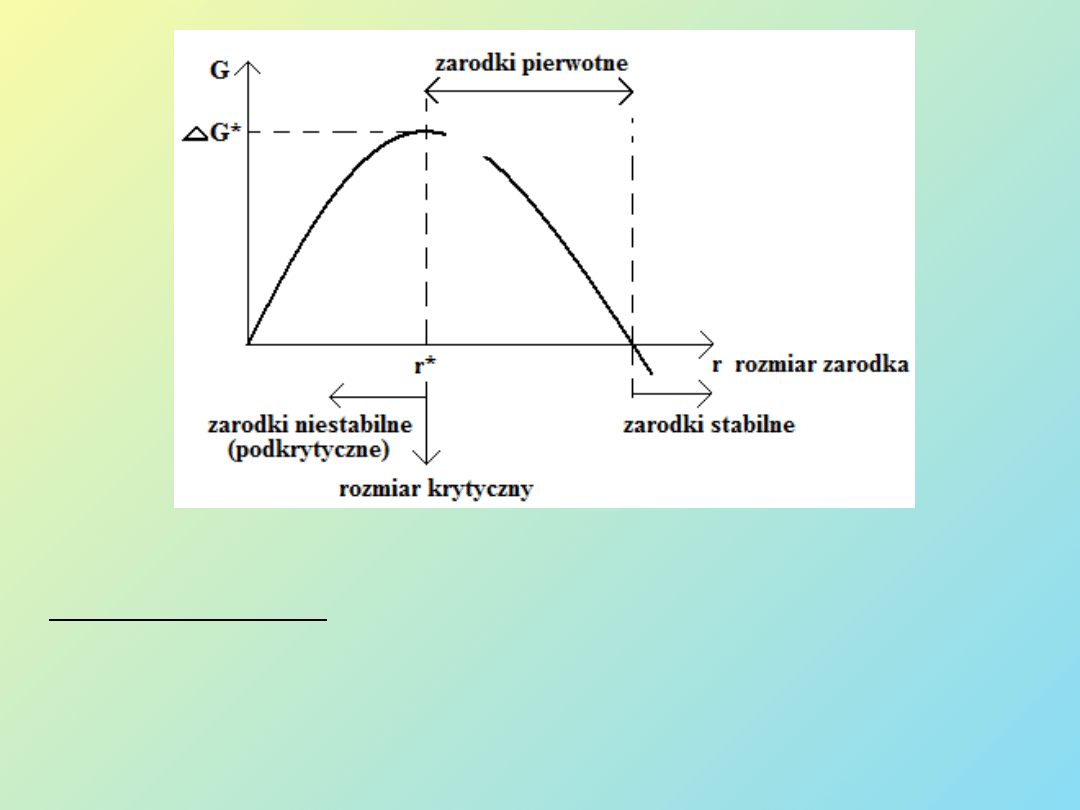
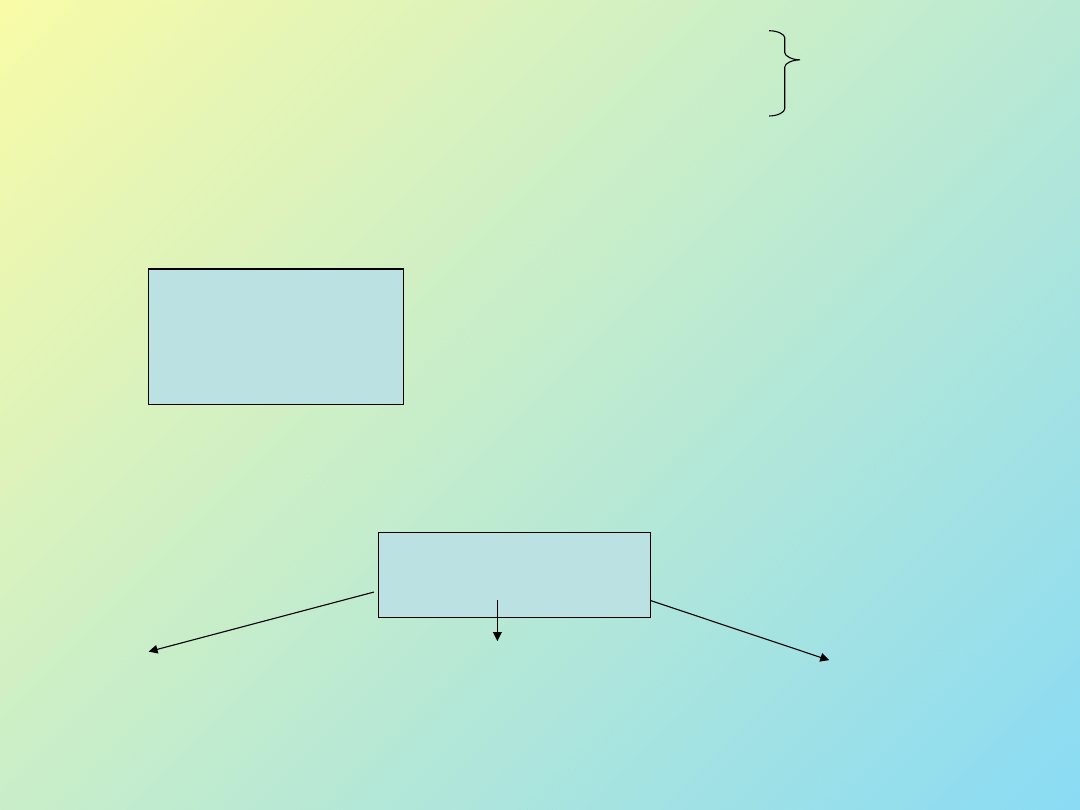
4
Rys. 2 Zależność
G od rozmiaru zarodka.
Proces nukleacji
Przyczyna powstania zarodków - termiczne fluktuacje konformacyjne
łańcuchów w stopie lub roztworze prowadzące do ciągłego tworzenia
się i rozpadania uporządkowanych ugrupowań cząsteczek.
(nadkrytycz
ne)
5
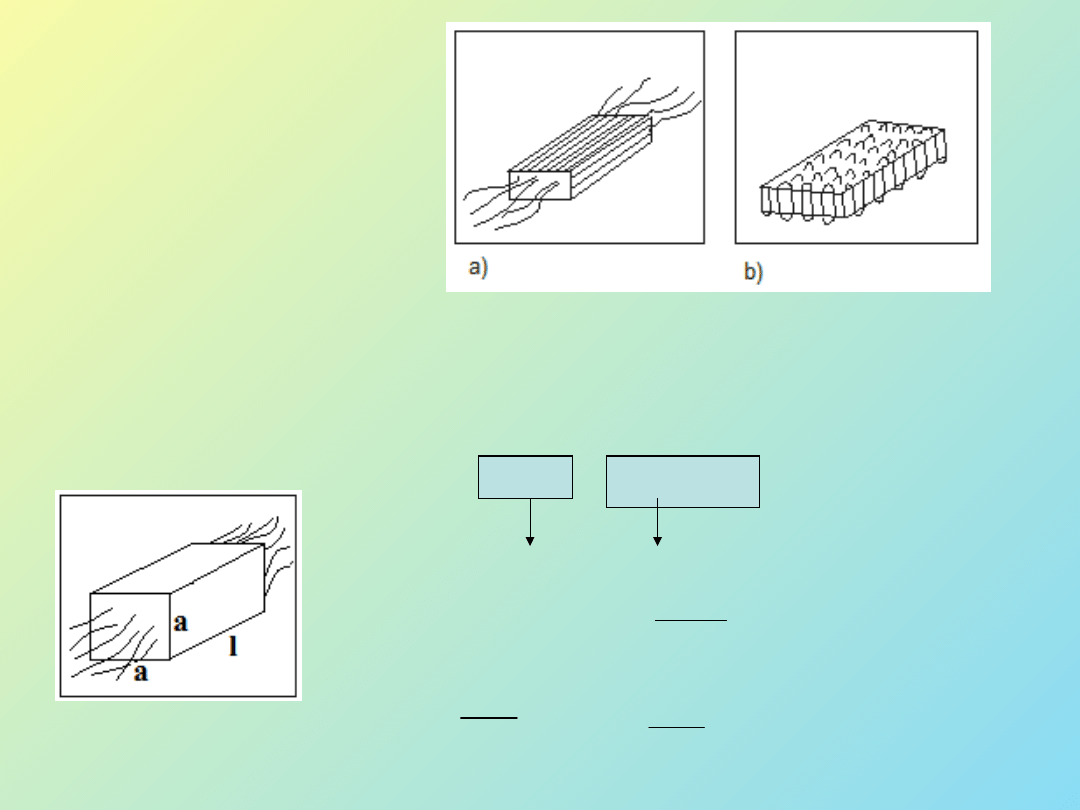
Kształty zarodków:
• kulisty (teoria
Gibbsa),
• prostopadłościenny,
• cylindryczny.
Rys. 3 Kształty zarodków w
polimerach:
a) micelarny (frędzlowaty), b)
lamelarny.
Pierwotna nukleacja, homogeniczna (prostopadłościenny zarodek micelarny);
G = -a
2
lg
f
+ 4al + 2a
2
e
G
v
A
dla rozmiaru krytycznego:
0
di
)
G
(
d
l
a
i
G
G
,
,
*
f
g
b
a
4
*
*
i
f
e
g
l
4
*
rozmiar krytyczny
6
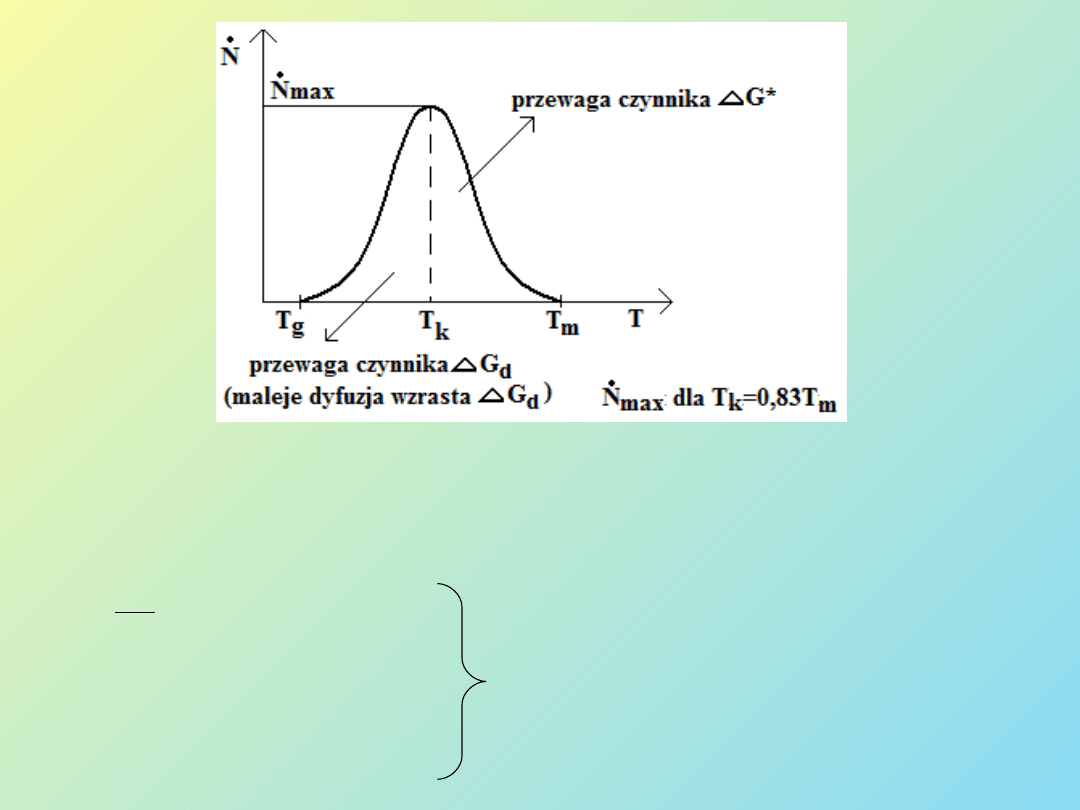
– równowagowa (termodynamiczna) temperatura topnienia,
T – przechłodzenie, różnica pomiędzy temperaturą topnienia, a
temperaturą np. krystalizacji,
h
v
– zmiana entalpii równa ciepłu topnienia (pod stałym ciśnieniem).
podstawiając
*
*
l
i
a
do
G
otrzymujemy
:
2
2
)
(
32
*
v
e
g
G
g
v
= h
v
–
TS
v
O
m
v
v
T
h
S
T
T
T
m
przechłodzenie
Wtedy:
O
O
O
O
m
v
m
m
v
m
v
v
v
T
T
h
T
T
T
h
T
h
T
h
g
gdzie:
o
m
T
7
Prawdopodobieństwo powstania zarodka w danym rozmiarze w stałej
objętości i energii
jest zgodne z prawem Boltzmanna
– liczba zarodków powstających w jednostce objętości i czasu,
– liczba segmentów (merów) biorących udział w nukleacji,
– temperatura krystalizacji,
– stałe Boltzmana i Plancka,
– temperatura zredukowana,
– molekularne ciepło parowania
– zmiana entalpii swobodnej dla powstania krytycznych
rozmiarów zarodka,
– zmiana entalpii związana ze swobodną energią aktywacji w
procesie dyfuzji
krystalizującego elementu przez powierzchnię granic
fazowych ciecz –
kryształ.
W
k
S
ln
)
kT
G
exp(
)
k
S
exp(
P
Szybkość nukleacji:
kT
)
G
*
G
(
exp
h
N
d
kT
n
N
h
kT
*
G
d
G
h
k
T
n
,
v
h
2
v
2
m
e
2
d
)
T
(
h
kT
T
32
kT
G
exp
h
n
kT
N
8
Rys. 4 Zależność szybkości nukleacji od temperatury
Proces wzrostu fazy krystalicznej. Kinetyka krystalizacji – równanie Avramiego
Szybkość przemiany fazy ciekłej w stałą.
V
V
V
k
dt
dV
o
)
(
o
V
objętość fazy ciekłej w t=0
V
objętość fazy ciekłej w t
V
V
o
k – stała szybkości
objętość fazy krystalicznej
9
3
t
N
a
V
V
o
wzrost trójwymiarowy
2
t
N
a
V
V
o
wzrost dwuwymiarowy
a – czynnik kształtu,
n – wykładnik czasowy,
– szybkość nukleacji.
1
n
o
t
N
a
V
V
ogólnie:
N
Po scałkowaniu:
o
V
V
n
Kt
e
X
1
równanie Avramiego
X – stopień krystaliczności,
1-X – udział fazy ciekłej,
K – stała krystalizacji;
n
N
a
k
K
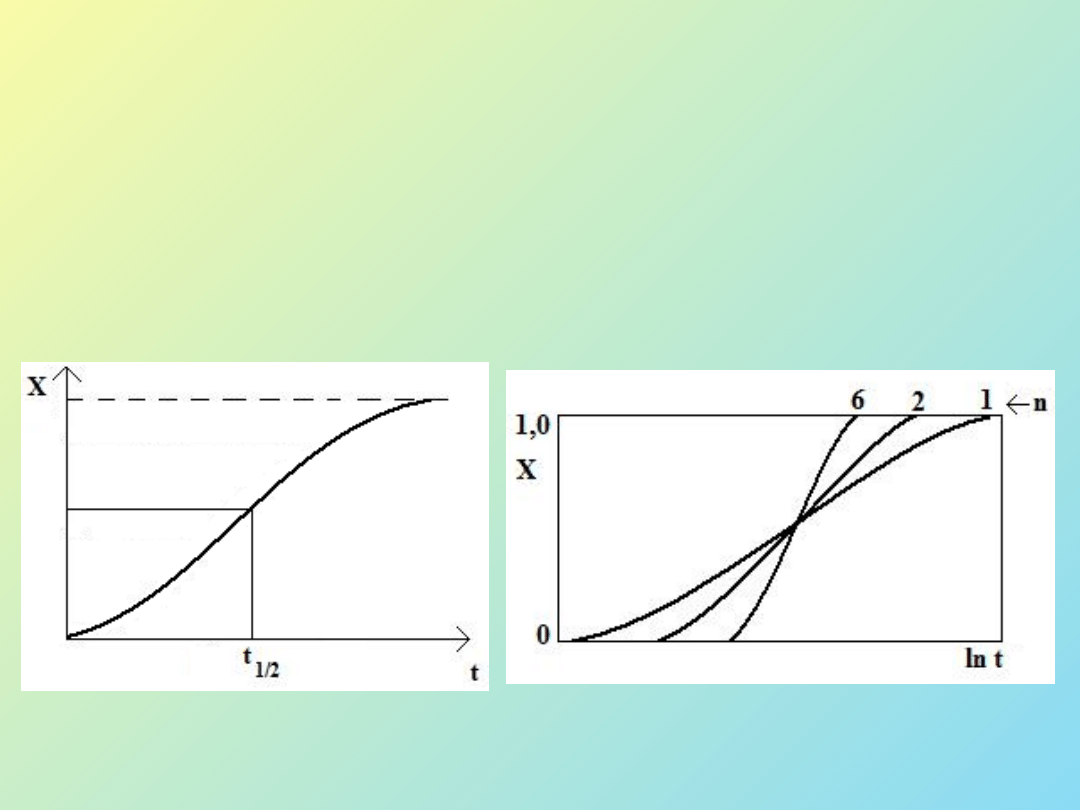
10
Rys. 5 Zależność stopnia krystaliczności od czasu
Równanie jest spełnione dla następujących założeń:
1. proces nukleacji jest I-go rzędu,
2. szybkość wzrostu jest stała,
3. gęstość krystalitów jest stała,
4. zarodki są rozmieszczone statystycznie,
5. brak nukleacji wtórnej.
Krzywe procesu krystalizacji:
2
/
1
t
- połówkowy czas krystalizacji
Rys. 6 Stopień krystaliczności X od ln t,
wpływ n na przebieg krzywej.
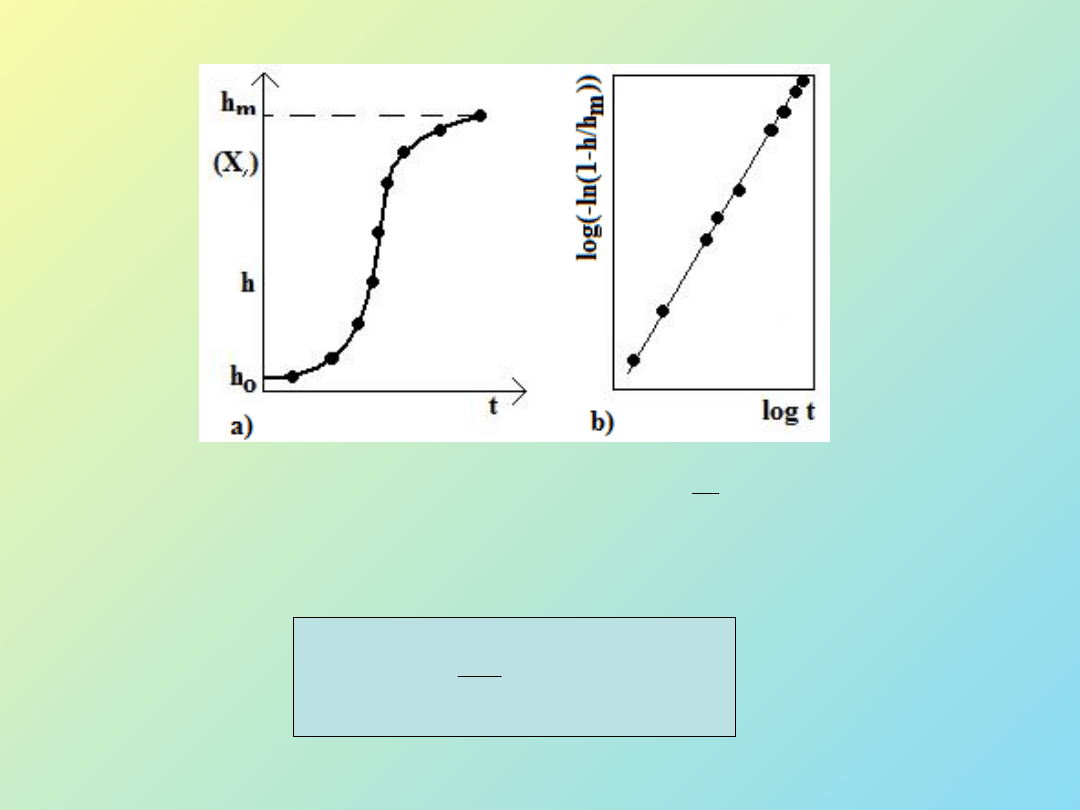
11
Experyment:
Rys. 7 a) Wykres h
m
od czasu t oraz b)
m
h
h
1
ln
log
od log t.
Eksperymentalne wyznaczanie k,n z zalezności:
logt
n
logK
h
h
1
ln
log
m
12
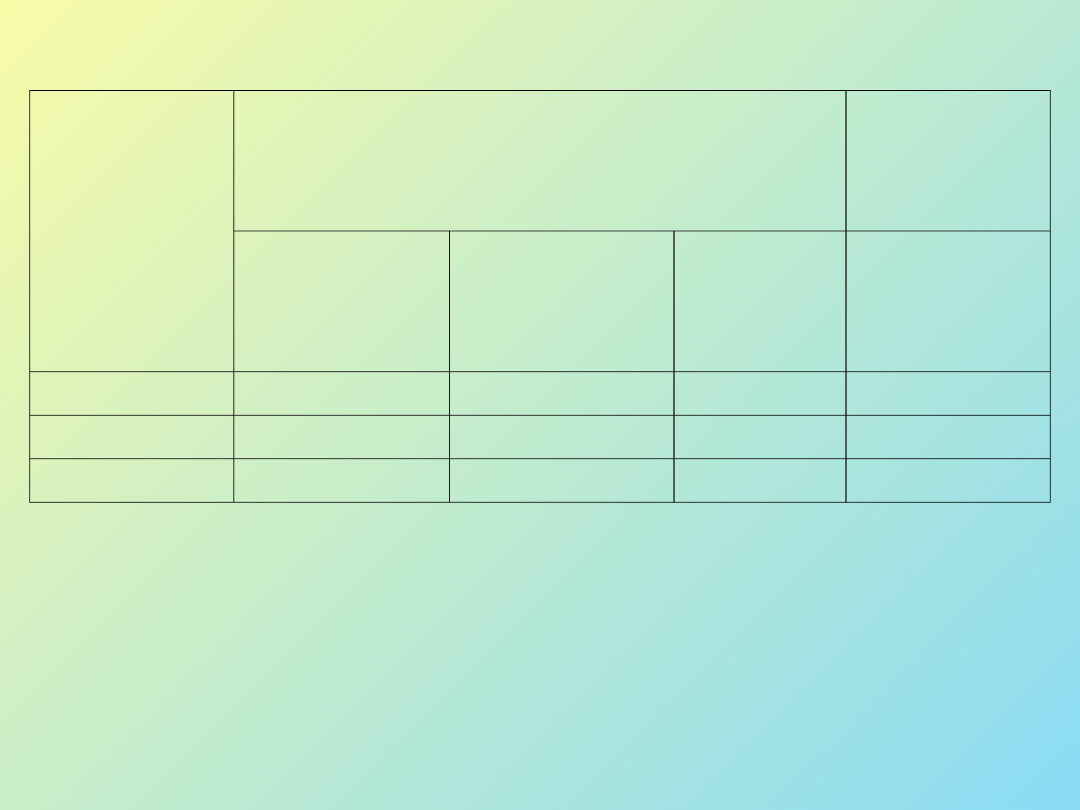
Wartości współczynnika n:
Wymiarowo
ść
wzrostu
kryształów
Nukleacja
Wzrost
kontrolowa
ny
dyfuzją
homogenicz
na
termiczna
heterogenicz
na
atermicz
na
3
4
3 < n < 4
3
5/2
2
3
2 < n < 3
2
2
1
2
1 < n < 2
1
3/2
Document Outline
Wyszukiwarka
Podobne podstrony:
06 Podstawy syntezy polimerówid 6357 ppt
2009 04 08 POZ 06id 26791 ppt
08 Prototypowanie oprogramowaniaid 7587 ppt
11 Fizyczne aspekty utleniania polimerówid 12417 ppt
08 Oświadczenie woliid 7465 ppt
08 kompresja orogenyid 7583 ppt
08 Teoria Hollandaid 7523 ppt
08 Funkcje rekurencjaid 7257 ppt
08 ZAPALENIA (2)id 7290 ppt
10 Degradacja polimerówid 10811 ppt
07 Masa cząsteczkowa polimerówid 6896 ppt
08 ognisko epidemiczeid 7586 ppt
11 polimeryid 12236 ppt
08 Stacje elektroenergetyczneid 7511 ppt
08 transakcje i blokadyid 7590 ppt
08 E Wybrane problemyid 7573 ppt
08 Pomoc psychologicznaid 7484 ppt
08 Kontrakt Ofertaid 7432 ppt
więcej podobnych podstron