

Aktywność enzymów
Szybkość reakcji nie zawsze jest
proporcjonalna do stężenia enzymu. Mierząc
szybkość reakcji enzymatycznej nie ocenia
się bezpośrednio stężenia enzymu, lecz
jego aktywność w warunkach badania.
Szybkość reakcji enzymatycznej, a co za
tym idzie i aktywność enzymu jest zmienna i
zależna od wielu czynników chemicznych i
fizycznych, mogących przyspieszać lub
hamować reakcję.

Aktywatory i inhibitory
reakcji enzymatycznej
AKTYWATORY
INHIBITORY
•Uczynniają enzymy
lub zwiększają ich
aktywność
•Jony metali
•Związki
wielkocząsteczkowe
•Małocząsteczkowe
związki organiczne
•Zmniejszają
szybkość reakcji
enzymatycznej
•Odwracalnie bądź
nieodwracalnie
hamują aktywność
enzymów


INDUKCJA - Umożliwia syntezę określonych
enzymów wyłącznie w obecności
odpowiedniego substratu lub jego
strukturalnego analogu
REPRESJA - Zahamowanie syntezy enzymów
pod wpływem nadmiernej ilości produktów
reakcji

Regulacja aktywności
enzymów Eucariota -
TRANSKRYPCJA
Transkrypcja - proces enzymatycznej syntezy RNA
na matrycy DNA.
Białka regulatorowe
Regulacja „w cis”, regulacja „w trans”

Białka regulatorowe
Są to inne niż podstawowe czynniki
transkrypcyjne oddziaływujące z polimerazą RNA.
Zdolne do przyłączenia do DNA, mogą regulować
poziom transkrypcji dodatnio lub ujemnie.
-domeny wiążące DNA,
-domeny odpowiedzialne za dimeryzację,
-domeny transaktywujące
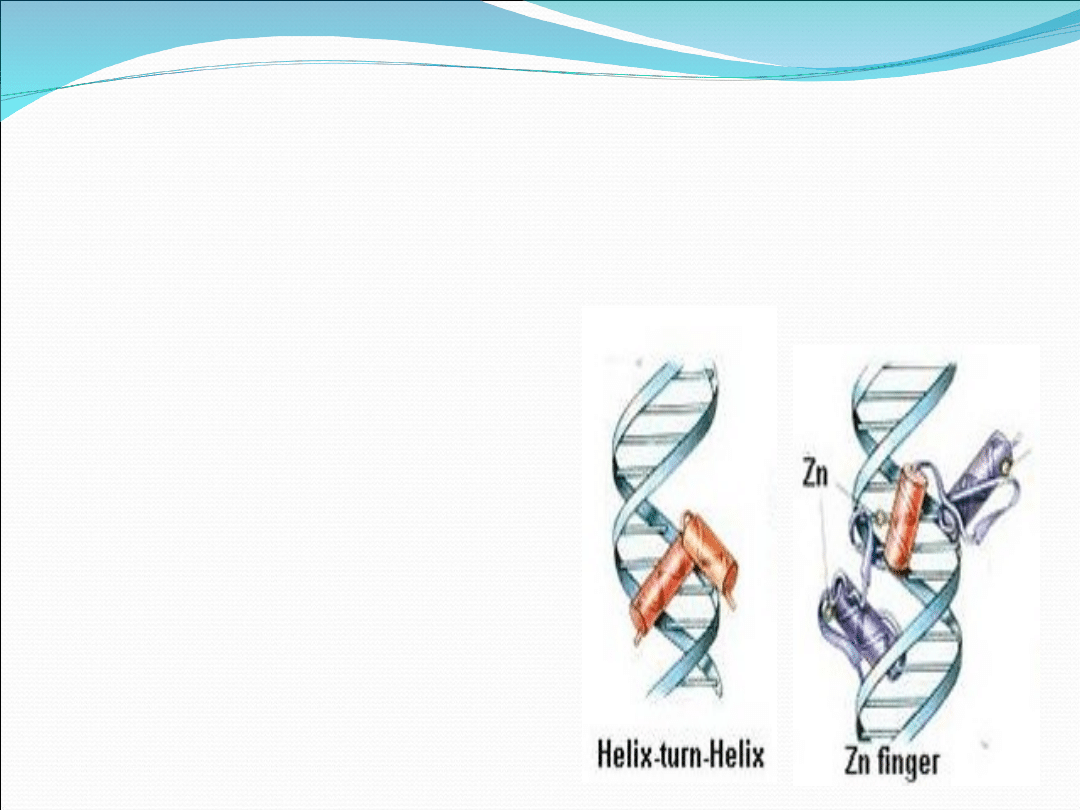
Domeny wiążące DNA i opdowiedzialne za
dimeryzację zawierają struktury białkowe
zwane motywami:
-motyw „helisa-zwrot-helisa”,
-motyw „palca cynkowego”,
-motyw „helisa-pętla-helisa”

Regulacja aktywności
enzymów Eucariota -
TRANSLACJA
Translacja - jest drugim (po transkrypcji)
procesem w biosyntezie enzymów.
Powstawanie łańcucha polipeptydowego
sterowane jest przez sekwencję mRNA.
modyfikacja czynników inicjacji
fosforylacja
acetylacja
glikolizacja

Regulacja aktywności
enzymów Procariota
Na poziomie transkrypcji -
poprzez regulację
liczby wytworzonych cząsteczek mRNA
Na poziomie translacji - przez regulację
liczby kopii łańcuchów polipeptydowych
syntetyzowanych z wykorzystaniem
konkretnej cząsteczki mRNA
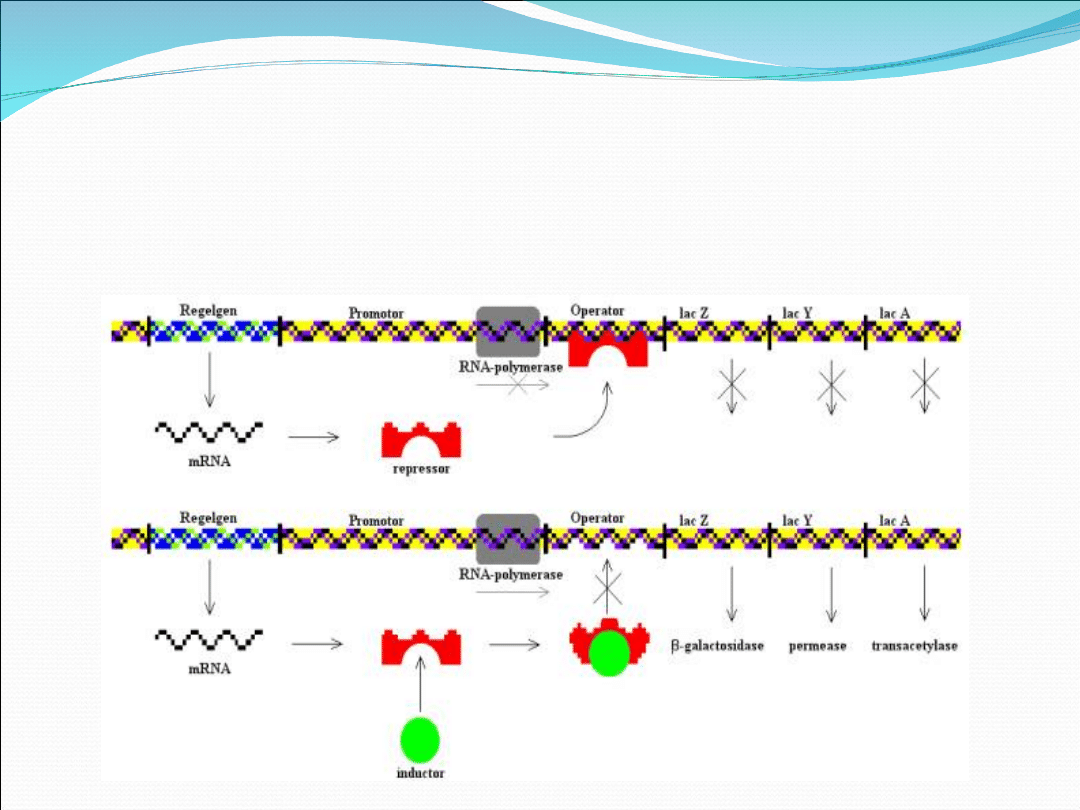
Regulacja ekspresji
enzymów u Procariota
Operon laktozowy
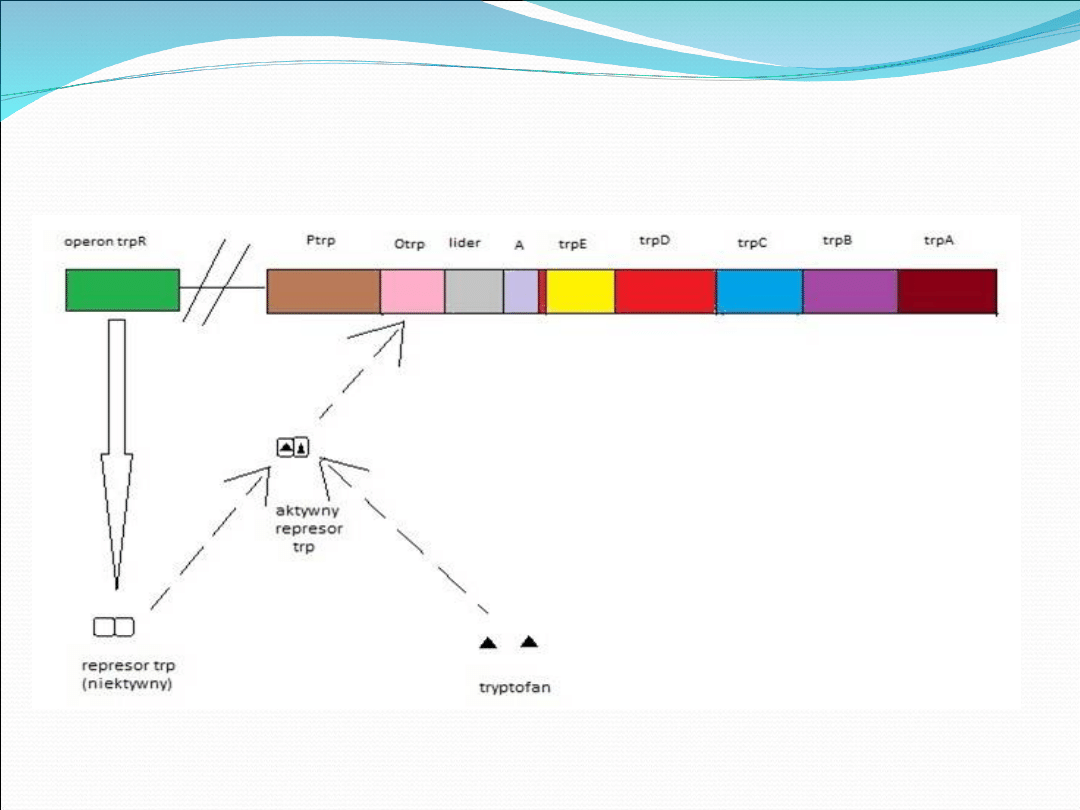
Operon tryptofanowy


Modyfikacje
posttranslacyjne
Posttranslacyjnym
modyfikacjom
łańcuchów bocznych aminokwasów
ulega 15, spośród 20 aminokwasów
białkowych, z wyjątkiem alaniny,
waliny,
leucyny,
izoleucyny
i
metioniny.

Glikozylacja
•Jedna z najpowszechniejszych modyfikacji zachodząca w ER.
•Wiekszość białek przechodzących przez ER ulega tej modyfikacji
(wyjątek-albumina).
•Glikozylacja białek polega na przyłączaniu wiązaniem glikozydowym
cukrowców do określonych reszt aminokwasowych polipeptydu.
•Proces ten prowadzi do powstania glikoproteiny.
•Kieruje to białko do właściwego miejsca przeznaczenia na terenie
komórki lub poza komórkę.
•Glikozylacja ma odmienny przebieg podczas tworzenia O-glikanów i
N-glikanów.
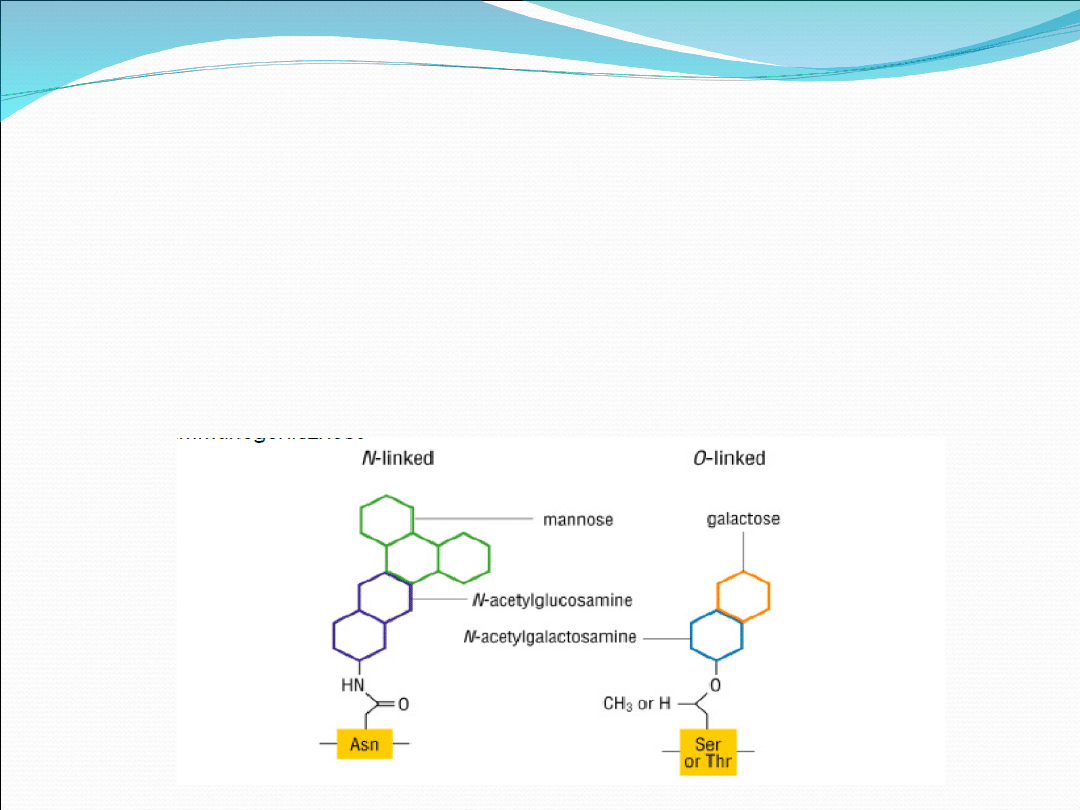
1. Tworzenie wszystkich O- glikanów glikoprotein następuje drogą
glikozylacji sekwencyjnej, tj. kolejno następującego po sobie
przyłączania reszt monocukrowych do białka. Wydłużanie O-
oligosacharydu charakteryzuje się tym, że produkt działania
jednej glikozylotransferazy staje się akceptorem-substratem dla
następnej glikozylotransferazy.
2. N-glikozylacja polega na przyłączeniu glikanu do amidowej
grupy
asparaginy
za
pośrednictwem
reszty
N-
acetyloglukozaminowej. Biosynteza N-glikanów polega na
dołączaniu kolejnych monosacharydów z udziałem glikozylaz
oraz glikozylotransferaz zlokalizowanych w aparacie Golgiego
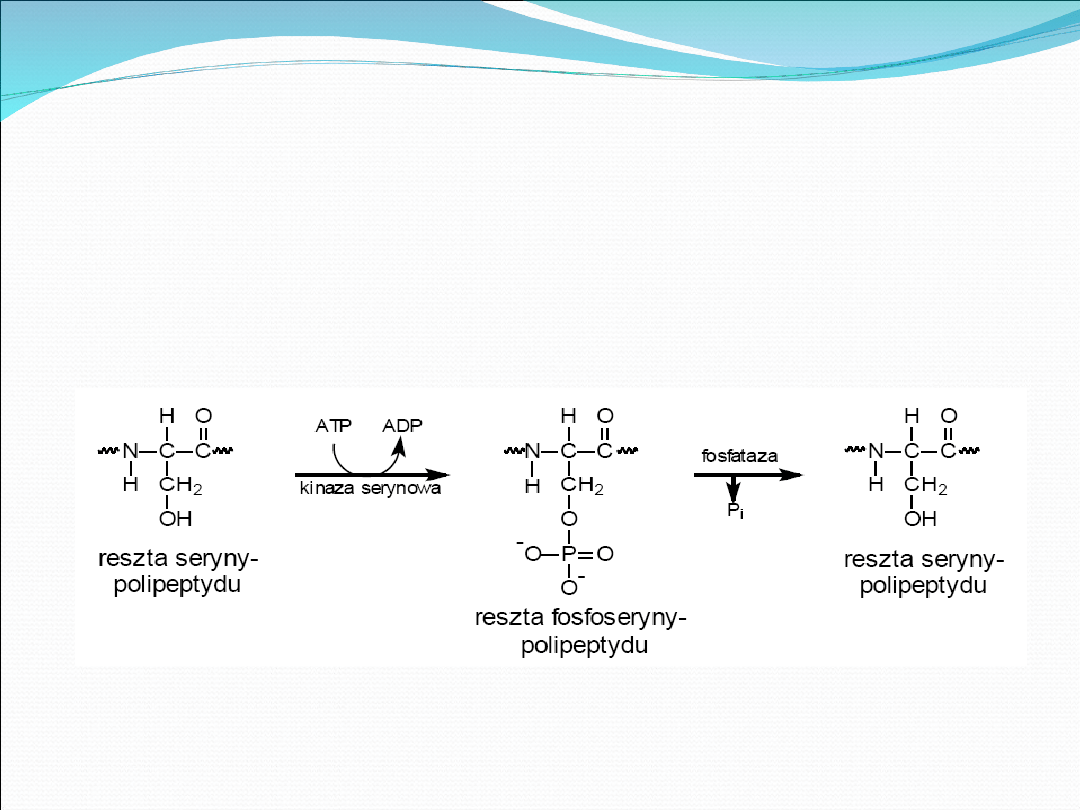
Fosforylacja
Reakcje fosforylacji polegają na przeniesieniu końcowej grupy
fosforanowej z ATP na atom tlenu grupy hydroksylowej
specyficznej reszty aminokwasowej, mianowicie: Ser, Thr lub Tyr.

•Reakcje fosforylacji, zachodzące w organizmie
są katalizowane enzymatycznie przez kinazy
(fosfotransferazy), wśród których wyróżnia się
dwie klasy: kinazy białkowe fosforylujące Ser lub
Thr (klasa I) i kinazy białkowe fosforylujące Tyr
(klasaII).
•Może aktywować ( np. Fosforylaza glikogenowa),
lub hamować (syntaza glikogenowa) aktywność
niektórych enzymów
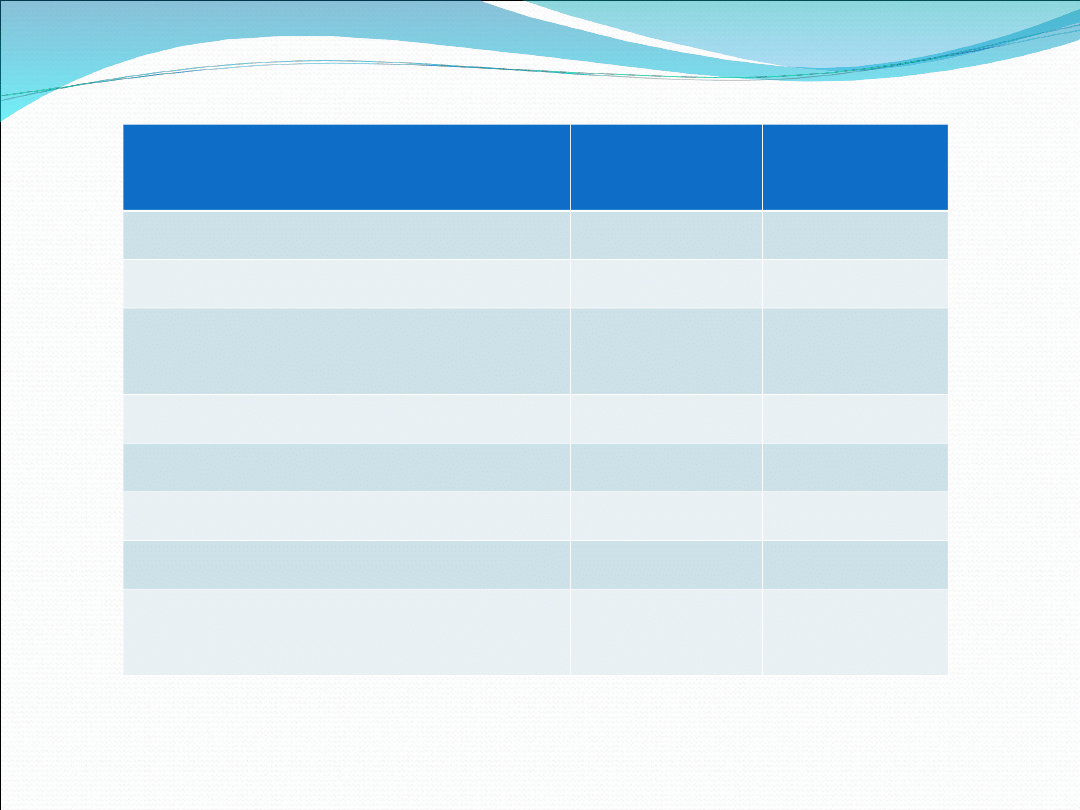
Enzym
Aktywno
ść: mała
Aktywno
ść: duża
Karboksylaza acetylo-CoA
EP
E
Syntaza glikogenoza
EP
E
Dehydrogenaza
pirogronianowa
EP
E
Reduktaza HMG-CoA
EP
E
Fosforylaza glikogenowa
E
EP
Liaza cytryianowa
E
EP
Kinaza fosforylazy b
E
EP
Kinaza reduktazy HMG-
CoA
E
EP
E- forma defosforylowana
EP- forma fosforylowana
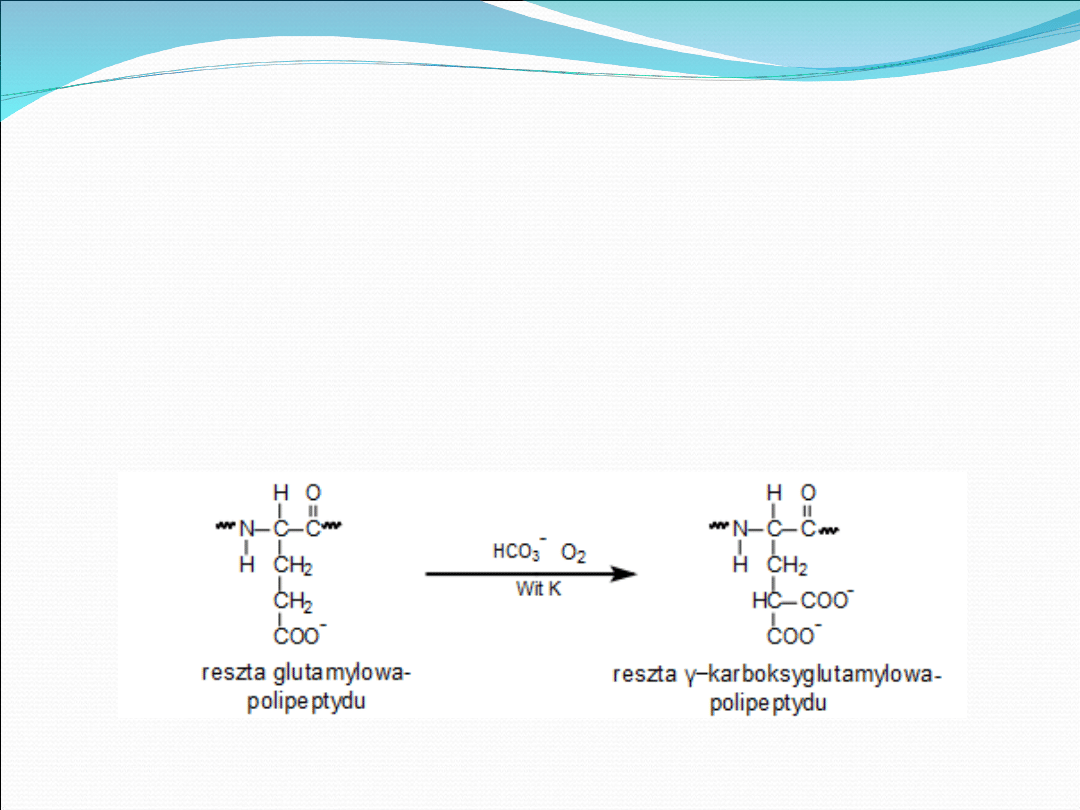
Karboksylacja
Karboksylacja reszt glutaminianu do γ-arboksyglutaminianu w
białkach uczestniczących w krzepnięciu krwi dostarcza miejsc
wiążących jony Ca+2, przekształcając je ze słabych chelatorów
wapnia w silne.
Wytworzone γ-karboksyglutaminiany w protrombinie wiążą jony
wapnia, dzięki czemu protrombina wiąże się z fosfolipidami
błonowymi płytek krwi.
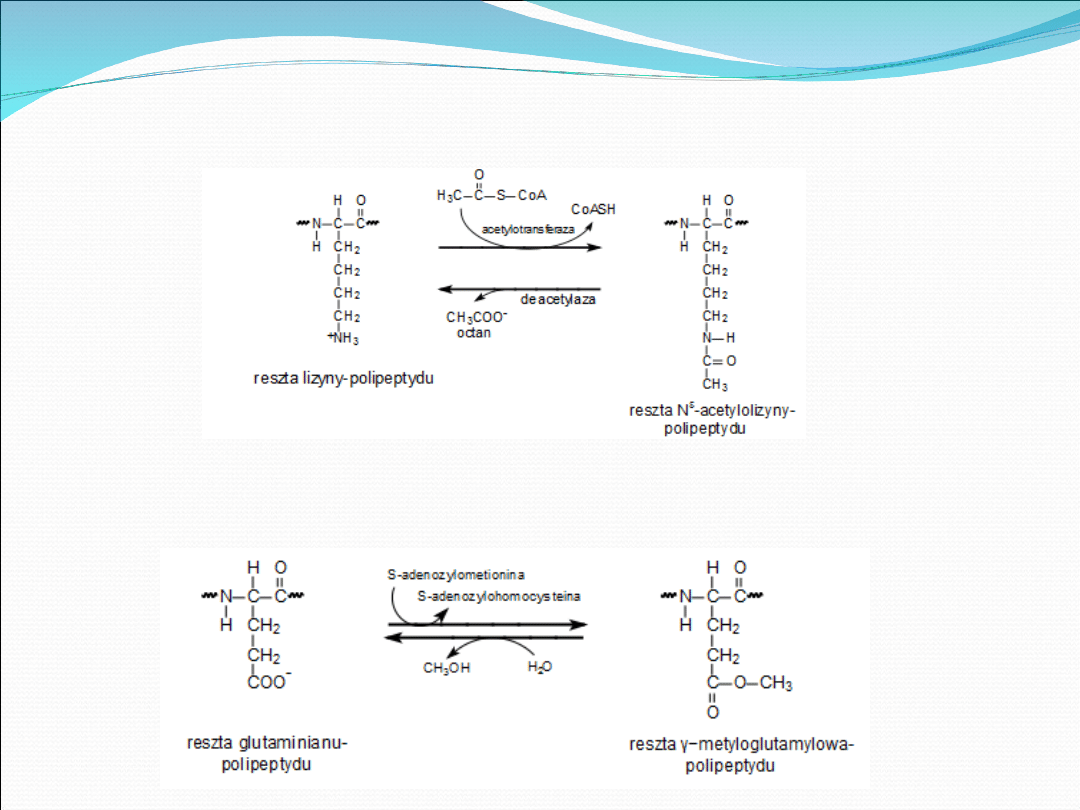
• Acetylacja:
– Dołączenie grupy acetylowej
• Metylacja:
– Dołączenie grupy metylowej

Cięcie proteolityczne
• Obróbka białka poprzez cięcie go przez proteazy:
– Odcinanie jednego z końców polipeptydu
– Cięcie na kilka fragmentów
– Aktywacja białka poprzez usunięcie zbędnych
fragmentów
– Usunięcie sekwencji liderowych
– Splicing polipeptydowy - usunięcie
fragmentów ze środka

Ubikwitynacja


Inhibitory
Substancje zmniejszające szybkość reakcji
enzymatycznej.
Zahamowanie aktywności enzymatycznej jest
jednym ze sposobów regulacji różnych
procesów w żywej komórce.
Mogą one odwracalnie i nieodwracalnie
hamować aktywność enzymów.

Ze względu na mechanizm działania na
enzym dzieli się je na:
- inhibitory kompetycyjne
- inhibitory allosteryczne
- inhibitory niekompetycyjne

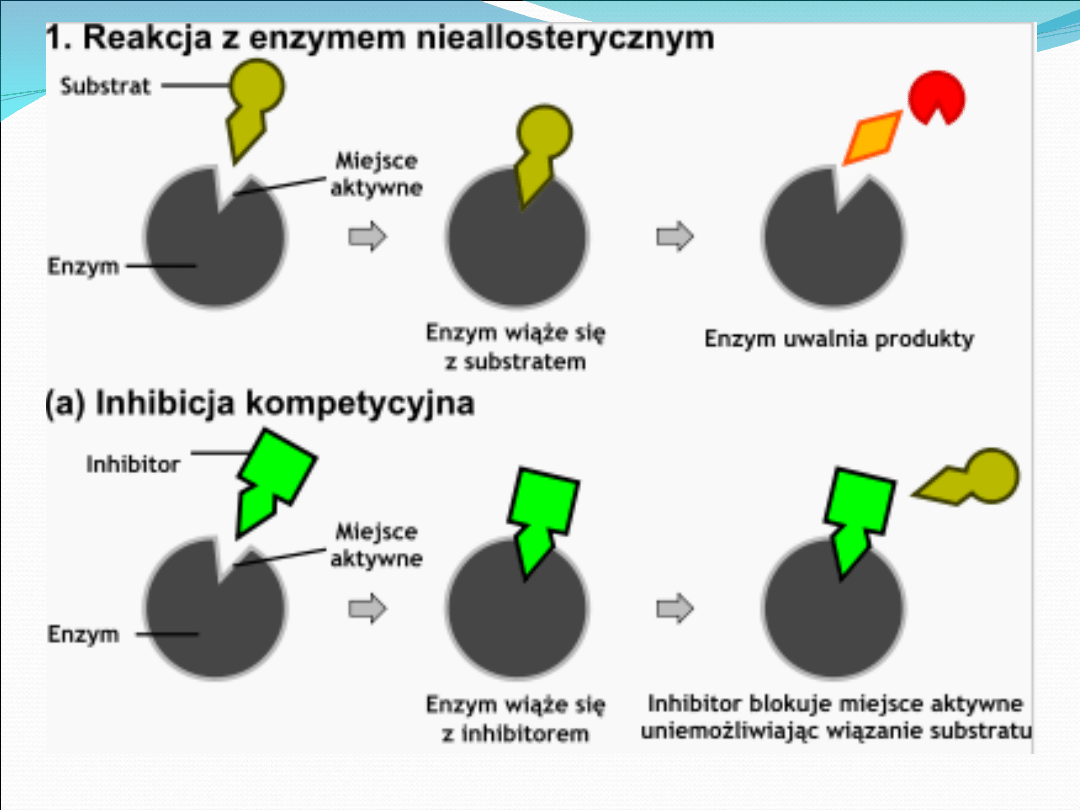
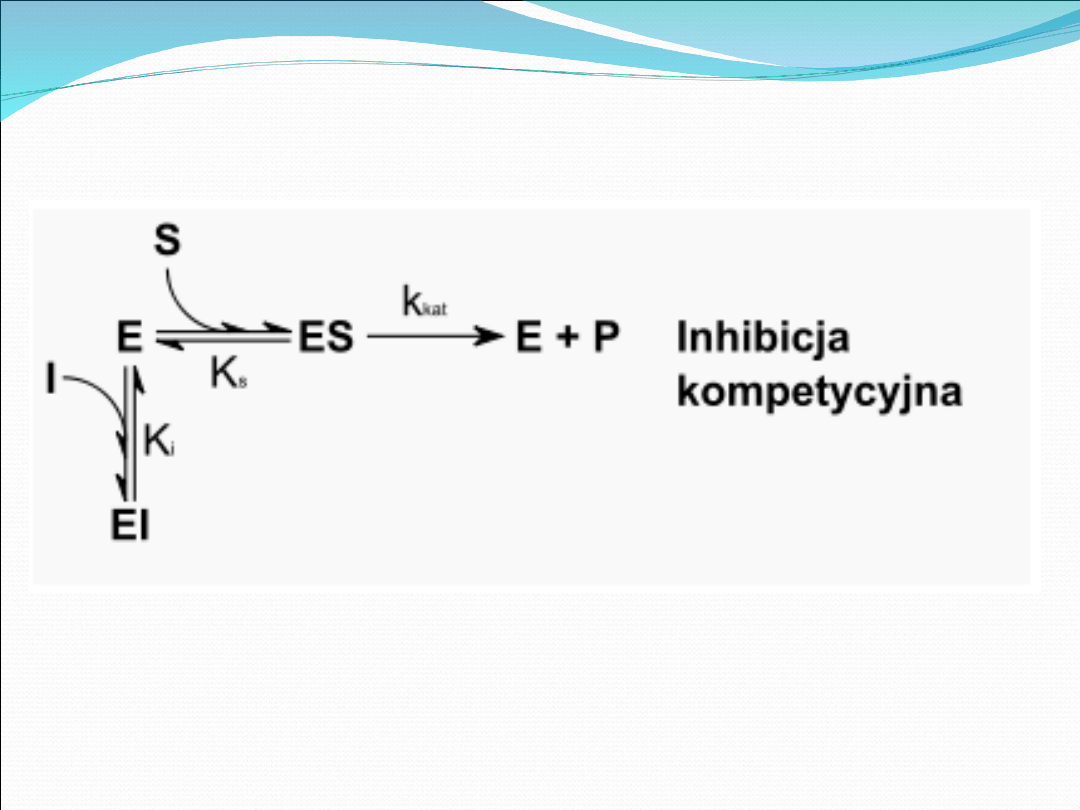
Inhibicja
kompetycyjna
W inhibicji kompetycyjnej inhibitor i substrat
współzawodniczą o miejsce aktywne cząsteczki
enzymu.
Inhibitorami kompetycyjnymi (współzawodniczącymi)
mogą być związki wykazujące analogie strukturalne
do substratu, które konkurują z nim o centrum
katalityczne enzymu z powodu braku absolutnej
specyficzności grup czynnych tego centrum.
Przykładem jest hamowanie dehydrogenazy
bursztynianowej przez malonian.
COO —CH
2
—COO malonian
COO—(CH
2
)
2
COO bursztynian

Cechą hamowania kompetycyjnego jest
zależność szybkości reakcji enzymatycznej od
stężenia substratu, stężenia inhibitora oraz od
względnego powinowactwa substratu i
inhibitora do centrum aktywnego enzymu

Inhibicja
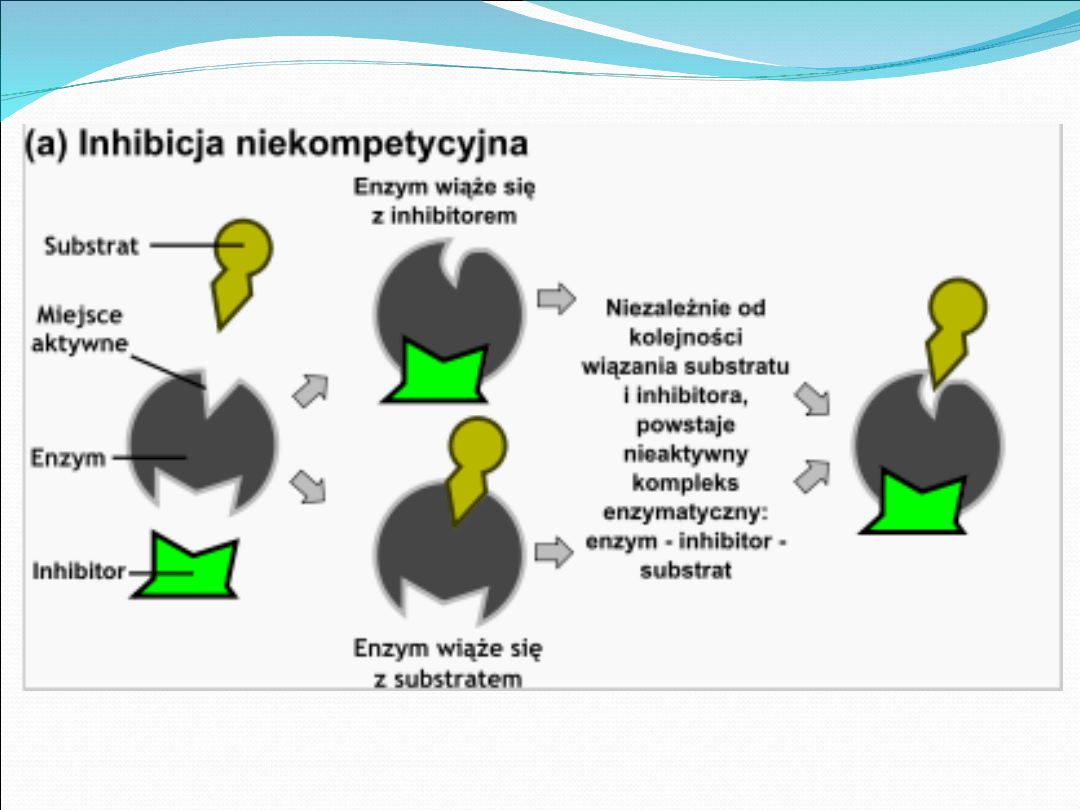
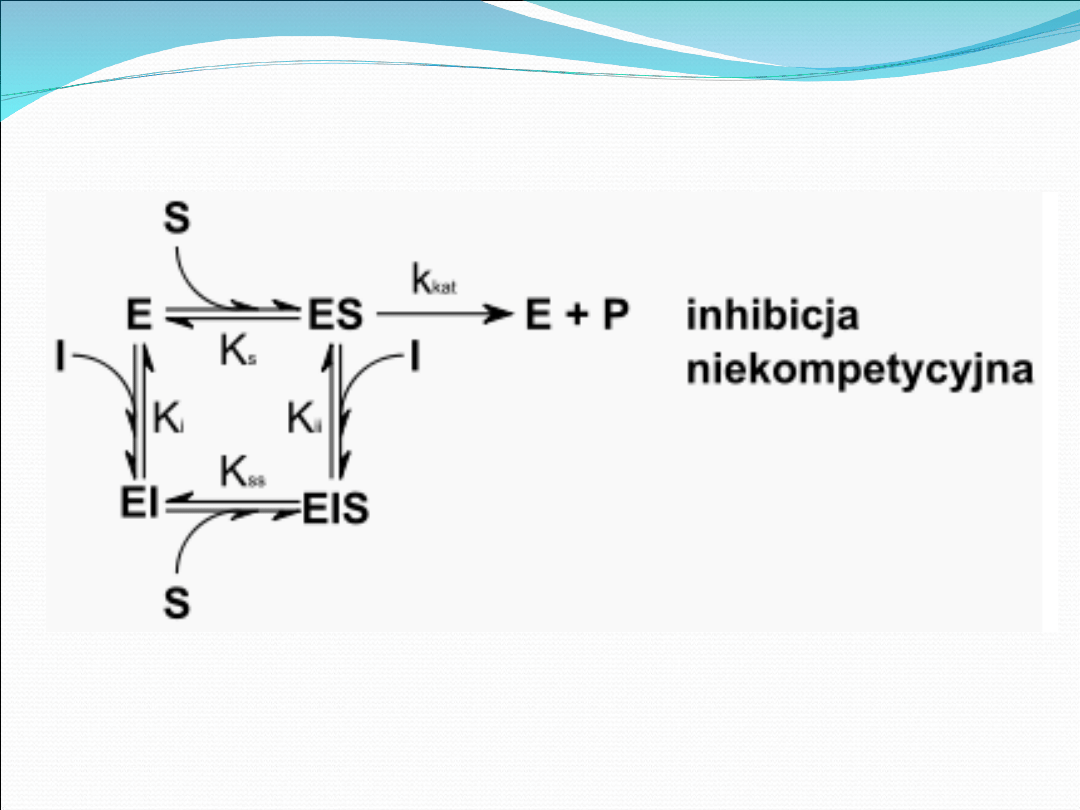
niekompetycyjna
Inhibitory niekompetycyjne - związki
hamujące szybkość reakcji enzymatycznej
przez działanie na wolny enzym lub na
kompleks ES.
Nie zależy od stężenia substratu, a tylko od
stężenia inhibitora i jego wartości K,
charakteryzującej powinowactwo inhibitora do
enzymu.

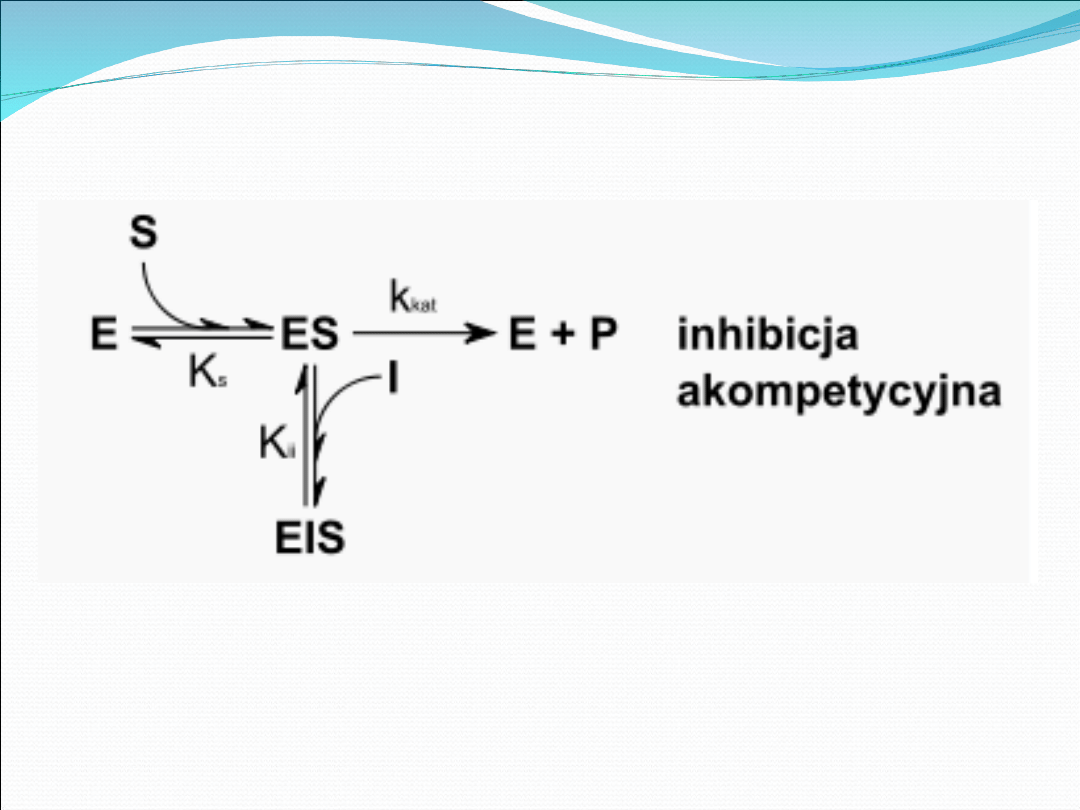
Inhibicja
akompetycyjna
•
Inhibitorem akompetycyjnym jest związek,
który wiąże się odwracalnie z kompleksem ES
(nie wiąże się z wolnym enzymem), tworząc
nieaktywny katalitycznie kompleks EIS.
•
Utworzony kompleks EIS jest enzymatycznie
nieaktywny i reakcja nie może być
kontynuowana, dopóki miejsce aktywne
enzymu nie zostanie zwolnione.

Regulacja
allosteryczna
Aktywność enzymów może być zmieniana
poprzez wiązanie allosterycznych efektorów
do miejsc, które leżą poza centrum aktywnym
(w centrum allosterycznym).
Efektory te mogą działać zarówno
pozytywnie, zwiększjąc szybkość reakcji
enzymatycznej, jak i negatywnie, powodując
jej zmniejszenie (aktywatory i inhibitory
allosteryczne reakcji).

Aktywatory
Substancje zmieniające powinowactwo
enzymu do substratu lub szybkość
maksymalną reakcji.
Mogą być związkami nisko- i
wysokocząsteczkowymi, zarówno
nieorganicznymi, jak i organicznymi.

Kinaza pirogronianowa kontroluje wypływ
metabolitów glikolizy - regulacja indukowana
przez fruktozo-1,6-bisfosforan (aktywujący
enzym i tym samym przyśpieszająca proces
glikolizy na tym etapie) oraz ATP oraz alaninę
(hamujące enzym i spowalniające glikolizę)

Hamowanie zwrotne
Jest ujemną modulacją kluczowego etapu
szlaku metabolicznego przez produkt końcowy
tego szlaku. Zapobiega to niepotrzebnemu
wytwarzaniu nadmiaru końcowego produktu
przez obniżenie aktywności szlaku aż do
momentu zwiększenia zapotrzebowania na
ten produkt.
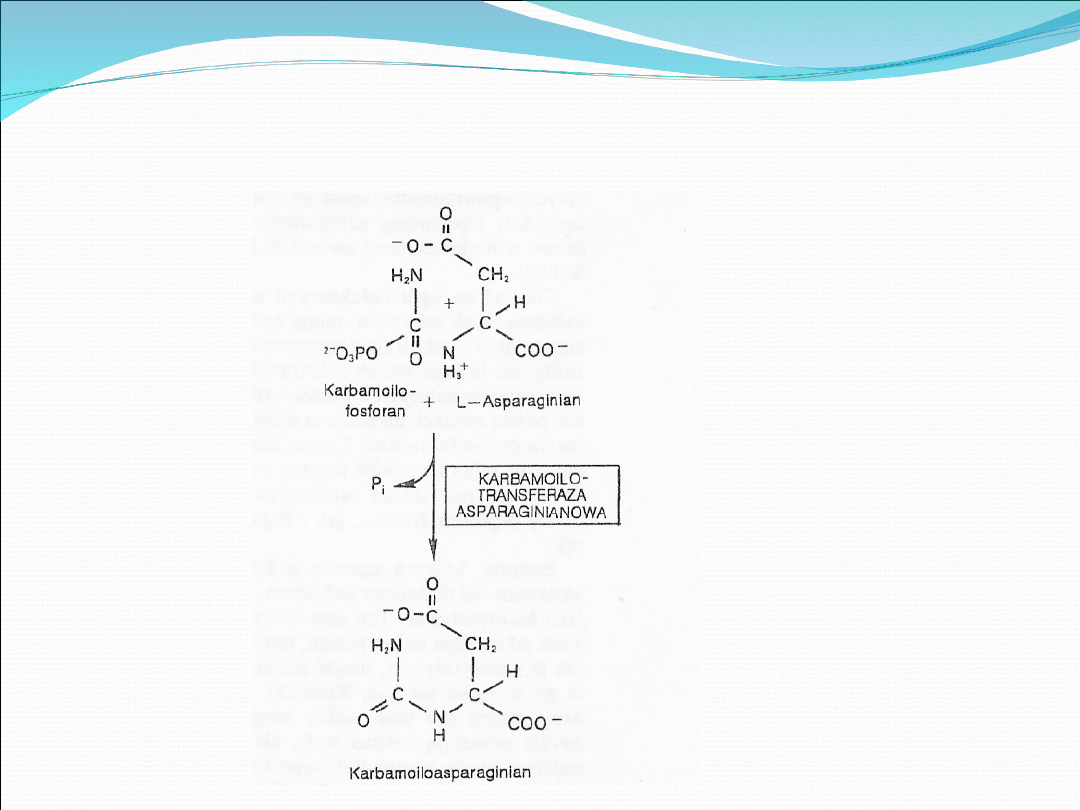
Przykladem enzymu allosterycznego jest
karbamoilotransferaza asparaginianowa

Jest on regulowany na zasadzie sprzężenia
zwrotnego przez trifosforan cytydyny (CTP) i
trifosforan adenozyny (ATP).
CTP hamuje, a ATP aktywuje enzym.
Wysoki poziom ATP może znieść hamujący
efekt CTP.
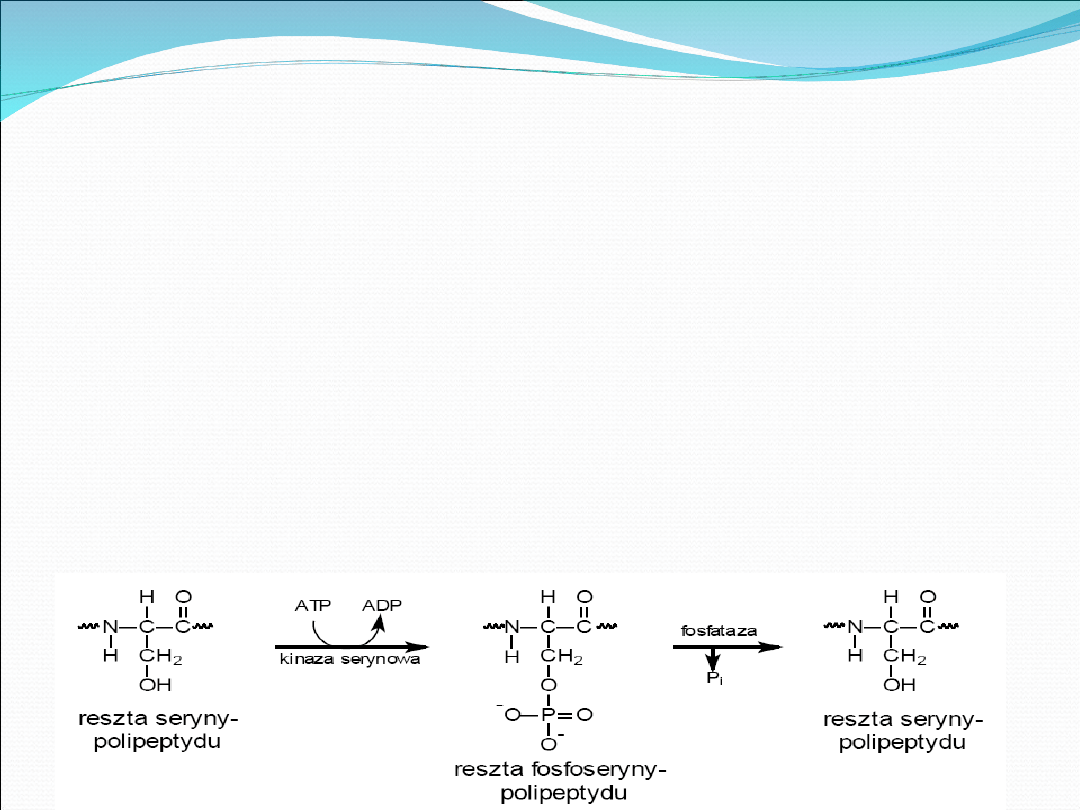
Fosforylacja
•
Dołączenie reszty fosforanowej
•
Regulowana przez kinazy
•
Może aktywować ( np.. Fosforylaza
glikogenowa), lub hamować (syntaza
glikogenowa) aktywność niektórych enzymów,
•
silnie wzmacnia sygnał
•
wykorzystuje ATP jako donor grup
fosforanowych

Bibliografia
Biochemia Harpera, Murray R.K. i wsp..
Genomy T. A. Brown
Diagnostyka Laboratoryjna, tom 1, pod red. A.
Szutowicza
i A. Raszei-Specht
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
- Slide 41
- Slide 42
- Slide 43
Wyszukiwarka
Podobne podstrony:
AKTYWNOŚĆ ENZYMÓW PRZECIWUTLENIAJĄCYCH!
9) Oznaczanie aktywności enzymów amylolitycznych
Oznaczanie aktywności enzymów lipolitycznych
(), biochemia L, Wpływ temperatury na aktywność enzymów (ćw E)
Lab06 Aktywnosc enzymow I, Lekarski WLK SUM, lekarski, biochemia, enzymy
biochemia III, Czynniki warunkujące aktywność enzymów
Aktywność enzymów przy niedoborze żelaza
Regulamin aktywności KSM
cwiczenie 1 oksydoreduktazy i transferazy wykrywanie aktywnosci enzymow w materiale biologicznym 05
3-Aktywność-enzymów-materiały, Biotechnologia SGGW
AKTYWNOŚĆ ENZYMÓW PRZECIWUTLENIAJĄCYCH(1)
AKTYWNOŚĆ ENZYMÓW PRZECIWUTLENIAJĄCYCH
Lab07 Aktywnosc enzymow II Wita Nieznany
oznaczanie aktywności enzymów, Biotechnologia, laborki
5) Czynniki warunkujące aktywność enzymów na przykładzie fosfatazy kwaśnej
Ocena aktywności enzymów jako wskaźnik uszkodzenia narządów, MEDYCYNA, Biochemia
Czynniki wpływającego na aktywność enzymów
biochemia III;], Czynniki warunkujące aktywność enzymów
więcej podobnych podstron