
W2
Klonowanie

Enzymy wykorzystywane
w obróbce DNA in vitro
• Nukleazy
• Ligazy
• Fosfatazy
• Kinazy
• Glikozylazy
• Metylotransferazy
• Polimerazy
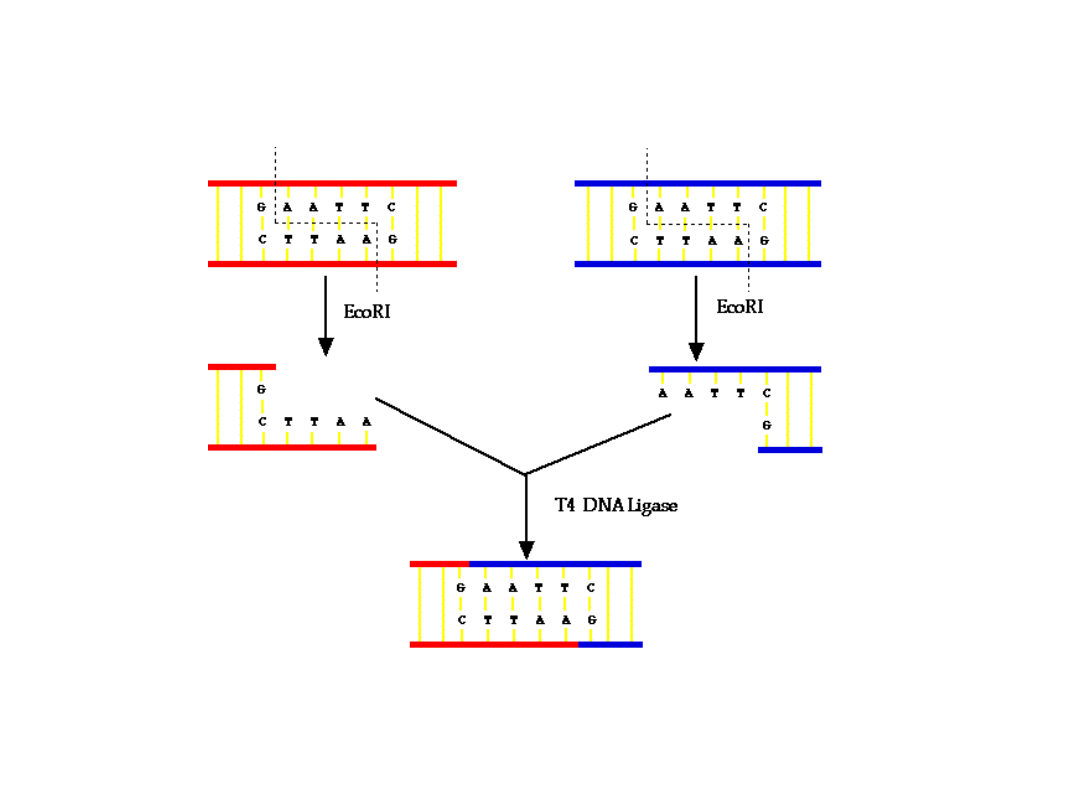
Łączenie fragmentów
DNA
Fragmenty DNA mogą być połączone przy pomocy
ligazy, jeżeli ich końce mają odpowiadające sobie
sekwencje i właściwe grupy funkcyjne 3’ i 5’

Plazmidy
•
Plazmid – pozachromosomowa, kolista cząsteczka
DNA zawierająca niezależny początek replikacji
•
Wektory plazmidowe są plazmidami sztucznie
zmodyfikowanymi, dzięki czemu lepiej nadają się
do obróbki w probówce
•
Typowe modyfikacje
:
–
Stałe miejsce do klonowania zawierające szereg
unikalnych miejsc restrykcyjnych (polilinker)
–
Obecność
co
najmniej
jednego
markera
selekcyjnego (np. oporności na antybiotyki)
–
Obniżona ilość DNA
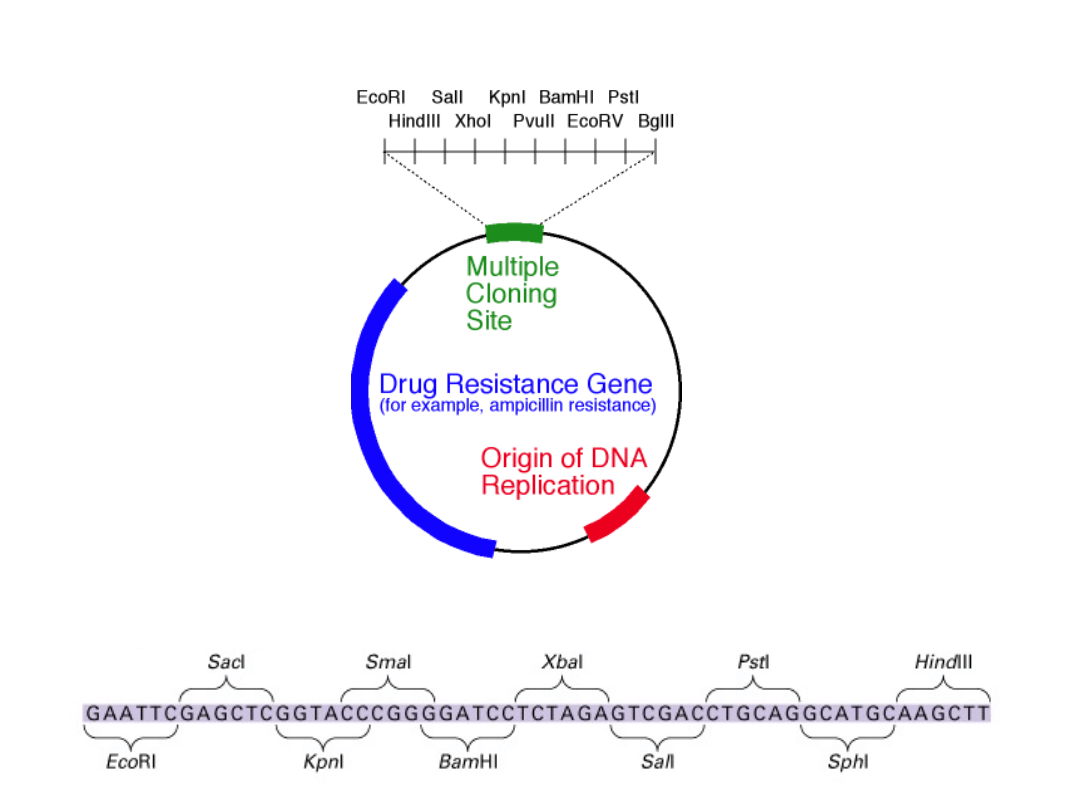
Polilinker zawiera szereg pojedynczych miejsc restrykcyjnych
Schemat budowy wektora plazmidowego

Inne wektory
Bakteriofagi:
lambda i jego pochodne (dwuniciowe)
M13 i jego pochodne (jednoniciowe)
Sztuczne chromosomy bakteryjne
Sztuczne chromosomy drożdżowe
Wektory drożdżowe
Wektory bakulowirusowe (z wirusów owadzich)
Pochodne wirusów roślinnych
Pochodne plazmidów bakterii zakażających rośliny
Pochodne wirusów zakażających komórki ludzkie
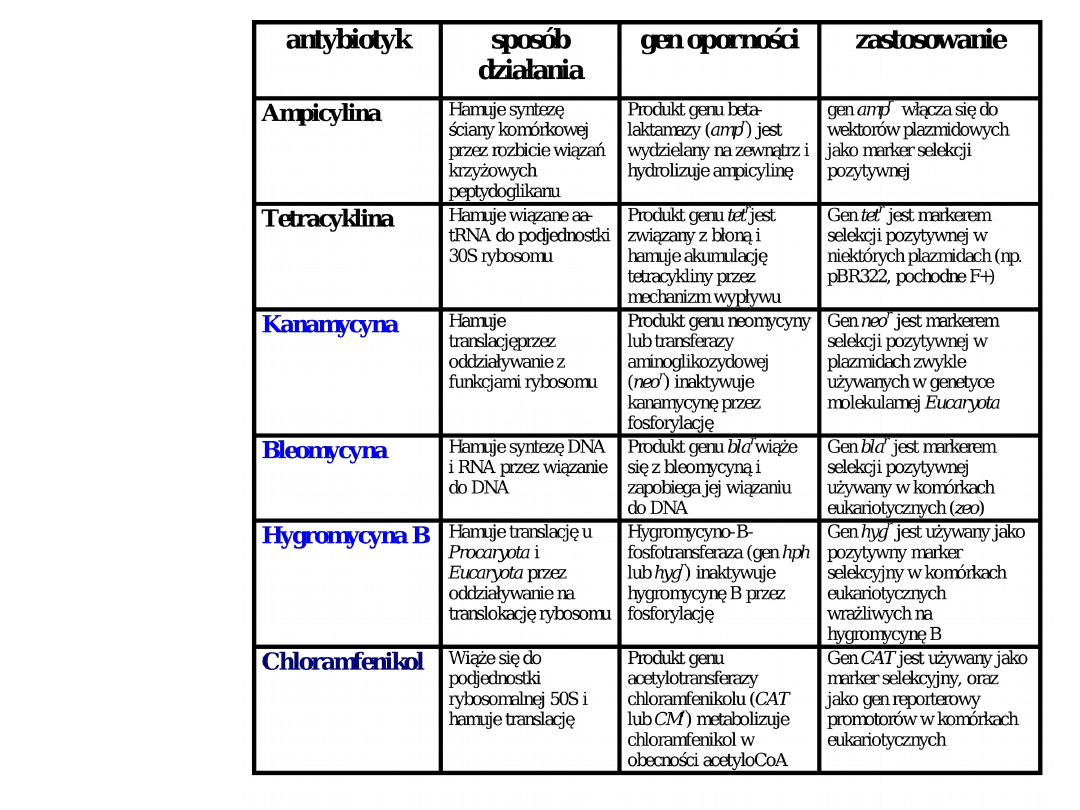
Antybiotyki
i geny
oporności
powszechnie
wykorzystywa
ne w biologii
molekularnej
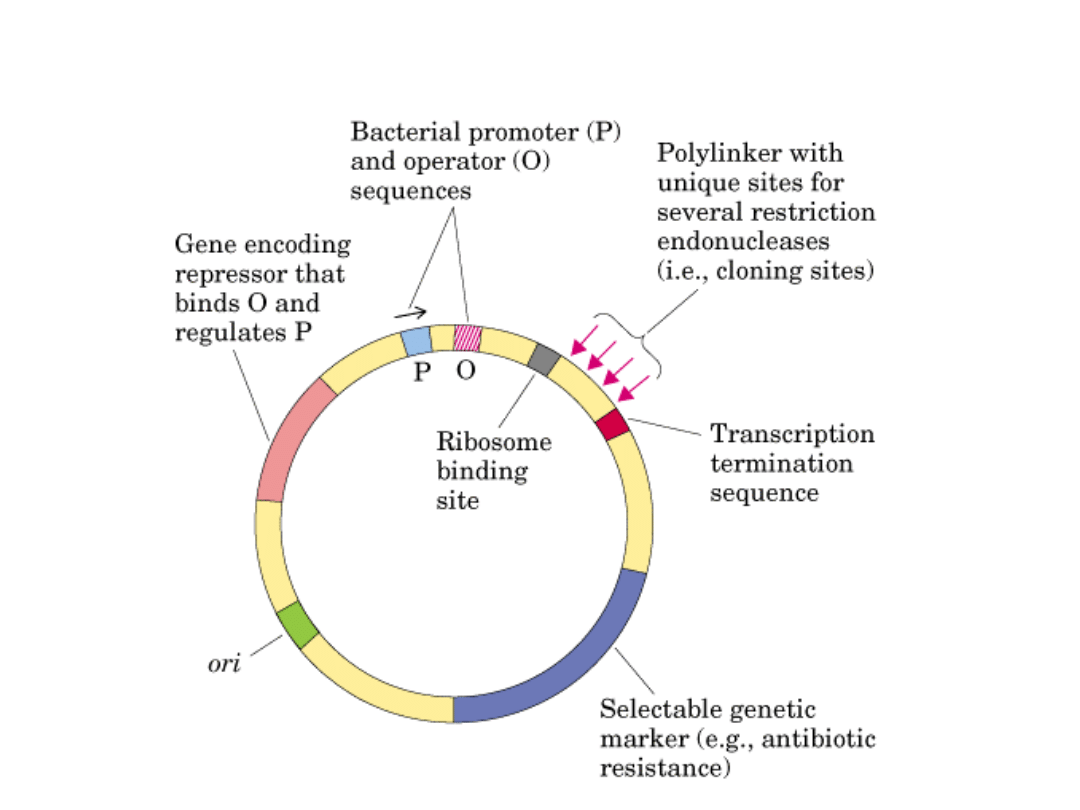
Wektory ekspresyjne
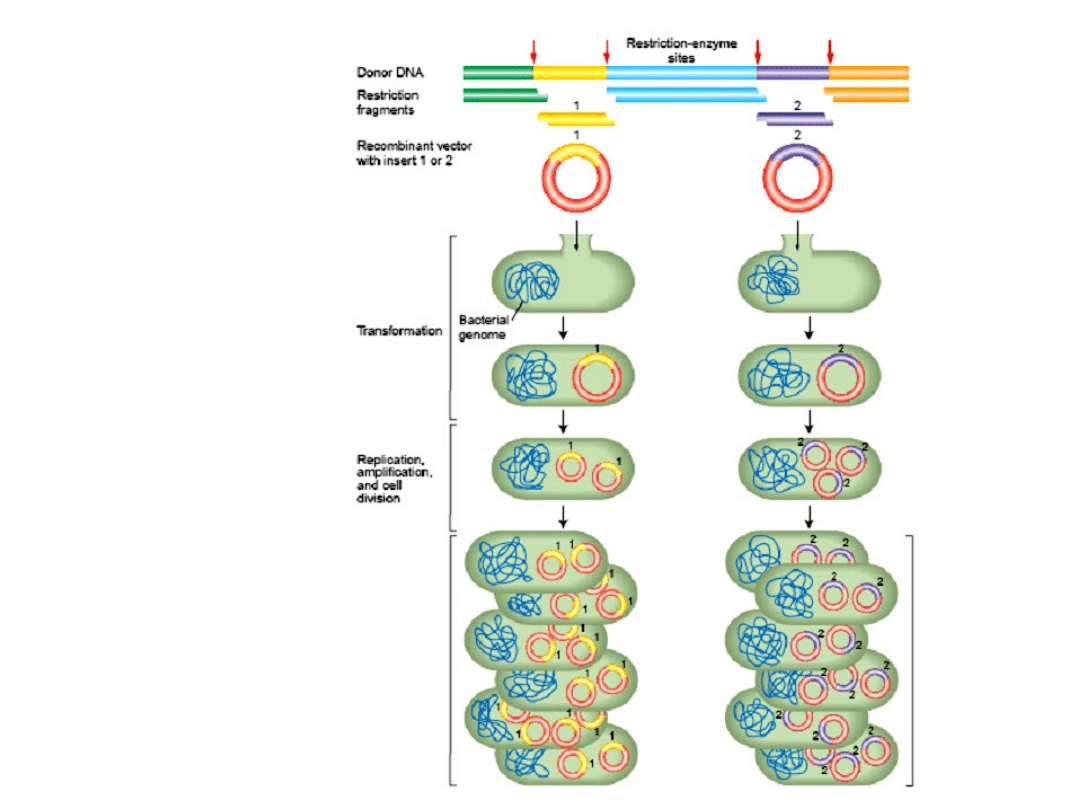
Klonowanie

Główne etapy
klonowania
1)
Trawienie próbki DNA
enzymem restrykcyjnym.
2)
Trawienie DNA wektora
enzymem restrykcyjnym.
3)
Ligacja próbki DNA
z wektorem.
4)
Transformacja bakterii
(E. coli) produktem ligacji.
5)
Wzrost bakterii na płytkach
agarowych
z antybiotykiem
selekcyjnym.
6)
Detekcja
interesujących nas klonów.

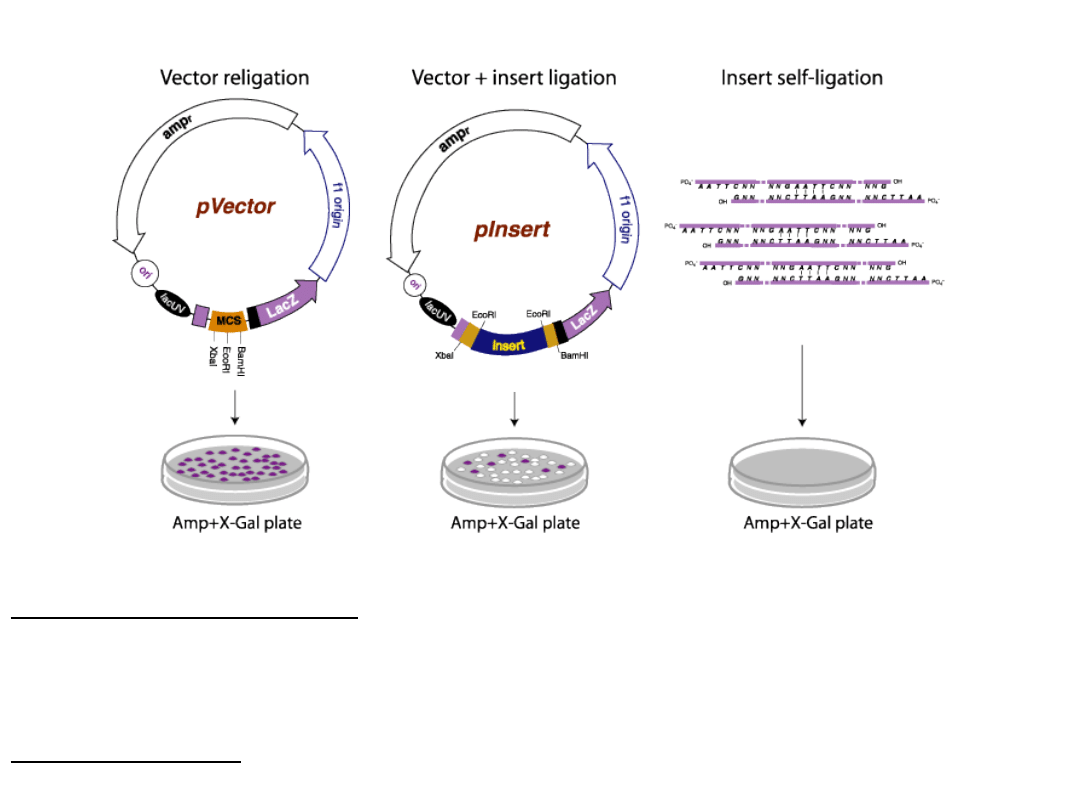
Łączenie różnych fragmentów
DNA
• Wektor-konkretna wstawka
• Biblioteka genomowa
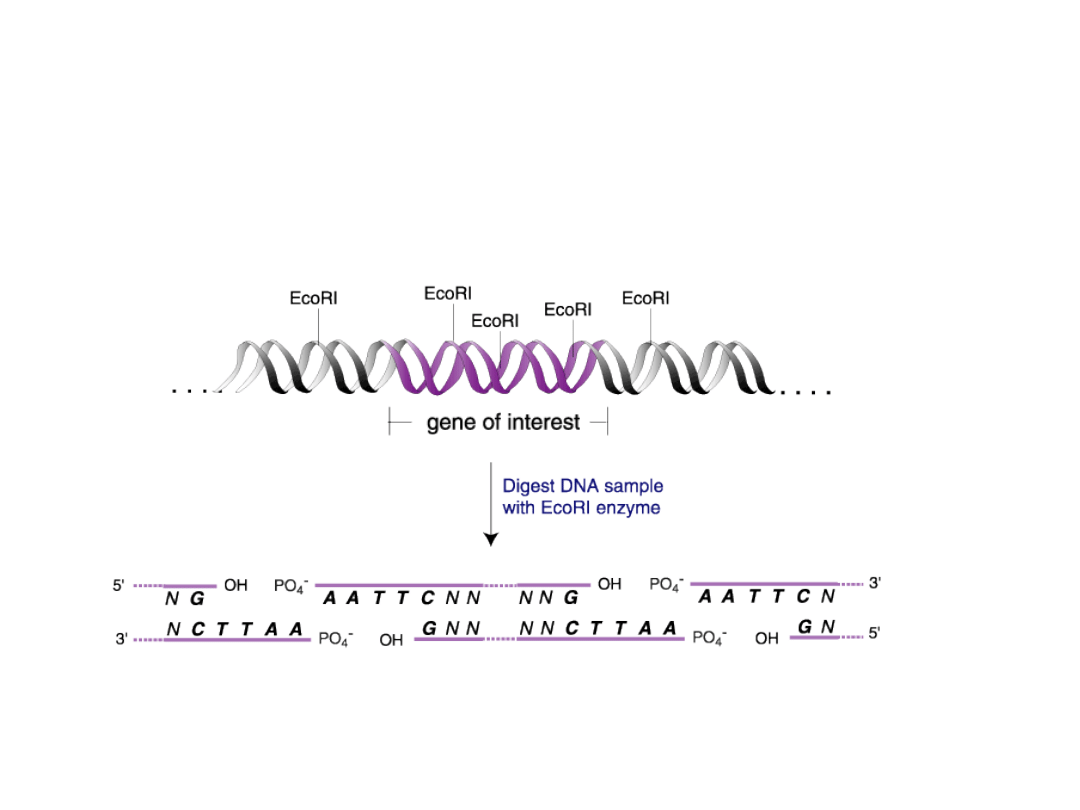
Trawienie badanego DNA
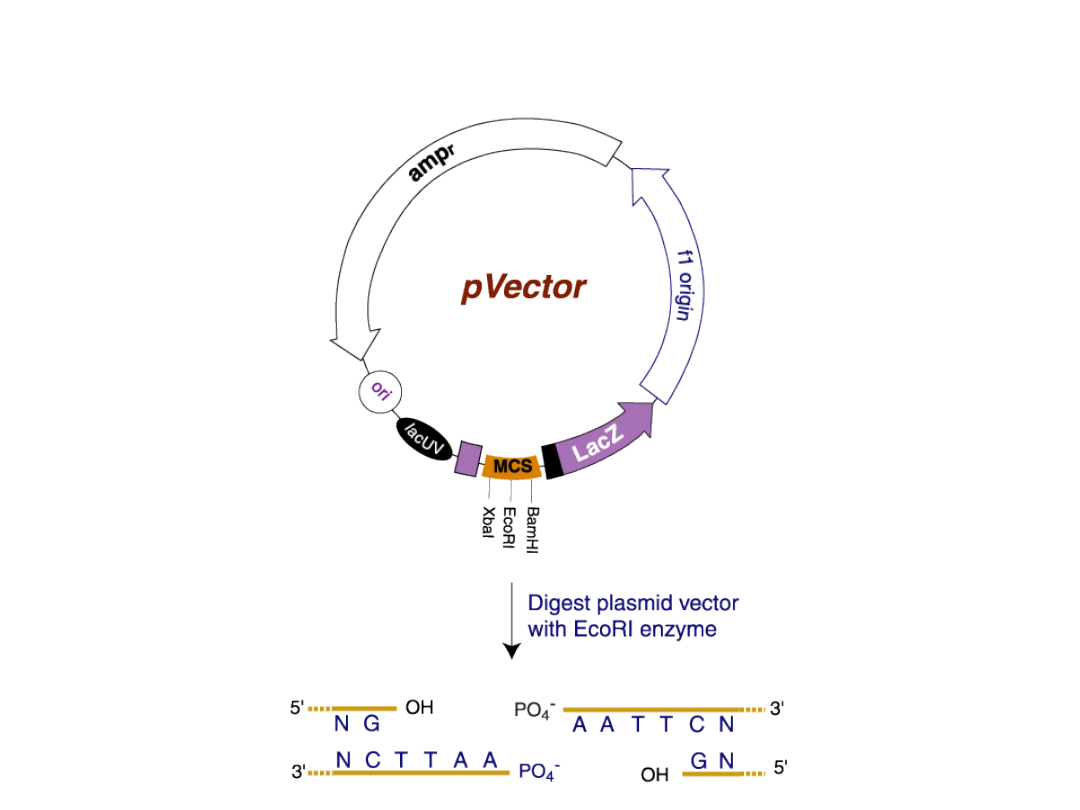
Trawienie wektora tym samym enzymem restrykcyjnym
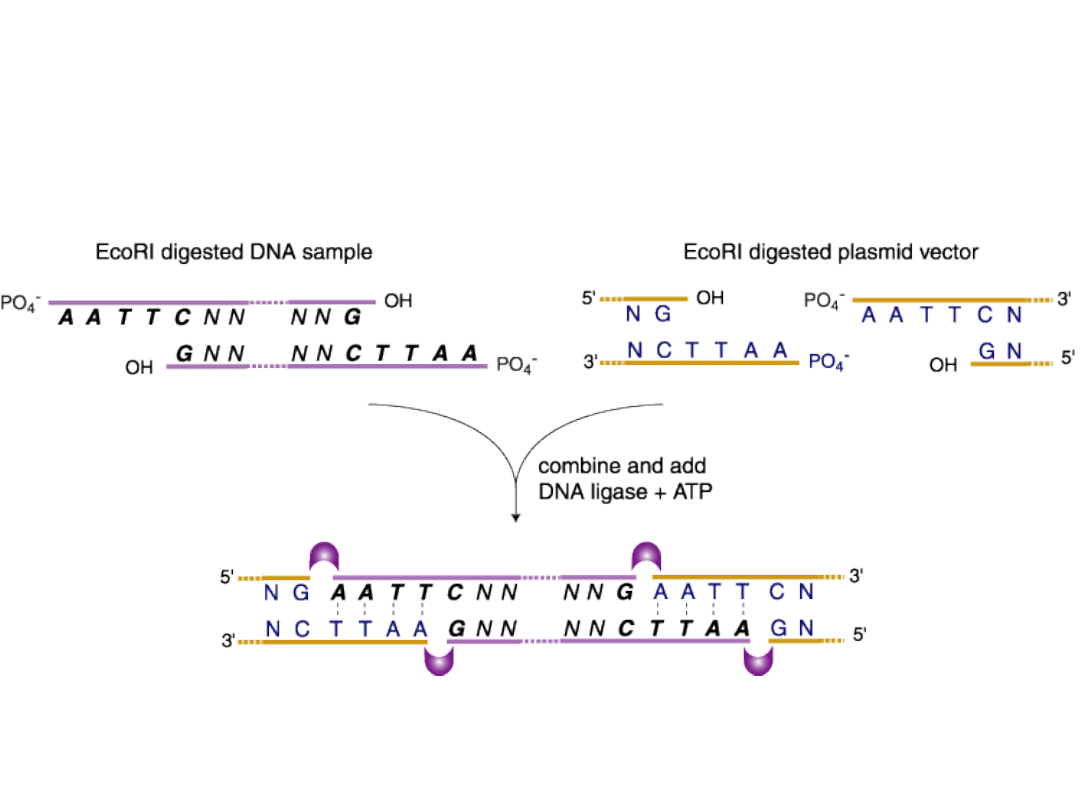
Ligacja plazmidu i
wstawki
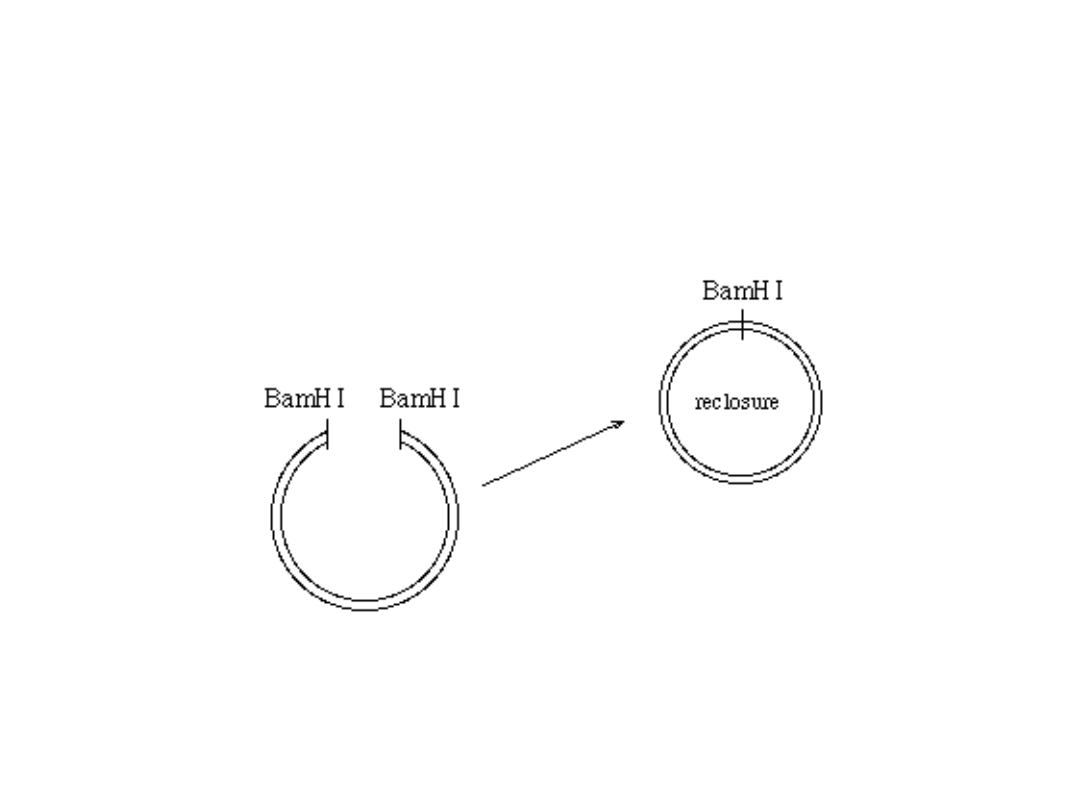
Recyrkularyzacja (religacja)
plazmidu
T4 ligaza

Zapobieganie religacji
plazmidu
• Wykorzystanie alkalicznej fosfatazy
• Klonowanie ukierunkowane
• Adaptory
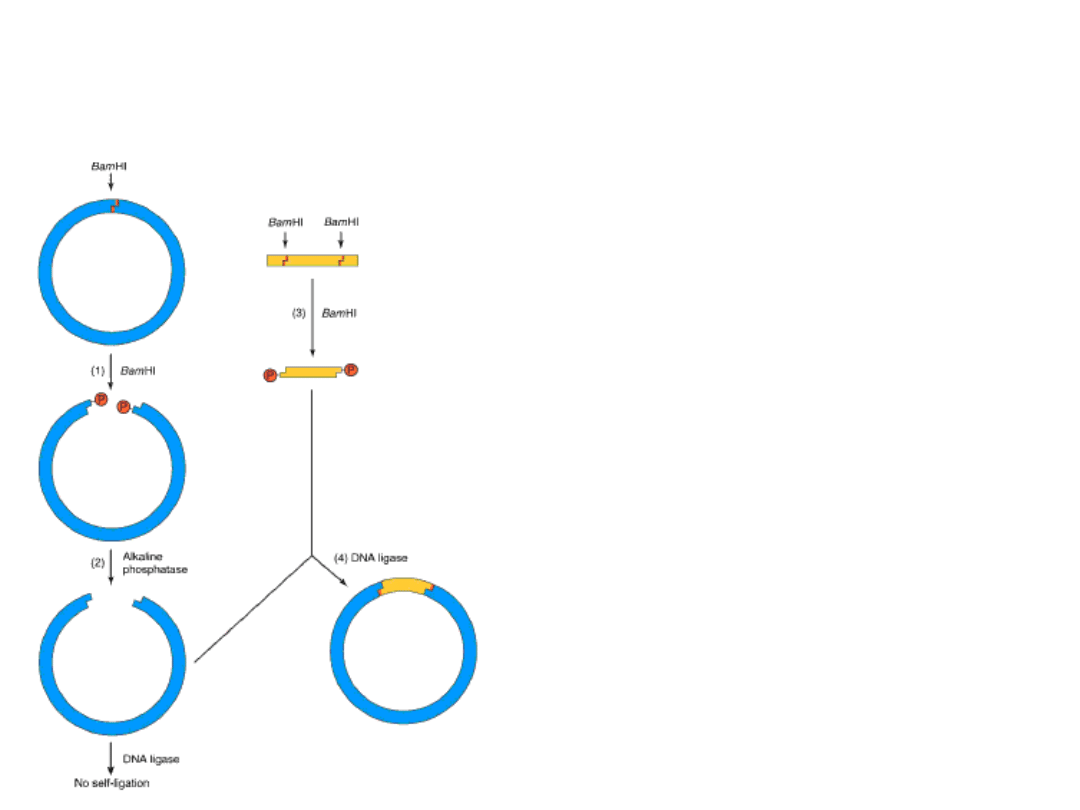
Wykorzystanie alkalicznej fosfatazy
do zapobieżenia ponownej ligacji
wektora
Zdefosforylowany wektor
(posiadający grupy OH
przy końcu 3’ i 5’) nie jest
odpowiednim substratem
dla ligazy DNA. Jest nim
natomiast
kombinacja
zdefosforylowanego
plazmidu
i
ufosforylowanego
(przy
końcu 5’) DNA wstawki.
Jako produkt końcowy
otrzymuje się wektor ze
wstawką
i
z
pojedynczym
nacięciem
w każdej z nici.
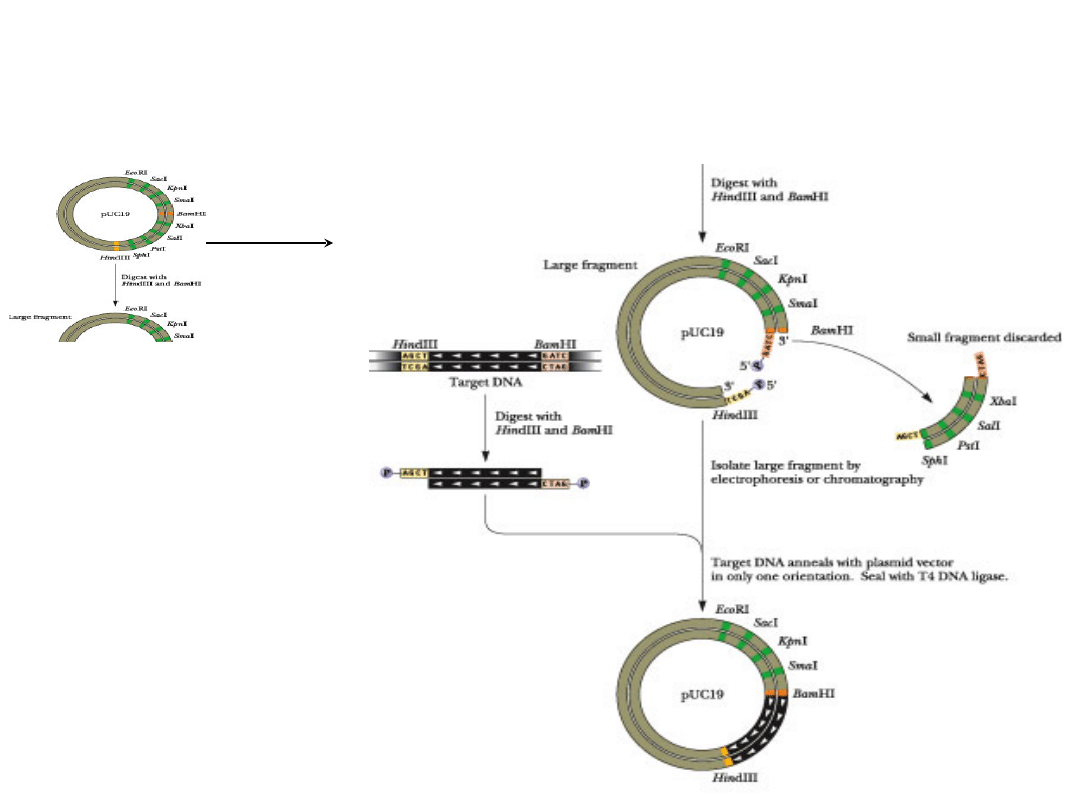
Klonowanie
ukierunkowane
Trawienie dwoma
różnymi
enzymami
restrykcyjnymi
umożliwia
włączenie
żądanego
fragmentu tylko w
jednej
orientacji
i
zabezpiecza
przed
religacją
wektora.
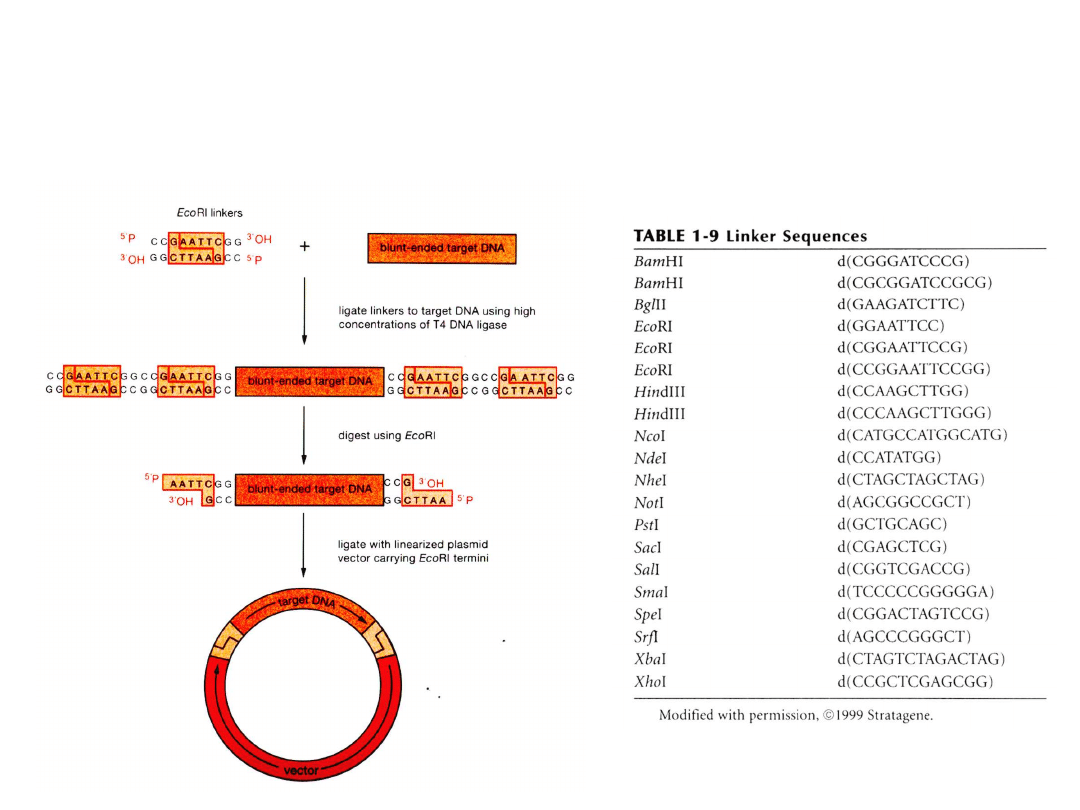
Adaptory i łączniki
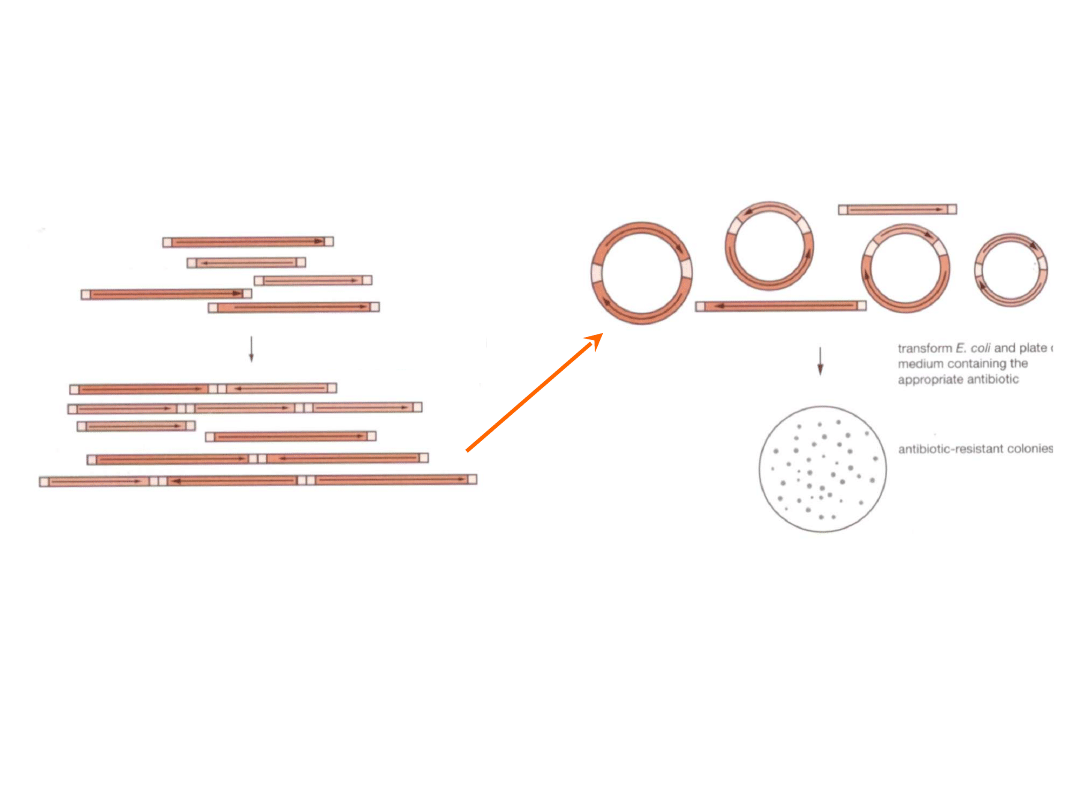
Łączenie tępych końców
DNA
1.
Ligowanie
cząsteczek
wektora
i
wstawki,
przy
dużym
stężeniu DNA oraz ligazy z
faga T4
2. Zamykanie pierścienia po
rozcieńczeniu
DNA,
transformacja
i
selekcja
bakterii

Najczęściej używane metody
transformacji bakterii to:
Metoda chemiczna:
wykorzystująca
CaCl
2
(również mieszaniny innych soli i chlorek
sześcioaminokobaltowy) oraz szok
termiczny.
Elektroporacja:
oparta na krótkim
pulsowym zadziałaniu prądu
elektrycznego.
Biolistyka:
bombardowanie komórek
mikrocząstkami opłaszczonymi DNA.
Transformacja E. coli K-
12
produktem ligacji
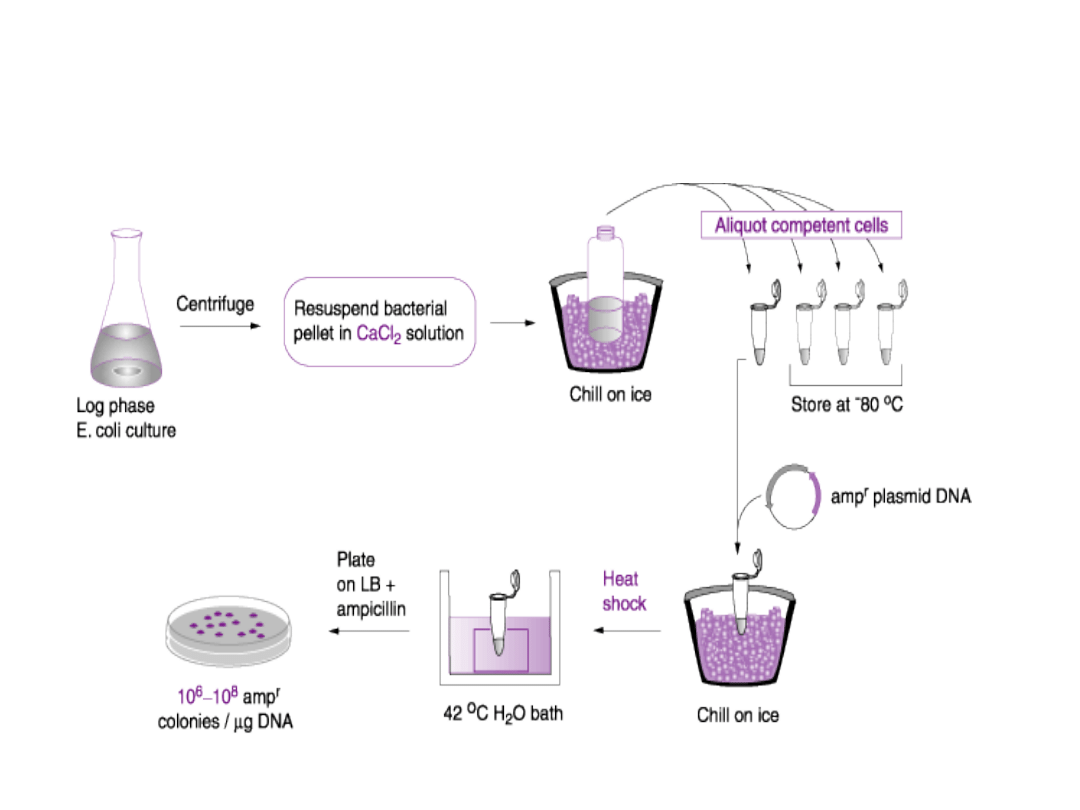
Transformacja chemiczna
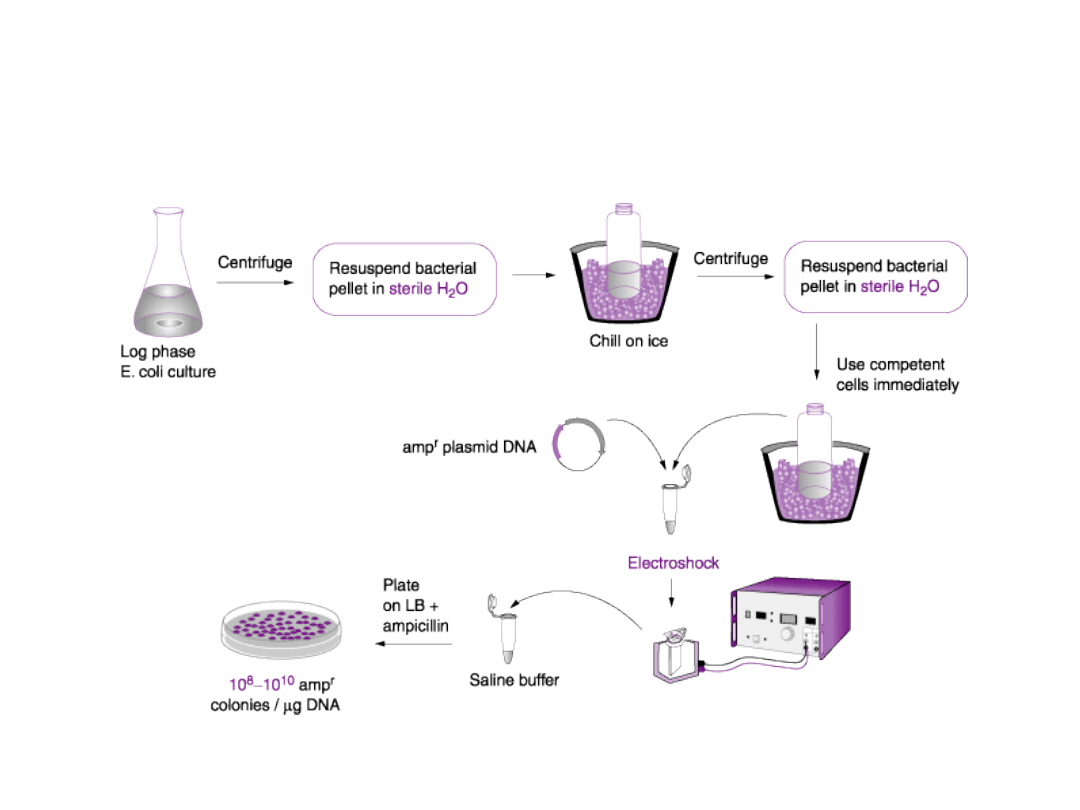
Elektroporacja
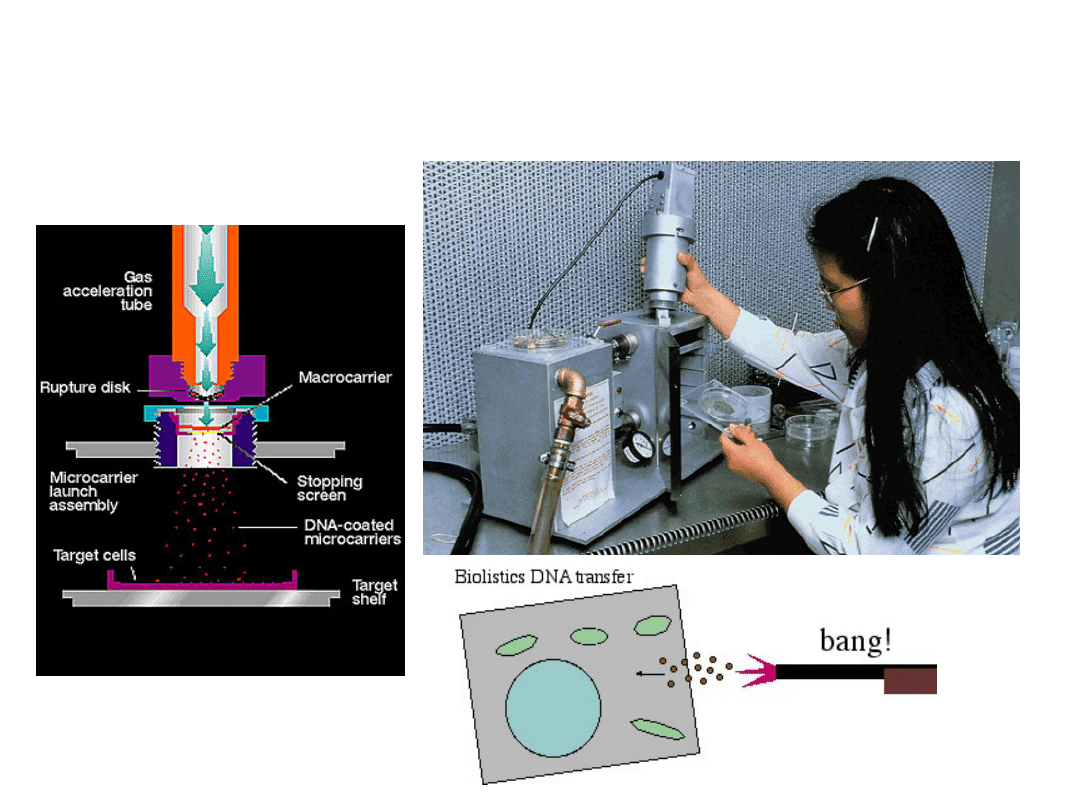
Biolistyka (gene-
gun)
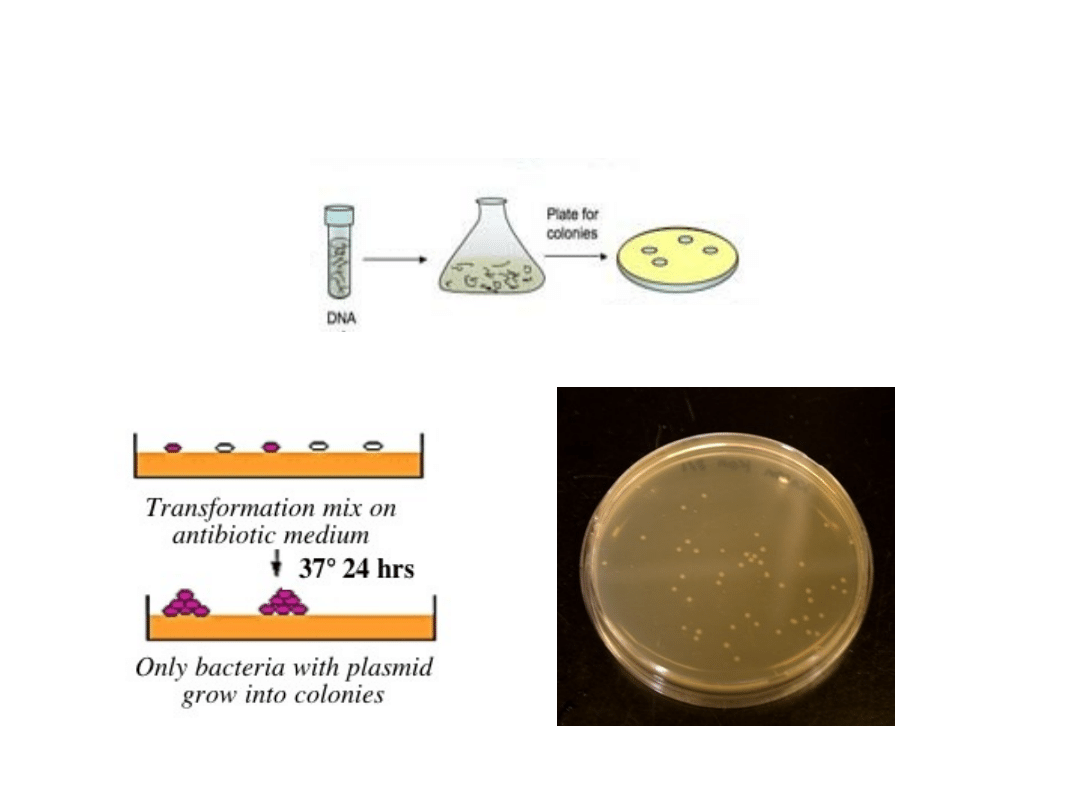
Wysiewanie bakterii na
szalki

Identyfikacja
poszukiwanych
rekombinantów
A Identyfikacja
zrekombinowanych
plazmidów:
1. System
oparty
na
aktywności
-
galaktozydazy
(-komplementacja)
2. Analiza wielkości plazmidu
B Identyfikacja konkretnego klonu:
1. Przeszukiwanie kolonii przy użyciu metod
hybrydyzacyjnych (duża ilość kolonii)
2. Przeszukiwanie kolonii przy pomocy PCR
(niewielka ilość kolonii)
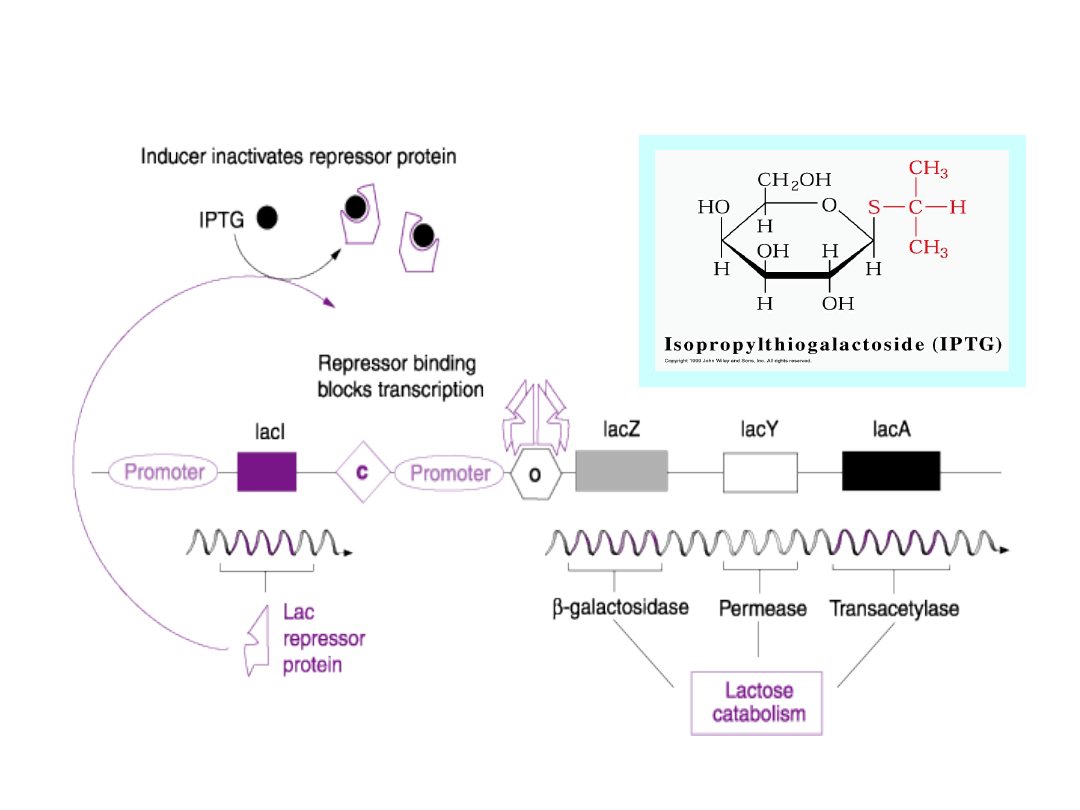
System ekspresyjny indukowany IPTG

Funkcja
enzymatyczna
beta-
galaktozydazy może zostać odtworzona z
dwóch fragmentów polipeptydowych, z
których
żaden
oddzielnie
nie jest aktywny.
Fragment genu kodujący koniec aminowy
(tzw. fragment alfa) jest obecny na
plazmidzie,
podczas
gdy
C-końcowy
(fragment
omega)
występuje
w
chromosomie bakteryjnym gospodarza,
lub na plazmidzie pomocniczym.
Wykorzystanie genu beta
galaktozydazy (lac Z) E.coli do
systemu detekcji
stransformowanych kolonii
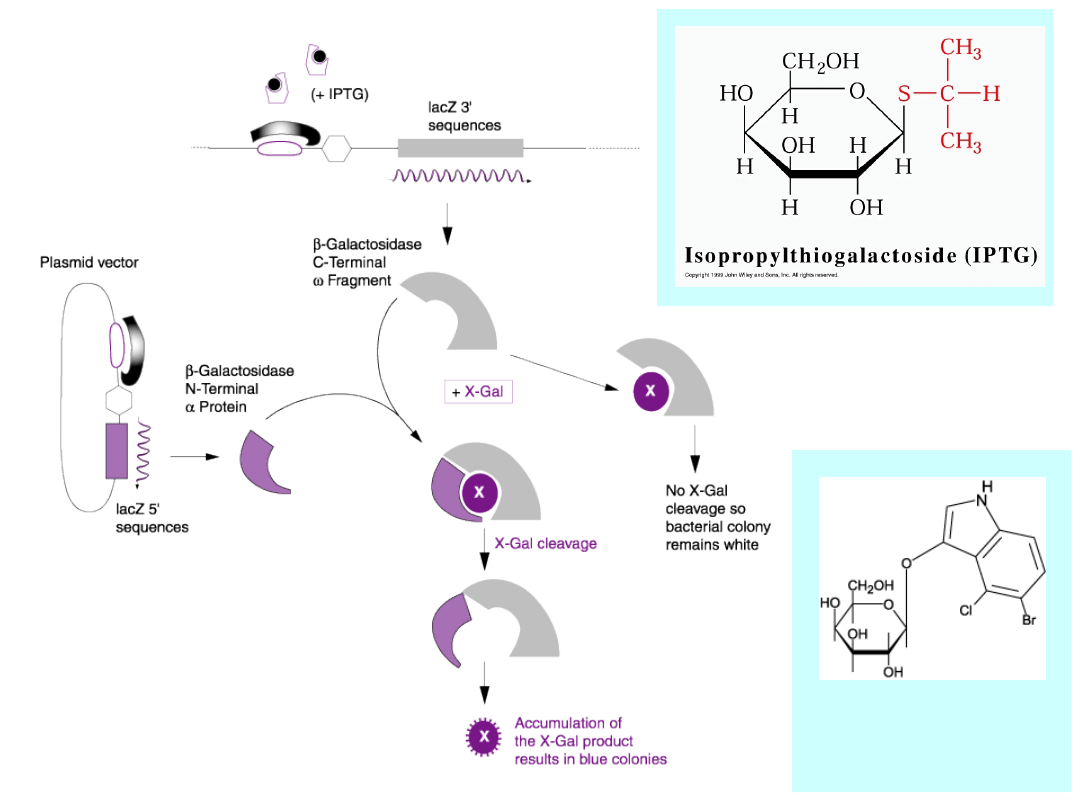
Bacterial DNA
X-gal =
5-bromo-4-chloro-
3-indolilo--D-
galaktozyd
Niebieskie
kolonie
reprezentują
bakterie
oporne
na
ampicylinę, które zawierają wektor i produkują funkcjonalny
fragment
alfa
z nieuszkodzonej sekwencji kodującej LacZ alfa (brak insertu).
Białe kolonie reprezentują bakterie oporne na ampicylinę,
które zawierają wektor z insertem i nie produkują aktywnego
fragmentu alfa LacZ.
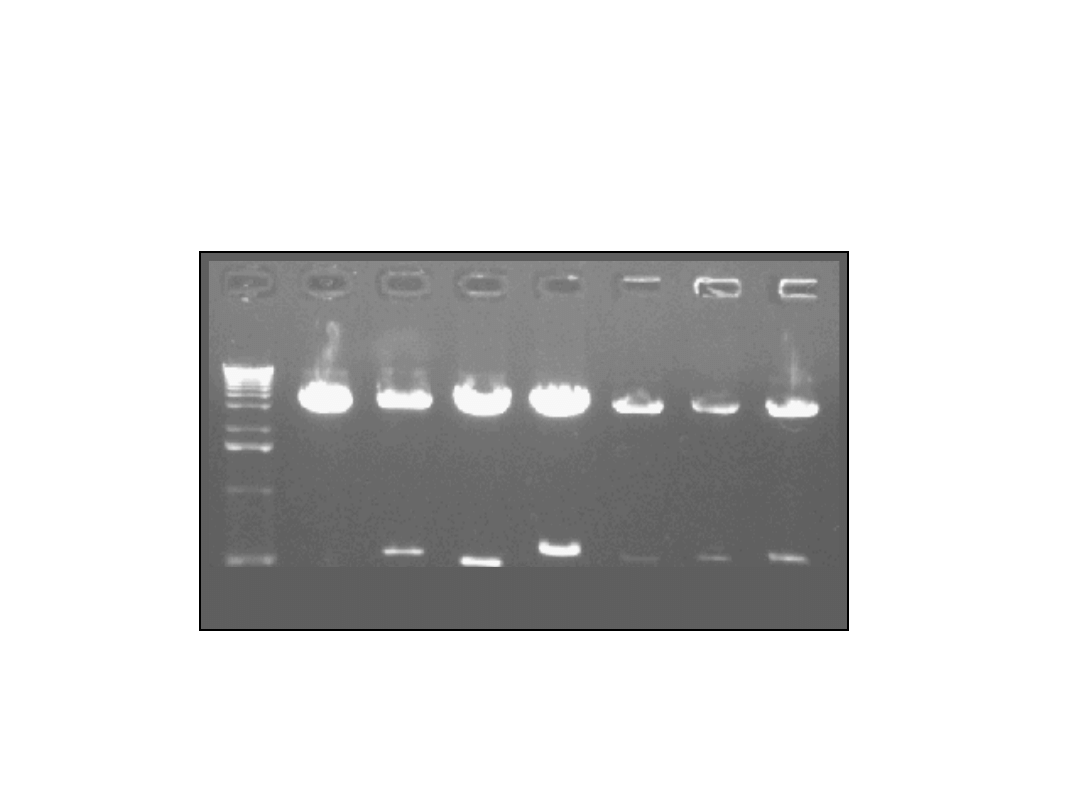
Elektroforeza trawionego
plazmidu
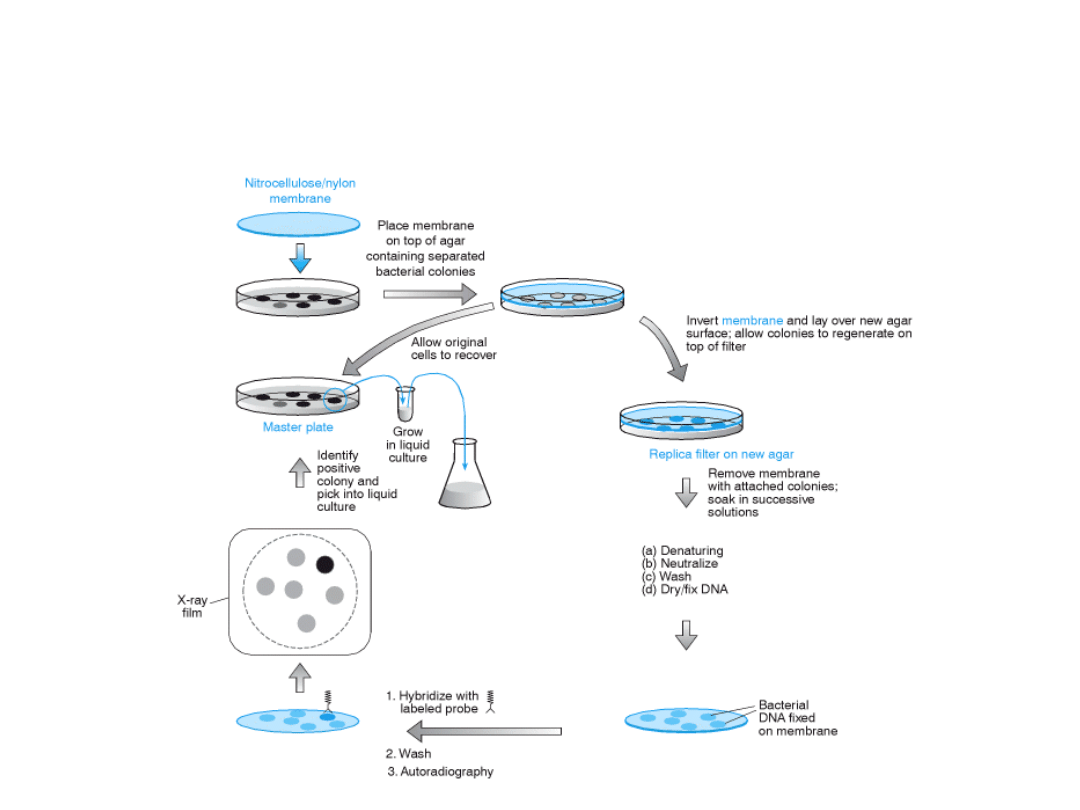
Identyfikacja rekombinantów
przez hybrydyzację

Przeszukiwanie kolonii przy
pomocy PCR
Startery specyficzne dla poszukiwanej wstawki
pozwalają na identyfikację poszukiwanej
sekwencji.
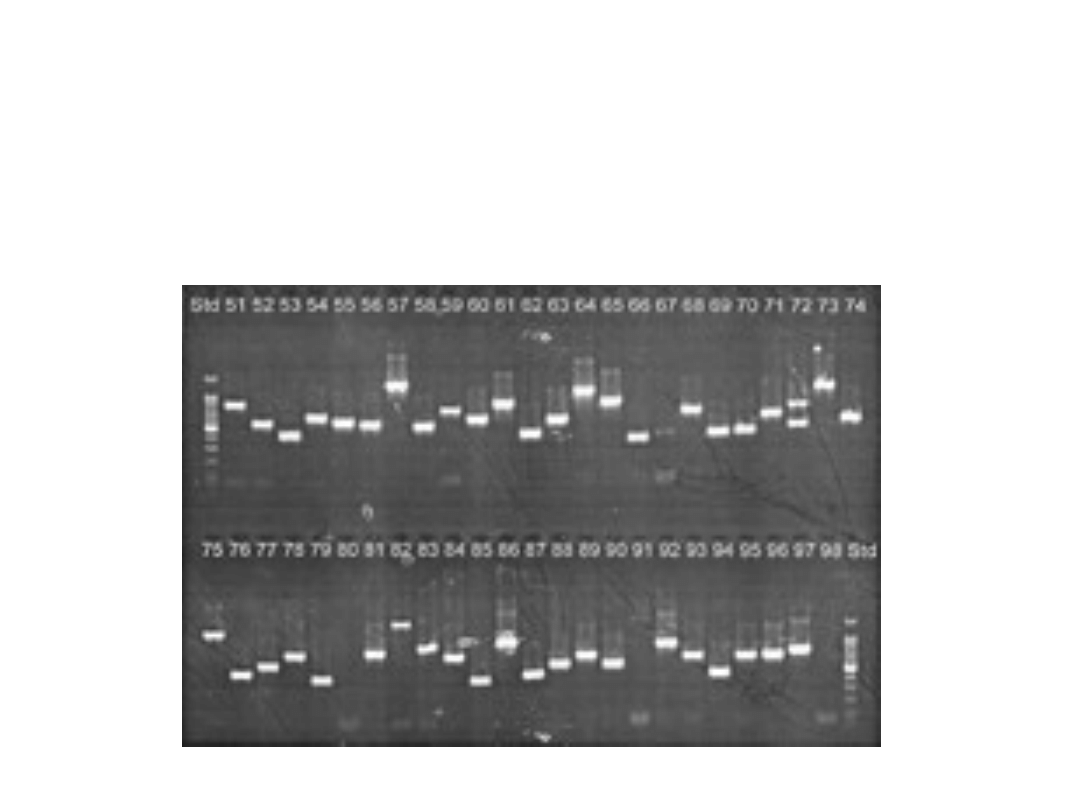
Wykorzystanie starterów
flankujących wstawkę pozwala
na wykrycie wszystkich
rekombinantów
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
Wyszukiwarka
Podobne podstrony:
BMiGO Wykład 4 PCR, Sekwencjonowanie
biol.medyczna, wykład - Klonowanie, Klonowanie
BMiGO Wykład 1 DNA izolacja i analiza
BMiGO Wykład 5 Izolacja RNA, hybrydyzacja, RT PCR
Napęd Elektryczny wykład
wykład5
Psychologia wykład 1 Stres i radzenie sobie z nim zjazd B
Wykład 04
geriatria p pokarmowy wyklad materialy
ostre stany w alergologii wyklad 2003
WYKŁAD VII
Wykład 1, WPŁYW ŻYWIENIA NA ZDROWIE W RÓŻNYCH ETAPACH ŻYCIA CZŁOWIEKA
Zaburzenia nerwicowe wyklad
Szkol Wykład do Or
Strategie marketingowe prezentacje wykład
Wykład 6 2009 Użytkowanie obiektu
więcej podobnych podstron