RABBIA
RABBIA
Malattia infettiva virale del
S.N.C., ad esito infausto, che
colpisce animali a sangue caldo
ed occasionalmente anche l’uomo
occasionalmente anche l’uomo
(zoonosi)
; viene trasmessa con la
saliva
degli
animali
infetti
tramite il morso o, raramente, il
graffio o il leccamento.
Rabbia
Rabbia
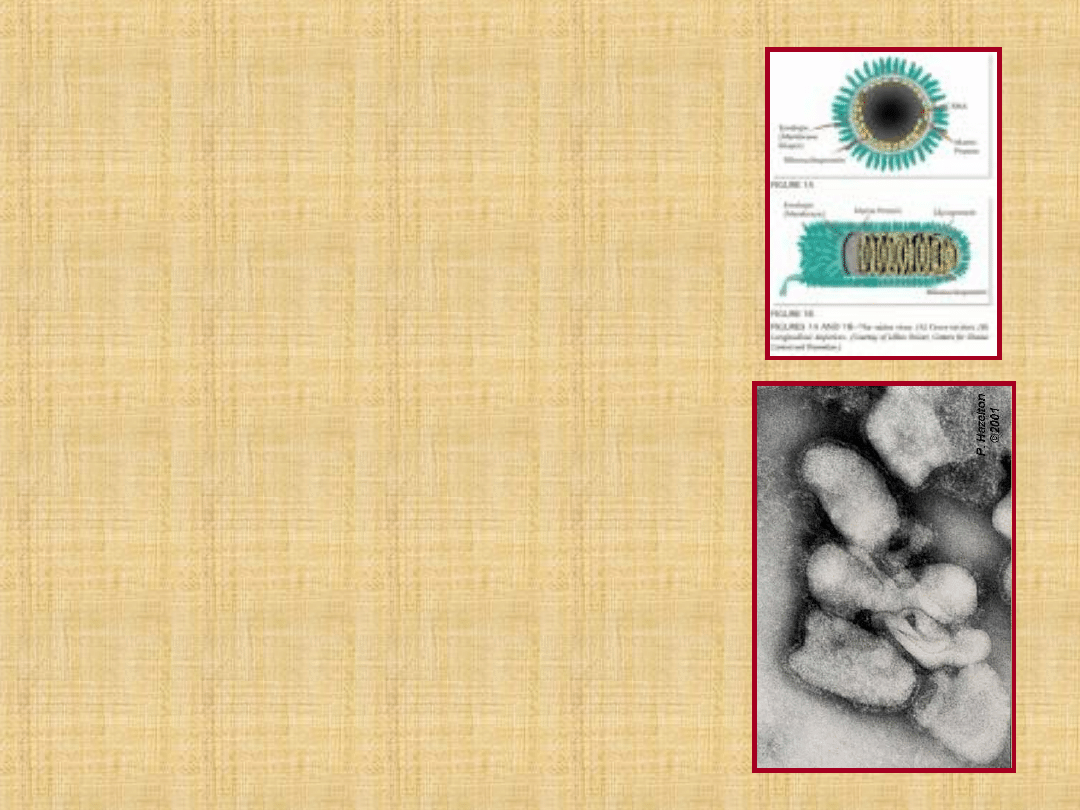
Eziologia
Eziologia
Virus Rabico
Virus Rabico
, genere
Lyssavirus
Lyssavirus
, famiglia
Rhabdoviridae
Rhabdoviridae
RNA-virus, simmetria elicoidale,
aspetto “a proiettile”,
dimensioni: 130-200 nm,
Ǿ 60-100 nm; nucleocapside
con membrana esterna a
doppio strato da cui originano
numerose protuberanze
Sensibile: pasteurizzazione, UV,
solventi lipidi
Resistente: essiccamento,
congelamento/scongelamento

Rabbia
Rabbia
Eziologia
Eziologia
Antigeni ( Ab. Nt, HAI, FC):
Proteina N (Nucleocapside) gruppospecifico
Glicoproteina G
–
Proteine di Membrana M
1
, M
2
Spettro d’ospite:
Coltura: Uova embrionate (pollo, anatra), C.
Cellululari Primarie (encefalo embrionale topo, rene
criceto, cane, …), C.C.Linea Continua
Animali di laboratorio: topo, criceto, cavia, coniglio
(via intra-cerebri)
2 tipi di virus:
Virus da strada
: variabilità di virulenza,
localizzazione S.N. e Ghiandole salivari
Virus fisso
(+++ passaggi intra-cerebri):
localizzazione solo S.N., incubazione costante, breve
Rabbia
Rabbia
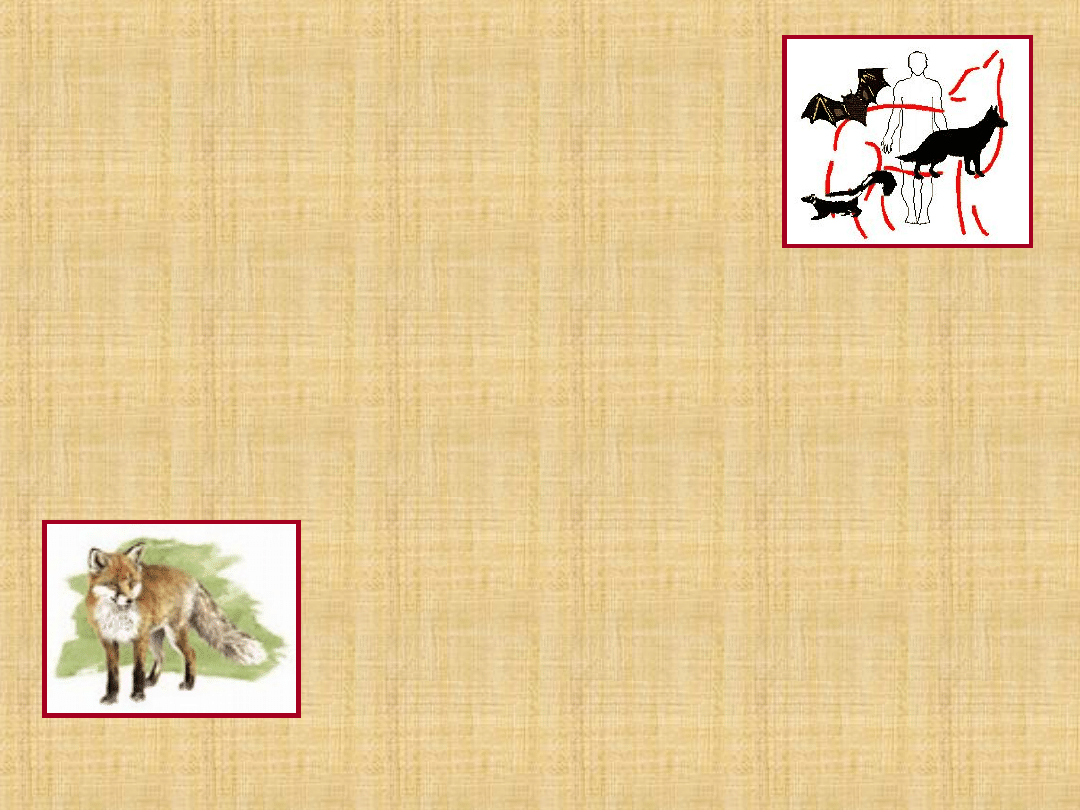
Epidemiologia
Epidemiologia
Malattia animale ubiquitaria, raramente
interessa l’uomo (zoonosi)
Animali a sangue caldo: tutti ma solo
alcuni possono trasmettere la malattia
(morso +++) cani, gatti, volpi, lupi,
sciacalli, pipistrelli, vampiri.
Serbatoio principale virus: cani randagi,
animali selvatici; Europa volpe
Attuale epizoozia da focolaio volpino in
Polonia (1935) diffusione II
a
guerra
mondiale Germania 1947; Danimarca,
Olanda 1964; Belgio, Lussemburgo,
Austria 1966; Svizzera 1967; Francia
1968.
Dal 1977 in Italia, regione alpina: Alto
Adige, Trentino, Lombardia, Piemonte;
non casi umani !
Animale
Animale
Uomo
≠
Uomo

Rabbia
Rabbia
Patogenesi
Patogenesi
Penetrazione
: morso animale;
Diffusione
: nervi periferici
(spazi periassonali) cellule
nervose gangli spinali (1
a
replica) midollo, fasci dorsali
encefalo: neuroni lobo limbico,
corno d’Annone, ipotalamo,
tronco, corteccia cerebellare
vie nervose: periferia
ghiandole salivari saliva
Rabiesvirus
Rabiesvirus
intracellular
intracellular
e
e
Rabbia
Rabbia
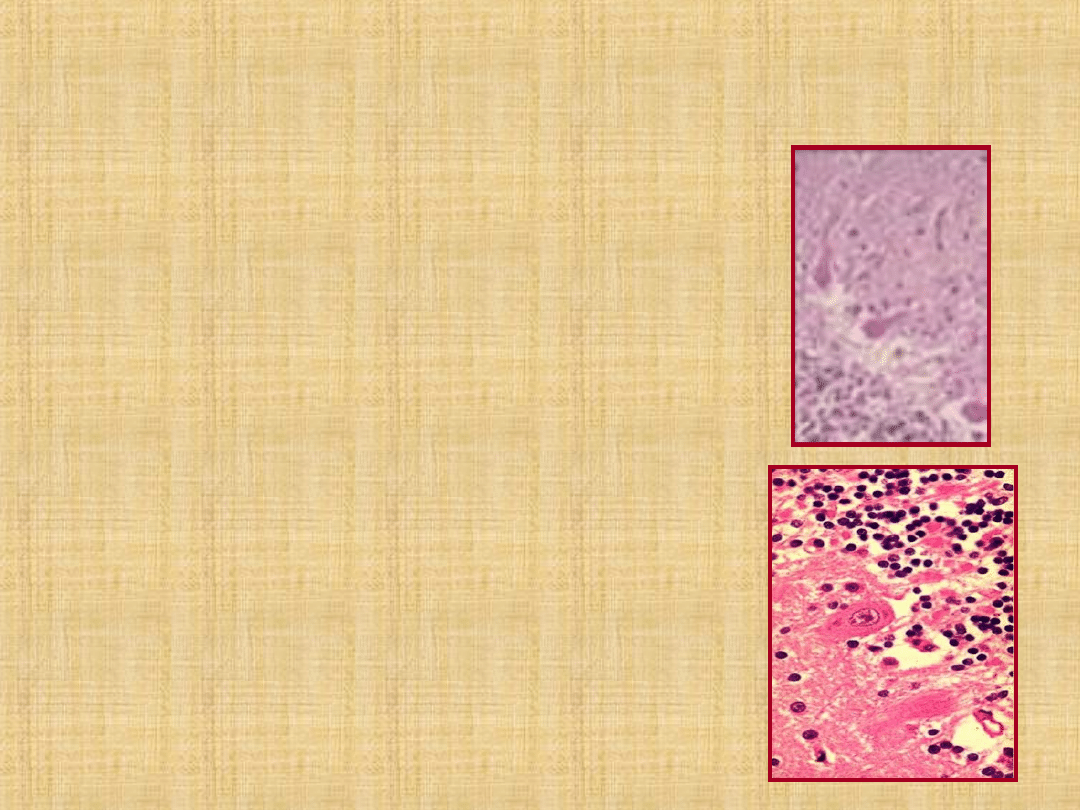
Anatomia Patologica
Anatomia Patologica
Encefalomielite non purulenta
Encefalomielite non purulenta
:
congestione meningea ed edema
cerebrale;
alterazione neuroni sostanza
grigia;
infiltrati di cellule mononucleate
perivascolari e perineuronali.
“Corpi del Negri” : inclusi
eosinofili intracitoplasmatici,
rotondeggianti (Ø 1-15 m)
presenti in tutto il SNC, ma +++
densità sedi di infezione (Corno
d’Annone)

Rabbia
Rabbia
Clinica
Clinica
(1)
Periodo di Incubazione
: 15 gg – 4 m
Localizzazione: testa ≠ arti
Età soggetto: giovane ≠ anziano
Fase Prodromica
: 2 – 4 gg
Cefalea, malessere
Sede del morso : prurito,
parestesie, anestesia + iperestesia
circostante

Rabbia
Rabbia
Clinica
Clinica
(2)
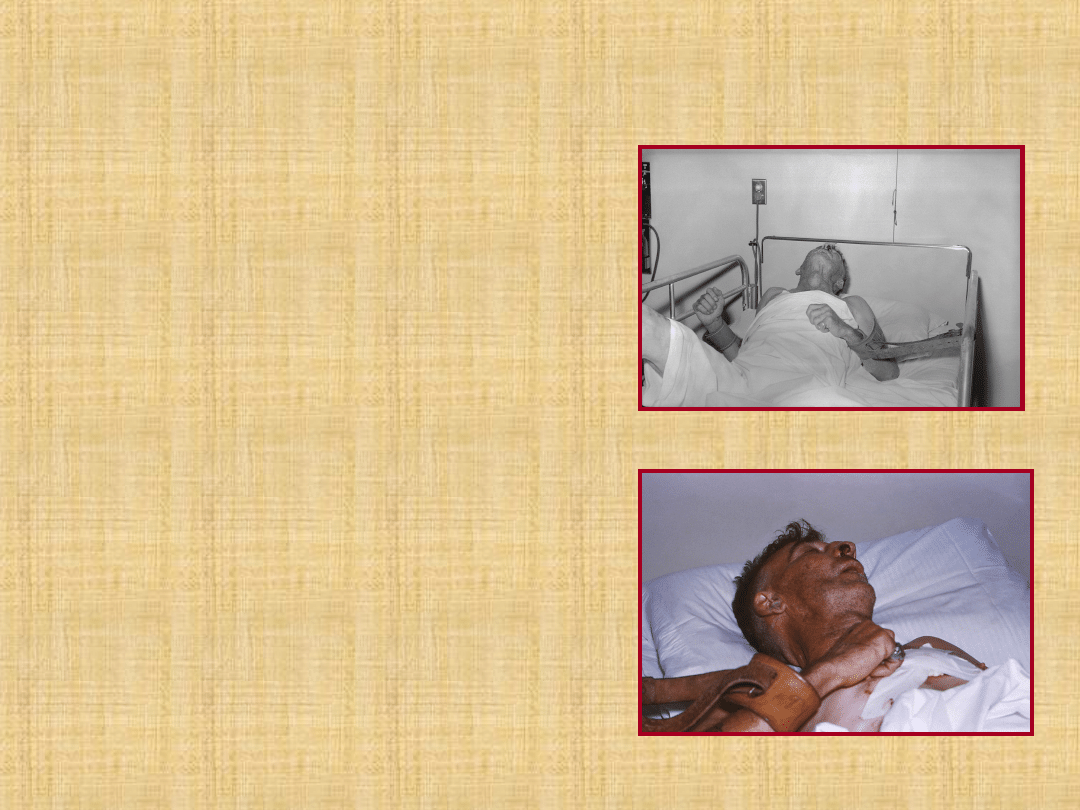
Fase di eccitamento
:
Agitazione, allucinazioni, movimenti
afinalistici
Episodi di paura, di ira irrazionale o di
depressione
Spasmi dolorosi oro-faringei tracheo-
bronchiali, crisi asfittiche – provocati da
deglutizione/vista di liquidi = “idrofobia
idrofobia
”
Ipersensibilità a stimoli esterocettivi
convulsioni
S.N. Autonomo : midriasi, lacrimazione,
sudorazione, salivazione, spesso
sanguinolenta con scolo dai lati della bocca.
Rabbia
Rabbia
Clinica
Clinica
(3)
Respiro superficiale, polso
piccolo, frequente, t°C
In 3-5 gg : spasmi
frequenti, +++ crisi
convulsive morte (per
crisi di apnea)
Fase Paralitica
:
se
sopravvive alla fase
precedente dopo 3-5 gg:
Paralisi, prima all’arto
interessato, poi diffuse,
flaccide
Depressione, apatia,
iporeflessia coma
morte (per insufficienza
cardiaca)

Rabbia
Rabbia
Clinica
Clinica
(4)
Dati strumentali e di laboratorio
EEG: profonde alterazioni,
disorganizzazione del ritmo
LCR: normale; non caratteristiche
alterazioni emato-chimiche
Diagnosi
Sindrome neurologica dopo morso di
animali !!! (zone di endemia)
Isolamento virale (saliva); sierologia;
PCR (laboratori di riferimento)
Prognosi
Infausta !

Rabbia
Rabbia
Diagnosi
Diagnosi
(a)
(a)
Gold standard WHO : direct
direct
Fluorescent Antibody test
Fluorescent Antibody test
(dFA
test)
Ricerca diretta nucleoproteine
antigeniche su tessuto nervoso,
preferibilmente non fissato in
formalina, mediante anticorpi
anti-rabbia fluoresceinati
(essenzialmente esame post-
mortem)
Rabies virus replica nel citoplasma
delle cellule; queste possono
contenere inclusioni grandi
inclusioni grandi
(2-10
μm), ovali o rotonde, di nucleo-
proteine o particelle più piccole
particelle più piccole
(<1 μm), che appaiono
fluorescenti al dFA test
.
Rabbia
Rabbia
Diagnosi
Diagnosi
(b)
(b)
Istopatologia generale
Evidenza di encefalomielite su materiale da biopsia
o autopsia cerebrale (color.EO) unico metodo
diagnostico storico
Encefalomielite rabida include varie lesioni
patologiche tipiche tra cui:
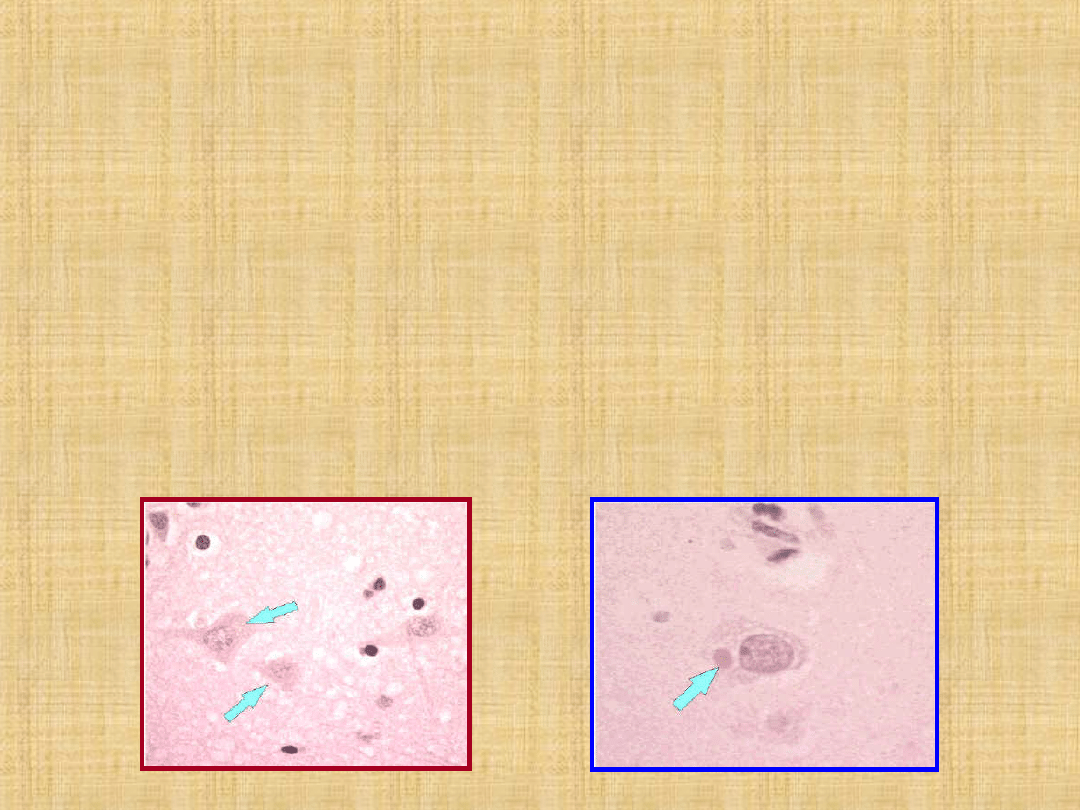
Corpi del Negri
Corpi del Negri
inclusioni rotondeggianti (0,25 –
27 μm) nel citoplasma di cellule nervose (c.
piramidali corno di Annone, c. del Purkinje
cervelletto, ma anche neuroni, ghiandole salivari,
lingua, ecc.)
Neuron without Negri
bodies - CDC
Negri body in infected neuron
- CDC

Rabbia
Rabbia
Diagnosi in vita
Diagnosi in vita
(Protocollo CDC,
USA)
Ricerca antigeni
Ricerca antigeni
(dFA) nei nervi cutanei alla base dei
follicoli piliferi della nuca Biopsia cutanea (~4 mm)
Ricerca anticorpi
Ricerca anticorpi
(Nt o ELISA) Siero e Liquor: la
positività su siero è diagnostica se il pz. non è stato
vaccinato né immunizzato; in tal caso l’esame su
liquor è superfluo
Rt-PCR
Rt-PCR
Saliva e biopsie cutanee, con sequenziamento
genico per identificare le varianti virali.
Immunoistochimica
Immunoistochimica
Ab marcati, anche monoclonali,
per svelare inclusioni cellulari in tessuti fissati in
formalina.
Isolamento virale
Isolamento virale
in colture cellulari, cellule di
neuroblastoma di topo (MNA) e di rene di hamster
neonato (BHK) o, più raramente, in animali da
laboratorio. E’ un metodo di amplificazione che
permette la moltiplicazione del virus (quando di
difficile identificazione con tecniche precedenti)

Rabbia
Rabbia
Profilassi
Profilassi
Lotta alle epizoozie (abbattimento delle
volpi)
Prevenzione esposizione umana
Vaccinazione animali
Lotta al randagismo
Vaccinazione preventiva soggetti
potenzialmente esposti
Vaccinazione post-esposizione +
immunotrattamento [IgG specifiche
umane, (IgG cavallo)] + toilette lesione
(saponi, sali di ammonio quaternario,
alcool 70°, tintura di jodio)

Rabbia
Rabbia
Profilassi vaccinica
Profilassi vaccinica
HDCV
HDCV
(Human Diploid Cell Vaccine)
preparato con virus coltivato su cellule
diploidi umane, inattivato con β-
propionolattone
Non effetti secondari pericolosi
Minor numero di inoculazioni
Risposta anticorpale a titolo più elevato
Costo elevato
Altri vaccini (non più usati negli USA ed in
Europa) :
DBV
DBV
(Duck Embryo Vaccine) preparato su cellule
d’anatra, scarsamente immunogeno, complicanze
neurologiche 1:25.000
NTV
NTV
(Nervous Tissue Vaccine) ex “Fermi”,
preparato su tessuto nervoso animale,
complicanze neurologiche 1:2.000

Rabbia
Rabbia
Profilassi vaccinica post-
Profilassi vaccinica post-
esposizione
esposizione
(Centers for Disease Control and Prevention - USA -
1999)
Specie Animale
Condizioni Animale al
Momento del Morso
Trattamento Soggetti
Esposti
Cane, Gatto,
Furetto
Sano o rintracciabili;
10 gg osserazione
Rabido o sospetto;
Sconosciuto o
fuggito
Nessuno, a meno di
insorgenza sintomi
nell’animale
RIG + HDCV
Volpe, Tasso,
Faina, Ghiro,
Martora, Riccio,
Camoscio,
Capriolo,
Pipistrello,
Scimmia, Iena,
Coyote, …
Da considerare
rabidi fino a prova
contraria (Abbattere
animale ed esami di
laboratorio)
RIG + HDCV
Bestiame (equini,
bovini, ovini,
caprini, …),
conigli, lepri ed
altri roditori
Valutare caso per
caso; sentire Centro
di Riferimento locale
Non richiedono
generalmente
trattamento specifico
morsi di: scoiattoli,
criceti, cavie, gerbilli,
topi, ratti ed altri
roditori
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
Wyszukiwarka
Podobne podstrony:
04 22 PAROTITE EPIDEMICA
zestawy zadań, rrz 04 22
pg 2010 04 22
Intro FINALDraft 04 22 05
2009-04-22, pedagogium, wykłady, Teoretyczne podstawy wychowania, ćwiczenia
2002 04 22
04.2010-04-22
04 22 NEVRASSITI
Zaliczenie 08 04 22
zestawy zadań rrz-04-22
SERWIS 2010.04.22
plan 11.04-22.04, plany, scenariusze, Plany
ERA-2011.04.22-all, 1---Eksporty-all, 1---Eksporty---, 8---telefony+info, telefony-all, Era-all-info
04 22 ENTEROVIROSI POLIO
2003 04 22
2010-04-22, Zarządzanie kryzysowe, Obrona Cywilna
04 22 Uczenie się i rozwój a komunikacjaid 4959 ppt
04 22 PAROTITE EPIDEMICA
więcej podobnych podstron