
Układ okresowy
pierwiastków
Układ okresowy
pierwiastków

Dymitr Mendelejew
Wielki chemik rosyjski żyjący w latach 1834-1907.
Sformułował w 1896 roku prawo okresowości.
Twierdzenie to zakłada, że właściwości chemiczne i
fizyczne zmieniają się okresowo, w miarę jak od
pierwiastków o mniejszej liczbie atomowej
przechodzimy do tych o coraz większej liczbie
atomowej. Początkowo uczony wraz z Lotharem
Mayerem szeregowali pierwiastki według
wzrastającego ciężaru atomowego, ponieważ nie
znali wtedy jeszcze pojęcia liczby atomowej.
Wyjaśnienie tego stało się możliwe w XX wieku, kiedy
poznano strukturę atomu.
Wielki chemik rosyjski żyjący w latach 1834-1907.
Sformułował w 1896 roku prawo okresowości.
Twierdzenie to zakłada, że właściwości chemiczne i
fizyczne zmieniają się okresowo, w miarę jak od
pierwiastków o mniejszej liczbie atomowej
przechodzimy do tych o coraz większej liczbie
atomowej. Początkowo uczony wraz z Lotharem
Mayerem szeregowali pierwiastki według
wzrastającego ciężaru atomowego, ponieważ nie
znali wtedy jeszcze pojęcia liczby atomowej.
Wyjaśnienie tego stało się możliwe w XX wieku, kiedy
poznano strukturę atomu.

Mendelejew oprócz wygłoszonego prawa,
stworzył układ okresowy pierwiastków i
przewidział istnienie i niektóre właściwości kilku
pierwiastków chemicznych m.in. galu, skandu,
germanu, polonu i fransu oraz ich związków.
Prowadził badania w dziedzinie roztworów,
termochemii, katalizy, chemii pierwiastków ziem
rzadkich (badał ropę naftową).
Opracował metodę produkcji
prochu bezdymnego.
Napisał również kilka prac naukowych.
Mendelejew oprócz wygłoszonego prawa,
stworzył układ okresowy pierwiastków i
przewidział istnienie i niektóre właściwości kilku
pierwiastków chemicznych m.in. galu, skandu,
germanu, polonu i fransu oraz ich związków.
Prowadził badania w dziedzinie roztworów,
termochemii, katalizy, chemii pierwiastków ziem
rzadkich (badał ropę naftową).
Opracował metodę produkcji
prochu bezdymnego.
Napisał również kilka prac naukowych.

W tabeli układu okresowego przewidziane były
miejsca dla prawdopodobnie istniejących, a nie
odkrytych jeszcze pierwiastków. W kilku miejscach
przestawiono kolejność pierwiastków, uznając
podobieństwo właściwości pierwiastków w tej samej
grupie za ważniejsze od ich masy atomowej (np. jod o
masie 126,9 u został umieszczony za tellurem o masie
127,6 u aby zgodnie z właściwościami, znaleźć się w
tej samej grupie, co fluor, chlor i brom. Mendelejew
pozostawił miejsce np. przed glinem, dla eka – glinu
lub krzemem dla eka – krzemu. Ponadto na podstawie
ich położenia w swojej tabeli określił, jakie powinny
być ich przybliżone masy atomowe i właściwości.
W tabeli układu okresowego przewidziane były
miejsca dla prawdopodobnie istniejących, a nie
odkrytych jeszcze pierwiastków. W kilku miejscach
przestawiono kolejność pierwiastków, uznając
podobieństwo właściwości pierwiastków w tej samej
grupie za ważniejsze od ich masy atomowej (np. jod o
masie 126,9 u został umieszczony za tellurem o masie
127,6 u aby zgodnie z właściwościami, znaleźć się w
tej samej grupie, co fluor, chlor i brom. Mendelejew
pozostawił miejsce np. przed glinem, dla eka – glinu
lub krzemem dla eka – krzemu. Ponadto na podstawie
ich położenia w swojej tabeli określił, jakie powinny
być ich przybliżone masy atomowe i właściwości.

Układ okresowy pierwiastków podany przez Mendelejewa
składa się z rzędów:
poziomych (
okresów
)
i pionowych (
grup
),
przy czym grupy tworzyły pierwiastki o zbliżonych
własnościach.
Puste miejsca zostały pozostawione dla odkrytych później:
skandu, galu, germanu, itru, technetu, indu, ceru i renu.
Przykładami własności pierwiastków podlegających prawu
okresowości są m.in. objętość atomowa, energia jonizacji,
powinowactwo elektronowe, elektroujemność, promień
atomowy, promień jonowy, gęstość, własności metaliczne
i niemetaliczne, temperatura topnienia i wrzenia, aktywność
i inne.

Krótka charakterystyka układu
okresowego:
Część grup rozpoczyna się od okresu 1 lub 2. Są
to tzw.
GRUPY GŁÓWNE
. Rozmieszczone są one
z lewej i prawej strony układu okresowego i
oznaczone są liczbami
1, 2, 13, 14, 15, 16, 17, 18
,
tworzące bloki s i p, przy czym pierwiastki z 18
grupy to pierwiastki gazowe o całkowicie
zapełnionej ostatniej powłoce elektronowej,
nazywane z racji swej bierności chemicznej
gazami szlachetnymi.
Pierwiastki grup głównych – bloków s i p zajmują
skrajne części tablicy Mendelejewa.
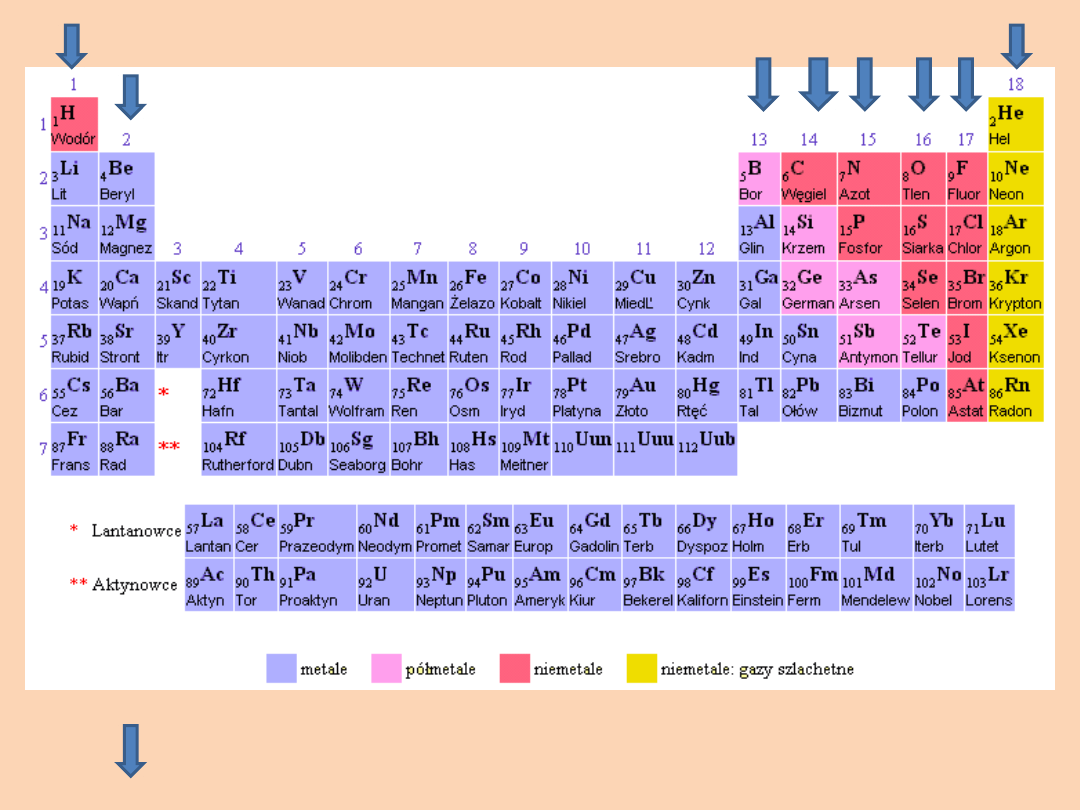
Strzałkami zostały oznaczone GRUPY GŁÓWNE

W części środkowej znajdują się
pierwiastki GRUP PRZEJŚCIOWYCH
( pobocznych), czyli
pierwiastki bloku d.
Pierwiastki bloku f zostały wyodrębnione
w dwa szeregi u dołu tablicy jako
lantanowce (wypełniające orbital 4f)i
aktynowce
( wypełniają orbital 5f).
W części środkowej znajdują się
pierwiastki
GRUP PRZEJŚCIOWYCH
( pobocznych), czyli
pierwiastki bloku d.
Pierwiastki bloku f zostały wyodrębnione
w dwa szeregi u dołu tablicy jako
lantanowce (wypełniające orbital 4f)i
aktynowce
( wypełniają orbital 5f).
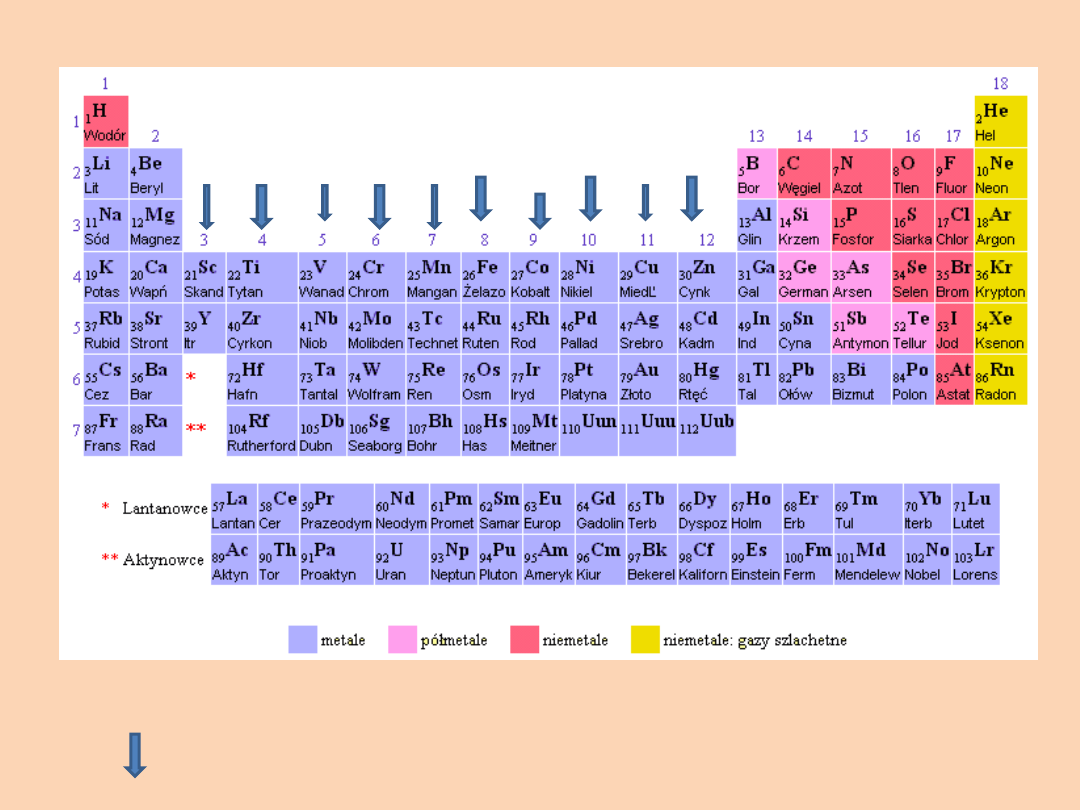
Strzałkami zostały oznaczone GRUPY POBOCZNE (przejściowe)

Pierwiastek chemiczny
Pierwiastek chemiczny
• Pierwiastek chemiczny, zbiór atomów o tej samej
liczbie atomowej. Atomy danego pierwiastka chemicznego
mogą się różnić liczbą neutronów, a zatem i masą jądra.
Atomy takie nazywamy izotopami danego pierwiastka.
Niektóre pierwiastki chemiczne tworzą odmiany
alotropowe (alotropia).
Przemiany jednych pierwiastków w inne zachodzą
samorzutnie w przypadku pierwiastków
promieniotwórczych (promieniotwórczość naturalna), a w
przypadku innych pierwiastków tylko w wyniku
bombardowania jąder atomowych wysokoenergetycznymi
cząstkami lub powolnymi neutronami.
• Pierwiastek chemiczny
, zbiór atomów o tej samej
liczbie atomowej. Atomy danego pierwiastka chemicznego
mogą się różnić liczbą neutronów, a zatem i masą jądra.
Atomy takie nazywamy izotopami danego pierwiastka.
Niektóre pierwiastki chemiczne tworzą odmiany
alotropowe (alotropia).
Przemiany jednych pierwiastków w inne zachodzą
samorzutnie w przypadku pierwiastków
promieniotwórczych (promieniotwórczość naturalna), a w
przypadku innych pierwiastków tylko w wyniku
bombardowania jąder atomowych wysokoenergetycznymi
cząstkami lub powolnymi neutronami.
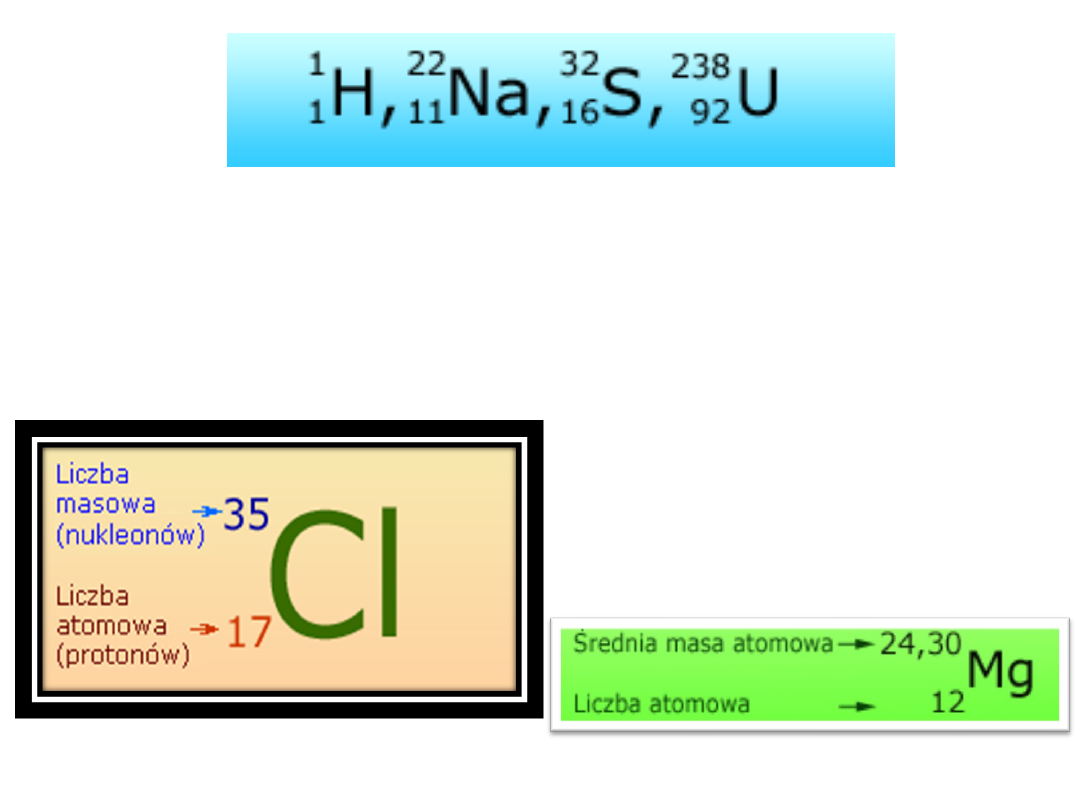
W tablicy układu okresowego wykorzystuje się
skrótowe oznaczenia pierwiastka chemicznego
(symbole pierwiastka) z dopisanymi wskaźnikami
- dolny z lewej strony z podaniem liczby
ładunkowej Z, górny - z podaniem liczby
masowej lub masy atomowej.
Liczba masowa – liczba
atomowa
= LICZBA NEUTRONÓW
Masa atomowa w odróżnieniu od
liczby masowej najczęściej nie
jest liczbą całkowitą - zobacz
układ okresowy. Często jest ona
nazwana średnią masą
atomową.
PODZIAŁ PIERWIASTKÓW CHEMICZNYCH
PODZIAŁ PIERWIASTKÓW CHEMICZNYCH
METALE
METALE
PÓŁMETALE
PÓŁMETALE
NIEMETALE
(+gazy
szlachetne)
NIEMETALE
(+gazy
szlachetne)

METALE
(najliczniejsza grupa)
METALE
(najliczniejsza grupa)
Metale, dobrze przewodzące ciepło i elektryczność
pierwiastki chemiczne, odznaczające się zazwyczaj
kowalnością i charakterystycznym połyskiem. Mają
najczęściej niską elektroujemność, w reakcjach
chemicznych wykazują tendencję do oddawania
elektronów. W temperaturze pokojowej wszystkie
metale, z wyjątkiem rtęci, występują w stałym stanie
skupienia (tworzą tzw. kryształy metaliczne).
Na 111 znanych obecnie pierwiastków
88
stanowią
metale. Zależnie od gęstości metale dzieli się na metale
lekkie oraz metale ciężkie. Z uwagi na położenie w
układzie okresowym pierwiastków (wynikające z
budowy ich atomów) można je podzielić na metale grup
głównych, wraz z cynkowcami, oraz metale przejściowe.
Metale, dobrze przewodzące ciepło i elektryczność
pierwiastki chemiczne, odznaczające się zazwyczaj
kowalnością i charakterystycznym połyskiem. Mają
najczęściej niską elektroujemność, w reakcjach
chemicznych wykazują tendencję do oddawania
elektronów. W temperaturze pokojowej wszystkie
metale, z wyjątkiem rtęci, występują w stałym stanie
skupienia (tworzą tzw. kryształy metaliczne).
Na 111 znanych obecnie pierwiastków
88
stanowią
metale. Zależnie od gęstości metale dzieli się na metale
lekkie oraz metale ciężkie. Z uwagi na położenie w
układzie okresowym pierwiastków (wynikające z
budowy ich atomów) można je podzielić na metale grup
głównych, wraz z cynkowcami, oraz metale przejściowe.

PÓŁMETALE
PÓŁMETALE
Półmetale, pierwiastki posiadające charakter
pośredni pomiędzy metalami i niemetalami: bor,
krzem, german, arsen, antymon, selen, tellur.
Półmetale mają szereg fizycznych cech metali, jak
połyskliwa powierzchnia w stanie stałym i
wysokie temperatury topnienia. Chociaż mają one
dużo gorsze przewodnictwo elektryczne i cieplne
od typowych metali, to jednak wyższe od
typowych niemetali, stąd też są stosowane w
materiałach półprzewodnikowych.
Półmetale, pierwiastki posiadające charakter
pośredni pomiędzy metalami i niemetalami: bor,
krzem, german, arsen, antymon, selen, tellur.
Półmetale mają szereg fizycznych cech metali, jak
połyskliwa powierzchnia w stanie stałym i
wysokie temperatury topnienia. Chociaż mają one
dużo gorsze przewodnictwo elektryczne i cieplne
od typowych metali, to jednak wyższe od
typowych niemetali, stąd też są stosowane w
materiałach półprzewodnikowych.

NIEMETALE
NIEMETALE
Niemetale, nie wykazują żadnych właściwości
metalicznych. Inaczej niż w przypadku metali, nie
można podać jednoznacznych cech wszystkich
niemetali, gdyż są one
bardzo zróżnicowane.
Pierwiastków niemetalicznych jest znacznie mniej (18)
niż metalicznych, które stanowią całą pozostałą część
układu okresowego.
Do niemetali zaliczamy GAZY SZLACHETNE
(znajdujące się w osiemnastej grupie). Mają one
bardzo szczególne własności fizyczne i chemiczne.
Niemetale, nie wykazują żadnych właściwości
metalicznych. Inaczej niż w przypadku metali, nie
można podać jednoznacznych cech wszystkich
niemetali, gdyż są one
bardzo zróżnicowane.
Pierwiastków niemetalicznych jest znacznie mniej (18)
niż metalicznych, które stanowią całą pozostałą część
układu okresowego.
Do niemetali zaliczamy GAZY SZLACHETNE
(znajdujące się w osiemnastej grupie). Mają one
bardzo szczególne własności fizyczne i chemiczne.

Podstawę współczesnego układu pierwiastków
stanowi ich konfiguracja elektronowa
wyznaczająca podział na bloki: s,p,d,f.
- Blok s obejmuje pierwiastki grupy 1 i 2.
- Blok p obejmuje pierwiastki grup od 13 do 18.
- Blok d obejmuje pierwiastki grup od 3 do 12.
- Blok f tworzą lantanowce i aktynowce.
Podstawę współczesnego układu pierwiastków
stanowi ich konfiguracja elektronowa
wyznaczająca podział na bloki: s,p,d,f.
- Blok s obejmuje pierwiastki grupy 1 i 2.
- Blok p obejmuje pierwiastki grup od 13 do 18.
- Blok d obejmuje pierwiastki grup od 3 do 12.
- Blok f tworzą lantanowce i aktynowce.

Okresowość fizycznych i chemicznych właściwości
pierwiastków spowodowana jest regularnym
powtarzaniem się analogicznych konfiguracji
walencyjnych. O strukturze układu okresowego
decyduje kolejność zapełniania elektronami
poszczególnych powłok i podpowłok. Pierwiastki o
wspólnej konfiguracji walencyjnej, tworzące grupę, mają
zbliżone własności chemiczne. Niewielkie różnice we
właściwościach tych pierwiastków uwarunkowane są
odmienną budową rdzenia. Wynika z stąd wniosek o
dominującym wpływie elektronów walencyjnych na
właściwości pierwiastków i drugi wniosek, że budowa
rdzenia nie pozostaje bez wpływu na cechy chemiczne,
ale wpływ ten jest wielokrotnie słabszy. Masy atomowe
pierwiastków nie zmieniają się w sposób okresowy, jak
inne właściwości, praktycznie, bowiem nie zależą od
liczby elektronów tylko od jądra.
Okresowość fizycznych i chemicznych właściwości
pierwiastków spowodowana jest regularnym
powtarzaniem się analogicznych konfiguracji
walencyjnych. O strukturze układu okresowego
decyduje kolejność zapełniania elektronami
poszczególnych powłok i podpowłok. Pierwiastki o
wspólnej konfiguracji walencyjnej, tworzące grupę, mają
zbliżone własności chemiczne. Niewielkie różnice we
właściwościach tych pierwiastków uwarunkowane są
odmienną budową rdzenia. Wynika z stąd wniosek o
dominującym wpływie elektronów walencyjnych na
właściwości pierwiastków i drugi wniosek, że budowa
rdzenia nie pozostaje bez wpływu na cechy chemiczne,
ale wpływ ten jest wielokrotnie słabszy. Masy atomowe
pierwiastków nie zmieniają się w sposób okresowy, jak
inne właściwości, praktycznie, bowiem nie zależą od
liczby elektronów tylko od jądra.

Zmiany wartości promieni atomowych następują
okresowo, mimo że masa atomowa stale wrasta niemal
liniowo. Masa atomowa jest, bowiem uzależniona od
składu jądra. O objętości atomu decyduje, zatem
czynnik zupełnie inny niż masa. W miarę przybywania
elektronów rośnie ładunek jądra +Z, elektrony są coraz
silniej przyciągane przez jądro i kurczą się rozmiary
chmury elektronowej. Dlatego w obrębie okresu
następuje systematyczne zmniejszanie się promieni
atomowych. Ponowny wzrost promienia atomowego w
atomie pierwiastka rozpoczynającego okres jest
wywołany pojawieniem się nowej powłoki elektronowej.
Zmiany wartości promieni atomowych następują
okresowo, mimo że masa atomowa stale wrasta niemal
liniowo. Masa atomowa jest, bowiem uzależniona od
składu jądra. O objętości atomu decyduje, zatem
czynnik zupełnie inny niż masa. W miarę przybywania
elektronów rośnie ładunek jądra +Z, elektrony są coraz
silniej przyciągane przez jądro i kurczą się rozmiary
chmury elektronowej. Dlatego w obrębie okresu
następuje systematyczne zmniejszanie się promieni
atomowych. Ponowny wzrost promienia atomowego w
atomie pierwiastka rozpoczynającego okres jest
wywołany pojawieniem się nowej powłoki elektronowej.

Koniec.
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
Wyszukiwarka
Podobne podstrony:
II wykład wersja na office 2003
Prawo miejscowe-referat wersja ostateczna, I SEMESTR, streszczenia na egzamin
referat na optymalizację 8 I 2003
wszystkie wykłady z matmy stoiński - wersja na telefon, MATMA, matematyka
Po prostu Office 2003
Referaty przygotowywane na spotkania z rodzicami
wszystkie wykłady z matmy stoiński - wersja na telefon, MATMA, matematyka
wszystkie wykłady z matmy stoiński - wersja na telefon, MATMA, matematyka
referat1, materiały na studia, I rok studiów, Pedagogika społeczna i socjologia
wszystkie wykłady z matmy stoiński - wersja na telefon, MATMA, matematyka
referaty Historia Kultury, referat o chłopach na hk, historia mydła
referat właściwy, Na początek krótkie wprowadzenie aby każdy wiedział o jakim państwie mówimyJ
miesnie brzucha office97 2003
A Prawo energetyczne do BIP wersja na 25 09 2012 id 49516
Pytania wersja na egzamin, Licencjat
więcej podobnych podstron