
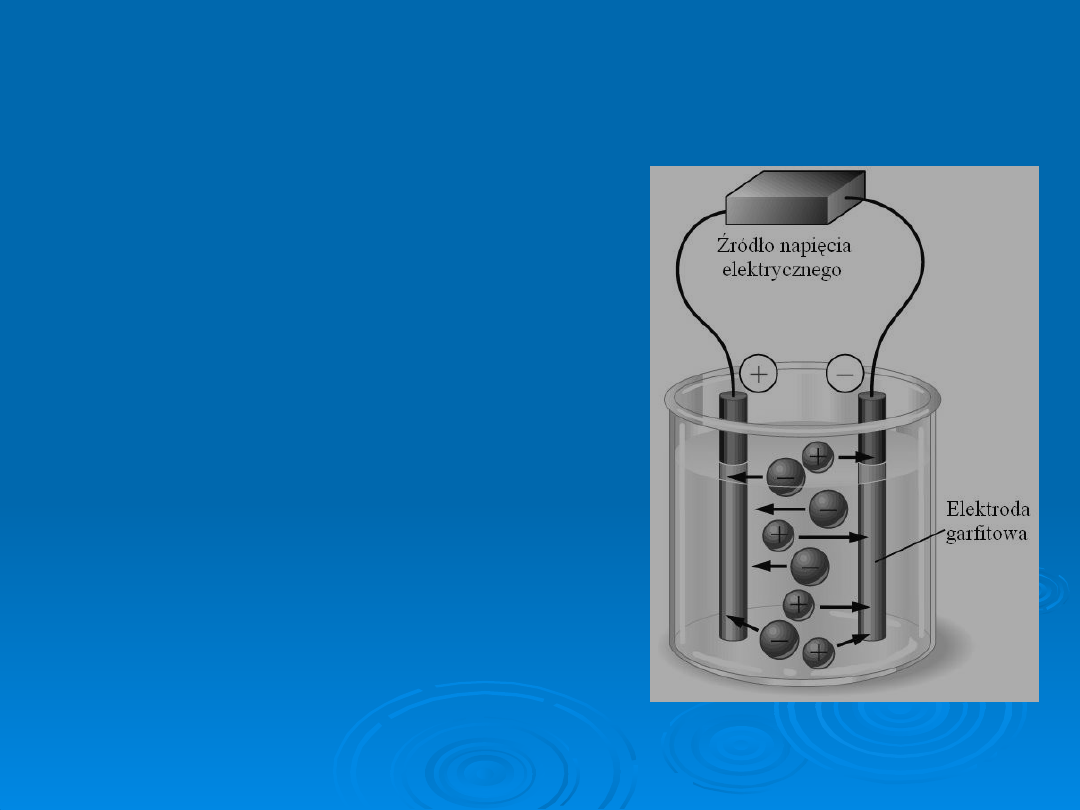
Zasada działania
Zasada działania
Przewodząc prąd elektryczny, związki jonowe
ulegają procesom chemicznym: utlenianiu i
redukcji. Pierwszym uczonym, który zauważył tę
właściwość był Michael Faraday. Skorzystał z jego
obserwacji inny uczony, Svante Arrhenius, który
udowodnił, że po przyłożeniu napięcia do
zanurzonych w elektrolicie elektrod, znajdujące
się w nim jony dążą w zależności od ładunku do
elektrody połączonej z dodatnim lub ujemnym
biegunem źródła energii elektrycznej. Po dotarciu
do elektrody jony oddają nadmiar elektronów lub
je pobierają , osiągają obojętny ładunek
elektryczny i mogą się wydzielać na elektrodach
w postaci pęcherzyków gazów lub osadów. Jak
rozpoznać zatem elektrody? Ta, na której jony
redukują się nazywana jest katodą, natomiast ta,
na której biegnie proces utleniania nazywana jest
anodą. Przypisywanie im określonych „znaków”
zależy od tego czy mamy do czynienia z
samorzutnym procesem oddawania ładunków czy
wymuszonym
.

Pierwsza bateria
Pierwsza bateria
Pierwsza bateria elektryczna wykonana została przez włoskiego fizyka, Aleksandra
Voltę w 1800 roku. Jego rodak, fizjolog Luigi Galvani, przeprowadzając sekcję żaby,
zauważył dziwne zjawisko. Zaobserwował, że dotknięcie mięśni i nerwów
wypreparowanej kończyny płaza dwoma różnymi metalami wywołuje ich skurcze. Volt
stwierdził, że owe drgania są spowodowane elektrycznością, powstającą w wyniku
kontaktu dwóch różnych metali. W końcu XVIII wieku rozpoczął on systematyczne
badania nad odkrytą przez siebie elektrycznością. Doszedł do wniosku, że może
wytwarzać prąd elektryczny, umieszczając dwie metalowe płytki, zwane elektrodami,
w przewodzącym prąd związku chemicznym - elektrolicie. Ogniowo odkryte przez
Volta składało się z par cynkowych i miedzianych blaszek, przekładanych filcowym
krążkiem, zwilżonym lekkim roztworem soli lub kwasu. Dwa jego przeciwległe końce
połączone były drutem, w którym pojawiał się prąd elektryczny.
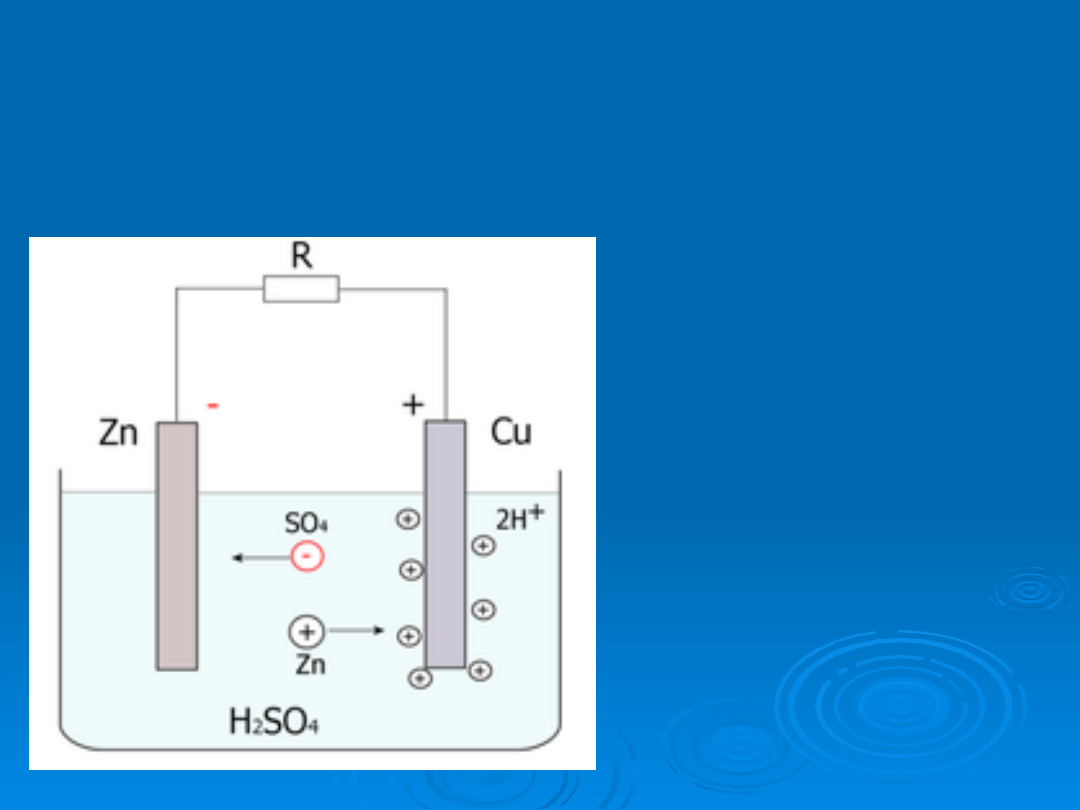
Kiedy w naczyniu
wypełnionym wodą
zakwaszoną kwasem
siarkowym (VI)
umieścimy dwie
płytki: miedzianą i
cynkową, połączone
z miernikiem
elektrycznym. Po
kilku sekundach
miernik pokaże
napięcie ok. 1.05V.
Na elektrodzie
miedzianej powstaną
drobne pęcherzyki
gazu.
Ogniwo Volty
Ogniwo Volty

Zn
Zn
e
-
e
-
Zn
2+
e
-
e
-
Zn
2+
Na anodzie zachodzi proces
utleniania cynku. Takie
zjawisko jest możliwe dzięki
różnicy potencjałów
elektrodowych. Potencjał cynku
jest bardziej ujemny od
potencjału wodoru, dlatego
cynk „chętniej” oddaje
elektrony i przechodzi do
roztworu w postaci dwu
dodatnich jonów. Zjawisko
obrazuje równanie:
A (-)
Zn → Zn2+ +
2e-
Dzięki nagromadzeniu się na
płytce cynkowej wolnych
elektronów, jej ujemny
potencjał rośnie i staje się ona
ujemnym biegunem ogniwa.

H
2
C
u
C
u
Kationy wodorowe dążą w tym
czasie do płytki miedzianej.
Spowodowane jest to zjawiskiem
nadnapięciowego wydzielania
wodoru. Na skutek połączenia
elektrod, elektrony wędrują na
elektrodę miedzianą w celu
wyrównania ich gęstości na
obydwóch płytkach. Ponieważ
miedź ma mniejsze nadnapięcie
wydzielania wodoru, protony
redukują się na elektrodzie
miedzianej.
K (+)
2H+ + 2e- →
H2↑

Ogniwo Leclanchego
Ogniwo Leclanchego
Kolejnym krokiem, w celu udoskonalenia ogniwa wytwarzającego
prąd, było wyeliminowanie pewnej niedogodności, która ujawniała
się po pewnym czasie użytkowania ogniwa. Niedogodnością tą było
zbieranie się na elektrodzie miedzianej pęcherzyków wodoru, które
zmniejszały jego reagującą powierzchnię. Równocześnie wytrącał
się osad siarczanu cynku na płytce cynkowej. Powodowało to stały
wzrost oporu wewnętrznego ogniwa i zmniejszenie napięcia na jego
biegunach. Rozwiązaniem tego problemu zajął się francuski chemik
Georges Leclanch
é
. Zastąpił on miedzianą płytkę pręcikiem
grafitowym, pozostawiając cynk jako biegun ujemny. Jako elektrolitu
użył stężonego roztworu chlorku amonu, a w celu depolaryzacji
pokrywającej się wodorem elektrody węglowej, umieścił ją w
płóciennym woreczku, wypełnionym dwutlenkiem manganu z
domieszką grafitu. Dwutlenek manganu utleniał wodór do wody,
która nie zatrzymywała jonów wodorowych. Mechanizm procesów
zachodzących na anodzie nie został do końca wyjaśniony.
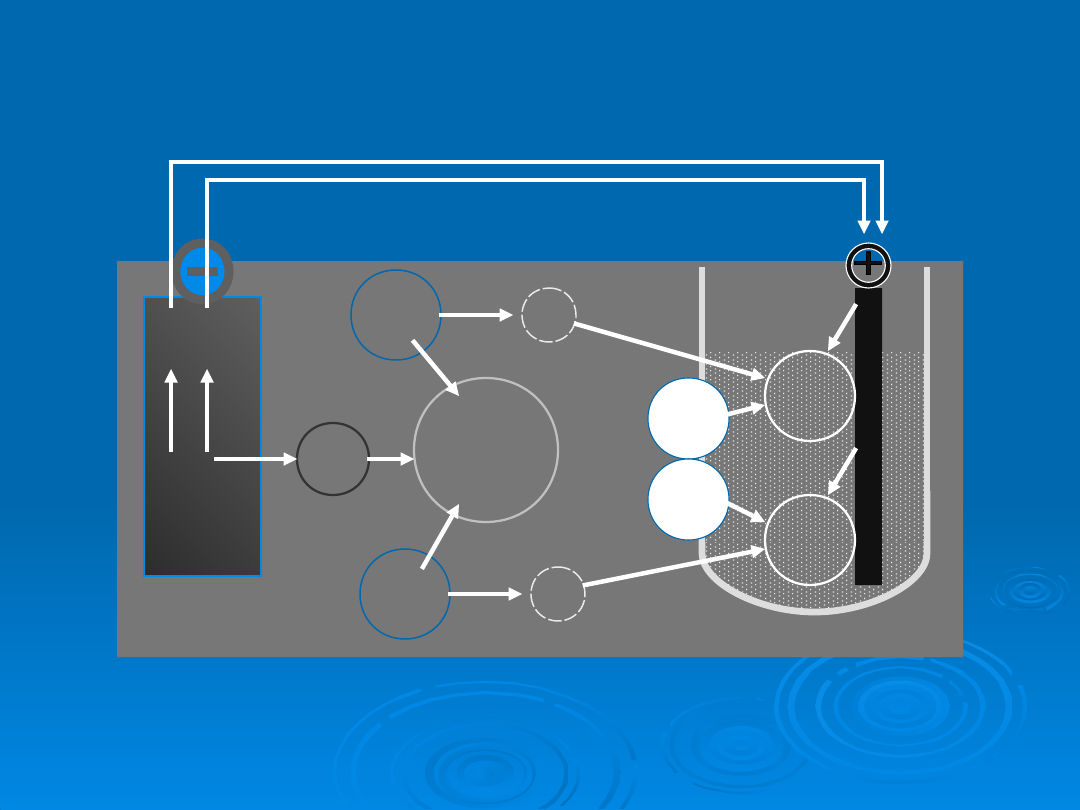
Zn
2
+
Z
n
NH
4
Cl
NH
4
Cl
e
-
e
-
Zn(NH
3
)
2
Cl
2
H
+
H
+
MnO
2
MnO
2
MnO(O
H)
MnO(O
H)
e
-
e
-
Schemat
działania
ogniwia
Lechlanchégo

Na anodzie przechodzą do roztworu jony
cynkowe, po czym łączą się z anionami
chlorkowymi i amoniakiem:
A (-) Zn → Zn2+ + 2e-
2 NH4Cl + Zn2+ →
Zn(NH3)2Cl2 + 2 H+
Na grafitowej katodzie następuje proces
elektronacji protonów, a powstały w wyniku
reakcji wodór łączy się z tlenkiem manganu (IV)
tworząc między innymi wodorotlenek
manganu(III):
K (+)
2 H+ + 2MnO2 +
2e- → 2 MnO(OH)

Ogniwo LeclanchEgo
zmodyfikował jago brat i
syn, zastępując roztwór
chlorku amonowego
trocinami nasączonymi
tym związkiem, a cynkową
płytkę, cylinderkiem z tego
metalu. Powstałe po
modyfikacjach ogniwo było
podobne do dzisiejszych
baterii typu UM-2


Rodzaje baterii
Rodzaje baterii
* bateria alkaliczna – akumulator, którego po rozładowaniu nie można
naładować.
* bateria ogniw - to dwa lub więcej ogniw galwanicznych połączone
razem przeznaczone do zasilania różnych urządzeń przenośnych, np.
żarówki w latarce elektrycznej. Potocznie również w odniesieniu do
pojedynczego ogniwa galwanicznego.
* bateria akumulatorowa to akumulator elektryczny składający się z
dwóch lub więcej ogniw akumulatorowych połączonych ze sobą
elektrycznie i przeznaczonych do stosowania jako źródło prądu stałego
* bateria anodowa - to zespół ogniw galwanicznych lub akumulatorów
służący do zasilania obwodów anodowych lamp elektronowych
* bateria jądrowa - to przyrząd półprzewodnikowy zamieniający energię
ciał promieniotwórczych na energię elektryczną
* bateria buforowa - to bateria akumulatorowa połączona równolegle z
prądnicami prądu stałego w celu zmniejszenia zmian ich napięcia i
wytwarzanego przez nie prądu elektrycznego
* bateria słoneczna (fotoelektryczna) - to zespół fotoelementów
półprzewodnikowych do bezpośredniej przemiany energii promieniowania
słonecznego w energię elektryczną
* bateria termoelektryczna - to zespół ogniw termoelektrycznych
* bateria żarzenia - to pojedyncze ogniwo lub zespół ogniw
galwanicznych lub akumulatorów służący do zasilania obwodów żarzenia
lamp elektronowych.
Baterie pierwotne
Baterie pierwotne
Baterie pierwotne to
baterie, których budowa
umożliwa całkowite
rozładowanie tylko raz.
Często baterie pierwotne
są zbudowane z
materiałów używanych w
produkcji baterii
wtórnych. Jednak ich
konstrukcja i proces
produkcji jest zupełnie
inny. Dlatego nie należy
ładować baterii
pierwotnych!!!
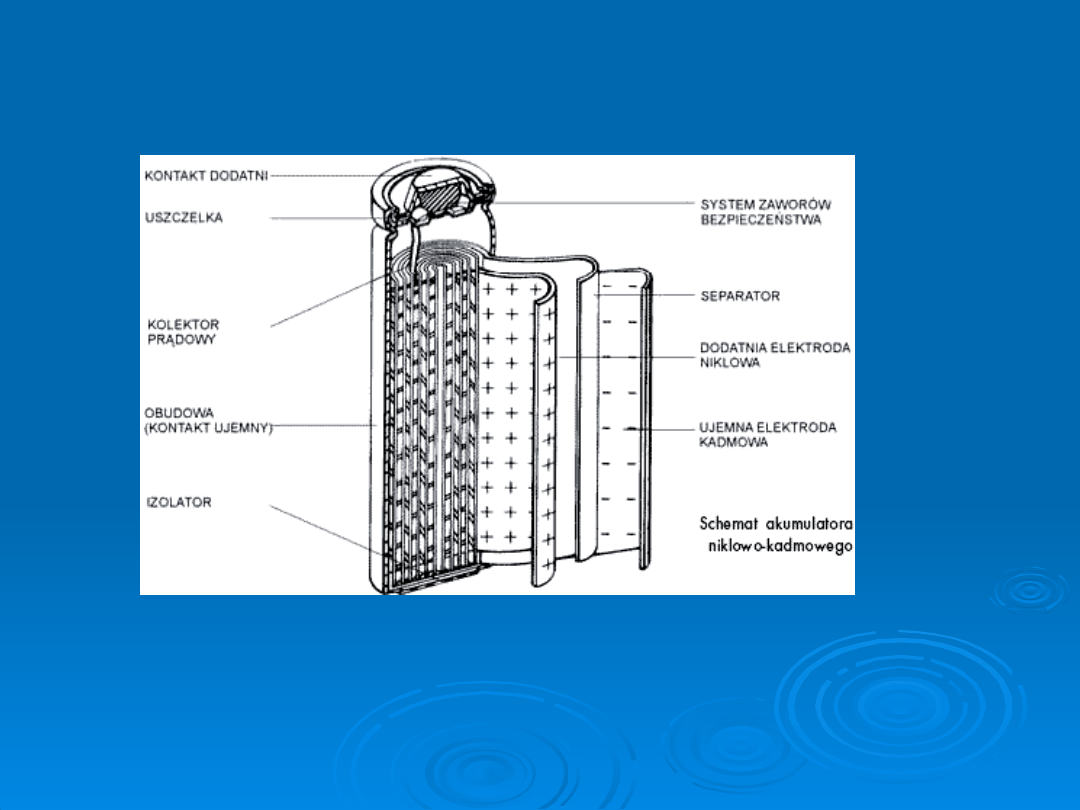
Baterie wtórne
Baterie wtórne
Baterie odnawialne działają na tej samej zasadzie co baterie pierwotne,
z tą różnicą, że zachodzące w nich procesy chemiczne mogą być
odwrócone poprzez mechanizm ładowania. W wyniku tego działania
bateria "odzyskuje" pierwotne właściwości prądowe. W zależności od
użytych kompozytów baterie takie mają żywotność pomiędzy 100 i
1000 cykli.

Prezentację wykonały:
Prezentację wykonały:
Monika Bielska
Kamila Golasa
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
Wyszukiwarka
Podobne podstrony:
Fizyka 0 wyklad organizacyjny Informatyka Wrzesien 30 2012
Badania fizykalne kostno stawowo mięśniowy
Badanie fizykalne kości, mięśni i stawów
Sieci komputerowe fizyka informatyka
Badanie fizykalne1
Fizyka j c4 85drowa
Badanie fizykalne 3
Wyk ad Fizyka 2
BADANIE FIZYKALNE SKÓRY ppt
metody fizykalne w dermatologii
Badanie fizykalne
Technika badania fizykalnego klatki piersiowejZDZ8
Fizyka jadrowa
więcej podobnych podstron