
Wykład 3
Wykład 3
WIĄZANIA
CHEMICZNE
-
kowalencyjn
e
*
-jonowe
-metaliczne
Wiązania
chemiczne
-wiązania międzycząsteczkowe (van der
Waalsa)
-wiązania
wodorowe
- inne wiązania (np.
klatratowe)
teoria
elektronowa
teoria
kwantowa
teoria elektrostatyczna (pola
kr.)
* atomowe, spolaryzowane,
koordynacyjne
Wspólna para elektronowa należy
jednocześnie do obu
atomów i stanowi pojedyncze wiązanie
kowalencyjne
Teoria elektronowa
Wzory Lewisa
Wzory
kreskowe
Wiązania kowalencyjne:
atomowe
H· + ·H H-H
Atomy osiągają konfigurację gazu
szlachetnego
Cl + Cl Cl Cl
N + N N
N
H· + ·H H:H
Cl - Cl, NN

Wspólna para elektronowa należy jednocześnie
do obu
atomów, ale w różnym stopniu. Zależy to od
elektroujemności.
Teoria elektronowa
Wzory Lewisa
Wiązania kowalencyjne:
spolaryzowane
Atomy osiągają konfigurację gazu
szlachetnego
Cl + I Cl I
Br : C : C : H
H
.. Cl
..
..
H
..
H
:
:
O
H
H
H20
wolne pary
elektronowe
C
H
H
CH4
H
H
1s2
2s2
2p2
1s2
2sp3
1s2
2s2 2p4
1s2
2sp3
HYBRYDYZACJA
sp
3
sp
sp
2
dsp
2
dsp
3
d
2
sp
3
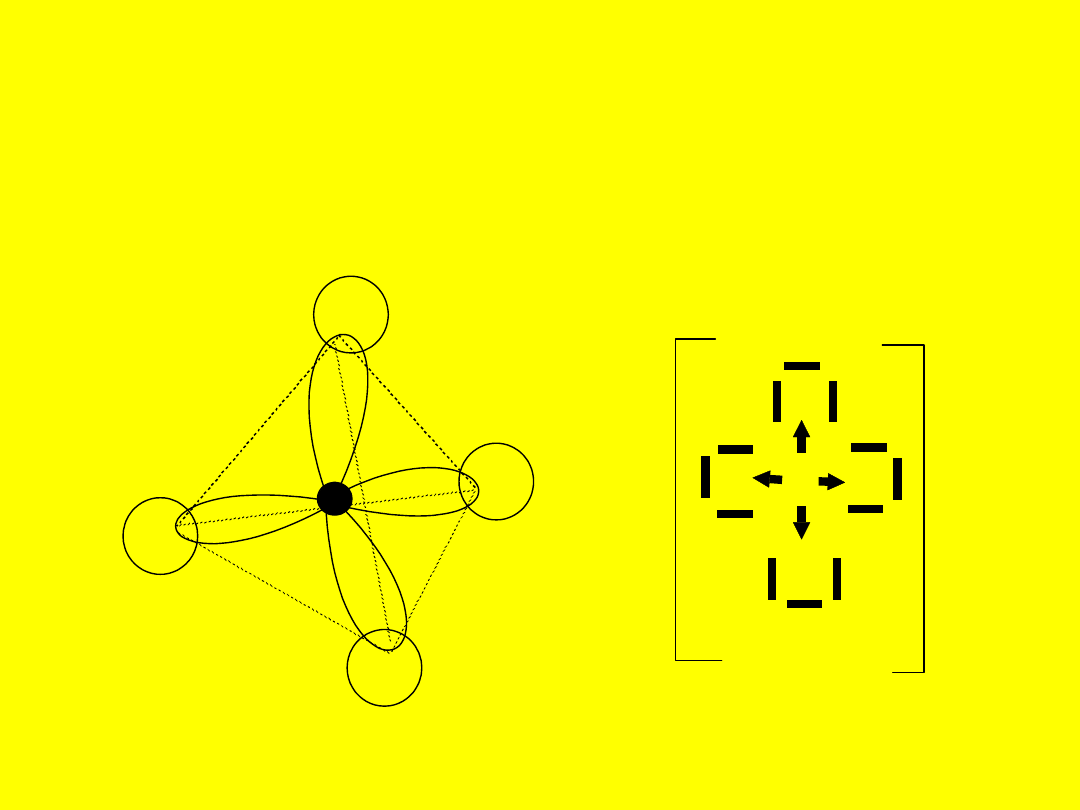
Wiązania
koordynacyjne
Wiążąca para elektronowa pochodzi od jednego
z atomów
S
O
O
SO4=
O
O
O S O
O
O
=
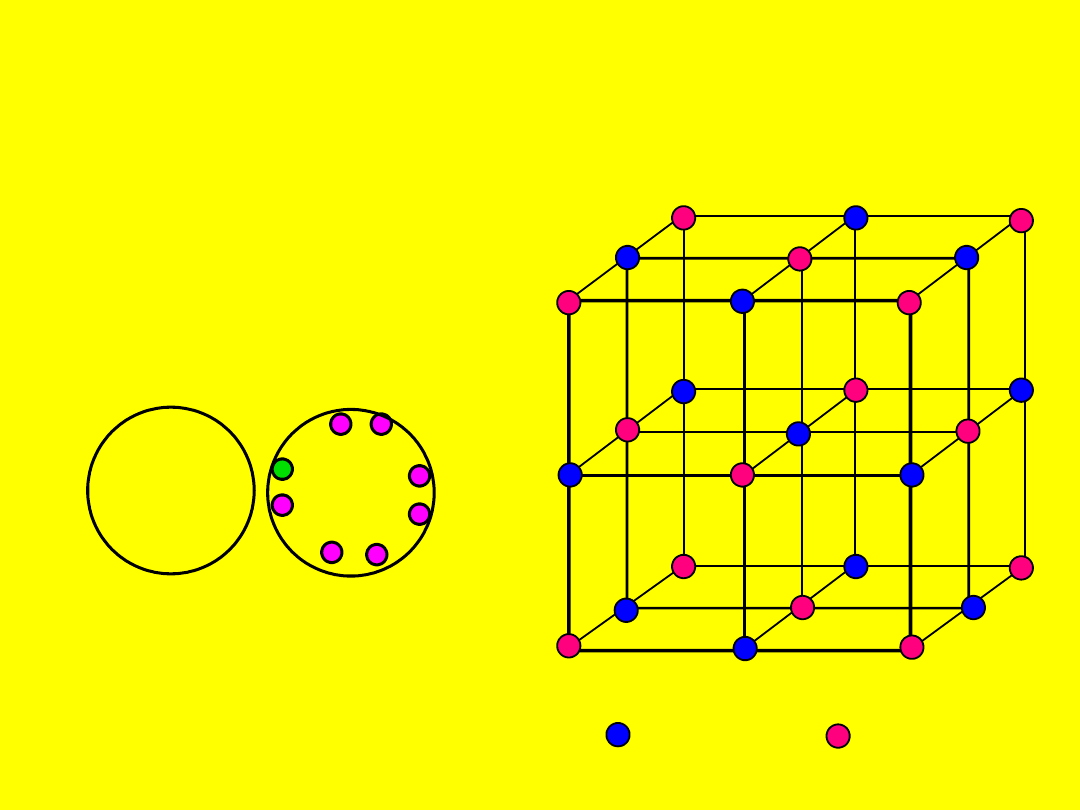
Wiązanie jonowe (teoria
elektronowa)
Wiązania jonowe powstaje w wyniku
przeniesienia elektronu i pojawieniu się
oddziaływań elektrostatycznych
Na
Cl
Na
Cl
+
-
F < F
F = F
kr
kr
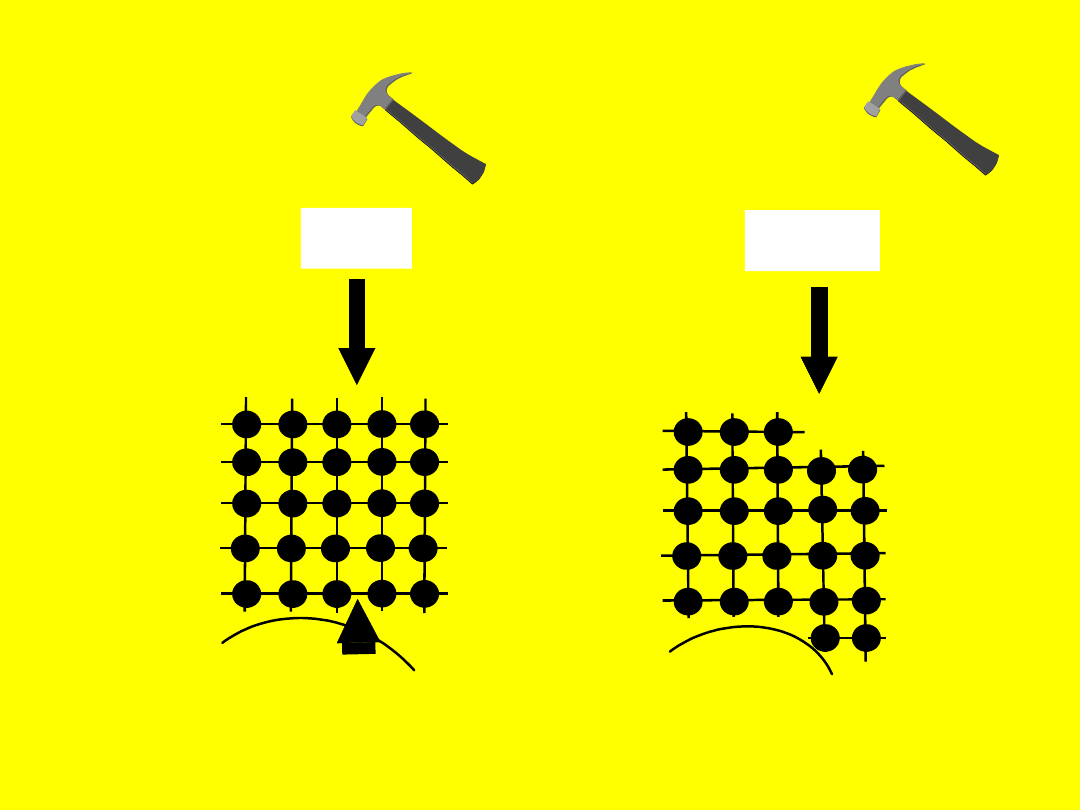
Istota wiązań
metalicznych
Działanie sił odkształcających na
substancje metaliczne
F < F
F = F
F
F
F
kr
kr
F << F
kr
r
r
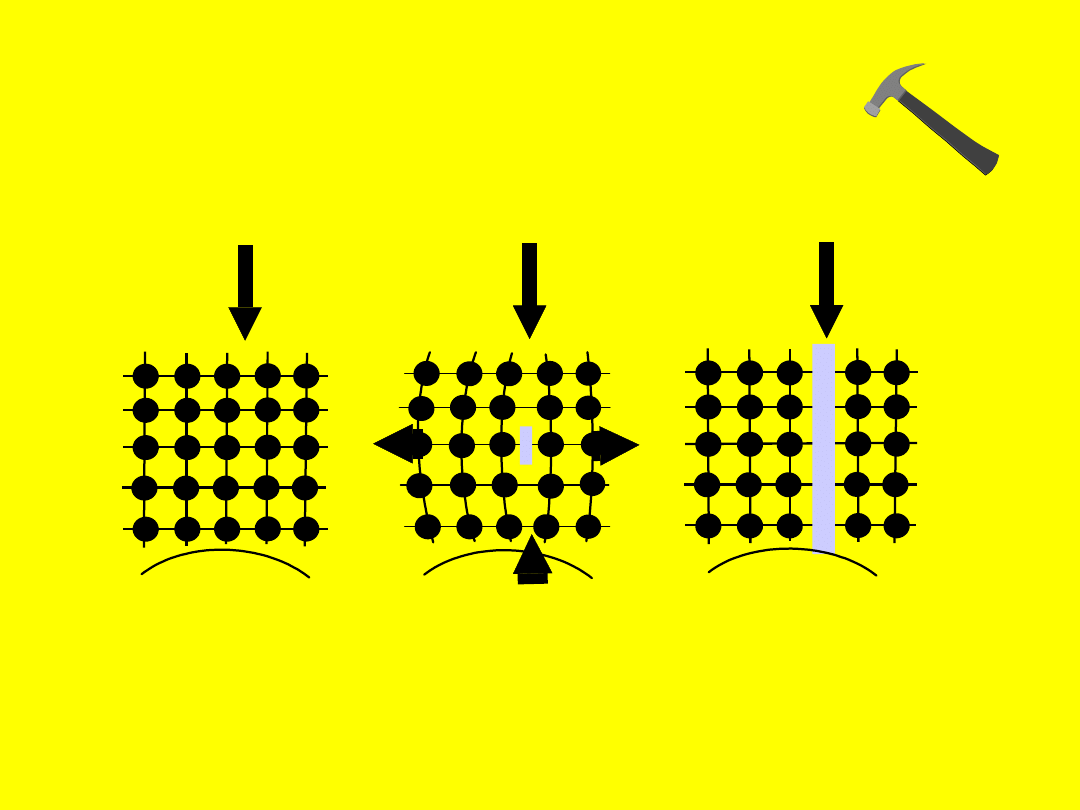
s
Działanie sił odkształcających na
substancje
jonowe i kowalencyjne
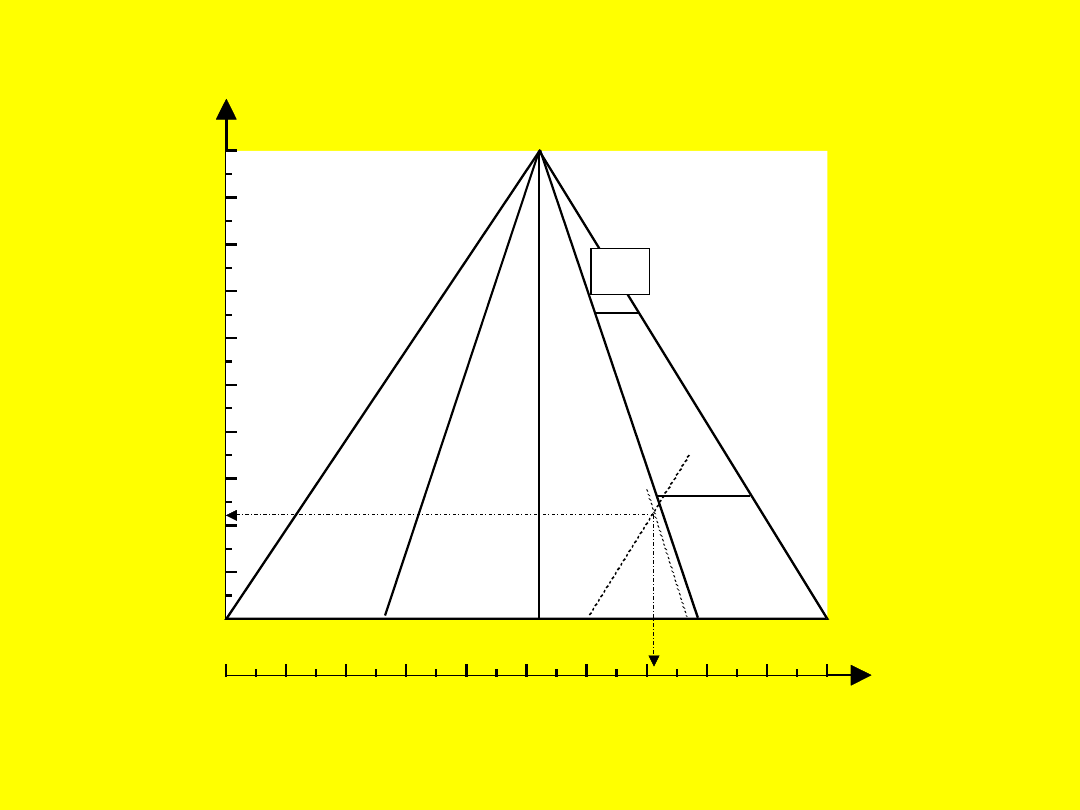
0
10
20
30
40
50
60
70
80
90
100
0
10
20
30
40
50
60
70
80
90
100
I
Fr Cs Rb Na Li Ba Sr Ca Mg Tl In Be Ga Al Pb Ge Bi Si B As TeP Se ICSBr Cl H N O F
A
M
I
I
II
III
SiC
IVA
IVB
IVC
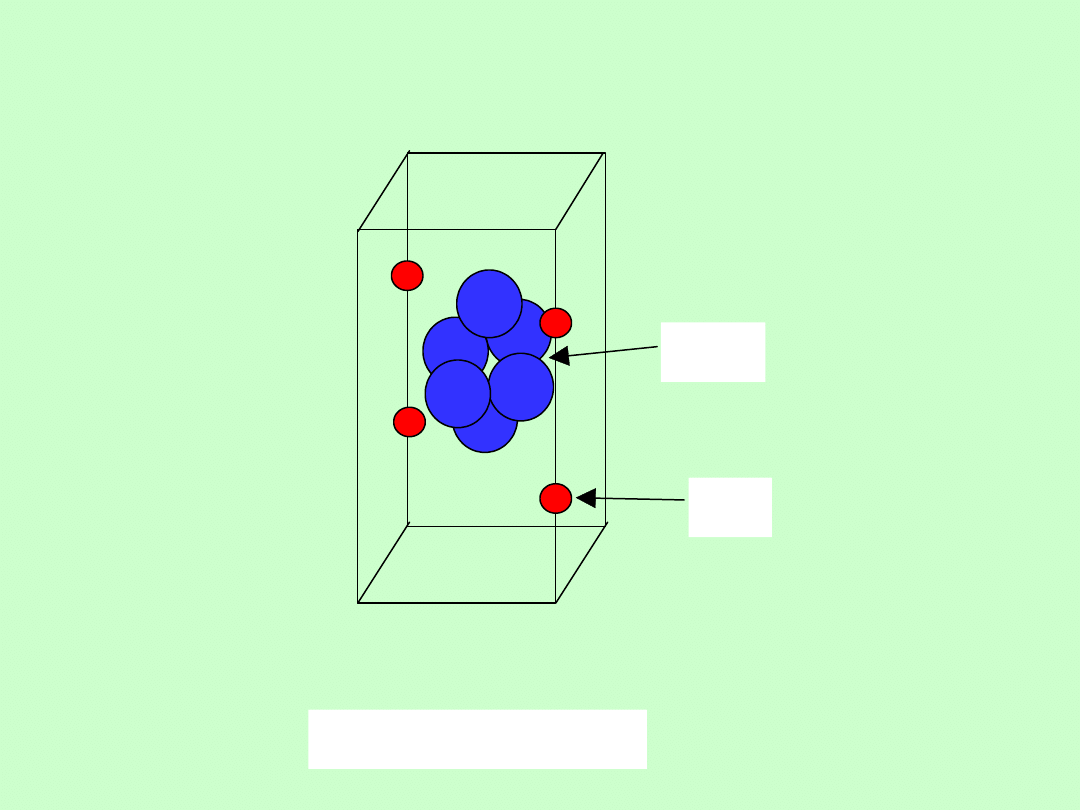
Związki kladratowe
Ni(CN)2NH3nC6H6
NH3
C6H6
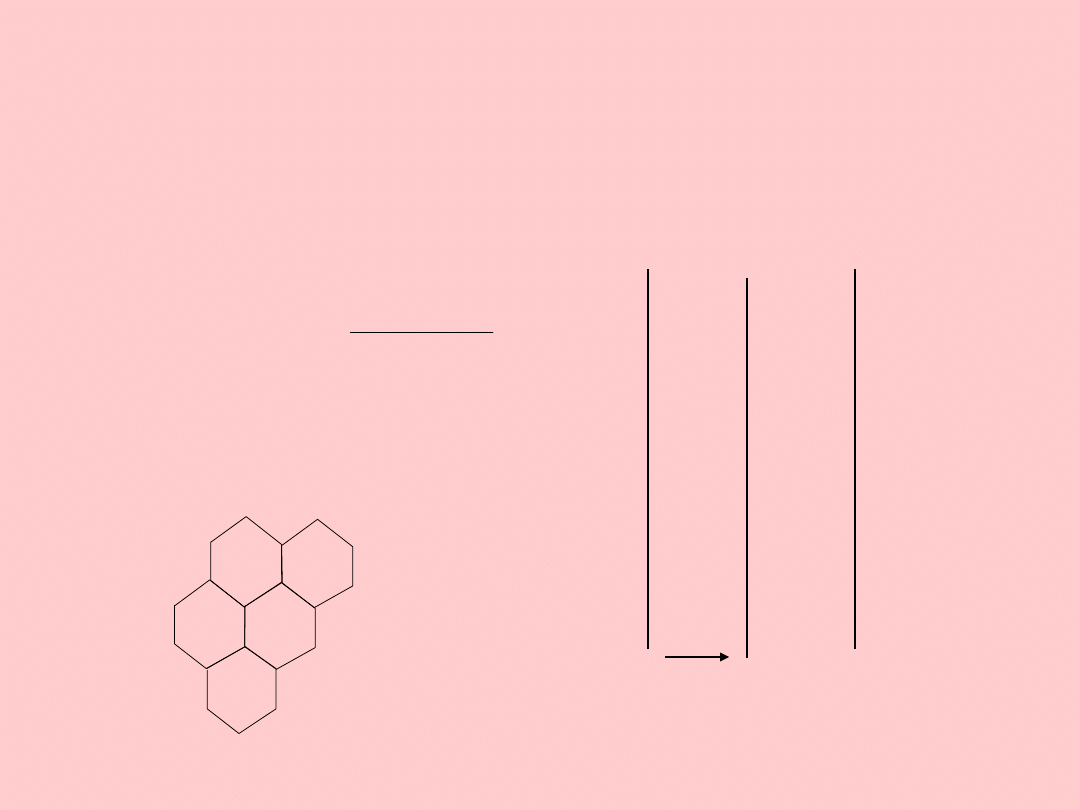
Oddziaływania van der
Waalsa
Powodowane dipolami
chwilowymi
2
12 H
A
G
x
d
x
H
grafit
A - stała Hamakera
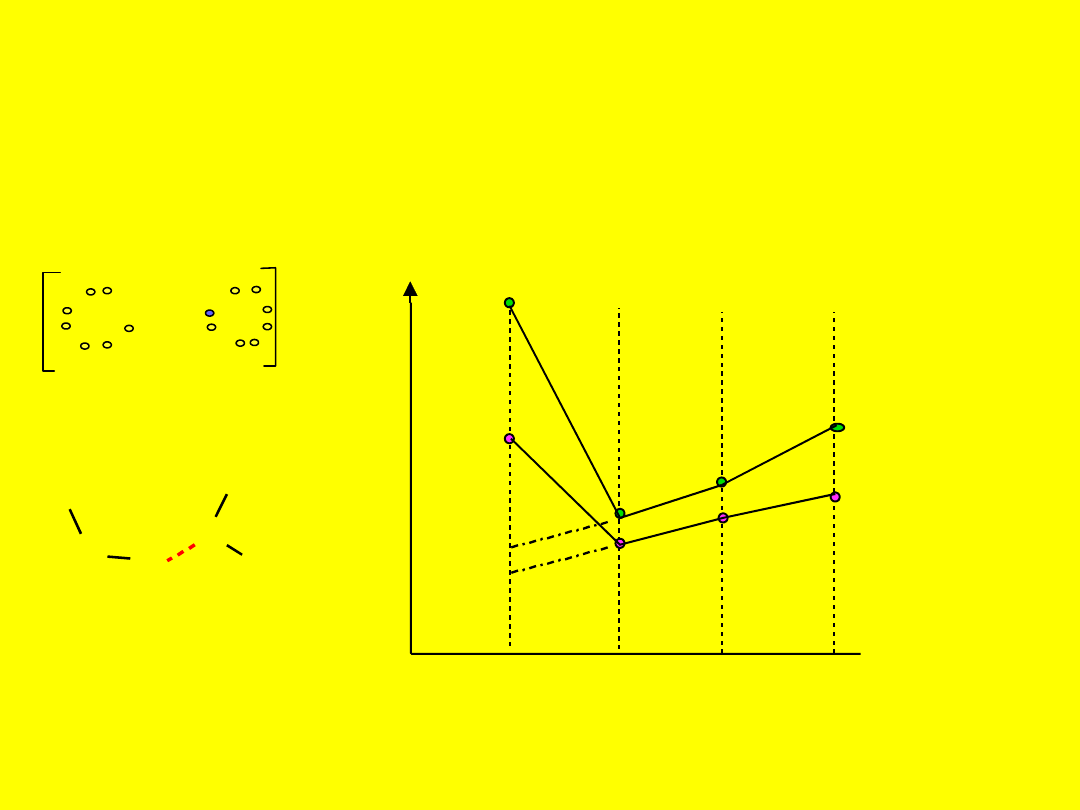
Wiązania wodorowe
Specjalny rodzaj wiązania
kowalencyjnego
Dotyczy silnie elektroujemnych
pierwiastków B, N, O, F
F : H F
-
okres
T (K)
150
250
200
350
300
2
3
4
5
temp. wrzenia
temp. topnienia
H2O
H2S
H2Se
H2Te
H
H
H
H
O
O

Koniec wykł adu

Wzory kreskowe i kropkowe dla złożonych
cząsteczek
H : C : C : H
H
.. H
..
..
H
..
H
H - C - C - H
H H
H
H
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
Wyszukiwarka
Podobne podstrony:
kl 2, kartkowka-benzen, Benzen - C6H6 Wzór Elektronowy - 6¬¬C KL 1H K Węglowodory Aromatyc
Wiązania chemiczne elektronowe
Napęd Elektryczny wykład
Podstawy elektroniki i miernictwa2
elektryczna implementacja systemu binarnego
urządzenia elektrotermiczn
Podstawy elektroniki i energoelektroniki prezentacja ppt
Elektryczne pojazdy trakcyjne
elektrofizjologia serca
Ćwiczenia1 Elektroforeza
elektrolity 3
Wyklad 1 Wiazania
Urządzenia i instalacje elektryczne w przestrzeniach zagrożonych wybuchem
Elektroforeza DNA komórkowego BioAut1, BioAut2 i Ch1
Instalacje elektroenergetObl1
więcej podobnych podstron