
APS
APS
–
–
zespół
zespół
antyfosfolipidowy
antyfosfolipidowy
zespół opisany po raz pierwszy przez Hughes’a w
zespół opisany po raz pierwszy przez Hughes’a w
1983 r. (?)
1983 r. (?)
W 1987 r. Harris i wsp. nazwali zespołem
W 1987 r. Harris i wsp. nazwali zespołem
antyfosfolipidowym zespół obejmujący:
antyfosfolipidowym zespół obejmujący:
•
zakrzepicę żylną i tętniczą
zakrzepicę żylną i tętniczą
•
nawracające samoistne poronienia
nawracające samoistne poronienia
•
małopłytkowość
małopłytkowość
•
obecność przeciwciał antyfosfolipidowych i/lub
obecność przeciwciał antyfosfolipidowych i/lub
obecność antykoagulanta toczniowego
obecność antykoagulanta toczniowego

APS- zespół antyfosfolipidowy
(antiphospholipid syndrome)
PAPS
- pierwotny
SAPS
- wtórny
APL s-
przeciwciała antyfosfolipidowe
(antiphospholipid antibodies)
a CL (ACA) przeciwciała
antykardiolipinowe
LAC- krążący antykoagulant toczniowy
(lupus anticoagulant
).

Przeciwciała antyfosfolipidowe-historia
-1952r
. –po raz pierwszy stwierdzono in vitro
wydłużenie całkowitego czasu krzepnięcia krwi w
osoczu chorych na SLE, u których nie stwierdzono
żadnych niedoborów osoczowych czynników
krzepnięcia
-1972r.
–Feinstein i Rappaport wyjaśnili, że zjawisko to
zależne jest od obecności czynnika o naturze
immunologicznej, skierowanego przeciwko
fosfolipidom biorącym udział w procesie krzepnięcia
krwi na etapie przejścia protrombiny w trombinę i
nazwali ten czynnik antykoagulantem toczniowym.

PRZECIWCIAŁA
PRZECIWCIAŁA
ANTYFOSFOLIPIDOWE
ANTYFOSFOLIPIDOWE
-
-
Immunoglobuliny w klasach
Immunoglobuliny w klasach
IgG,
IgG,
IgM
IgM
lub rzadziej
lub rzadziej
IgA
IgA
(najczęściej
(najczęściej
występują u chorych rasy czarnej z SLE
występują u chorych rasy czarnej z SLE
lub PAPS)
lub PAPS)
reagujące z aktywnymi,
reagujące z aktywnymi,
spolaryzowanymi fosfolipidami
spolaryzowanymi fosfolipidami
(o
(o
ujemnym ładunku elektrycznym):
ujemnym ładunku elektrycznym):
fosfatydyloseryna, kardiolipina,
fosfatydyloseryna, kardiolipina,
fosfatydyloglicerol,
fosfatydyloglicerol,
fosfatydyloinozytol, kwas
fosfatydyloinozytol, kwas
fosfatydowy i inne.
fosfatydowy i inne.

PRZECIWCIAŁA ANTYFOSFOLIPIDOWE
–
antiphosphlipid antibodies (aPLs)- przeciwciała
skierowane przeciw fosfolipidom, które mają
ujemny ładunek elektryczny.
1). Przeciwciała antykardiolipinowe (aCL).
2). Antykoagulant toczniowy (LAC).
3). Przeciwciała odpowiedzialne za fałszywie dodatnie
wyniki serologicznych testów kiłowych (VDRL).

APLs IgG i/lub IgA
APLs IgG i/lub IgA
- zaburzenia
- zaburzenia
krzepnięcia
krzepnięcia
APLs IgM
APLs IgM
- małopłytkowość lub
- małopłytkowość lub
niedokrwistość hemolityczna
niedokrwistość hemolityczna
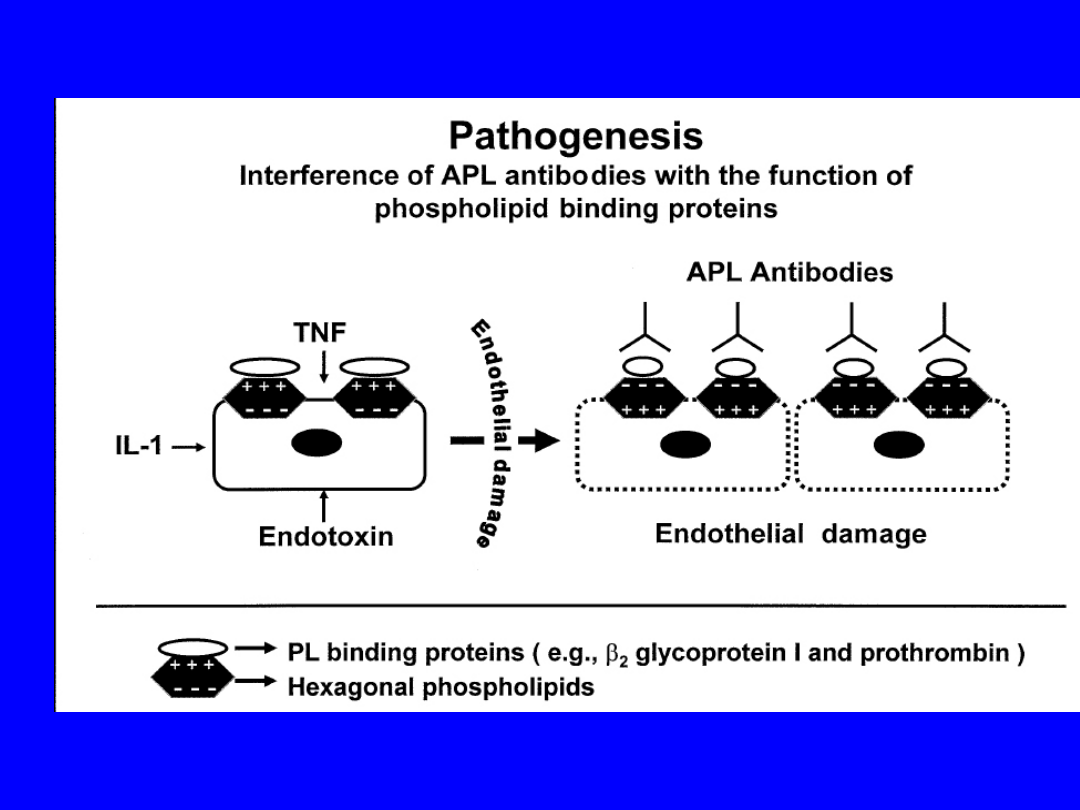
Reakcja APLs – fosfolipid wymaga
Reakcja APLs – fosfolipid wymaga
obecności
obecności
białkowego kofaktora
białkowego kofaktora
, który
, który
tworzy kompleks z anionowym
tworzy kompleks z anionowym
fosfolipidem
fosfolipidem
ACL –
ACL –
β
β
2
2
Glikoproteina I
Glikoproteina I
LAC –
LAC –
protrombina
protrombina

W przebiegu zespołu antyfosfolipidowego
wykrywane są następujące przeciwciała:
1) antykardiolipinowe (aCL),
2) antykoagulant toczniowy (LAC),
3) przeciwko β2 glikoproteinie (β 2GPI),
4) przeciwko PTC (IX czynnikowi krzepnięcia –
składnikowi tromboplastyny osoczowej),
5) przeciwko protrombinie,
6) przeciwko antykoagulacyjnym białkom,
7) przeciwko utlenionym lipoproteinom,
8) przeciwko śródbłonkowi naczyń,
9) przeciwko trofoblastowi,
10) przeciwko mitochondriom

Seronegatywny APS
Ujemne wyniki badań przeciwciał
antyfosfolipidowych
mogą
występować w trakcie epizodów
zamknięcia naczyń, prawdopodobnie
z
powodu
„konsumpcji"
przeciwciał.
Około
10-15%
wszystkich pacjentów z typowymi
objawami
APS
ma
stale
seronegatywne wyniki w zakresie
tych przeciwciał.

Przeciwciała w APS
Przeciwciała w APS
Obecność przeciwciał w surowicy chorych z APS (33)
%
a. Przeciwciała antykardiolipinowe
IgG i IgM
32,1
wyłącznie
IgG
43,6
wyłącznie IgM
12,2
b. Antykoagulant toczniowy (LAC)
wyłącznie
LAC
12,1
LAC równocześnie z przeciwciałami antykardiolipinowymi
41,5
c.
Przeciwciała przeciwjądrowe
Przeciwciała p. ds DNA
29,2
Przeciwciała p. Ro/SSA
14,0
Przeciwciała p.La/SSB
5,7
Przeciwciała p.RNP 5,9
Przeciwciała p.Sm
5,5
d. Czynnik reumatoidalny
7,8

ANTYGENY FOSFOLIPIDOWE
- aniony (ujemnie naładowane)
- obecne na powierzchni wielu komórek
organizmu, śródbłonkach naczyń
krwionośnych, ośrodkowym układzie nerwowym
- np. fosfatydyloseryna,
fosfatydyloinozytol, fosfatydylocholina,
fosfatydyloglicerol, fosfatydyloetanolamina,
kardiolipina (dwufosfatydyloinozytol).
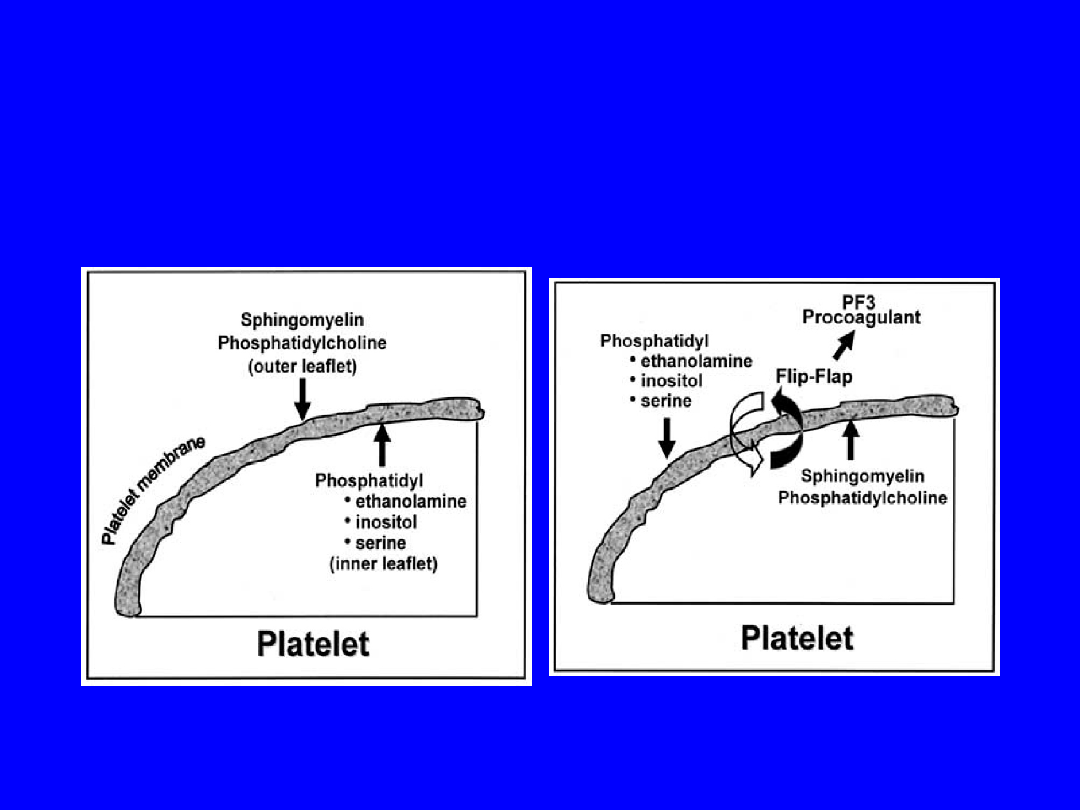
Fosfolipidy błon komórkowych
trombocytów

WYKRYWANIE PRZECIWCIAŁ
ANTYKARDIOLIPINOWYCH
Metoda immunoenzymatyczna (ELISA
)
Antygen – kardiolipina
Umowna jednostka stężenia (GPL-U dla
IgG, MPL-U dla IgM) odpowiada aktywności
wiążącej 1 μg/ml oczyszczonego
przeciwciała odpowiedniej klasy
metoda półilościowa
Przedłużony APTT
Czas trombinowy
Prawidłowy czas
trombinowy
Nieprawidłowy czas
trombinowy
APTT mieszaniny
osocza badanego
i zdrowego
Neutralizacja
heparyny
Czas trombinowy
Pzedłużony
Prawidłowy
Niedobór osoczowych
czynników krzepnięcia
Procedura
neutralizacji płytek
APTT
prawidłowy
przedłużony
LAC
Specyficzny
inhibitor
prawidłowy
przedłużony
Obecna
heparyna
Nieprawidłowy
fibrynogen

Klasyfikacja przeciwciał
antyfosfolipidowych
Autoprzeciwciała
– Pierwotne
bez towarzyszącej choroby
autoimmunologicznej
– Wtórne
w przebiegu:
•SLE, zespołów toczniopodobnych
•Innych chorób autoimmunologicznych: rzs,
młodzińcze zapalenie stawów, twardzina
układowa, overlap syndromes, zespół
Sjögrena, zapalenie skórno-mięśniowe, łzs,
polymyalgia rheumatica, zzsk, ch. Behçeta,
ch. Kawasaki, małopłytkowości o podłożu
autoimmunologicznym, wole Hashimoto, ch.
Graves-Basedova, ch. Crohna

Alloprzeciwciała
Alloprzeciwciała
w przebiegu zakażeń: wirusy (HIV,
w przebiegu zakażeń: wirusy (HIV,
hepatitis, EBV), bakterie (kiła, gruźlica),
hepatitis, EBV), bakterie (kiła, gruźlica),
pierwotniaki (pneumocystis carini)
pierwotniaki (pneumocystis carini)
nowotworów złośliwych (oskrzela,
nowotworów złośliwych (oskrzela,
prostata)
prostata)
chorób limfoproliferacyjnych: białaczki,
chorób limfoproliferacyjnych: białaczki,
chłoniaki, makroglobulinemia
chłoniaki, makroglobulinemia
Waldenstr
Waldenstr
ö
ö
ma
ma
Auto- lub alloprzeciwciała
Auto- lub alloprzeciwciała
Indukowane lekami: chlorpromazyna,
Indukowane lekami: chlorpromazyna,
prokainamid, hydralazyna, etosuksymid,
prokainamid, hydralazyna, etosuksymid,
chlorotiazyd, chinidyna, fenytoina, doustne
chlorotiazyd, chinidyna, fenytoina, doustne
środki antykoncepcyjne, antybiotyki
środki antykoncepcyjne, antybiotyki
Klasyfikacja przeciwciał
antyfosfolipidowych c.d.


Udział kofaktora białkowego w
reakcji APLs - fosfolipid
Autoprzeciwciała:
• wymagają dla swej aktywności białkowych kofaktorów
(β
2
glikoproteina I, protrombina, inne białka?)
• powikłania zakrzepowo-zatorowe
• niewyjaśniony mechanizm powstania
Alloprzeciwciała:
• wiążą się z fosfolipidami bez udziału białkowego kofaktora
• nie wywołują epizodów zakrzepowo-zatorowych
• przyczyną powstania jest ekspozycja na obcy antygen
(infekcja, leki)
• znikają samoistnie po upływie tygodnia - kilku tygodni

β
2
Glikoproteina I (Apolipoproteina
H)
Surowicze białko o ciężarze cząsteczkowym ok.
40 – 50 kD
.
Występuje w krążeniu w formie niezwiązanej oraz związanej z
frakcją lipoprotein o wysokiej gęstości
HDL
(w niewielkiej ilości –
Gambio i wsp,).
Wykazuje silne powinowactwo do ujemnie naładowanych fosfolipidów
Syntetyzowana jest w wątrobie
, ale także w
komórkach
śródbłonka
,
neuronach i limfocytach
– może to mieć znaczenie w
patofizjologii APS.
Średnie stężenie w surowicach zdrowych dawców wynosi 200
μg/ml.
Zbudowana jest z pojedynczego łańcucha peptydowego złożonego z
326 aminokwasów,
ma budowę domenową - składa się z 5 domen białkowych
tworzących
kształt wydłużonej litery J
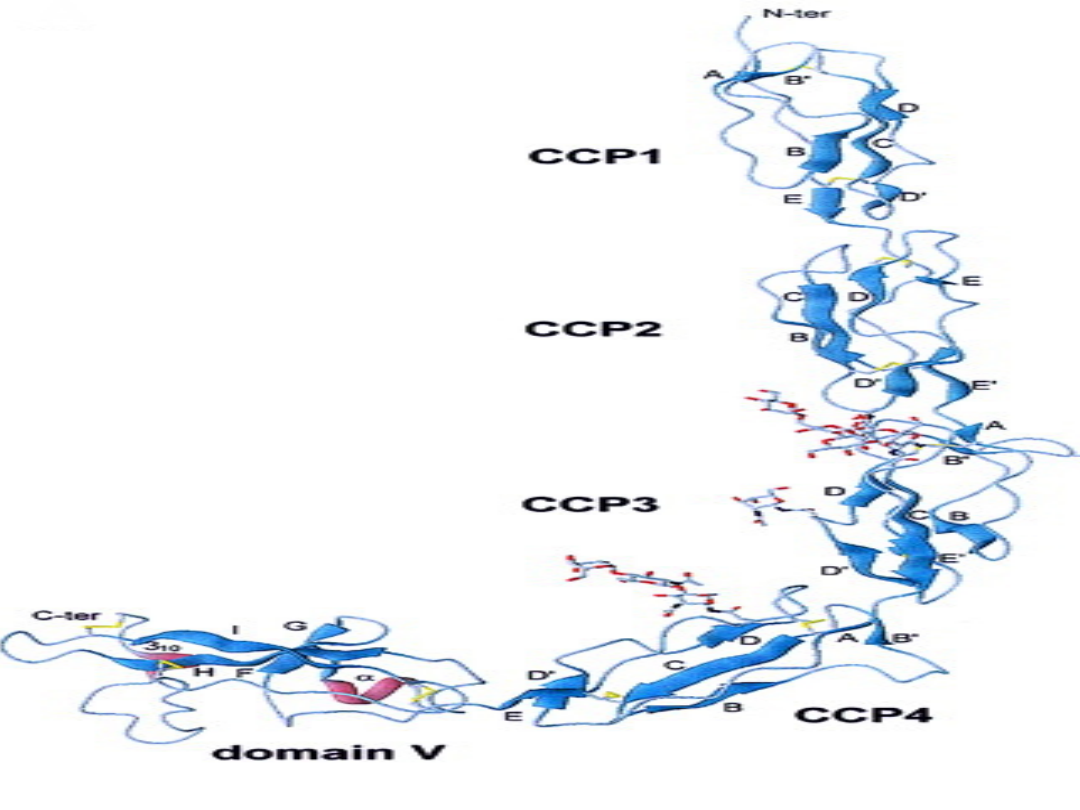
β 2 GLIKOPROTEINA
β 2 GLIKOPROTEINA

β 2- GLIKOPROTEINA I
β
2 glikoproteina I (apolipoproteina H) jest to białko łączące się z
ujemnie naładowanymi błonami fosfolipidowymi. Cząsteczka
β
2
GPI składa się z 4 N-końcowych modułów białkowych podlegających
kontroli dopełniacza i piątej domeny w odcinku C-końcowym. Pięć
domen ułożonych jak paciorki tworzy wydłużoną cząsteczkę o
kształcie litery J. W piątej domenie naładowana dodatnio sekwencja
aminokwasów CKNKEKKC i sąsiadująca z nią hydrofobowa pętla
mogą uczestniczyć w wiązaniu białka z ujemnie naładowanymi
błonami fosfolipidowymi (7).
β
2 GPI występuje w osoczu i
prawdopodobnie odgrywa rolę w metabolizmie lipidów, chociaż
ostatnio Gambino i wsp. udowodnili, że iloć
β
2 GPI związanej z
lipoproteinami jest niewielka.
β
2 GPI jest syntetyzowana w
wątrobie, ale powstaje także w komórkach śródbłonka
naczyniowego, neuronach i limfocytach. Być może ekspresja
β
2 GPI
w tych komórkach ma znaczenie w patofizjologii APS. Cząsteczka
β
2
GPI może być rozkładana przez plazminę i inne proteazy osocza

Przeciwciała przeciwko β
2
glikoproteinie I
• Nie są przeciwciałami dla fosfolipidów, ale są
związane z pulą tych przeciwciał
• 83 chorych: 11 SLE, 43 SLE + APS, 29 PAPS
• Przeciwciała przeciwko β2 glikoproteinie I
znaleziono w 21% przypadków SAPS i 24%
przypadków PAPS.
– Nie znaleziono ich w żadnym przypadku
SLE bez APS
• Istotne zwiększenie częstości takich objawów jak
poronienia, małopłytkowość, livedo
reticularis w grupie z obecnością przeciwciał
przeciwko β2 glikoproteinie I w surowicy.
• Są obiecującym markerem APS i mogą mieć
określone znaczenie prognostyczne co do
przebiegu i ciężkości APS (łącznie z aCL i LAC)

1
). PAPS
- pierwotny zespół antyfosfolipidowy
(primary antiphospholipid syndrome). Do tej
grupy należą chorzy, u których
nie stwierdza
się
wystarczającej liczby objawów
klinicznych i laboratoryjnych upoważniających
do rozpoznania
określonej układowej choroby
tkanki łącznej).
2). SASP
- wtórny zespół antyfosfolipidowy
(secondary antiphospholipid syndrome).
Towarzyszy on określonej układowej chorobie
tkanki łącznej.

3). CASP
-
katastroficzny zespół
antyfosfolipidowy (catastrophic antiphospholipid
syndrome
)-
gwałtowne zaostrzenie APS
gwałtowne zaostrzenie APS
•
Przyczyna nieznana, czynnik wywołujący: infekcja, zabieg chirurgiczny,
Przyczyna nieznana, czynnik wywołujący: infekcja, zabieg chirurgiczny,
rozległy uraz, nagłe przerwanie leczenia przeciwkrzepliwego
rozległy uraz, nagłe przerwanie leczenia przeciwkrzepliwego
- nagły początek
- bardzo burzliwy, gwałtowny przebieg kliniczny,
zwykle kilka dni
- zakrzepica zlokalizowana w co najmniej 3 narządach
(rozległa
wielonarządowa zakrzepica:
płuca-
mikrozatorowość z krwiopluciem, zajęcie CUN, nerek,
serca, skóry, przewodu pokarmowego, nadnerczy).
- bardzo wysokie miana przeciwciał
antykardiolipinowych w klasie IgG
- pomimo intensywnego leczenia w ok. 60 % kończy się
zgonem chorego (ARDS, ndl krążenia, śpiączka, ONN,
trombocytopenia)

CHOROBY LUB STANY FIZJOLOGICZNE, W
KTÓRYCH MOGĄ WYSTĘPOWAĆ
PRZECIWCIAŁA ANTYFOSFOLIPIDOWE
1
).
Pierwotny
zespół antyfosfolipidowy
2).
Układowe choroby tkanki łącznej
(głównie SLE !!!, RZS, SD,
DM, z. Sjögrena, z. Behceta, układowe zapalenia naczyń).
3).
Nowotwory
(rak: prostaty, sutka, trzustki, nerek,
oskrzeli
rzadziej mięsaki).
4).
Choroby hematologiczne
(niedokrwistość
autoimmunohemolityczna, małopłytkowość autoimmunologiczna,
chłoniaki- Hodgkin – i non-Hodgkin lymphoma)- głównie w klasie
IgM).
5). Choroby wątroby
( marskość wątroby, przewlekle aktywne
zapalenie wątroby).

6). Choroby infekcyjne
(bakteryjne- tbc, trąd, kiła, wirusowe-
AIDS, różyczka, WZW t.B., mononukleoza zakaźna, adenowirusy,
szczepienia przeciw chorobom wirusowym, pierwotniakowe-
Pneumocystis carrini). Poza tym-goraczka reumatyczna, ch. z Lyme,
b.z.w., malaria
7). Sarkoidoza
8). Po niektórych lekach
(doustne leki antykoncepcyjne,
prokainamid, hydralazyna, beta-blokery, chloropromazyna,
fenytoina, peniciliny, izoniazyd, chinina, chinidyna, metyldopa).
9). Zdrowi
(głównie starsi).

KRYTERIA DIAGNOSTYCZNE ZESPOŁU
ANTYFOSFOLIPIDOWEGO
(wg. Harrisa-1987
).
KLINICZNE: LABORATORYJNE
:
Zakrzepica żylna Przeciwciała AcL w klasie
IgG
(średnie lub wysokie poziomy)
Zakrzepica tętnic
Powtarzające się straty
ciąży
Przeciwciała AcL
w klasie
IgM
(średnie lub wysokie
poziomy)
Małopłytkowość Dodatnie testy na
obecność LAC

Warunki rozpoznania PASP:
1.
Chorzy na PAPS powinni spełnić co najmniej
1
kryterium kliniczne i 1 laboratoryjne
2. Test na obecność
aPL
powinien być
dodatni co
najmniej
dwukrotnie
w odstępach co najmniej trzech
miesięcy.
3. Wskazana jest co najmniej
5-letnia obserwacja
celem
wykluczenia SLE lub innej choroby układowej.
Za wynik dodatni przyjmujemy poziom powyżej 4
SD od średniej
zdrowych dawców krwi.

KRYTERIA KLINICZNE PAPS
(wg.
Alarcon-Segovia
)
Zakrzepica żył
Małopłytkowość
Anemia hemolityczna
Poronienia
Owrzodzenia podudzi
Niedrożność tętnic
Livedo reticularis
Zapalenie poprzeczne rdzenia kręgowego
Obecność co najmniej 2 objawów klinicznych u chorych z obecnością przeciwciał
antyfosfolipidowych upoważnia do rozpoznania PAPS

Kryteria diagnostyczne zespołu
antyfosfolipidowego
Kryteria kliniczne:
1.
Zakrzepica naczyniowa
Jeden lub kilka epizodów zakrzepicy tętniczej,
żylnej lub drobnych naczyń w jakiejkolwiek
tkance lub narządzie. Zakrzepica musi
być
potwierdzona
badaniem obrazowym
,
dopplerowskim albo histopatologicznym,
wyłączając zakrzepicę żył powierzchownych.
Obraz histopatologiczny musi potwierdzać
zakrzepicę bez obecności stanu zapalnego
ściany naczynia.

2.
Powikłania położnicze
a) Jeden lub więcej niewytłumaczonych epizodów
śmierci morfologicznie prawidłowego płodu w
wieku
≥ 10
tygodnia ciąży,
prawidłowa morfologia płodu winna
być potwierdzona badaniem ultrasonograficznym
lub bezpośrednim płodu (autopsja)
lub
b) Jeden lub więcej epizodów przedwczesnego
porodu morfologicznie prawidłowego płodu w
wieku
≤ 34 tygodnia
ciąży
z powodu ciężkiego
stanu przedrzucawkowego lub rzucawkowego albo
ciężkiej niewydolności łożyskowej
lub
c) Trzy lub więcej kolejnych niewytłumaczonych
spontanicznych poronień
przed 10 tygodniem
ciąży
, po wykluczeniu patologii anatomicznych lub
hormonalnych u matki oraz patologii
chromosomalnych u ojca i matki.
Kryteria diagnostyczne zespołu
antyfosfolipidowego c.d
.

Kryteria diagnostyczne zespołu
antyfosfolipidowego c.d
Kryteria laboratoryjne
1. Obecność we krwi
przeciwciał
antykardiolipinowych klasy IgG i/lub
IgM w
mianie średnim lub wysokim
,
wykazana w 2 lub więcej oznaczeniach
wykonanych w odstępie
co najmniej 6
tygodni
, przy użyciu
wystandaryzowanego testu
immunoenzynatycznego do pomiaru
przeciwciał antykardiolipinowych
zależnych od β
2
glikoproteiny I.

Kryteria diagnostyczne zespołu
antyfosfolipidowego c.d
Kryteria laboratoryjne c.d.
2. Obecność w osoczu
antykoagulantu
toczniowego
, potwierdzona co najmniej 2
badaniami wykonanymi w odstępie
co
najmniej 6 tygodni,
zgodnie z zaleceniami
Komitetu Naukowego ds. Standaryzacji
ISTH (Inernational Society on
Thrombosis and Haemostasis)
Do rozpoznania APS niezbędne jest
współistnienie
co najmniej jednego
kryterium klinicznego i jednego
kryterium laboratoryjnego.

TRUDNOŚCI W RÓŻNICOWANIU
PAPS I APS W PRZEBIEGU SLE
Chorzy na PAPS mogą spełniać
aż 6
spośród 11 kryteriów
klasyfikacyjnych
ARA dla SLE, chociaż patomechanizm
objawów jest tu ściśle związany z
obecnością aPLs.

Kryteria ARA Prawdopodobny
pato-
mechanizm PAPS
1). Zapalenie błon surowiczych
a). Zapalenie opłucnej Zatorowość płucna
Niewydolność lewej komory
serca
b). Zapalenie osierdzia Zawał m. serca
Mocznica
2). Nefropatia
Zakrzepica tętnicy lub żyły
nerkowej
Zakrzepowa
mikroangiopatia nerek

3). Zaburzenia neurologiczne
a). Drgawki Zakrzepica naczyń mózgowych
b). Psychoza Zakrzepowa mikroangiopatia naczyń
mózgowych
4). Zaburzenia hematologiczne
a). Małopłytkowość Zależna od aPL
b). Anemia hemolityczna Zależna od aPL

5). Zaburzenia immunologiczne
Fałszywie dodatnie testy
VDRL
zależne od aPL
6). Przeciwciała przeciwjądrowe
Wykrywane w niskich mianach
< 1:320

PROPONOWANE KRYTERIA WYKLUCZENIA PAPS
(wg. Piette i wsp.).
1.
Rumień twarzy
2.
Rumień krążkowy
3.
Owrzodzenia jamy ustnej i gardła z
wyjątkiem owrzodzenia i perforacji przegrody
nosa
4.
Zapalenie stawów
5.
Zapalenie opłucnej, po wykluczeniu zatoru
płuc i niewydolności lewokomorowej serca
6.
Zapalenie osierdzia, po wykluczeniu zawału
m. serca i mocznicy

7).
Utrzymująca się
proteinuria > 0,5 g/dobę,
potwierdzona
badaniem histopatologicznym nerki, dającym obraz
kłębkowego zapalenia nerek
8).
Limfopenia < 1000/ mm 3
9).
Obecność przeciwciał
p/n DNA
10).
Obecność przeciwciał
p/ENA
11).
Obecność przeciwciał
przeciwjądrowych w mianie
>1:320
12).
Stosowanie
leków indukujących aPL
Spełnienie jakiegokolwiek z powyższych kryteriów wyklucza
rozpoznanie PAPS.
Konieczna jest co najmniej 5-letnia obserwacja chorego od chwili
wystąpienia pierwszych objawów klinicznych celem wykluczenia SLE.

BADANIA SEROLOGICZNE U CHORYCH NA ZESPÓŁ ANTYFOSFOLIPIDOWY
Test PAPS SLE, LLD
n DNA (-) obecne/nieobecne
ENA (-) obecne/nieobecne
VDRL
(fałszywie dodatni) 20-30% 20-30%
Przeciwciała 20-30% 20-30%
p/mitochondrialne
Czynnik reumatoidalny rzadko często
Kompleksy immunolog. obecne obecne
Krioglobuliny obecne (rzadko) obecne
Niedobór C4 dopełniacza obecny obecny

W TOCZNIU RUMIENIOWATYM
UKŁADOWYM
-
Występuje większa przewaga
kobiet (9:1)
W PAPS- 2:1
- Częściej obserwuje się
wysypki na skórze
-
Zapalenie stawów
-
Zapalenie błon surowiczych
- Zajęcie
CUN
(inne niż naczyniopochodne)
-
Pląsawica
-
Zajęcie nerek
(białkomocz, patologiczny osad moczu).
- Zmiany na zastawkach serca (aseptyczne brodawkowate
zapalenie wsierdzia).
- Częściej
„zaostrzenia”

OBJAWY KLINICZNE, KTÓRE MOGĄ WYSTĄPIĆ W
PAPS
ZAKRZEPICA ŻYŁ GŁĘBOKICH KOŃCZYN DOLNYCH
(najczęściej-55% w ok. 30-50% powikłana zatorem TP)
(podudzi i uda, rzadziej zakrzepica kk. górnych, obręczy barkowej,
żył wątrobowych, śledzionowych, miednicy, siatkówki oka, zatok
żylnych mózgu-uporczywe bóle głowy). Rzadko występuje
zakrzepica żył powierzchownych. Zwykle
<45 r.z.
Nawroty !!
ZAKRZEPICA NACZYŃ TĘTNICZYCH
•
naczynia mózgowe – udar, przemijające niedokrwienie mózgu
naczynia mózgowe – udar, przemijające niedokrwienie mózgu
(TIA), zaburzenia psychiczne, padaczka, pląsawica, przejściowe
(TIA), zaburzenia psychiczne, padaczka, pląsawica, przejściowe
zaburzenia widzenia i słuchu
zaburzenia widzenia i słuchu
•
tętnice wieńcowe
tętnice wieńcowe
•
tętnice obwodowe kk dolnych-chromanie kończyn, zgorzel
tętnice obwodowe kk dolnych-chromanie kończyn, zgorzel
palców,
palców,
•
tętnice nerkowe, naczynia kłębuszków nerkowych
tętnice nerkowe, naczynia kłębuszków nerkowych
(nadciśnienie tętnicze – pierwszy objaw APS)
(nadciśnienie tętnicze – pierwszy objaw APS)
•
2-3 x rzadziej niż zakrzepica żylna
2-3 x rzadziej niż zakrzepica żylna

OBJAWY KLINICZNE, KTÓRE MOGĄ
WYSTĄPIĆ W PAPS
PATOLOGIA POŁOŻNICZA
:
APS wykrywany jest u
APS wykrywany jest u
20% kobiet z wywiadem nawykowych poronień
20% kobiet z wywiadem nawykowych poronień
•
utrata ciąży następuje najczęściej w II, III
utrata ciąży następuje najczęściej w II, III
trymestrze ciąży, opóźnienie
trymestrze ciąży, opóźnienie
wewnątrzmacicznego rozwoju płodu
wewnątrzmacicznego rozwoju płodu
•
przyczyna – zaburzenia czynności łożyska
przyczyna – zaburzenia czynności łożyska
spowodowane zakrzepicą w krążeniu maciczno-
spowodowane zakrzepicą w krążeniu maciczno-
łożyskowym
łożyskowym
•
Stan przed- i rzucawkowy, przedwczesne
Stan przed- i rzucawkowy, przedwczesne
odklejanie łożyska, upośledzenie wzrostu płodu,
odklejanie łożyska, upośledzenie wzrostu płodu,
zespół HELLP (haemolysis, elevated liver
zespół HELLP (haemolysis, elevated liver
enzymes, low platelets)
enzymes, low platelets)
•
zapalenie błon surowiczych w połogu
•
zakrzepica u noworodków

SKÓRA:
livedo reticularis (48%)
zakrzepica drobnych
tętniczek skóry- tani marker diagnostyczny, owrzodzenia
podudzi, zgorzel palców,ogniskowa martwica skóry
Zespół Sneddona
Zespół Sneddona
– nawrotowe udary mózgu + livedo
– nawrotowe udary mózgu + livedo
reticularis
reticularis
NERKI:
zawał nerki, nadciśnienie tętnicze, białkomocz,
niewydolność nerek (wynik zakrzepicy tętnic nerkowych,
żył nerkowych i mikrozatorów nerkowych).
CUN:
udar mózgu, pląsawica, przemijające
niedokrwienie mózgu (TIA),
zespół otępienny, myelitis transversalis, „pseudo” SM,
silne migrenowe bóle głowy, zaburzenia widzenia
związane z zatorami tt.siatkówki lub zakrzepami żył

Przeciwciała antyfosfolipidowe są
najczęściej związane z
epizodami
niedokrwiennymi
u młodych chorych <50
r.ż.,
ale częstość udaru u starszych
pacjentów wynosi 10-18% i jest większa niż
w ogólnej populacji(<4%).
Pląsawica
występuje w innym mechanizmie niż w
gorączce reumatycznej (pląsawica
Sydenhana) lub w chorobach dziedzicznych
(pląsawica Huntingtona). Występuje częściej
u dzieci, może wystąpić
po raz pierwszy
podczas ciąży
lub w
połogu
a wystąpienie jej
mogą przyspieszać doustne leki
antykoncepcyjne u podatnych pacjentek.

SERCE:
* uszkodzenie zastawek serca (na zastawkach mogą
tworzyć się brodawkowate zmiany złożone z leukocytów, komórek
plazmatycznych, płytek krwi i fibryny. Zmiany te, znane jako
zapalenie wsierdzia typu Libman-Sacksa, mogą doprowadzić
do niedomykalności lub stenozy zastawek serca, a w późniejszym
okresie do zwiększonego ryzyka powikłań zatorowych mózgu.
*pierwotne wewnątrzsercowe skrzepliny (zlokalizowane
zarówno w przedsionkach i komorach)
* U ponad 50% z przedoperacyjnie stwierdzonymi przeciwciałami
aPL występują późne zakrzepy założonych pomostów
wieńcowych.
*zawał serca, * nadciśnienie tętnicze,
*kardiomiopatia
-ostra (wynik uogólnionej zakrzepicy tętniczek, bez cech
vasculitis). Odpowiada ona za rozległą martwicę serca.
Klinicznie: zastoinowa ndl krążenia
-przewlekła
Klinicznie: ndl lewokomorowa

OBJAWY PŁUCNE:
*zatorowość płucna, *zawał płuca,*
nadciśnienie płucne, *wewnątrzpęcherzykowe krwawienie płucne
NARZĄD WZROKU
: *zawał siatkówki, *wylewy krwawe do ciałka
szklistego, *odklejenie się siatkówki, *zaćma
OBJAWY HEMATOLOGICZNE:
*małopłytkowość
występuje u ok.. 25% pacjentów z APS
występuje u ok.. 25% pacjentów z APS
,
*niedokrwistość hemolityczna
bardzo rzadko PAPS, częściej w SAPS w
bardzo rzadko PAPS, częściej w SAPS w
przebiegu SLE – w 30-40% przypadków stwierdza się dodatni odczyn Coombsa
przebiegu SLE – w 30-40% przypadków stwierdza się dodatni odczyn Coombsa
OBJAWY SEROLOGICZNE:
* ppj <1:160, VDRL
(+)
CHOROBA ADDISONA
(wynik obustronnej martwicy nadnerczy-
zakrzepica żylna, doprowadza do obrzęku nadnerczy i wtórnie do
ucisku na tętnice).
WĄTROBA
– Z.Budd-Chiariego, zawał wątroby,
Krwawienia
Krwawienia
bardzo rzadko, przyczyna hipoprotrombinemia, małopłytkowość
bardzo rzadko, przyczyna hipoprotrombinemia, małopłytkowość
≤
≤
50 000/mm
50 000/mm
3
3

Potencjalne przyczyny krwawienia u
chorych
na
zespół
antyfosfolipidowy.
1. Specyficzne czynniki hamujące
– inhibitor czynnika VIII,
– inhibitor czynnika II.
2. . Trombocytopenia.
3. Dysfunkcja lub nieprawidłowa czynność
płytek.
4. Mocznica.
5. Jednoczesne podawanie leków (np. aspiryny).

APS –PROBLEM INTERDYSCYPLINARNY- PACJENT MOŻE ZGŁOSIĆ SIĘ
DO NASTĘPUJĄCYCH LEKARZY:
-
LEKARZ OGÓLNY, INTERNISTA
-PEDIATRA
-REUMATOLOG
-HEMATOLOG
-GINEKOLOG-POŁOŻNIK
-CHIRURG OGÓLNY I NACZYNIOWY
-NEUROLOG -PSYCHIATRA
-CHIRURG OGÓLNY I NACZYNIOWY
-NEUROLOG -PSYCHIATRA
-OKULISTA
-ENDOKRYNOLOG -GASTROENTEROLOG
-PULMONOLOG -NEFROLOG
-DERMATOLOG

Czynniki ryzyka zakrzepów u chorych
na zespół antyfosfolipidowy
.
1. Przedłużające się leżenie w łóżku.
2. Po zabiegach chirurgicznych.
3. Po doustnej antykoncepcji (estrogeny).
4. Ciąża i połóg.
5. Aktywny toczeń.
6. Choroby nerek.
7. Po nagłym przerwaniu leczenia
antykoagulacyjnego np. z powodu biopsji,
operacji.
8. Inne czynniki ryzyka np. nadciśnienie, palenie
tytoniu, itd.

GRUPY PACJENTÓW Z PRZECIWCIAŁAMI
ANTYKARDIOLIPINOWYMI
1). Grupa 1 (niskie ryzyko)-
osoby bez zakrzepicy w wywiadzie, z
niskim mianem przeciwciał
2). Grupa 2 (wysokie ryzyko)-
osoby z co najmniej dwoma
epizodami zakrzepicy lub nawracającymi poronieniami, z wysokim
mianem przeciwciał
3). Grupa 3 (pośrednie ryzyko)-
osoby z najwyżej jednym
epizodem zakrzepowym, lecz nie więcej jak dwoma poronieniami i
wysokim poziomem przeciwciał.
Tylko pacjenci należący do Grupy 2 wymagają (przez całe życie) leczenia
antykoagulantami.

LECZENIE APS
1). PAPS-
leki antyagregacyjne (aspiryna)
lub p/zakrzepowe (heparyna lub doustne
antykoagulanty)
2). APS +LLD-
leki antymalaryczne lub
GKS w małych lub średnich dawkach
3).APS +SLE
– Leczyć energicznie
chorobę podstawową! GKS, cytostatyki
+ leki antyagregacyjne lub p/zakrzepowe

LECZENIE APS
4). CAPS- GKS i.v.
Cyclofosfamid i.v.
Leki p/zakrzepowe
Plazmafereza (jak najwcześniej)
Ig i.v.
Leczenie podtrzymujące stosownie do stanu klinicznego
(mechaniczna wentylacja, hemodializa i inne).
LECZENIE PROFILAKTYCZNE
- małe dawki aspiryny (75-150
mg/dobę)-wysokie miana aPL, przy braku objawów klinicznych

Leczenie APS
Leczenie APS
Objawy kliniczne
Brak
Zakrzepica żył głębokich ± zatorowość płuc
Dużych tętnic (udar mózgu)
Przejściowy incydent niedokrwienia mózgu (TIA)
Katastroficzny zespół antyfosfolipidowy
Ciąża
Bez wywiadu zakrzepicy naczyń lub strat
ciąży
Straty ciąży w wywiadzie
Zakrzepica naczyń + straty ciąży w
wywiadzie
Małopłytkowość
Łagodna (100 000-150 000)
Umiarkowana (70 000-100 000)
Ciężka (< 70 000)
Leczenie
Aspiryna 75 mg/dz (?)
– Heparyna, potem doustne antykoagulanty (INR >=
3)
– Heparyna, potem doustne antykoagulanty (INR >=
3)
– Aspiryna 75 mg/dz (?)
– Heparyna, potem doustne antykoagulanty (INR >=
3)
– Aspiryna 75 mg/dz
– Heparyna, potem doustne antykoagulanty (INR >=
3)
– glikokortikosteroidy lub cytostatyk
– dożylne preparaty immunoglobulin
– ew. plazmafereza
– Aspiryna 75 mg/dz
– Aspiryna 75 mg/dz ± Heparyna s.c.
– Aspiryna 75 mg/dz ± Heparyna s.c.
-Obserwacja
– Aspiryna 75 mg/dz
– Glikokortykosteroidy + dożylne preparaty
immunoglobulin

ZAKRZEPICA ŻYŁ GŁĘBOKICH
Ostra faza
:
Heparyna
(7-10 dni)- i.v. w pompie infuzyjnej lub s.c.
(mogą być trudności w monitorowaniu leczenia z uwagi na wyjściowo
wydłużony APTT – wtedy należy oznaczać poziom heparyny we krwi
lub stosować heparyny drobnocząsteczkowe np.
Fraxiparyna,
Clexane).
Czas APTT powinien wydłużyć się
1,5- 2x w stosunku do wyjściowego
APTT chorego.
a następnie
doustne antykoagulanty (Sintrom
) pod kontrolą INR
* przez 3 m-ce przy pierwszym incydencie zakrzepowym
* do 6 m-cy przy drugim incydencie zakrzepowym
* przez całe życie po trzecim epizodzie, szczególnie zakrzepicy w
CUN.

ZAKRZEPICA TĘTNICZA
Heparyna, doustne antykoagulanty (INR< 3),
ale
celowe jest dołączenie małych dawek kwasu
acetylosalicylowego
W zakrzepicy naczyń siatkówki- dodać pentoksyfilinę.
ZAKRZEPICA Z MAŁOPŁYTKOWOŚCIĄ
-najpierw włączyć
sterydy
aż do uzyskania wzrostu
liczby płytek >50000 i dopiero wówczas rozpocząć
podawanie
leków p/zakrzepowych.

CIĄŻA i APS
1). Profilaktyka (gdy są tylko aPL)- bez strat ciąży, bez zakrzepicy
w wywiadzie
Aspiryna (75-150 mg/dobę)- przerwać aspirynę na 2 tygodnie
przed porodem.
2). Wywiad zakrzepowy i/lub poronienie + aPL
Heparyna s.c., ew. + aspiryna (75 –150 mg/dobę)
3). Małopłytkowość + aPL
GKS, gdy T < 70000 (15-30 mg/dziennie)- zwykle staje się to
konieczne w II połowie ciąży.
4). Ciąża + APS+ SLE
GKS zgodnie z aktywnością SLE + Heparyna s.c. +- Aspiryna.

Małopłytkowość
Łagodna (100 000-150 000)
obserwacja
Umiarkowana (70 000-100 000)
Aspiryna 75 mg/d
Ciężka (< 70 000)–
Glikokortykosteroidy +
dożylne
preparaty
immunoglobulin

HEPARYNA
Drogi podawania:
* i.v. w postaci tzw. bolusów (tylko do rozpoczynania leczenia).
dożylnie w ciągłym wlewie kroplowym
podskórnie
Cele stosowania heparyny
-profilaktyczne (podskórnie)
-lecznicze - zaczynamy od bolusa i.v.( jednorazowo 5 000 j). lub rzadko
od większych dawek heparyny podawanej podskórnie. Następnie
kontynuujemy ciągły wlew kroplowy i.v. w ilości
32 000j./dobę do wartości APTT 1,5-2,5x > niż wartość wyjściowa.

Heparyny drobnocząsteczkowe w celach
leczniczych:
Po wstrzyknięciu podskórnym poziom terapeutyczny uzyskuje się
bardzo szybko i nie ma potrzeby podawania wstępnej dawki
dożylnej.
· Fraxiparyna 0.1 ml/10 kg co 12 godz. (0,6 ml co 12 godz.).
· Clexane 1mg/kg co 12 godz.
Zalety heparyn drobnocząsteczkowych
:
1). Podaje się co 12 godzin podskórnie, ale można też podawać
1x dz.
2). Stosowanie profilaktycznie może odbywać się bez kontroli
laboratoryjnej APTT.
3). Rzadsze występowanie małopłytkowości.
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
- Slide 41
- Slide 42
- Slide 43
- Slide 44
- Slide 45
- Slide 46
- Slide 47
- Slide 48
- Slide 49
- Slide 50
- Slide 51
- Slide 52
- Slide 53
- Slide 54
- Slide 55
- Slide 56
- Slide 57
- Slide 58
- Slide 59
- Slide 60
Wyszukiwarka
Podobne podstrony:
Zespol antyfosfolipidowy
Zespół antyfosfolipidowy 2
Zespół nerczycowy
9 RF ZEspól 0 Środki trwałe
Zespół kanału łokciowego i nerw pachowy (tryb edytowalny)
Zespoly paranowotworowe
Zespoly interdyscyplinarne
Teoria organizacji i kierowania w adm publ prezentacja czesc o konflikcie i zespolach dw1
zespoly otepienne
Role w zespole projektowym
Zespół Marfana
więcej podobnych podstron