
Wykład 10 – KINETYKA CHEMICZNA I KATALIZA
KINETYKA CHEMICZNA
I KATALIZA
Postęp reakcji chemicznej, definicja szybkości reakcji.
Równanie kinetyczne i rząd reakcji. Wykres przebiegu
energetycznego reakcji egzo- i endotermicznej. Reakcje
elementarne jedno-, dwu- i trójcząsteczkowe.

Wykład 10 – KINETYKA CHEMICZNA I KATALIZA
Kinetyka chemiczna:
– badanie przebiegu reakcji w czasie
– badanie szybkości reakcji
– ustalenie mechanizmu reakcji
– badanie wpływu różnych czynników
na szybkości reakcji
υ
1
≈ −
Δn(O
2
)
Δt
υ
2
≈ −
Δn(H
2
)
Δt
Wykład 10 – KINETYKA CHEMICZNA I KATALIZA
Szybkość reakcji chemicznej =
zmiana liczności (stężenia) reagenta
czas
O
2
+ 2H
2
= 2H
2
O
υ
1
υ
2
υ
3
υ
3
≈ +
Δn(H
2
O)
Δt
Szybkość
υ
i
powinna
być zawsze dodatnia
Δn(substrat)<0
,
gdyż substratów
ubywa podczas reakcji
UWAGA! W określonym czasie,
zmiana Δn(H
2
) i Δn(H
2
O)
jest dwa razy większa niż Δn(O
2
)
υ
2
= υ
3
= 2υ
1
Szybkość reakcji υ
i
nie powinna
zależeć od wyboru reagenta !
POSTĘP REAKCJI
Wykład 10 – KINETYKA CHEMICZNA I KATALIZA
Postęp reakcji
Δξ
=
Δn
i
v
i
v
i
– współczynnik stechiometryczny
reagenta
„i”
J ≈
Δξ
Δt
Szybkość reakcji
dlaczego „≈” ?
n
t
υ
≈
Δn
i
Δt·v
i
Δt’
Δn
Δn’
Δt
Δn’
Δt’
Δn
Δt
różna od
Wartość
Δt
!
Dokładne obliczenie szybkości w
określonym punkcie wymaga aby
Δt
było jak najmniejsze,
a najlepiej nieskończenie małe
dt
–
zmianę liczności oznaczamy wtedy jako
dn
J =
dξ
dt
SZYBKOŚĆ REAKCJI
=
dn
i
dt·v
i
t
o
Wykład 10 – KINETYKA CHEMICZNA I KATALIZA
J =
dξ
dt
SZYBKOŚĆ REAKCJI
=
dn
i
dt·v
i
Jeżeli reakcja przebiega w stałej objętości V:
dc =
dn
V
c =
n
V
SZYBKOŚĆ
REAKCJI
= r =
J
V
dc
i
dt·v
i
Pomiar szybkości reakcji
r
– śledzenie stężenia jednego z reagentów
− zmiana barwy reagenta
− zmiana pH roztworu
− zmiana ciśnienia całkowitego
(reakcje w fazie gazowej)
− zmiana przewodnictwa
elektrycznego roztworu
− zmiana właściwości optycznych
(pomiar skręcalności optycznej)
− zmiana masy
Wykład 10 – KINETYKA CHEMICZNA I KATALIZA
Od czego zależy SZYBKOŚĆ REAKCJI CHEMICZNEJ ?
Liczba zderzeń w określonym czasie jest proporcjonalna do stężeń
reagentów
Przereagowanie substratów wymaga zderzenia się ich
cząsteczek
Zatrzymane kadry filmu
Krótki film
Substraty......zderzenie...
...produkty

Wykład 10 – KINETYKA CHEMICZNA I KATALIZA
RÓWNANIE KINETYCZNE REAKCJI
r = k·[A]
α
[B]
β
[C]
γ
...
A, B, C - substraty
α, β, γ
- rząd reakcji względem reagenta A, B, lub C
n = α + β + γ + ...
- ogólny rząd reakcji
k –
stała szybkości reakcji
SZYBKOŚĆ REAKCJI CHEMICZNEJ
w danej temperaturze jest
proporcjonalna do iloczynu stężeń
molowych substancji wchodzących
w reakcję.
Liczba zderzeń w określonym czasie jest proporcjonalna do stężeń
reagentów
... w1863 roku...
... norwescy chemicy
Cato Guldberg (1836-
1902)
i Peter Waage (1833-
1900)...
... sformułowali PRAWO DZIAŁANIA MAS mówiące, że...
Wykład 10 – KINETYKA CHEMICZNA I KATALIZA
Z równania...
Większość reakcji przebiega etapami w których
biorą udział od 1 do najwyżej 3 cząsteczek.
Są to tzw. reakcje elementarne.
2NO + 2H
2
= N
2
+ 2H
2
O
...wynikałoby, że jednocześnie
muszą zderzyć się 4 cząsteczki
( 2NO + 2H
2
).
Zderzenie się 4 ( i więcej) odpowiednich
cząsteczek jest bardzo mało prawdopodobne
Cząsteczkowość reakcji – liczba
cząsteczek (albo atomów,
jonów, rodników) biorących
udział w reakcji.
Przereagowanie substratów wymaga zderzenia się ich
cząsteczek.
ilu cząsteczek ?
Reakcja elementarna
dwucząsteczkowa
Wykład 10 – KINETYKA CHEMICZNA I KATALIZA
REAKCJE ELEMENTARNE
2NO + 2H
2
= N
2
+ 2H
2
O
Reakcja
przebiega w dwóch etapach:
Reakcja elementarna
trójcząsteczkowa
2NO + H
2
= N
2
+ H
2
O
2
r
1
= k
1
·[NO]
2
[H
2
]
H
2
O
2
+ H
2
= 2H
2
O
r = k ·[Br
2
]
W przypadku reakcji
elementarnej, rzędy
reakcji względem
poszczególnych
substratów są równe ich
współczynnikom
stechiometrycznym.
Równanie kinetyczne
reakcji
2NO + 2H
2
= N
2
+ 2H
2
O
r = k ·[NO]
2
[H
2
]
WOLNO
SZYBKO
– dlaczego nie 2 ?
O ogólnej szybkości reakcji
decyduje jej najwolniejszy etap
i jego rzędowości występują
w końcowym równaniu kinetycznym
Reakcja elementarna
jednocząsteczkowa
Br
2
= 2Br
r
2
= k
2
·[H
2
O
2
]
[H
2
]

Wykład 10 – KINETYKA CHEMICZNA I KATALIZA
Czy każde zderzenie cząsteczek substratów
kończy się ich przereagowaniem ?
Obserwacja
praktyczna:
Po odkręceniu kurka gaz się nie pali.
Gaz trzeba zapalić!
Dlaczego ?
– trzeba dostarczyć
trochę energii (płomień zapałki, iskra).
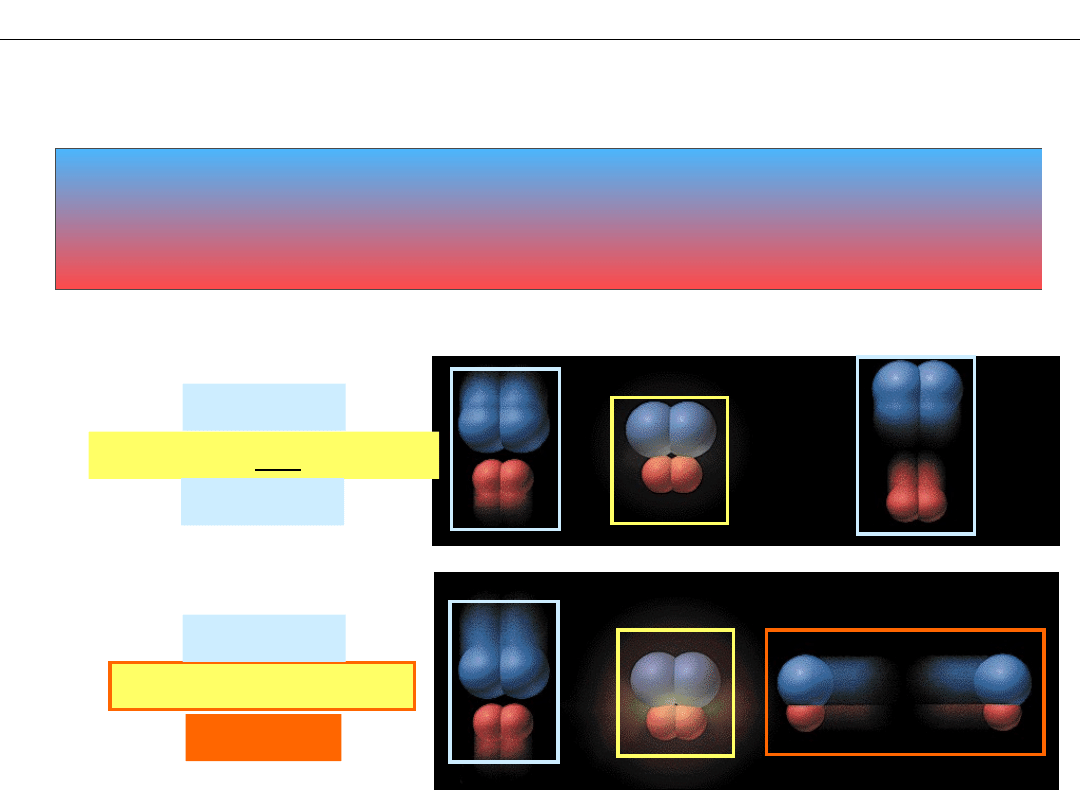
„mocne” zderzenie
Wykład 10 – KINETYKA CHEMICZNA I KATALIZA
Czy każde zderzenie cząsteczek substratów
kończy się ich przereagowaniem ?
NIE !
Aby zaszła reakcja chemiczna
zderzenie cząsteczek substratów musi być aktywne
– cząsteczki muszą mieć dostatecznie dużą energię
Przykład:
H
2
+ Cl
2
= 2HCl
zderzenie nieaktywne
zderzenie aktywne
substraty
substraty
substraty
produkty
„lekkie” zderzenie
Wykład 10 – KINETYKA CHEMICZNA I KATALIZA
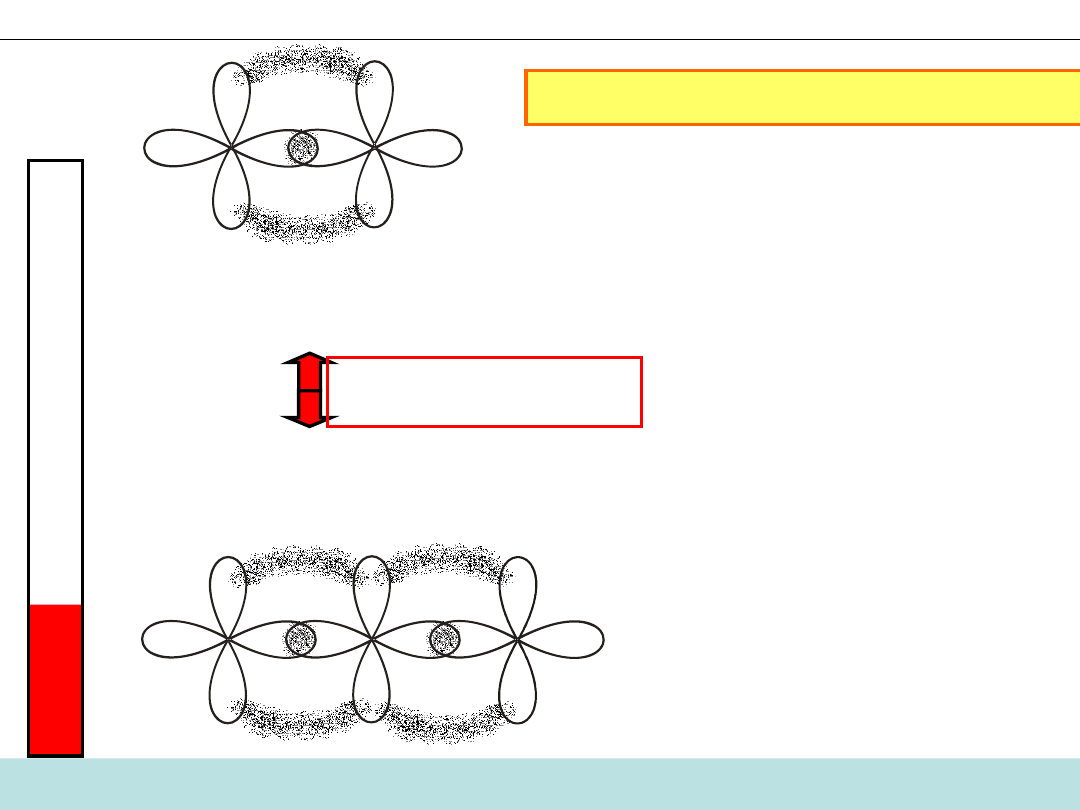
Kiedy zderzenie jest aktywne?
Reakcja:
CO + NO
2
= CO
2
+ NO
C
O
O
UWAGA! Wiązania
π
prostopadłe do rysunku zostały pominięte
Energia
kinet.
cząst.
odpychanie się
chmur elektronowych
N
O
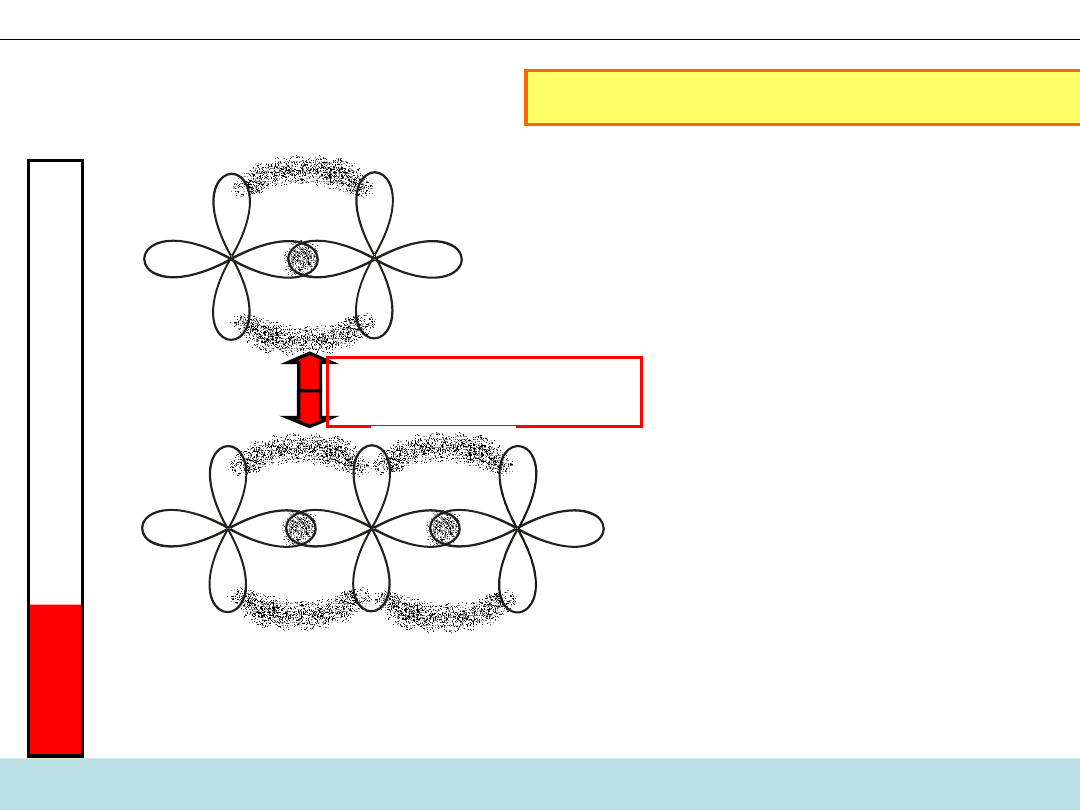
Wykład 10 – KINETYKA CHEMICZNA I KATALIZA
Kiedy zderzenie jest aktywne?
Reakcja:
CO + NO
2
= CO
2
+ NO
C
O
O
UWAGA! Wiązania
π
prostopadłe do rysunku zostały pominięte
Energia
kinet.
cząst.
odpychanie się
chmur elektronowych
N
O
Wykład 10 – KINETYKA CHEMICZNA I KATALIZA
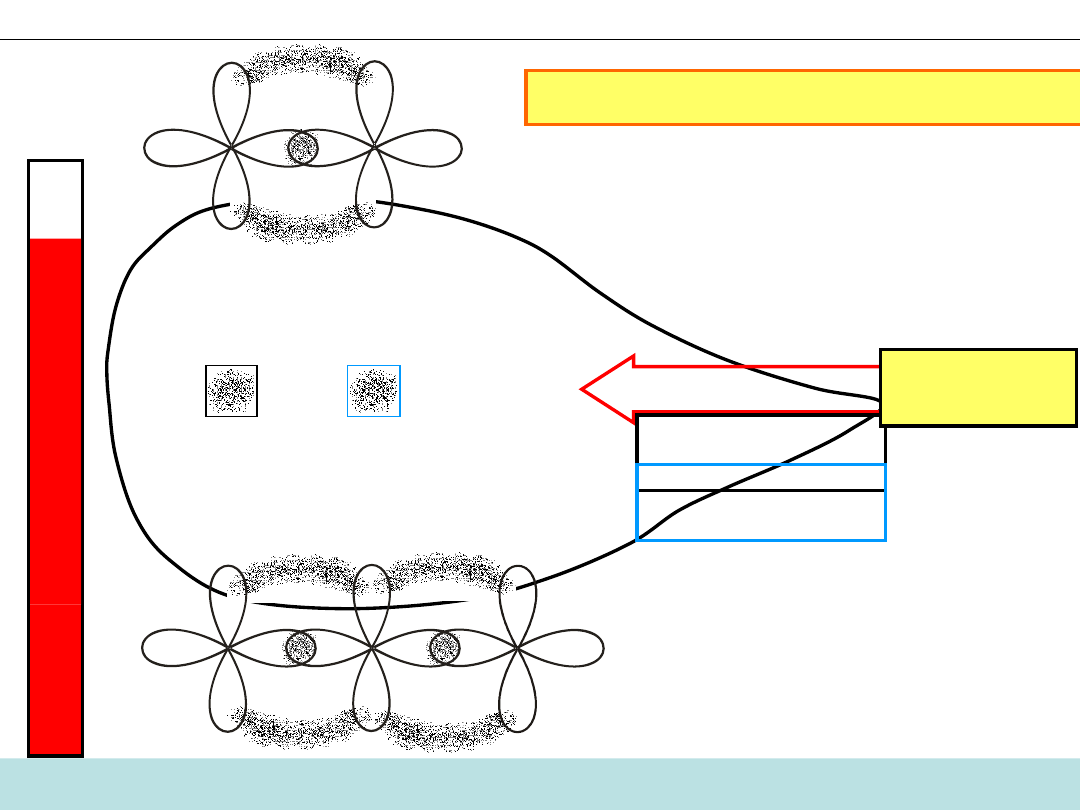
Kiedy zderzenie jest aktywne?
Reakcja:
CO + NO
2
= CO
2
+ NO
C
O
O
UWAGA! Wiązania
π
prostopadłe do rysunku zostały pominięte
Energia
kinet.
cząst.
N
O
nowe wiązania
C – O 358
kJ/mol
N – O 201
kJ/mol
KOMPLEKS
AKTYWNY
Kompleks aktywny ma nadmiar
energii, której się pozbywa poprzez
zerwanie
słabszych wiązań N−O
Wykład 10 – KINETYKA CHEMICZNA I KATALIZA
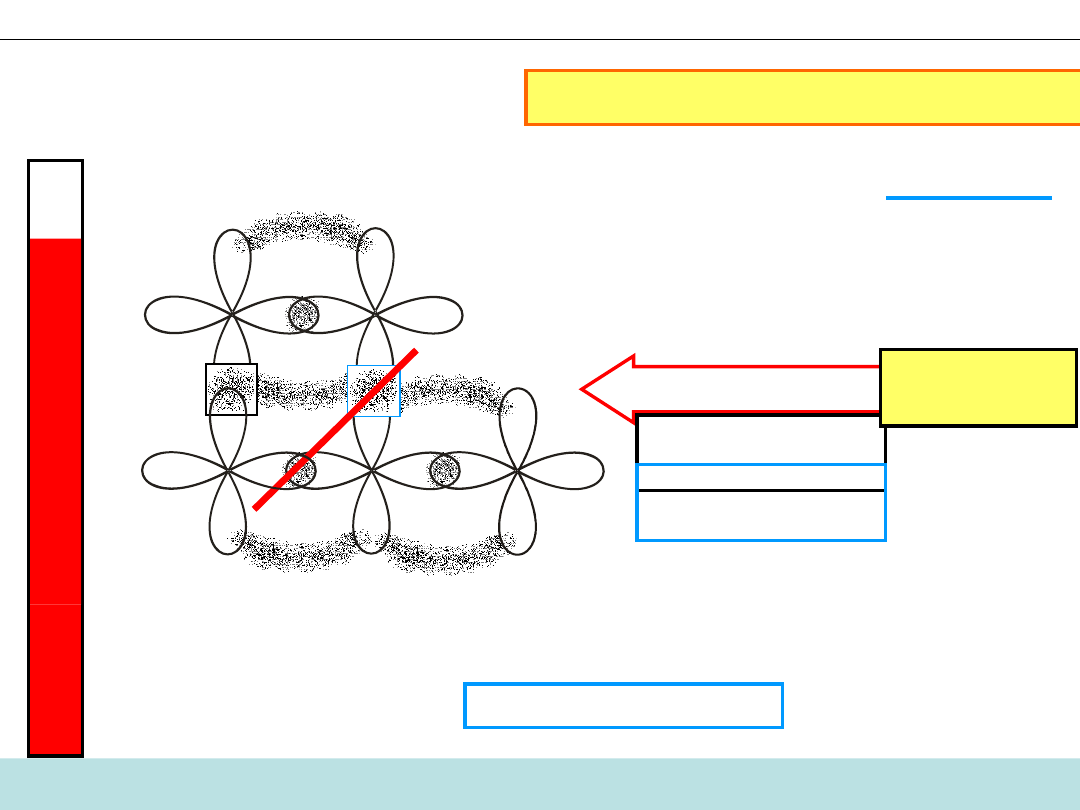
Kiedy zderzenie jest aktywne?
Reakcja:
CO + NO
2
= CO
2
+ NO
C
O
UWAGA! Wiązania
π
prostopadłe do rysunku zostały pominięte
Energia
kinet.
cząst.
N
O
nowe wiązania
C – O 358
kJ/mol
N – O 201
kJ/mol
KOMPLEKS
AKTYWNY
Kompleks aktywny ma nadmiar
energii, której się pozbywa poprzez
zerwanie
słabszych wiązań N−O
CO
2
NO
PRODUKTY REAKCJI
O
Wykład 10 – KINETYKA CHEMICZNA I KATALIZA
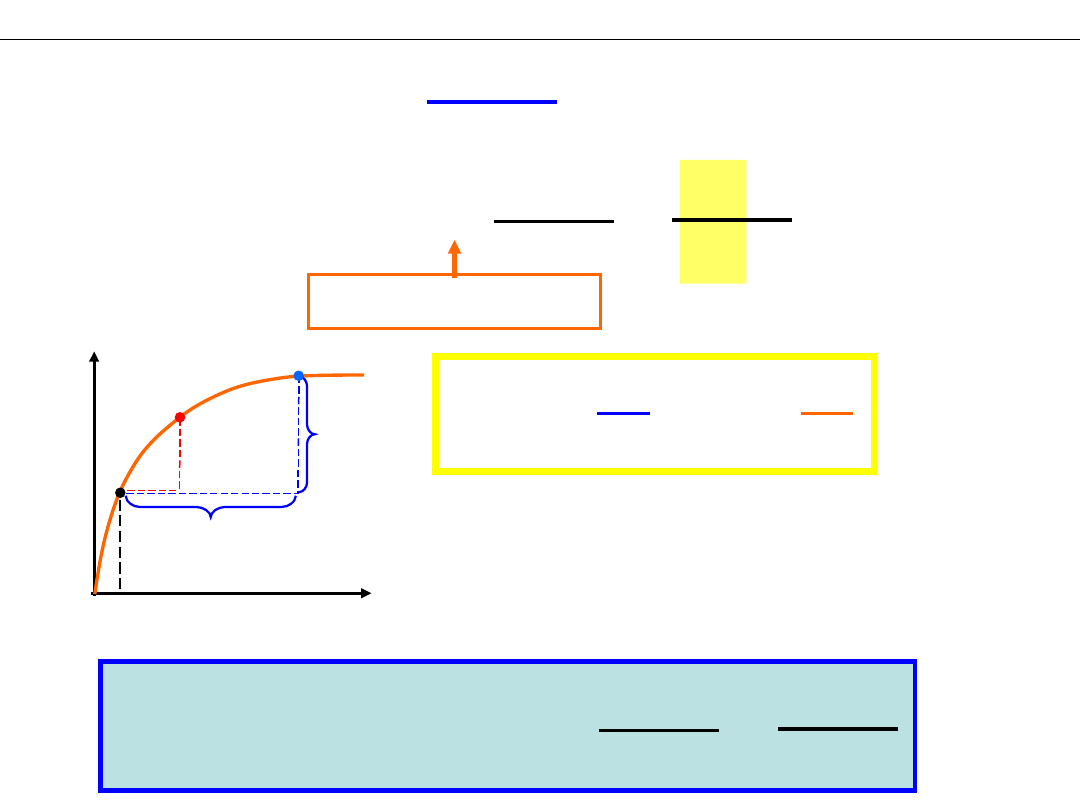
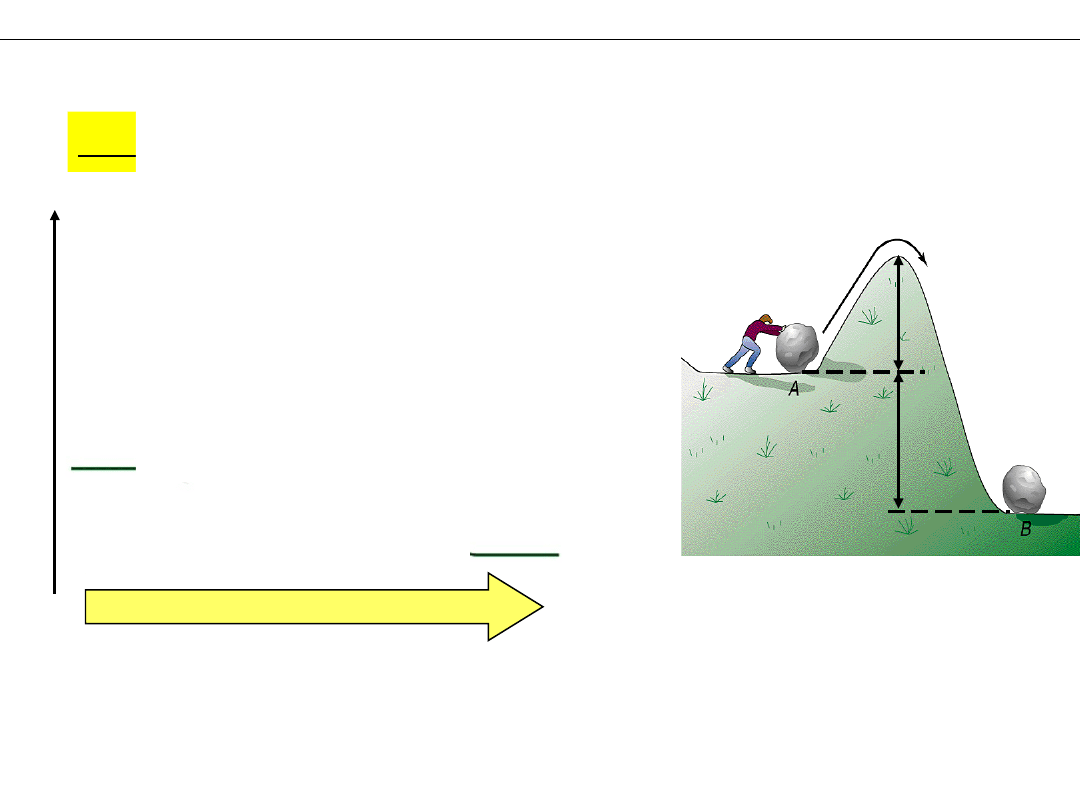
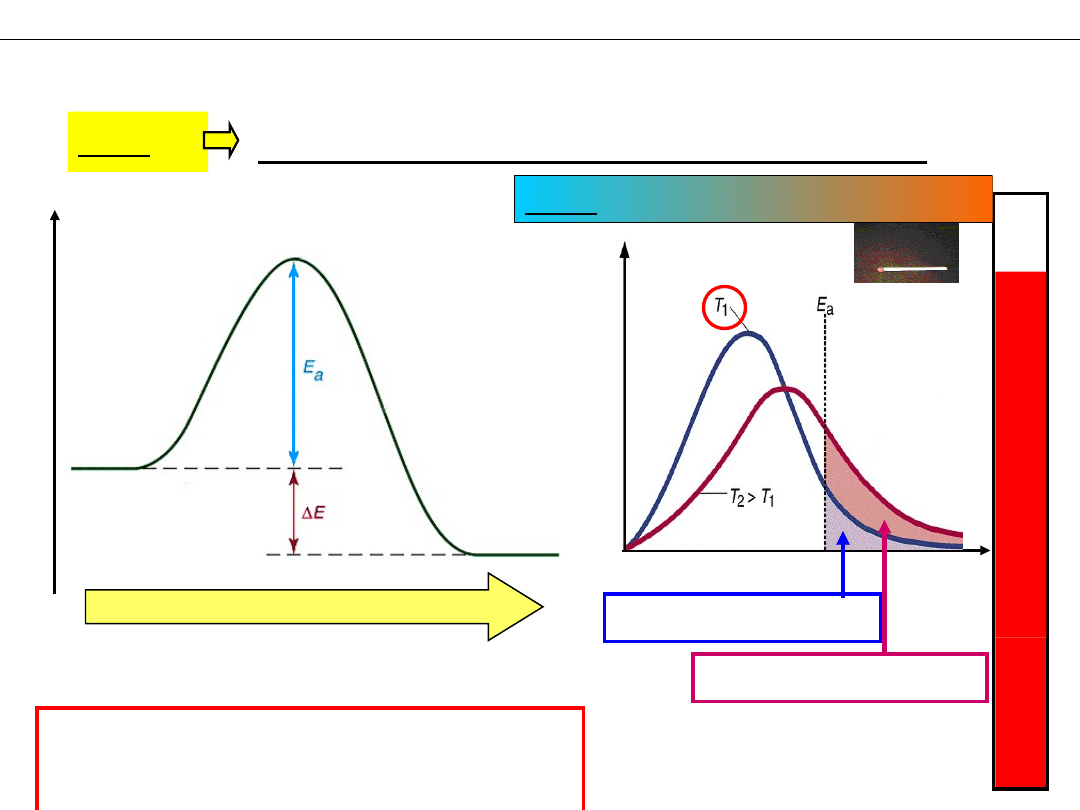
Jaką energię musza mieć cząsteczki aby zderzenie było aktywne?
E
droga reakcji
PRODUKTY
ΔE
– energia reakcji =
ΔH
O
– entalpia reakcji
E
a
– energia aktywacji
– energia niezbędna do utworzenia kompleksu
aktywnego
E
a
ΔE
Odp:
E
a
SUBSTRATY
E
liczba
cząstek
Wykład 10 – KINETYKA CHEMICZNA I KATALIZA
Jak podnieść energię cząsteczek do wartości E
a
?
E
droga reakcji
PRODUKTY
SUBSTRATY
Energia
kinet.
cząst.
Jaką energię musza mieć cząsteczki aby zderzenie było aktywne?
Odp:
E
a
Odp:
Podnieść temperaturę
mało cząst. o E>E
a
więcej cząst. o E>E
a
Odp:
Podnieść temperaturę
Podniesienie temperatury o 10
stopni przyspiesza reakcję około 2
÷ 4 razy.
Wykład 10 – KINETYKA CHEMICZNA I KATALIZA
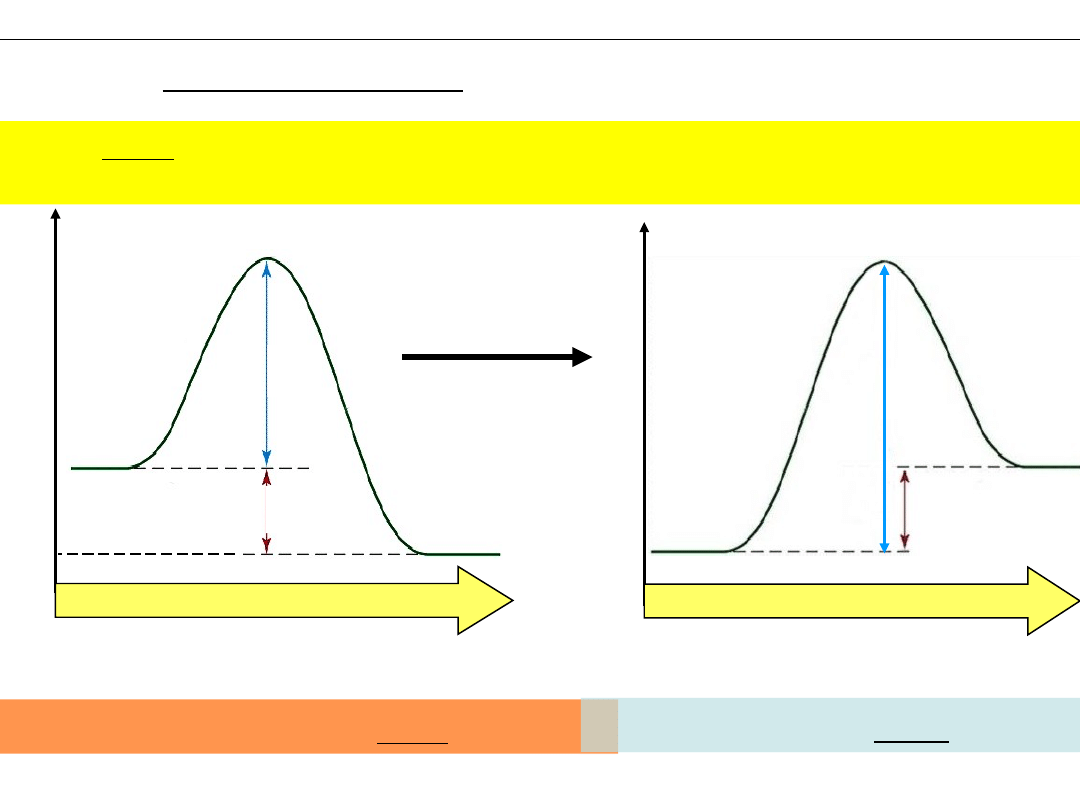
ΔE = ΔH
O
< 0
–reakcja egzotermiczna
Czy zawsze tylko na początku reakcji trzeba dostarczyć energię?
E
s
E
p
ΔE = E
p
− E
s
E
droga reakcji
PRODUKTY
SUBSTRATY
E
a
ΔE
ΔE > 0
–reakcja endotermiczna
ΔE = E
p
− E
s
Odp: Podczas reakcji endotermicznej energię trzeba
dostarczać cały czas.
Reakcja
odwrotna
E
s
E
p
E
SUBST.
PROD.
E
a
ΔE
droga reakcji
Wykład 10 – KINETYKA CHEMICZNA I KATALIZA
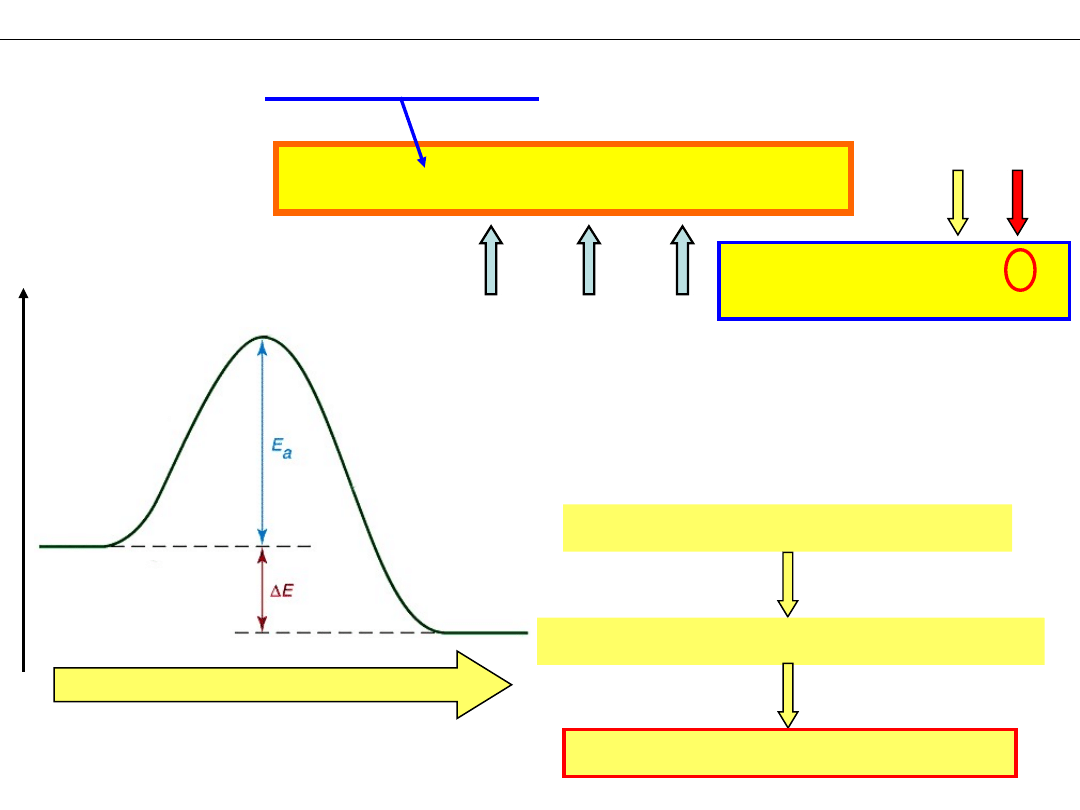
Jak uwzględnić wpływ temperatury w równaniu kinetycznym reakcji?
E
droga reakcji
PRODUKTY
SUBSTRATY
r = k·[A]
α
[B]
β
[C]
γ
...
k = k
o
· e
–Ea/RT
Jak zwiększyć szybkość reakcji?
1. podwyższyć
stężenia
substratów
2. podwyższyć
temperaturę
3. obniżyć energię aktywacji
skierować reakcję na inną drogę
zastosować KATALIZATOR
e = 2,718...
E
droga reakcji
PRODUKTY
SUBSTRATY
ΔE
Wykład 10 – KINETYKA CHEMICZNA I KATALIZA
KATALIZA CHEMICZNA
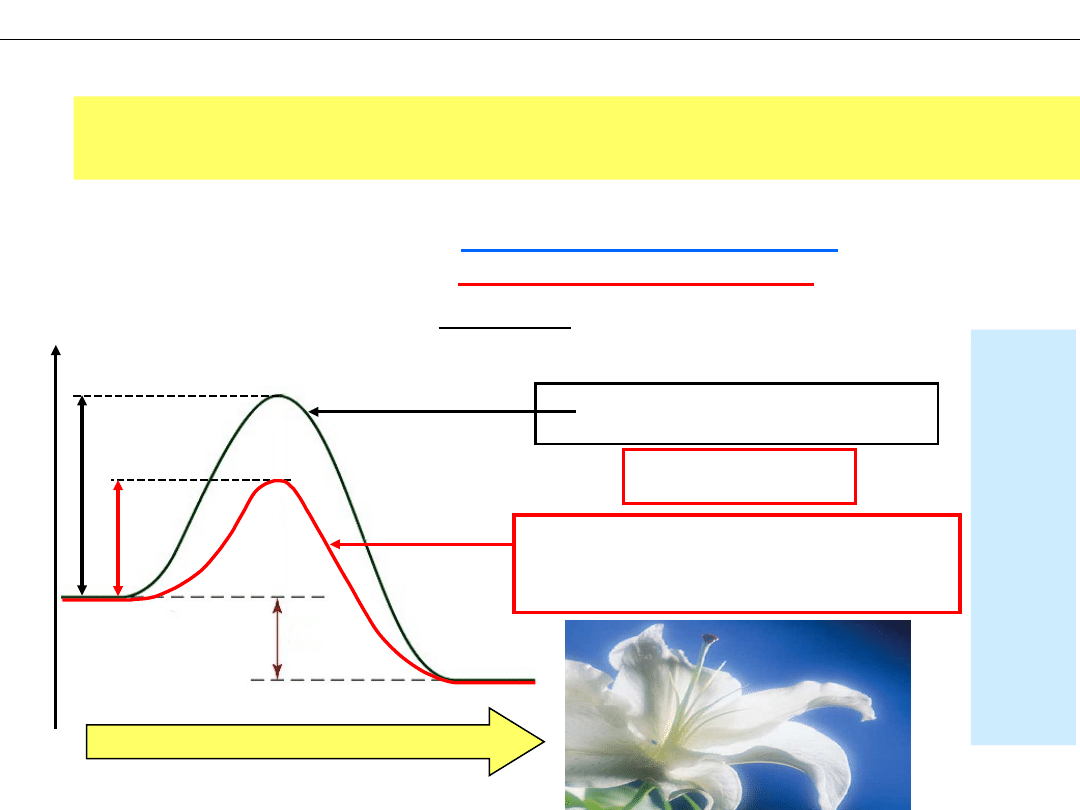
Katalizator – przyspiesza reakcję chemiczną
– po reakcji pozostaje w stanie niezmienionym
Katalizator przyspiesza reakcję chemiczną poprzez
skierowanie jej na inną drogę,
o mniejszej energii aktywacji.
Przykład: rozkład nadtlenku wodoru
2H
2
O
2
= 2H
2
O + O
2
H
2
O
2
+ I
−
= H
2
O + IO
−
H
2
O
2
+ IO
−
= H
2
O + O
2
+ I
−
E
a
E
a
k
Katalizator
I
−
Wzrost
szybkoś
ci
1
~950
razy
~10
11
razy
Katalizatory biologiczne –
– enzymy
np: KATALAZA

Wykład 10 – KINETYKA CHEMICZNA I KATALIZA
KATALIZA CHEMICZNA
Kataliza homogeniczna – katalizator w tej samej fazie co reagenty
Przykład: rozkład H
2
O
2
w obecności I
−
Kataliza heterogeniczna – katalizator w innej fazie niż reagenty
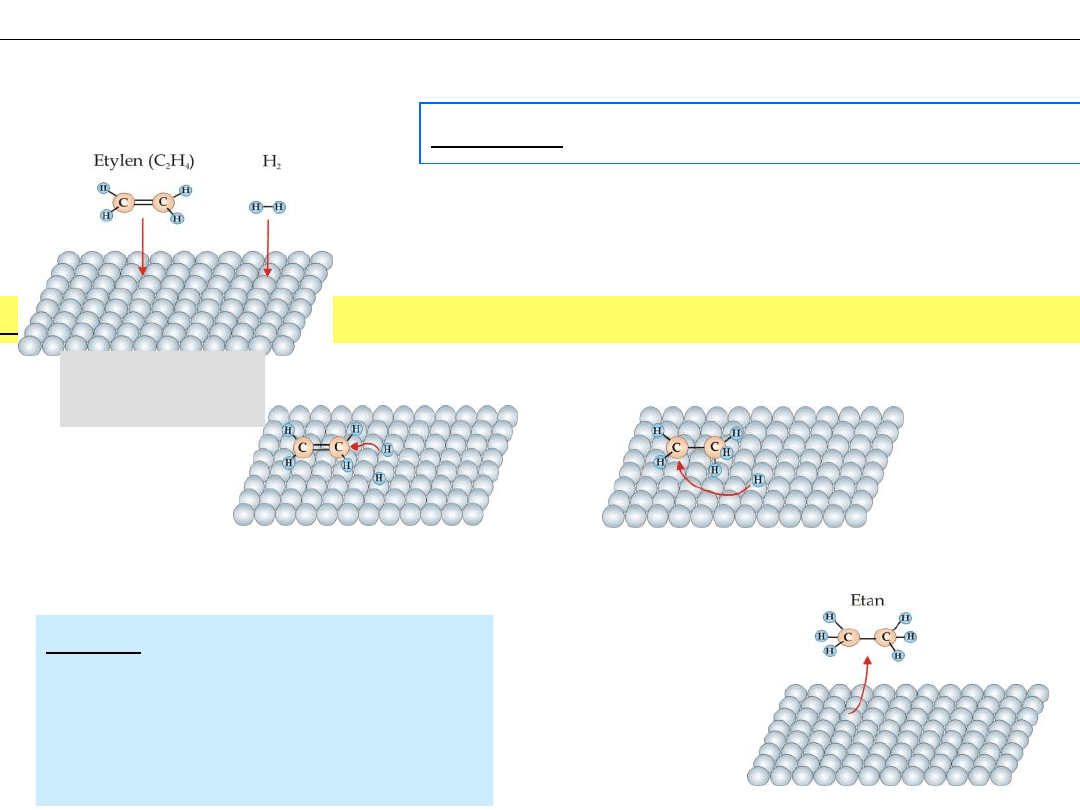
Kataliza heterogeniczna – katalizator w innej fazie niż reagenty
Wykład 10 – KINETYKA CHEMICZNA I KATALIZA
Przykład:
C
2
H
4
+ H
2
= C
2
H
6
w obecności Ni
1. Chemisorpcja na katalizatorze
2. Reakcja na powierzchni katalizatora
3. Desorpcja produktów
Chemisorpcja – adsorpcja
połączona z wytworzeniem
wiązań chemicznych
pomiędzy substancją a
adsorbentem
Katalizator –
metaliczny Ni

Wykład 10 – KINETYKA CHEMICZNA I KATALIZA
KATALIZA CHEMICZNA
Katalizator – przyspiesza reakcję chemiczną
Inhibitor – hamuje lub zatrzymuje reakcję chemiczną
inhibeo - zatrzymuję)
Inhibitory korozji – środki chemiczne hamujące przebieg
procesów niszczenia materiałów.
Inhibitory mogą zmniejszać szybkość postępowania korozji poprzez
tworzenie warstwy ochronnej na powierzchni metalu (pasywacja).
Druty żelazne po miesiącu przebywania na
zewnątrz.
Druty pokryte
preparatem
antykorozyjnym.
Druty bez
zabezpieczenia
Doświadczenie:
Zablokowanie działania enzymu
przez INHIBITOR
Wykład 10 – KINETYKA CHEMICZNA I KATALIZA
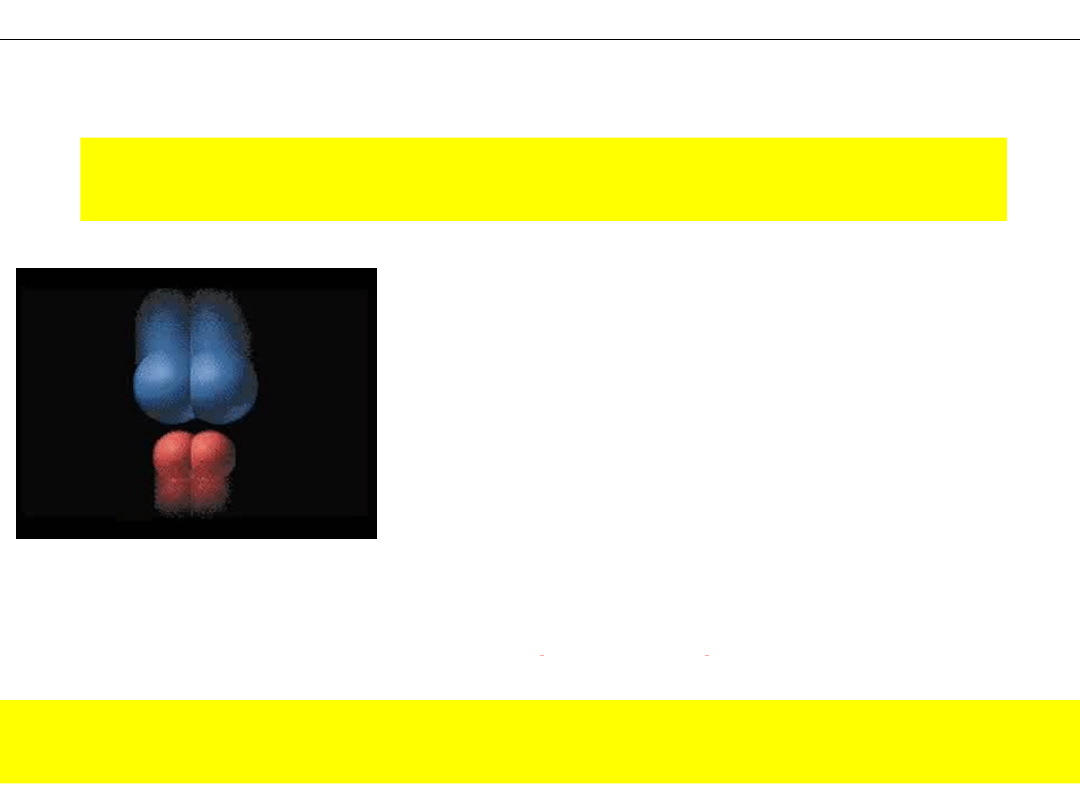
Inhibitory enzymów – substancje wiążące się z centrami
aktywnym enzymów, blokujące ich katalityczne działanie
ENZYM
INHIBITOR
enzymu
Naturalne działanie enzymu
ENZYM
Substancja
naturalna
Substancja
naturalna
Centrum
aktywne
enzymu
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
Wyszukiwarka
Podobne podstrony:
10 Kinetyka chemicznaid 10897 ppt
10 Kinetyka chemiczna
04 Kinetyka reakcji chemicznych i kataliza
10 wykad Statyka kinetyka chemiczna[F 2006]
04 Kinetyka reakcji chemicznych i kataliza
Kinetyka Chemiczna
kinetyka chemiczna
4) Kinetyka chemiczna
Kinetyka chemiczna, CHEMIA, semestr 1, chemia ogólna, wykłady
10 wiązania chemiczne
chemia, kinetyka chemiczna, KINETYKA CHEMICZNA- 1
Kinetyka chemiczna
Laboratorium nr 9-10, Technologia chemiczna, Chemia ogólna i nieorganiczna, semestr 3, Laboratorium
Ćwiczenie 10.6, technologia chemiczna, Fizyczna, Labolatorium
więcej podobnych podstron