
UKŁAD OKRESOWY PIERWIASTKÓW
PRAWO OKRESOWOŚCI
Dymitr Mendelejew - 1869
Lothar Meyer - 1870
Właściwości chemiczne i fizyczne
pierwiastków
zmieniają
się
okresowo,
w miarę jak od pierwiastków o
mniejszej
liczbie
atomowej
przechodzimy do pierwiastków o
coraz to większej liczbie atomowej
W tym okresie nie znano jeszcze
pojęcia liczby atomowej, obaj
uczeni szeregowali pierwiastki wg
wzrastającej masy atomowej.
Wyjaśnienie tego empirycznego
prawa stało się możliwe dopiero w
XX
wieku,
kiedy
poznano
strukturę atomu.

UKŁAD OKRESOWY PIERWIASTKÓW
OKRESY PIERWIASTKÓW
Rozróżniamy siedem szeregów
poziomych zwanych okresami
GRUPY PIERWIASTKÓW
Pierwiastki należące do tej samej
kolumny pionowej, zwanej grupą
lub rodziną, mają analogiczną
konfigurację zewnętrznych powłok
elektronowych i wykazują wiele
podobieństw we właściwościach
chemicznych i fizycznych
Do grup głównych zaliczamy
grupy 1, 2
oraz od 13 do 18
Pozostałe grupy to grupy
przejściowe, dawniej zwane
pobocznymi
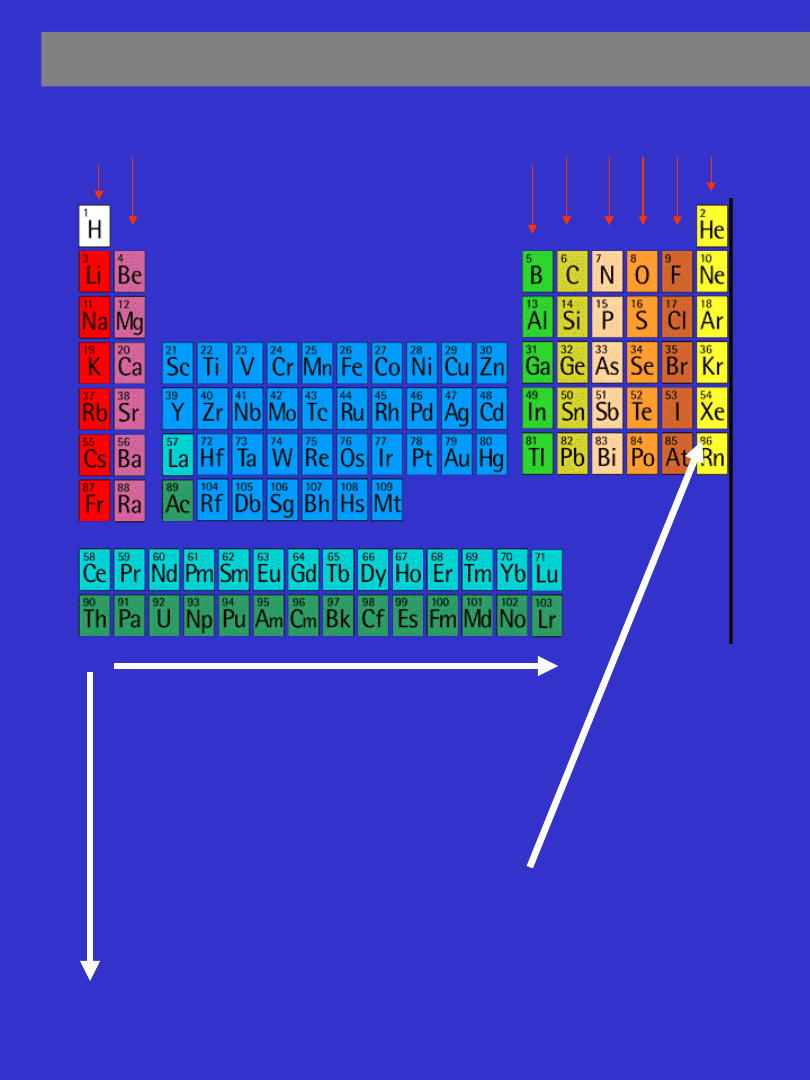
UKŁAD OKRESOWY PIERWIASTKÓW
OKRESY
GRUPY
LICZBA ATOMOWA
1 2 3 4 5 6 7 8 9 101112131415161718
1
2
3
4
5
6
7
Określa liczbę protonów
znajdujących
się
w
jądrze atomowym

OKRESOWOŚĆ WŁAŚCIWOŚCI
FIZYCZNYCH
Do wielkości fizycznych, których
znajomość
bardzo
ułatwia
przedstawienie
zmian
właściwości
chemicznych
pierwiastków w zależności od
położenia
w
układzie
okresowym, należą:
ROZMIARY ATOMU
ENERGIA JONIZACJI
POWINOWACTWO
ELEKTRONOWE
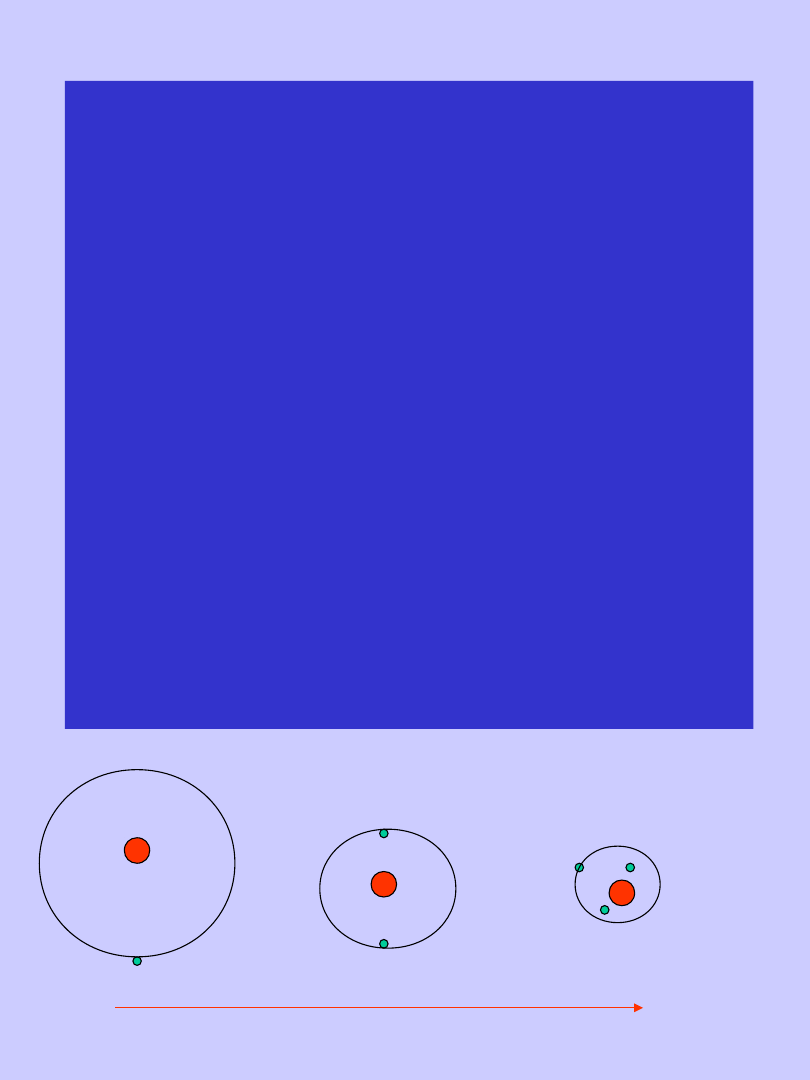
ROZMIARY ATOMU
•W
poszczególnych
okresach
największy
promień
atomowy
maja pierwiastki grupy litowców
(gr I).
•W miarę jak w danym okresie
wzrasta liczba atomowa, promień
atomowy maleje.
Obserwuje się więc zmniejszanie
się rozmiarów atomu w szeregu
poziomym np. od litu do fluoru,
od sodu do chloru itd.
•Zjawisko to jest spowodowane
tym, że im większy jest ładunek
jądra, tym silniej przyciąga ono
elektrony wszystkich powłok.

• W
obrębie
okresów
liczba
powłok
elektronowych,
mimo
zwiększania się liczby
elektronów,
pozostaje
taka sama.
• Atomami,
w
których
zapoczątkowuje
się
zabudowa nowej powłoki
elektronowej są atomy
litowców rozpoczynające
poszczególne okresy

OKRESOWOŚĆ WŁAŚCIWOŚCI
FIZYCZNYCH
ENERGIA JONIZACJI
Energia
jonizacji
oznacza
energię potrzebną do usunięcia
elektronu
z
atomu
danego
pierwiastka.
Jest to jedna z najważniejszych
wielkości
charakteryzujących
atom.
O energii jonizacji decydują siły,
które w atomie działają na
elektron walencyjny. Zależą one
przede wszystkim od odległości
tego elektronu od jądra oraz od
efektywnego ładunku jądra.
Im
mniejsza
jest
odległość
elektronu od jądra, tym większy
nakład energii jest konieczny do
usunięcia elektronu z atomu.
Energię jonizacji wyraża się w kJ
x mol
-1

• Energia potrzebna do oderwania
pierwszego elektronu zwana jest
pierwszą
energią
jonizacji,
drugiego drugą itd.
• W
poszczególnych
okresach
układu okresowego najmniejsze
wartości
przyjmuje
energia
jonizacji
pierwiastków
o
największym
promieniu
atomowym,
tzn
pierwiastków
należących do grupy litowców.
• W obrębie poszczególnych grup
układu okresowego stwierdza się
wyraźne
zmniejszenie
energii
jonizacji, w miarę jak wzrasta
liczba atomowa. Jest to związane
ze
wzrostem
promienia
atomowego.

OKRESOWOŚĆ WŁAŚCIWOŚCI
FIZYCZNYCH
POWINOWACTWO
ELEKTRONOWE -
ELEKTROUJEMNOŚĆ
Jest to wielkość wprowadzona
przez
Paullinga
dla
scharakteryzowania
zdolności
atomu wchodzącego w skład
cząsteczki do przyciągania ku
sobie elektronów.
Wielkość ta należy do właściwości
pierwiastków
podlegających
prawu okresowości.
Wzrasta ona w okresach układu
od strony lewej do prawej.

• Pierwiastki
o
największej
elektroujemności takie jak fluor,
tlen,
azot
i
chlor
wykazują
wyraźne właściwości niemetali.
• Pierwiastki
o
najmniejszej
elektroujemności
wykazują
właściwości metali np.. Frans, cez,
rubid i bar.
• Pierwiastki
o
charakterze
pośrednim pomiędzy metalami a
niemetalami
są
zwane
półmetalami
np.
bor,
krzem,
german, arsen, antymon, bizmut,
selen, tellur i polon.
• Pierwiastki różniące się znacznie
elektroujemnością
wytwarzają
między sobą wiązania jonowe.
• W
miarę
jak
różnice
elektroujemności
pomiędzy
łączącymi
się
pierwiastkami
maleją, wzrasta tendencja do
tworzenia
się
wiązań
kowalencyjnych lub metalicznych.
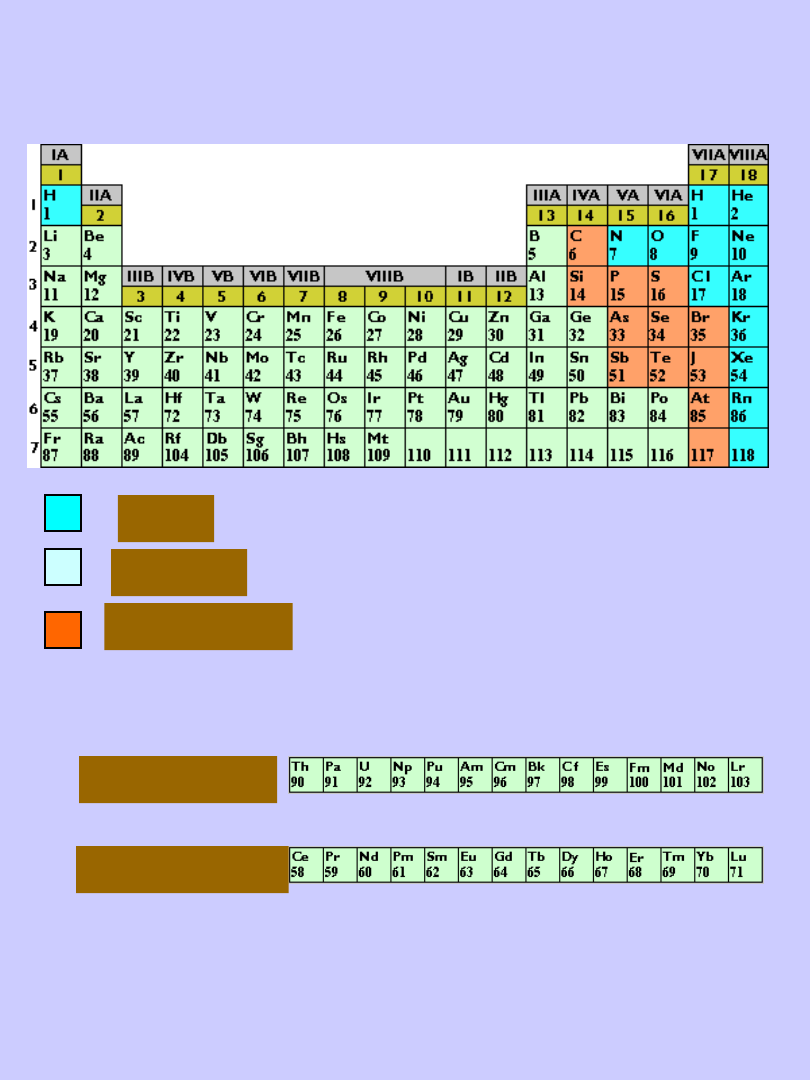
gazy
metale
niemetale
aktynowce
lantanowce

http://znik.wbc.lublin.pl/ChemFan/Oprogramowanie/Uop.html
Program Układ okresowy pierwiastków
- dostępny w internecie
Document Outline
Wyszukiwarka
Podobne podstrony:
budowa atomu ukl okresowy, Chemia, Gimnazjum, kl1, Budowa atomu
Budowa Układu Okresowego Pierwiastków
choroby wirus i bakter ukł odd Bo
APD 9 ukł synchroniczne
PA2 4 podstawy ukł sekw
Zaburzenia ukł pozapiramidowego (1)
ukł kostny KD
Stres a ukł krąż Sałabun Sękowska
Obw ukł nerw
PIELĘGNOWANIE CHORYCH w schorz ukł moczowego
ukl wspolczulny zapis 2003
Rozwoj ukl‚adu pokarmowego
Wyklad V Ukl moczowy
BF ukł nerw
Dgn Ukł Krąż
ukł sercowo naczyniowy
więcej podobnych podstron