Patologia wykład 3

Choroby krwi i układu krwiotwórczego
Choroby krwi i układu krwiotwórczego są
mniej znaną, ale bardzo ważną częścią nauk
medycznych. Spotykamy się z nimi na co dzień,
począwszy od stosunkowo "łagodnej"
niedokrwistości z niedoboru żelaza do bardzo
złośliwych i niebezpiecznych białaczek. Chorobami
krwi zajmuje się hematologia.

Niedokrwistość (anemia)
Niedokrwistość, potocznie nazywana anemią
(łac. anaemia) – zespół objawów chorobowych,
który polega na stwierdzeniu niższych od normy
wartości hemoglobiny, erytrocytów i ich następstw.
Niedokrwistość rzekoma – względne obniżenie
Hb i hematokrytu poprzez zwiększenie objętości
osocza w przypadku przewodnienia i u ciężarnych.

Podział niedokrwistości
•
Niedokrwistości dzielimy na trzy grupy:
•
Niedokrwistości spowodowane utratą krwi
•
Niedokrwistości będące wynikiem upośledzonego
wytwarzania erytrocytów:
–
niedoborowe
–
hipoplastyczne
–
aplastyczne
–
dysplastyczne
•
Niedokrwistości związane ze skróconym czasem życia
erytrocytów
–
zespół hemolityczny wrodzony
–
zespół hemolityczny nabyty
–
zespół hemolityczny mieszany

Niedokrwistości pokrwotoczne
Niedokrwistości pokrwotoczne dzielimy na:
•niedokrwistości pokrwotoczne ostre
•niedokrwistości pokrwotoczne przewlekłe
Objawy zależą od ilości utraconej krwi, są to przede
wszystkim:
•bladość powłok skórnych
•utrata przytomności
•niskie ciśnienie krwi
•tachykardia
•bóle zamostkowe

Niedokrwistości niedoborowe
Są to niedokrwistości, w których do upośledzonego
wytwarzania erytrocytów dochodzi z powodu
niewystarczającej podaży substancji potrzebnych w procesie
erytropoezy. Spośród niedokrwistości niedoborowych
wyróżniamy:
•niedokrwistość z niedoboru żelaza
•niedokrwistość z niedoboru kwasu foliowego
•niedokrwistość z niedoboru witaminy B12
•niedokrwistość z niedoboru miedzi

Niedokrwistości z niedoboru żelaza
Niedokrwistość z niedoboru żelaza (łac. anaemia
sideropenica) – niedokrwistość sideropeniczna. Występuje
najczęściej u niemowląt między 6–18 miesiącem życia.
Przyczyną niedoboru żelaza jest niedostateczne zaopatrzenie
organizmu w ten pierwiastek przy zwiększonym jego
zapotrzebowaniu. Do najczęstszych przyczyn niedoboru
zaliczamy:
•zmniejszone zapasy w życiu płodowym
•wcześniaki, noworodki niekarmione mlekiem matki
•zaburzenia wchłaniania
•szybki rozwój

U dorosłych niedokrwistości z niedoboru żelaza mogą być
skutkiem przewlekłego krwawienia, stymulującego szpik do
zwiększenia tempa erytropoezy doprowadzając do
wyczerpania ustrojowych zapasów żelaza. U kobiet jedną z
najczęstszych przyczyn są obfite krwawienia miesięczne. U
kobiet po menopauzie i u mężczyzn w piątej dekadzie życia i
starszych częstą przyczyną przewlekłego krwawienia mogą
być zmiany dysplastyczne w obrębie układu pokarmowego
(polipy jelita grubego, nowotwór jelita grubego). Innym
częstym miejscem krwawienia są owrzodzenia żołądka i
dwunastnicy. Również w tym przypadku należy wykluczyć
obecność zmiany o charakterze nowotworowym.

Objawy:
•spaczony, wybiórczy apetyt (np. na glinę, krochmal, kredę),
niekiedy wyprzedza niedokrwistość
•bladość skóry śluzówek i spojówek
•szorstkość skóry
•zanik brodawek
•ból, pieczenie i wygładzenie języka
•zajady w kącikach ust
•pieczenie w jamie ustnej i przełyku
•łamliwość włosów i paznokci
•osłabienie

Podział niedoboru żelaza:
•
utajony – może być spadek ferrytyny, żelazo w
szpiku spada
•
jawny – ferrytyna ↓↓, Fe ↓, żelazo w szpiku ↓,
natomiast wzrasta: transferyna i rozpuszczalny
receptor dla transferyny, Hb i MCV – w normie
•
jawny z niedokrwistością – tak jak w jawnej,
lecz większe wartości spadku/wzrostu oraz
dołącza się spadek Hb i MCV

Niedokrwistości megaloblastyczne
Objawy:
•bladość z odcieniem słomkowym
•duszność
•osłabienie
•zapalenie błony śluzowej żołądka
•piekący, czerwony język
•objawy neurologiczne (tylko w przypadku niedoboru
witaminy B12)
•mała ruchliwość

Niedokrwistość megaloblastyczna należy do
niedokrwistości powstałych na skutek niedoboru witaminy
B12 lub kwasu foliowego. Wynika ona z nieprawidłowej
syntezy DNA (do której te witaminy są niezbędne) przy
prawidłowej syntezie białek i RNA. Efektem jest zaburzenie
dojrzewania komórek krwi, zwane dyssynchronizacją.
Skutkuje to megaloblastyczną odnową w szpiku i
hiperchromiczną makrocytową niedokrwistością. Dodatkowo
mogą występować zaburzenia ze strony ośrodkowego układu
nerwowego, który również potrzebuje tych witamin do
prawidłowego funkcjonowania.

Podział niedokrwistości
megaloblastycznych
•Niedokrwistości z niedoboru witaminy B12
–Niedobory w diecie (np. dieta wegetariańska)
–Zaburzenia wchłaniania
•Brak czynnika wewnętrznego (stan po gastrektomii
lub tzw. niedokrwistość Addisona-Biermera
•Zaburzenia wchłaniania w jelicie cienkim
–Zarażenie Bruzdogłowcem szerokim

Podział niedokrwistości
megaloblastycznych
•Niedokrwistości z niedoboru kwasu
foliowego
–Niedobór w diecie
–Zaburzenia wchłaniania
–Wpływ leków (leki wpływające na metabolizm
lub wchłanianie kwasu foliowego, ewentualnie
działające antagonistycznie (np. niektóre z
leków immunosupresyjnych).
–Wzmożone zapotrzebowanie (np. ciąża)

Niedokwistość Addisona-Biermera
Jest jedną z najczęściej spotykanych
niedokrwistości. Jest chorobą autoimmunologiczną,
polegającą na uszkodzeniu komórek
odpowiedzialnych za wytwarzanie czynnika
wewnętrznego, niezbędnego do wchłaniania wit.
B12.

Niedobory pokarmowe
Mogą wystąpić przede wszystkim przy długotrwałej
diecie wegetariańskiej (niedobór wit. B12),
żywieniu się konserwami (niedobór kwasu
foliowego), oraz w przebiegu alkoholizmu (zespół
wieloniedoborowy). Przy nieprawidłowym żywieniu
zazwyczaj jako pierwszy objawia się niedobór
kwasu foliowego. W przypadku głodu może
dochodzić do zespołów wieloniedoborowych, gdzie
będą miały większe znaczenie niedobory białka i
żelaza oraz różnych witamin.

Resekcja żołądka
Wycięcie dużej powierzchni żołądka może
skutkować brakiem komórek wytwarzających
czynnik wewnętrzny (czynnik Castle'a). Po 5–6
latach zapasy wit. B12 wyczerpują się i dołączają
się do niedoborów żelaza (które często występują
już po dwóch latach).

Zespoły złego wchłaniania
Występują one w warunkach sprzyjających
nadmiernemu rozwojowi flory bakteryjnej. Np.
uchyłki jelita, zespół ślepej pętli, przetoki jelitowe.
Niedobory będą występowały na zasadzie
konkurencji ze strony bakterii lub innych
drobnoustrojów. Najpierw objawi się niedobór
kwasu foliowego i żelaza dopiero potem objawia
się niedobór wit. B12.

Wzmożone zapotrzebowanie
Występuje u kobiet w ciąży, u dzieci w okresach
wzmożonego wzrostu, oraz po krwotokach i po
stanach hemolitycznych ze względu na zwiększoną
hemopoezę.

Niedobory związane ze stosowaniem leków
•metotreksat
•kotrimoksazol
•5-fluorouracyl
•analogi zasad purynowych
•arabinozyd cytozyny

Niedokrwistość hipoplastyczna
Następuje zmniejszona produkcja składników
morfotycznych krwi: głównie krwinek czerwonych
ale też granulocytów i płytek krwi, z powodu
postępującego zaniku tłuszczowego szpiku.

Niedokrwistość aplastyczna
Niedokrwistość aplastyczna, aplazja szpiku, anemia aplastyczna –
(łac anaemia aplastica, ang. aplastic anaemia – AA) – to stan w którym
dochodzi do niewydolności szpiku kostnego, wskutek jego hipoplazji lub
aplazji prowadząca do pancytopeni czyli obniżenia ilości wszystkich linii
komórek krwi, to znaczy erytrocytów, leukocytów i trombocytów. Występuje z
częstością 2–6 przypadków na milion. Może wystąpić w każdym wieku, ale
największa zachorowalność występuje między 15 a 25 rokiem życia oraz po
60 roku życia, z przewagą u mężczyzn. Pierwszy opis tej choroby pochodzi z
1888 i został podany przez Ehrlicha.
Aplazja szpiku wynika ze zwiększenia użycia (także niektórych leków) i
obecności środków chemicznych oraz toksycznych w życiu człowieka.
Charakteryzuje się występowaniem we krwi erytrocytów o prawidłowej
budowie i zawartości hemoglobiny, lecz stopniowo w coraz mniejszej liczbie.
Niedokrwistość aplastyczna spowodowana jest najczęściej naświetlaniem
szpiku kostnego promieniami X lub Gamma, oraz toksycznym uszkodzeniem
szpiku przez jady bakteryjne i substancje chemiczne.

Objawy:
•wybroczyny, sińce
•krwawienia z nosa, krwotoki
•czasami stany zapalne jamy ustnej lub migdałków
•podatność na infekcje

Etiologia
U źródła choroby leży zaburzenie dotyczące
komórek macierzystych krwi, prowadzące do
zahamowania dzielenia się i różnicowania się
komórek. Nabyte niedokrwistości aplastyczne są
wynikiem reakcji autoimmunologicznej przeciwko
tym komórkom, zależnej od aktywacji limfocytów T
i zwiększenia produkcji cytokin hamujących
hematopoezę oraz pobudzeniem zjawiska
apoptozy.

•postaci pierwotne
–wrodzona niedokrwistość aplastyczna
–niedokrwistość Fanconiego – dziedziczona jako cecha
autosomalna recesywna
–zespół Diamonda i Blackfana
–postać idiopatyczna

•postaci wtórne
–promieniowanie jonizujące
–radioterapia
–środki chemiczne
•benzen, barwniki anilinowe
•trinitrotoulen
•rozpuszczalniki organiczne
•środki chwasto- i owadobójcze

–leki
•busulfan
•cyklofosfamid
•metotreksat
•chloramfenikol
•sulfonamidy
•chlorpropamid
•metamizol (Pyralginum)
•fenytoina, karbamazepina
•sole złota
•antracykliny
•fenylobutazon
•penicylamina

–zakażenia wirusowe: HAV, HBV, HCV, HIV, wirusy herpes,
parwowirus B 19
–kolagenozy
–grasiczak
–ciąża
–choroby krwi:zespół mielodysplastyczny, nocna
napadowa hemoglobinuria, niedokrwistość hemolityczna

Objawy chorobowe
Objawy chorobowe zależą od współistnienia i
przeplatania się objawów zaburzonej
hematopoezy: niedokrwistości (zależnej od
uszkodzenia szlaku rozwoju czerwono-
krwinkowego), skłonności do zakażeń (zależnych
od uszkodzenia powstawania neutrofilów) oraz
skazy krwotocznej (zależnej od uszkodzenia
powstawania płytek krwi).

Rozróżnia się 3 stopnie ciężkości AA (w zależności od spadku liczby komórek
(tak zwanej 'cytopenii) we krwi obwodowej:
•postać nieciężka
–liczba neutrofilów < 1500 komórek w 1μl krwi
–liczba płytek krwi < 50 000 komórek w 1μl krwi
–liczba retikulocytów < 60 000 komórek w 1μl krwi
•postać ciężka
–liczba neutrofilów < 500 komórek w 1μl krwi
–liczba płytek krwi < 20 000 komórek w 1μl krwi
–liczba retikulocytów < 20 000 komórek w 1μl krwi
•postać bardzo ciężka
–liczba neutrofilów < 200 komórek w 1μl krwi
–liczba płytek krwi < 20 000 komórek w 1μl krwi
–liczba retikulocytów < 10 000 komórek w 1μl krwi

Rozpoznanie
Rozpoznanie opiera się na stwierdzeniu przynajmniej 2 z 3
objawów: neutropenii, małopłytkowości i retikulocytopenii.
Zakres norm podano powyżej. Oprócz opisywanych powyżej
zmian widocznych w krwi obwodowej, wykonuje się punkcję
szpiku, która wykazuje obecność zmniejszenie ilości komórek
krwiotwórczych poniżej 30%, dużą ilość tkanki tłuszczowej,
zmniejszenie liczby megakariocytów. W obrazie
trepanobiopsji występują nieliczne pola zawierające komórki.

Choroba wymaga różnicowania z następującymi
jednostkami chorobowymi:
•białaczki ostre
•zespół mielodysplastyczny
•każdy nowotwór z naciekiem szpiku kostnego
•ciężka niedokrwistość megaloblastyczna
•niektóre chłoniaki
•skrobiawica
•choroba Gauchera

Leczenie
Choroba przebiega jako postać ostra i przewlekła.
Postaci ostre, w przypadku braku leczenia lub jego
nieskuteczności, doprowadzają do zgonu w ciągu
6–12 miesięcy. Postaci przewlekłe przebiegają
powoli i opisywane są przypadki samoistnej
poprawy. Ciężkość przebiegu zależy od stopnia
cytopenii. Najczęstszą przyczyną śmierci w
przebiegu AA są zakażenia (sepsa) bakteryjna lub
grzybicza.

Leczenie przyczynowe:
•allogeniczny przeszczep szpiku jako leczenie z wyboru u młodszych
chorych – wyleczenie uzyskuje się w 60 – 90% przypadków
•leczenie immunosupresyjne z zastosowaniem globuliny
antylimfocytowej (ALG) lub antytymocytowej (ATG) zwykle łącznie z
cyklosporyną A i glikokortykosterydami u chorych niekwalifikujących
się do przeszczepu szpiku. Ta metoda zapewnia podobny odsetek
wyleczeń jak przeszczep szpiku, nie uzyskuje się jednak zwykle
normalizacji parametrów morfologii krwii.
•cyklofosfamid z ATG przed przeszczepem szpiku oraz u osób
starszych z postacią nieciężką
•androgeny w niedokrwistości Fanconiego oraz w postaciach
nabytych. Brak poprawy po 6 miesiącach leczenie wskazuje na
nieskuteczność leczenia i nakazuje jego zakończenie.

Leczenie uzupełniające:
•profilaktyka zakażeń bakteryjnych i grzybiczych: w
postaciach z neutropenią poniżej 200 komórek w 1μl krwi –
antybiotykoterapia w oparciu o doustne podawanie
fluorochinonu z lekiem przeciwgrzybiczym. Konieczna jest
także profilaktyka pneumocystozy przez okres 6 miesięcy po
leczeniu immunosupresyjnym lub przeszczepieniu szpiku
•czynnik wzrostu G-CSF w ciężkich zakażeniach opornych na
antybiotyki i/lub leki przeciwgrzybicze
•objawowe przetoczenie koncentratu krwinek czerwonych i
płytkowych. Przetoczeń należy unikać w przypadku
planowanego przeszczepu szpiku.

Niedokrwistość hemolityczna
Spowodowana jest skróceniem czasu życia
erytrocytów, co powoduje zmniejszenie ich ilości
we krwi. Prawidłowo erytrocyt żyje 100–120 dni, w
stanie hemolitycznym – ok. 50 dni. Występuje
podczas nasilenia hemolizy (np. w wyniku
hipersplenizmu) i osłabienia zdolności
kompensacyjnej szpiku.

Niedokrwistości syderoblastyczne
Przyczyny:
•czynniki wewnątrzkrwinkowe
–defekty błony erytrocytów
–defekty enzymów tych krwinek
–zaburzenia tworzenia hemoglobiny
•czynniki zewnątrzkrwinkowe
–obce przeciwciała
–własne przeciwciała
–leki
–choroby zakaźne
–czynniki chemiczne
–czynniki fizyczne

Objawy:
•bladość
•duszność
•osłabienie
•żółtaczka
•powiększenie śledziony
•kamica żółciowa

Wrodzone niedokrwistości hemolityczne
Przyczyny:
•sferocytoza wrodzona
•owalocytoza
•hemoglobinopatia
•talasemia
•niedobór enzymów glikolitycznych
•eliptocytoza
•wrodzona żółtaczka hemolityczna

Sferocytoza wrodzona (mikrosferocytoza
wrodzona, choroba Minkowskiego-Chauffarda, ang.
hereditary spherocytosis, HS, łac. anaemia
microspherocytica congenita) – najczęstsza
wrodzona niedokrwistość hemolityczna w Europie
Północnej. Wywołana jest mutacjami w genach
kodujących białka błony komórkowej erytrocytów.
W zależności od rodzaju mutacji może być
dziedziczona w sposób autosomalny recesywny
(gorsze rokowanie, 25% przypadków) albo
autosomalny dominujący (lepsze rokowanie, 75%).

Epidemiologia
Sferocytoza wrodzona występuje w Europie Północnej z
częstością około 1:5.000 urodzeń.
Etiologia
Choroba jest wywołana najczęściej przez defekt białka
spektryny albo ankyryny erytrocytu. Zaburza to
przepuszczalność błony erytrocytów dla jonów i zmianę
kształtu komórek z dyskowatego na zbliżony do kulistego.
Nieprawidłowy kształt erytrocytów sprawia, ze czas ich
przeżycia ulega znacznemu skróceniu: komórki te są
niszczone w śledzionie.

Objawy kliniczne
•niedokrwistość i (lub) żółtaczka w wieku dziecięcym
•często dodatni wywiad rodzinny
•splenomegalia
•delikatna budowa ciała
•zmętnienie soczewki oka
•zmiany w narządzie słuchu
•małoocze
•skośne ustawienie gałek ocznych
•syndaktylia, brachydaktylia, polidaktylia
•czaszka wieżowata
•płaski nos
•hiperteloryzm
•podniebienie gotyckie
•wady zgryzu

Powikłania
•przełomy hemolityczne
•przełomy aplastyczne
•kamica żółciowa
•hipersplenizm

Leczenie
Jak dotąd nie ma metody leczenia przyczynowego.
W razie nawracających przełomów hemolitycznych
leczeniem z wyboru jest splenektomia. Erytrocyty
nadal mają nieprawidłowy kształt i upośledzoną
funkcję, ich czas przeżycia skraca się (w związku z
eliminacją przez śledzionę).

Nabyte niedokrwistości hemolityczne
Przyczyny:
•hemoglobinuria
•zakażenia paciorkowcem hemolizującym,
gronkowcem, pneumokokami, pałeczką okrężnicy
lub salmonellą
•zakażenia wirusowe (grypa typu A, mononukleoza
zakaźna, wirusowe zapalenie płuc) mogą
powodować powstanie zespołu hemolitycznego

Hemoglobinopatie
Choroby spowodowane nieprawidłową budową
hemoglobiny, np. anemia sierpowata, talasemie.

Niedokrwistość chorób przewlekłych
ACD – anaemia of chronic disease
Jest to niedokrwistość występująca u chorych z pobudzeniem
układu immunologicznego związanym z procesem zapalnym
(dokładniej – na skutek działania cytokin), która
charakteryzuje się zmniejszoną produkcją erytrocytów, małą
liczbą retikulocytów, małym stężeniem Fe i transferyny, ale
zwiększonym stężeniem ferrytyny. Druga co do częstości
występowania po niedokrwistości z niedoboru żelaza.

Przyczyny
•przewlekłe zakażenia bakteryjne, pasożytnicze i
grzybicze (np. gruźlica, przewlekłe zakażenie dróg
moczowych)
•nowotwory złośliwe (CRA – cancer related
anaemia)
•choroby z autoimmunizacji – reumatoidalne
zapalenie stawów, SLE, układowe zapalenie naczyń

Patogeneza
Cytokiny (głównie IL-1, TNFα, IFNγ) osłabiają
erytropoezę przez hamowanie proliferacji
prekursorów krwinek czerwonych i jednocześnie
pobudzenie ich apoptozy oraz zmniejszenie
ekspresji genów EPO i jej receptora, a także
zmniejszenie udostępniania żelaza dla
krwiotworzenia, m.in. przez indukcję hepcydyny –
hamuje wchłanianie żelaza w dwunastnicy i
uwalnianie żelaza z makrofagów.

Objawy kliniczne
•pojawia się w klika miesięcy po ujawnieniu
choroby podstawowej
•ogólne objawy niedokrwistości
•objawy związane z chorobą podstawową

Nieprawidłowości w badaniach pomocniczych
•Badania morfologiczne
–niedokrwistość normocytowa, mogą występować mikrocyty,
normochromiczne (stężenie Hb zwykle >9g/dl)
–mała liczba retikulocytów
–przyśpieszone OB
–zwiększone stężenie cytokin i białek ostrej fazy
–małe stężenie żelaza
–zmniejszone stężenie transferyny i TIBC w surowicy
–wzrost stężenia ferrytyny
•Szpik
–prawidłowa lub zwiększona ilość złogów żelaza – zwłaszcza w
makrofagach

Nieprawidłowości w badaniach pomocniczych
•Badania morfologiczne
–niedokrwistość normocytowa, mogą występować mikrocyty,
normochromiczne (stężenie Hb zwykle >9g/dl)
–mała liczba retikulocytów
–przyśpieszone OB
–zwiększone stężenie cytokin i białek ostrej fazy
–małe stężenie żelaza
–zmniejszone stężenie transferyny i TIBC w surowicy
–wzrost stężenia ferrytyny
•Szpik
–prawidłowa lub zwiększona ilość złogów żelaza – zwłaszcza w
makrofagach

Leczenie
dążenie do wyleczenia choroby podstawowej
Przy ciężkiej niedokrwistości:
•przetoczenia koncentratu krwinek czerwonych
•cząsteczki pobudzające erytropoezę np. erytropoetyna s.c.
przez 2–3 miesiące 3 razy w tygodniu
•preparaty żelaza tylko z erytropoetyną

Docelowe stężenie Hb wynosi 12 g/dl.

Skazy krwotoczne
Kolejną dużą grupą chorób krwi są tzw. skazy krwotoczne.
Jest to stan, w którym różne defekty hemostazy
(utrzymywania krwi w naczyniach krwionośnych) powodują
nieprawidłową, patologiczną skłonność do krwawień.
Skaza krwotoczna (łac. diathesis haemorrhagica) –
skłonność do krwawień w obrębie tkanek (np. skóry i błon
śluzowych), narządów (np. nosa, stawów) oraz układów (np.
pokarmowego, moczowo-płciowego, OUN).

Podział
Skazy krwotoczne, zgodnie z udziałem w procesie hemostazy
różnych mechanizmów, dzielimy na:
•skazy naczyniowe,
•skazy płytkowe – wynikają z niedoboru płytek krwi
(trombocytów)
•skazy osoczowe – obejmujące zaburzenia w układzie
krzepnięcia krwi i fibrynolizy, wynikają z niedoboru, lub braku
osoczowych czynników krzepnięcia. Niedobory te mogą być
wrodzone (np. w hemofilii) lub nabyte (np. niedobór
protrombiny wynikający z niedoboru wit. K)
•skazy mieszane (złożone).

W wielu nabytych skazach krwotocznych dochodzi
do zmian w obrębie drobnych naczyń
krwionośnych, płytek krwi i procesu krzepnięcia. W
przebiegu wielu chorób, np. w ostrej białaczce,
aplazji szpiku czy marskości wątroby może
występować skaza krwotoczna maskująca właściwy
obraz choroby.

Skazy osoczowe
Najważniejszymi skazami osoczowymi są koagulopatie niedoborowe
z najbardziej znaną hemofilią. Inne grupy koagulopatii to tzw.
koagulopatie ze zużycia (czynników krzepnięcia),
immunokoagulopatie (związane z tworzeniem przeciwciał przeciwko
czynnikom krzepnięcia) oraz hiperfibrynolizy (związane z nadmierną
aktywacją układu przeciwstawnego do kaskady krzepnięcia krwi,
czyli fibrynolizy rozpuszczającej zakrzepy).
Najbardziej znaną i najczęściej występującą koagulopatią jest
hemofilia, czyli krwawiączka. Jej przyczyną jest wrodzony niedobór
VIII (hemofilia A) lub IX (hemofilia B) czynnika krzepnięcia.

Hemofilia jest chorobą dziedziczną. Każdy człowiek ma 23 pary
chromosomów, w których zakodowana jest informacja o naszym
rozwoju i o niektórych chorobach. Wynika z tego, że geny również
są zdublowane i ustawione w pary. Ostatnia para chromosomów to
tzw. chromosomy związane z płcią określane jako X i Y. Kobieta ma
dwa chromosomy X, a mężczyzna jeden chromosom X i jeden Y.
Geny mogą być dominujące - wtedy wystarczy tylko jeden z pary,
aby mógł wywołać odpowiedni efekt, albo recesywne - oba geny w
parze muszą być wtedy recesywne, aby pojawił się właściwy im
skutek.

Nieprawidłowy gen odpowiedzialny za rozwój hemofilii
znajduje się na chromosomie X i jest recesywny. Wynika stąd,
że chorują w przeważającej mierze chłopcy. Bardzo rzadko
zdarza się, aby zachorowały kobiety - wtedy spotkać się ze
sobą muszą dwa nieprawidłowe geny na chromosomach X.
Kobiety mogą być natomiast przenosicielkami choroby i
przenosić ją na swoich synów.

W dziedziczeniu hemofilii A ważne są również
następujące stwierdzenia:
•wszystkie córki chorego na hemofilię są
nosicielkami (mają jeden gen prawidłowy, a drugi
nieprawidłowy)
•wszyscy synowie chorego na hemofilię są zdrowi
•szansa przekazania przez nosicielkę chorego
chromosomu X wynosi 50%

Krwawienia, podstawowy objaw hemofilii i innych skaz
krwotocznych, mogą pojawić się już u noworodka (krwawienie z
pępowiny). Najczęściej jednak choroba ujawnia się później w postaci
krwawień do mięśni i stawów, a także krwawień po operacjach,
krwotoków z nosa czy z dróg rodnych.
W rozpoznaniu oprócz obrazu klinicznego ważne są badania
laboratoryjne. W skazach krwotocznych mierzy się czas krwawienia i
krzepnięcia. W przypadku hemofilii czas krwawienia (za który
odpowiadają płytki krwi i skurcz naczyń krwionośnych) jest
prawidłowy, a czas krzepnięcia, z racji braku jednego z czynników
potrzebnych do tworzenia skrzepu jest przedłużony. Później ocenia
się również stężenie czynnika VIII (w przypadku hemofilii A) lub IX
(w przypadku hemofilii B) we krwi.

W zależności od stężenia czynników krzepnięcia we
krwi wyróżniamy różne stopnie ciężkości hemofilii.
Objawy pojawiają się zwykle dopiero w postaci
lekkiej (są jeszcze: subhemofilia, postać średnio
ciężka i ciężka), w której to stężenie wynosi 5-15
jednostek międzynarodowych w jednym decylitrze
krwi (jm./dl). Wtedy krwiaki pojawiają się po
wyraźnych urazach. W postaci ciężkiej krwawienia
mogą występować bez urazów, samoistnie.

Zasadniczym leczeniem jest podawanie
brakujących czynników krzepnięcia: VIII w
przypadku hemofilii A, a IX w przypadku hemofilii
B. U chorych z rzadkimi krwawieniami można
podawać te czynniki jedynie w koniecznych
przypadkach (krwawienie samoistne, przed
operacją). W ciężkiej hemofilii koncentraty
odpowiednich czynników podaje się bardziej
systematycznie. W hemofilii A o lekkim przebiegu
zamiast czynnika VIII podaje się niekiedy związek o
nazwie DDAVP (desmopresynę). Powoduje ona
uwalnianie czynnika VIII z "magazynów"
znajdujących się w śródbłonku naczyń.

Inną skazą osoczową (koagulopatią) jest choroba von Willebranda. W
tym schorzeniu brakuje jednego ze składników czynnika VIII, zwanego
właśnie czynnikiem von Willebranda. Chorują równie często chłopcy
(mężczyźni), jak i dziewczynki (kobiety). Dziedziczenie jest bardziej
złożone niż w hemofilii dlatego, że wyróżniamy aż trzy typy tej
choroby.
Obraz choroby jest kombinacją objawów spotykanych w hemofilii
(krwawienie do mięśni, stawów, podbiegnięcia krwawe) i symptomów
charakterystycznych dla skaz płytkowych (krwawienia z nosa i innych
błon śluzowych, drobne wybroczyny). Przedłużony jest zarówno czas
krwawienia (upośledzona funkcja płytek krwi), jak i czas krzepnięcia.
W leczeniu stosuje się DDAVP, a w cięższych przypadkach
koncentraty czynnika VIII z aktywnością czynnika von Willebranda.

Koagulopatie mogą być również nabyte, powstają wtedy
najczęściej w wyniku niedoboru witaminy K, niezbędnej do
prawidłowego tworzenia się niektórych czynników
krzepnięcia krwi. Przyczyną jest: uszkodzenie wątroby u
noworodków, upośledzenie wchłaniania w jelitach (w tym
witaminy K) występujące w wielu chorobach,
antybiotykoterapia (antybiotyki zabijają bakterie jelitowe,
które tworzą witaminę K) oraz żółtaczka mechaniczna (żółć
jest niezbędna do wchłaniania tej witaminy). Inną dużą grupę
przyczyn stanowi leczenie środkami, które są antagonistami
witaminy K, czyli wykazują przeciwstawne do niej działanie
(np. kumaryna).

Skazy płytkowe
Najczęstszymi skazami krwotocznymi są jednak nie skazy
osoczowe, ale skazy płytkowe. Spośród nich najważniejsze są
te wywołane małą liczbą płytek, czyli małopłytkowości
(trompocytopenie).
Mała liczba tych elementów krwi może być spowodowana
zaburzeniami ich wytwarzania w szpiku kostnym oraz
przyspieszonym niszczeniem płytek we krwi.

Przyczynami zmniejszonego ich wytwarzania jest uszkodzenie
szpiku przez leki (np. cytostatyki), substancje chemiczne (np.
benzen), zakażenia (np. HIV), a także wypieranie prawidłowych
komórek przez komórki białaczkowe czy chłoniakowe albo
zwłóknienie szpiku. Spośród małopłytkowości uwarunkowanych
przyspieszonym niszczeniem płytek sporą grupę stanowią
trombocytopenie spowodowane przez własne przeciwciała
organizmu. Tak dzieje się między innymi w samoistnej plamicy
małopłytkowej, jednej z najczęstszych i najbardziej znanych
małopłytkowości. Inne przyczyny obejmują niszczenie płytek
przez powiększoną śledzionę (hipersplenizm) oraz sztuczne
zastawki serca (uszkodzenia mechaniczne).

Krwawienia w skazach płytkowych różnią od obrazu hemofilii.
Chorzy krwawią z błon śluzowych (z nosa, dziąseł). Na ich skórze
pojawiają się drobne wybroczyny. Nie ma tutaj charakterystycznych
dla koagulopatii (m.in. hemofilia) wylewów do stawów i mięśni.
W badaniach laboratoryjnych obserwuje się przede wszystkim
zmniejszoną liczbę płytek (poniżej 140 tys w 1 mm3) Przedłużony
jest też czas krwawienia przy prawidłowym czasie krzepnięcia
(odwrotnie niż przy skazach osoczowych). W rozpoznaniu ważne jest
poszukiwanie ewentualnych chorób będących przyczyną
zmniejszonej liczby płytek (np. białaczki) oraz badanie szpiku
kostnego.

Leczy się przede wszystkim leżącą u podłoża
małopłytkowości chorobę. W razie krwawień lub
przed spodziewanym leczeniem cytostatykami
podaje się choremu koncentraty płytek krwi
uzyskanych od dawców (optymalnie jednego
dawcy). Oprócz ryzyka zakażenia (obecnie bardzo
małego) istnieje niebezpieczeństwo uczulenia
organizmu chorego przez podawane "obce"
preparaty. Wtedy przy następnych przetoczeniach
pojawia się groźba szybkiego zniszczenia
podanych płytek.

Skazy naczyniowe (waskulopatie)
Ostatnią, rzadszą grupą skaz krwotocznych są skazy
naczyniowe. Wtedy krwawienie jest uzależnione od kruchości
naczyń krwionośnych. W tej grupie chorób, podobnie jak w
skazach płytkowych, wydłużony jest czas krwawienia, a
prawidłowy czas krzepnięcia. Do wrodzonych skaz
naczyniowych zaliczamy między innymi chorobę Rendu-
Oslera, w której na wargach, języku, koniuszkach palców i
innych częściach ciała występują teleangiektazje -
rozszerzenia małych naczyń krwionośnych. Miejsca te mają
skłonność do krwawień.

Z nabytych skaz naczyniowych najbardziej znana
jest plamica Schoenleina-Henocha. Jest to
alergiczne zapalenie naczyń obserwowane przede
wszystkim u dzieci w wieku przedszkolnym.
Pojawiają się wówczas wybroczyny i wysypka na
nogach oraz pośladkach, obrzęki stawów, bóle
brzucha, krwiomocz. Na szczęście w zdecydowanej
większości przypadków choroba przebiega z
samoistnym wyleczeniem.

Chłoniaki stanowią bardzo zróżnicowaną i
niejednorodną grupę schorzeń nowotworowych. W
procesie ich powstawania, transformacji złośliwej
ulegają komórki układu odpornościowego z
szeregu limfoidalnego. Chłoniaki różnią się między
sobą obrazem klinicznym, przebiegiem,
powikłaniami oraz odpowiedzią na leczenie i
rokowaniem.

Termin „chłoniaki” w najszerszym znaczeniu obejmuje
wszelkie rozrosty wywodzące się z komórek różnych szczebli
rozwojowych limfocytów T i B oraz dodatkowo – ziarnicę
złośliwą (chłoniaka Hodgkina), szpiczaka plazmocytowego,
przewlekłą białaczkę limfatyczną i białaczki limfoidalne,
stanowiące postać uogólnioną niektórych chłoniaków – z
zajęciem szpiku i krwi obwodowej.
Umownie chłoniaki dzieli się na chłoniaki nieziarnicze i
ziarnicę złośliwą.

Według danych światowych, chłoniaki stanowią
każdego roku około 7% wszystkich zachorowań na
nowotwory złośliwe. W Polsce odsetek ten jest
zapewne zbliżony. W ostatnich latach obserwuje
się lawinowy wzrost częstotliwości zachorowań na
chłoniaki. Stanowią one istotny problem społeczny,
zarówno ze względu na sytuację epidemiologiczną,
jak i wysokie koszty związane z diagnostyką i
leczeniem.

Etiologia
Nie ma jednoznacznie ustalonych czynników
etiologicznych (przyczynowych) chłoniaków.
Podobnie nieznane są przyczyny zwiększonej
zachorowalności na te nowotwory złośliwe.

Czynniki ryzyka
Zidentyfikowano szereg czynników, które przypuszczalnie
zwiększają prawdopodobieństwo zachorowania na chłoniaki.
Wiek. Częstość występowania chłoniaków w 6 i 7 dekadzie
życia jest 5-10 razy wyższa niż w 4 i 5 dekadzie. Jednak
najbardziej złośliwe nowotwory z tej grupy– chłoniaki Burkitta
i chłoniaki limfoblastyczne zazwyczaj występują przed 40
rokiem życia.
Płeć męska.
Rasa kaukaska.

•Czynniki ryzyka
Długotrwała stymulacja antygenowa i zaburzenia
regulacji układu odpornościowego. Chłoniaki występują
częściej:
- u biorców przeszczepów narządowych, wskutek
długotrwałego przyjmowania leków immunosupresyjnych i
mniejszych lub większych niezgodności między tkankami
dawcy i biorcy;
- w stanach wrodzonych niedoborów odpornościowych (np.
hipogammaglobulinemia, zespół Wiskott-Aldricha),
- w schorzeniach autoimmunologicznych (takich jak
reumatoidalne zapalenie stawów, łuszczyca lub zespół
Sjogrena);
- u osób zakażonych wirusem HIV lub chorych na AIDS.

Praca w przemyśle gumowym, skórzanym, przy
rafinacji ropy naftowej.
Kontakt z pyłami biologicznymi, herbicydami i
pestycydami.
Zakażenia wirusowe (wirus Epsteina-Barra w chłoniaku
Burkitta; wirus limfocytotropowy typu I (HTLV I) w białaczce
dorosłych wywodzącej się z limfocytów T).
Przebyta lub przetrwała infekcja Helicobacter pylori.
Wcześniejsze leczenie z powodu ziarnicy złośliwej lub
nowotworu litego.
Dieta zawierająca dużo mięsa i tłuszczów.

Patogeneza
Początkiem choroby jest zainicjowanie przez czynnik
wyzwalający zmian w materiale genetycznym
komórki/komórek limfoidalnych. Zmutowana komórka
wymyka się spod kontroli mechanizmom regulującym i
zaczyna mnożyć się w sposób niekontrolowany, dając
początek rozrostowi nowotworowemu. Zmiany genetyczne w
limfocytach dotyczą zazwyczaj translokacji (przeniesienia)
genów z jednego chromosomu na inny. W ten sposób
dochodzi do rearanżacji materiału genetycznego. W
chłoniakach wywodzących się z dojrzałych komórek B
dochodzi natomiast do translokacji genów dla
immunoglobulin w pobliże protoonkogenów (cmyc, bcl2).
Wreszcie w rozrostach pochodzących z prekursorowych
komórek T częste są translokacje genów dla receptora
komórek T (TCR).

Przykłady translokacji stwierdzane w
określonych jednostkach chorobowych:
- translokacja t (8;14) w chłoniaku Burkitta,
- translokacja t (14;18) w chłoniaku
grudkowym,
- translokacja t (11;14) w chłoniaku
płaszcza.

Objawy kliniczne
Ponieważ termin "chłoniaki" obejmuje wiele
znacznie różniących się między sobą pod
względem przebiegu klinicznego jednostek
chorobowych, symptomatologia jest niejednolita i
zróżnicowana. We wszystkich schorzeniach z
omawianej grupy może wystąpić szereg
niespecyficznych dolegliwości, takich jak:
gorączka, zlewne nocne poty, utrata masy ciała,
przewlekłe zmęczenie. Trzy pierwsze zaliczane są
do tak zwanych „objawów ogólnych”, mających
znaczenie w określaniu stopnia zaawansowania
schorzenia zasadniczego.

W zależności od schorzenia objawy chłoniaków mogą być
następujące:
- niebolesne powiększenie węzłów chłonnych,
- świąd skóry,
- bóle o nieznanej przyczynie w obrębie klatki piersiowej lub w
kościach,
- bóle brzucha o nieznanej przyczynie – mogą być spowodowane
powiększeniem wątroby lub śledziony, albo być wynikiem
rozrastania się komórek chłonnych w świetle przewodu
pokarmowego – w tym drugim przypadku mogą występować
również niespecyficzne dolegliwości, takie jak biegunka, zespół
złego wchłaniania, oddawanie stolca z krwią,
- objawy neurologiczne pochodzenia obwodowego lub ośrodkowego
(zaburzenia czucia, bóle i zawroty głowy, zaburzenia widzenia),
- obrzęki kończyn, wodobrzusze, obecność płynu w klatce
piersiowej,
- zmiany w obrazie morfologii krwi (niedokrwistość, leukocytoza lub
leukopenia, trombocytopenia).

Przy naciekach w skórze lub narządach wewnętrznych w
przebiegu chłoniaków T komórkowych mogą wystąpić:
- długo utrzymujące się zmiany skórne,
- zaburzenia rytmu serca, objawy choroby niedokrwiennej –
przy zajęciu serca lub osierdzia,
- objawy guza piersi – przy nacieku tkanki gruczołowej,
- powiększenie jądra/jąder,
- objawy związane z naciekiem oka lub tkanek wewnątrz
oczodołu (wytrzeszcz gałek ocznych, zaburzenia widzenia),
- zaburzenia endokrynologiczne przy naciekach
zlokalizowanych w gruczołach wydzielania wewnętrznego
(nadczynność lub niedoczynność tarczycy, zaburzenia funkcji
jajników i jąder).

Kolejne etapy w przypadku podejrzenia chłoniaka to
rozpoznanie, określenie typu nowotworu i stopnia jego
zaawansowania i wreszcie - postawienie rokowania. Na
podstawie uzyskanych informacji podejmowane są decyzje
terapeutyczne.
Badaniem potwierdzającym rozpoznanie chłoniaka jest ocena
mikroskopowa (histopatologiczna) pobranego w całości
powiększonego węzła chłonnego. Materiał do badania
pozyskuje się metodą biopsji chirurgicznej. W przypadku
lokalizacji pozawęzłowej konieczne jest badanie wycinka z
nacieczonego nowotworem narządu. Najkorzystniejsza jest
ocena węzła szyjnego lub z dołu nadobojczykowego, ze
względu na małe prawdopodobieństwo występowania w nich
nieswoistych zmian odczynowych, utrudniających właściwą
ocenę morfologiczną materiału tkankowego.

Ocena morfologiczna chłoniaków obejmuje:
- morfologię komórek chłoniakowych,
- charakter ich wzrostu tkankowego (grudkowy lub
rozlany),
- zachowanie lub zatarcie prawidłowego utkania
węzła chłonnego,
- charakter odczynu podścieliska.

Ze względu na podobieństwo morfologiczne
różnych komórek chłoniakowych, konieczne jest
uzupełnienie badania o ocenę
immunohistochemiczną przy pomocy
specyficznych przeciwciał monoklonalnych,
skierowanych przeciwko receptorom CD (ang.
cluster of differentiation), znajdującym się na
powierzchni błony komórkowej. Określenie
fenotypu komórki (rodzaju receptorów) umożliwia
ustalenie przynależności klonu chłoniakowego do
linii komórkowej (B, T lub NK).

W pierwszym etapie ustala się, czy badane komórki w ogóle
należą do linii limfoidalnej, oznaczając specyficzny dla niej
receptor CD 45 (marker panlimfocytowy). Następnie
wykonuje się bardziej szczegółowe analizy, oznaczając
markery specyficzne wyłącznie dla komórek danej linii:
- markery „pan-B” dla linii B-komórkowej: CD 19, CD20,
CD22, CD79a,
- markery „pan -T” dla linii T-komórkowej: CD2, CD3, CD7,
- markery linii NK: CD16, CD56.
W diagnostyce chłoniaków może być również
wykorzystywana punkcja cienkoigłowa i fluorocytometria
przepływowa.

Punkcja cienkoigłowa – metoda pozyskiwania materiału do
badania, która znajduje zastosowanie w diagnostyce zmian
przetrwałych po leczeniu i nawrotowych.
Fluorocytometria przepływowa. Jest to badanie ilościowe,
określające immunofenotyp komórek chłoniaka (receptory
znajdujące się na powierzchni zmienionych limfocytów) na
podstawie względnie małej ilości komórek pochodzących z
węzła chłonnego, krwi obwodowej, szpiku, płynu mózgowo-
rdzeniowego, płynu w jamie ciała, lub zmian naciekowych
dostępnych biopsji cienkoigłowej.

Typy histopatologiczne i klasyfikacja chłoniaków
Bez ustalenia przy pomocy badań immunohistochemicznych
przynależności do określonej linii komórkowej, obraz
morfologiczny chłoniaków jest mało zróżnicowany w
porównaniu do mnogości odmian przebiegu klinicznego tych
schorzeń. Obowiązująca obecnie klasyfikacja Światowej
Organizacji Zdrowia (WHO), która powstała w latach 90.
ubiegłego wieku, uwzględnia wyniki badań
histopatologicznch i immunologicznych oraz obraz kliniczny.

Wyróżnia ona 3 grupy nowotworów układu
chłonnego:
- pochodzące z komórek B,
- pochodzące z komórek T/NK,
- ziarnicę złośliwą.
Nowotwory z komórek B i T dzielą się wtórnie na
prekursorowe (limfoblastyczne) oraz dojrzałe
(obwodowe).

Klasyfikacja chłoniaków złośliwych według WHO
Nowotwory z komórek B
A) Chłoniaki prekursorowe:
- białaczka/chłoniak limfoblastyczny z prekursorów B.
B) Chłoniaki z komórek dojrzałych:
- przewlekła białaczka/chłoniak z małych komórek B,
- białaczka prolimfocytowa z komórek B,
- chłoniak limfoplazmocytowy,
- plasmocytoma, szpiczak plazmocytowy,
-

- białaczka włochatokmórkowa,
- pozawęzłowy chłoniak strefy brzeżnej typu MALT,
- węzłowy chłoniak strefy brzeżnej,
- śledzionowy chłoniak strefy brzeżnej,
- chłoniak grudkowy,
- chłoniak z komórek płaszcza,
- chłoniak rozlany z dużych komórek B,
- chłoniak pierwotny śródpiersia z dużych komórek B (grasiczy),
- chłoniak wewnątrznaczyniowy z dużych komórek B,
- pierwotny chłoniak efuzyjny,
- chłoniak/białaczka Burkitta
- lymphomatoid granulomatosis,
- polimorficzny rozrost potransplantacyjny.

Nowotwory z komórek T
A) Chłoniaki prekursorowe
- białaczka/chłoniak limfoblastyczny z prekursorów T.
B) Chłoniaki z komórek dojrzałych:
- blastyczny chłoniak z komórek NK,
- białaczka prolimfocytowa z komórek T,
- białaczka z dużych ziarnistych limfocytów T,
- agresywna białaczka z komórek NK,
- białaczka/chłoniak z komórek T dorosłych,
-

-pozawęzłowy chłoniak strefy z komórek NK typu nosowego,
- chłoniak z komórek typu enteropatycznego,
- pierwotny chłoniak wątroby i śledziony z komórek T,
- chłoniak z komórek T tkanki podskórnej typu panniculitis,
- ziarniniak grzybiasty,
- zespół Sezary’ego,
- chłoniak anaplastyczny z dużych komórek,
- chłoniak anaplastyczny z dużych komórek pierwotnie
skórny,
- chłoniak z obwodowych limfocytów T, nieokreślony,
- chłoniak z komórek T angioimmunoblastyczny,
- lymphomatoid papulosis.

Stadia zaawansowania klinicznego
Podobnie jak w przypadku ziarnicy złośliwej, stadia zaawansowania
chłoniaków nieziarniczych określa się tradycyjnie według
klasyfikacji z Ann Arbor z 1971 roku. Klasyfikacja ta powstała w
czasach, gdy zasadniczą metodą leczenia ziarnicy złośliwej była
radioterapia. Opiera się na określeniu liczby umiejscowień zmian
chorobowych, ich położeniu w stosunku do przepony, obecności
zmian poza układem chłonnym i występowaniu objawów
systemowych. Jednak jej praktyczne zastosowanie w przypadku
chłoniaków nieziarniczych jest mniejsze niż w przypadku ziarnicy.
Przyczyną jest mniejsza przewidywalność rozsiewu chłoniaków,
który nawet w początkowych stadiach nie następuje przez ciągłość
w obrębie układu chłonnego.

Stadium I. Zajęcie jednej grupy węzłów chłonnych
lub jednego narządu pozawęzłowego (IE).
Stadium II. Zajęcie dwóch lub więcej grup węzłów
chłonnych po tej samej stronie przepony lub
umiejscowione (jednoogniskowe) zajęcie nzrządu
pozalimfatycznego i jednej lub więcej grup węzłów
chłonnych po tej samej stronie przepony (IIE).

Stadium III. Zajęcie węzłów po obu stronach przepony, czemu towarzyszyć
może jednoogniskowe zajęcie narządu pozalimfatycznego (IIIE) lub zajęcie
śledziony (IIIS) lub też jednoogniskowe zajęcie narządu pozalimfatycznego i
zajęcie śledziony (IIIES),
Stadium IV. Rozsiane zajęcie narządu pozalimfatycznego, niezależnie od
stanu węzłów chłonnych.
Symbole literowe, A i B, pozwalają na określenie dodatkowych parametrów
mających znaczenie prognostyczne. Oznaczają one odpowiednio:
A – brak objawów systemowych,
B – występowanie objawów systemowych: gorączki, nocnych potów, utraty
masy ciała.

Czynniki rokownicze
Nie ma jednoznacznie ustalonych czynników
wpływających na rokowanie w tak zróżnicowanej
grupie schorzeń, jaką stanowią chłoniaki. Jest to
spowodowane między innymi
nieprzewidywalnością szerzenia się chłoniaków. W
przeciwieństwie do ziarnicy złośliwej, nie szerzą się
one przez ciągłość w obrębie układu chłonnego.

Za jeden z najistotniejszych czynników rokowniczych u pacjentów z
chłoniakiem uznawane jest stadium zaawansowania (powyżej II
według klasyfikacji Ann Arbor). Do pozostałych zalicza się:
- wiek powyżej 60 lat,
- płeć,
- stan sprawności według skali WHO/ECOG lub Karnowskiego,
- obecność zmian masywnych (o średnicy powyżej 7 cm),
- zajęcie szpiku kostnego i/lub ośrodkowego układu nerwowego,
- obecność objawów systemowych,
- nieprawidłowości w badaniach laboratoryjnych – stężenie
dehydrogenazy mleczanowej (LDH) i ß2-mikroglobulin, stężenie
albumin, niedokrwistość; wielkość leukocytozy w fazie
białaczkowej).

Międzynarodowy czynnik rokowniczy, IPI (ang.
International Prognostic Index) powstał w oparciu o
analizę ponad 3000 chorych z „agresywnymi”
chłoniakami, leczonych w latach 80. XX wieku.
Omawiany parametr umożliwia wyodrębnienie
czterech grup ryzyka, różniących się pod
względem przeżycia 5-letniego. Nie uwzględnia on
jednak obecności zmiany masywnej ani zmian
genetycznych w komórkach nowotworowych.

Leczenie
Ponieważ chłoniaki stanowią niejednorodną grupę schorzeń o bardzo
różnym przebiegu i rokowaniu, w ich terapii stosowane są
różnorodne metody.
„Baczna obserwacja” (ang. watchful waiting). Stosuje się ją przy
przebiegających powoli, mało agresywnych schorzeniach u
pacjentów bezobjawowych. Polega na regularnych kontrolach
pacjenta i wyczekiwaniu z rozpoczęciem leczenia do momentu, w
którym choroba wykaże progresję miejscową lub ogólnoustrojową.

Chemioterapia. Jej istotą jest podawanie leków (cytostatyków),
których zadaniem jest zahamowanie podziałów komórek
nowotworowych. Cytostatyki mogą być podawane dożylnie,
doustnie lub (rzadziej) domięśniowo. W niektórych rodzajach
schorzeń leki podaje się do kanału kręgowego, w celu zapobieżenia
rozwojowi lub leczenia już istniejących zmian nowotworowych w
ośrodkowym układzie nerwowym.
Chemioterapia konwencjonalna. W zależności od rodzaju i
zaawansowania schorzenia, cytostatyki stosuje się pojedynczo
(monoterapia) lub w schematach wielolekowych
(polichemioterapia), łącznie ze steroidoterapią. Sterydy dodane do
chemioterapii działają antymitotycznie (hamują podziały
komórkowe), łagodzą stany zapalne, oraz zmniejszają obrzęki
zmienionych chorobowo tkanek.

Megachemioterapia i przeszczepianie komórek
macierzystych szpiku. Ta forma leczenia polega na
podawaniu choremu dużych dawek cytostatyków, które
doprowadzają do zniszczenia szpiku kostnego. Następnie
pacjentowi przeszczepia się komórki macierzyste: własne –
pobrane przed rozpoczęciem megachemioterapii lub
pochodzące od obcego dawcy.
Radioterapia znajduje zastosowanie w leczeniu wielu typów
chłoniaków. Zwykle nie jest jednak stosowana jako metoda
samodzielna, ale w ramach leczenia skojarzonego z
chemioterapią.

Biologiczna terapia celowana. Odgrywa coraz istotniejszą
rolę w leczeniu chłoniaków złośliwych. Przykładem leku, który
w zdecydowany sposób przyczynił się do poprawy rokowania
chorych z niektórymi chłoniakami złośliwymi, jest rituximab
– monoklonalne przeciwciało anty-CD20. Stosuje się także
przeciwciała monoklonalne sprzężone z izotopem
promieniotwórczym, które – po połączeniu z komórkami
nowotworowymi – niszczą je przy pomocy promieniowania
jonizującego.
Leczenie skojarzone to połączenie ze sobą dwu lub więcej
opisanych powyżej metod terapeutycznych. Zazwyczaj
stosuje się łącznie chemioterapię konwencjonalną i
naświetlania, lub chemioterapię konwencjonalną i
przeciwciała monoklonalne.

Ziarnica złośliwa (ang. Hodgkin Lymphoma – HL) jest chłoniakiem,
chorobą nowotworową wywodząca się ze zmienionych komórek
układu odpornościowego – komórek limfoidalnych. Określa się ją
również mianem choroby Hodgkina.
Tkanka chłonna, w której znajdują się komórki limfoidalne,
występuje praktycznie w każdej części naszego organizmu. Tak
więc, pierwotna lokalizacja ziarnicy może być zróżnicowana. Jednak
zazwyczaj dotyczy ona węzłów chłonnych, które ulegają
niebolesnemu powiększeniu. Częściej powiększeniu ulegają węzły
chłonne górnej połowy ciała – na szyi, w dołach pachowych, w
okolicy nadobojczykowej oraz w śródpiersiu (wewnątrz klatki
piersiowej). Pierwotnie pozawęzłowa lokalizacja ziarnicy to zaledwie
około 5% rejestrowanych przypadków.

Niekiedy powiększeniu węzłów chłonnych towarzyszą
niespecyficzne objawy ogólne: gorączka, zlewne poty,
niezwiązana z odchudzaniem się utrata masy ciała, świąd
skóry, uczucie przemęczenia. Objawy dodatkowe mogą
wyprzedzać powiększenie się węzłów chłonnych lub
występować równolegle z nim. Choroba Hodgkina może
rozwinąć się w każdym wieku, częściej występuje jednak tuż
po zakończeniu okresu dojrzewania i wieku podeszłym.
Choroba szerzy się dwojako: przez ciągłość wewnątrz układu
chłonnego oraz poprzez krew do narządów
pozalimfatycznych. Po ustaleniu rozpoznania oraz
wyjściowego stadium zaawansowania choroby, podejmuje się
optymalne w danej sytuacji klinicznej leczenie. U osób
dorosłych odpowiednio wcześnie rozpoznany chłoniak
Hodgkina jest uleczalny.

Etiologia i czynniki ryzyka
Przyczyna ziarnicy złośliwej, czyli jej etiologia, jest wciąż nieznana.
Zidentyfikowano natomiast wiele spośród czynników ryzyka, czyli
uwarunkowań zwiększających prawdopodobieństwo zachorowania na
chorobę Hodgkina. Zalicza się do nich:
- wiek – częściej chorują osoby tuż po osiągnięciu dojrzałości lub po 50
roku życia,
- płeć męską,
- infekcje wirusowe, a szczególnie zakażenie wirusem Epsteina-Barra i
wirusami limfocytotropowymi,
- wystąpienie ziarnicy u krewnych pierwszego stopnia (rodzeństwo,
rodzice),
- narażenie na promieniowanie jonizujące,
- przewlekłą immunosupresję (niewydolność układu odpornościowego,
która może być wywołana między innymi przyjmowaniem niektórych
leków),
- nabyty zespół niedoboru odporności (chorobę AIDS).

Objawy kliniczne
Najbardziej charakterystycznym objawem ziarnicy
jest niebolesne powiększenie węzłów chłonnych.
Jest ono łatwe do stwierdzenia, kiedy dotyczy
węzłów zlokalizowanych na szyi, w dołach
pachowych, pachwinach. Sytuacja jest trudniejsza,
gdy powiększeniu ulegają węzły chłonne
zlokalizowane wewnątrz ciała.

Objawy powiększenia węzłów chłonnych wewnątrz
klatki piersiowej i jamy brzusznej mogą być
związane ze spowodowanym przez nie uciskiem
bądź drażnieniem znajdujących się tam narządów.
Wówczas występują tak niespecyficzne
dolegliwości jak kaszel, bóle w klatce piersiowej,
trudności w oddychaniu, zaburzenia połykania,
bóle brzucha, dyskomfort w jamie brzusznej i wiele
innych.

Obraz kliniczny ziarnicy obejmuje również wiele
niespecyficznych objawów ogólnych, których występowanie
ma znaczenie zarówno dla ustalenia stadium zaawansowania
schorzenia jak i dla rokowania. Należą do nich:
- gorączka powyżej 38°C o nieznanej przyczynie,
- nocne poty,
- niczym nieuzasadniona utrata masy ciała.
Świąd skóry i uczucie przemęczenia, będące częstymi
objawami towarzyszącym ziarnicy, nie są zaliczane do
„objawów ogólnych”.
Jeśli pomimo zastosowanego leczenia (lek przeciwzapalny,
antybiotyk), powiększenie węzłów chłonnych utrzymuje się
przez 2-3 tygodnie, konieczne jest pobranie powiększonego
węzła do badania histopatologicznego (mikroskopowego).

Badania umożliwiające postawienie rozpoznania
Jedynym badaniem potwierdzającym rozpoznanie ziarnicy
jest ocena histopatologiczna pobranego w całości
powiększonego węzła chłonnego. Materiał do badania
pozyskuje się na drodze biopsji chirurgicznej (wycięcia). W
przypadku lokalizacji powiększonych węzłów wewnątrz jamy
brzusznej lub klatki piersiowej, konieczne jest użycie w tym
celu technik operacyjnych. Jeśli zmiany są zlokalizowane
pozawęzłowo, niezbędne jest badanie histopatologiczne
wycinka z nacieczonego nowotworowo narządu.
Nie istnieją żadne markery, umożliwiające postawienie
rozpoznania choroby Hodgkina na podstawie badania
surowicy krwi.

Typy histopatologiczne ziarnicy złośliwej
W preparatach ze zmienionych chorobowo węzłów
chłonnych stwierdza się obecność charakterystycznych dla
ziarnicy, zmienionych nowotworowo komórek Reed-
Sternberga i Hodgkina, otoczonych komórkami
odczynowymi. W zależności od przewagi bądź niedoboru
pewnych rodzajów komórek, a także ze względu na cechy
morfologiczne preparatów węzłowych, wyróżnia się pięć
głównych typów histopatologicznych chłoniaka Hodgkina.

A. Postacie klasyczne:
1. Bogata w limfocyty – ang. lymphocyte-rich, LP.
2. Stwardnienie guzkowe – ang. nodular sclerosis,
NS.
3. Postać mieszana – ang. mixed cellularity, MC.
4. Z zanikiem limfocytów – ang. lymphocyte
depletion, LD.
B. Postać nieklasyczna – guzkowa z przewagą
limfocytów – ang. nodular lymphocyte-
predominant.

• Leczenie ziarnicy złośliwej
• Leczenie ziarnicy złośliwej jest złożonym procesem,
obejmującym określenie zaawansowania choroby;
postawienie rokowania i wybór odpowiedniego schematu
terapeutycznego: chemioterapii, radioterapii lub połączenia
obu tych metod.
• Po ustaleniu rozpoznania, ważne jest oznaczenie
wyjściowego stadium zaawansowania ziarnicy złośliwej.
Określa się, czy choroba jest zlokalizowana w jednej grupie
węzłów chłonnych, czy też doszło do zajęcia innych części
układu chłonnego lub narządów pozalimfatycznych.

Postępowanie diagnostyczne obejmuje wywiad lekarski, badanie fizykalne,
badania obrazowe (zdjęcie rentgenowskie klatki piersiowej, tomografię
komputerową klatki piersiowej, jamy brzusznej i miednicy), biopsję
aspiracyjną i trepanobiopsję szpiku kostnego. W wybranych
przypadkach wykonuje się również badanie PET (pozytronową
tomografię emisyjną) lub torakocentezę (punkcję opłucnej – przy
występowaniu płynu w jamie opłucnowej). Pacjent jest również
konsultowany przez lekarzy specjalistów: stomatologa, laryngologa, a w
przypadku kobiet – również ginekologa. Zleca się też badania
laboratoryjne, obejmujące morfologię krwi obwodowej i wybrane
parametry biochemiczne surowicy krwi. Wykazane w powyższych
badaniach patologie są podstawą do określenia klinicznego
zaawansowania schorzenia.

• Stadia zaawansowania klinicznego ziarnicy złośliwej według
klasyfikacji Ann Arbor z 1971 roku
Klasyfikacja ta powstała w czasach, gdy zasadniczą metodą leczenia ziarnicy
złośliwej była radioterapia. Opiera się na określeniu liczby umiejscowień
zmian chorobowych, ich położeniu w stosunku do przepony, obecności zmian
poza układem chłonnym i występowaniu objawów systemowych.
Stadium I – zajęcie jednej grupy węzłów chłonnych lub jednego narządu
pozawęzłowego (IE).
Stadium II – zajęcie dwóch lub więcej grup węzłów chłonnych po tej samej
stronie przepony lub umiejscowione (jednoogniskowe) zajęcie narządu
pozalimfatycznego i jednej lub więcej grup węzłów chłonnych po tej samej
stronie przepony (IIE).

• Stadium III – zajęcie węzłów po obu stronach przepony;
może temu towarzyszyć jednoogniskowe zajęcie narządu
pozalimfatycznego (IIIE) lub zajęcie śledziony (IIIS) albo –
jednoogniskowe zajęcie narządu pozalimfatycznego i
zajęcie śledziony (IIIES).
Stadium IV – rozsiane zajęcie narządu pozalimfatycznego
niezależnie od stanu węzłów chłonnych. Zajęcie szpiku lub
wątroby zawsze jest klasyfikowane jako IV stopień
zaawansowania.

• Symbole literowe (A, B, E, S) pozwalają na określenie
dodatkowych parametrów mających znaczenie
prognostyczne. Oznaczają one odpowiednio:
A – brak objawów ogólnych,
B – występowanie objawów ogólnych (gorączki, utraty masy
ciała, nocnych potów),
E – pozawęzłową lokalizację w narządach (od ang.
extranodal – pozawęzłowy),
S – zajęcie śledziony (od ang. spleen – śledziona)
X – zmiany o średnicy większej niż 10 cm, tzw. bulky
disease.

• Czynniki wpływające na rokowanie
Zidentyfikowano szereg negatywnych czynników prognostycznych, czyli
sytuacji pogarszających rokowanie. Należą do nich:
- obecność w klatce piersiowej guza, którego najszerszy wymiar przekracza
1/3 jej szerokości, lub obecność guza o wymiarze przekraczającym 10 cm
(bulky disease),
- występowanie objawów ogólnych (gorączki, utraty masy ciała, nocnych
potów),
- zajęcie przez zmiany nowotworowe trzech lub więcej obszarów
anatomicznych,
- przyspieszony opad krwinek (OB) – powyżej 50 przy braku objawów
ogólnych i powyżej 30 w przypadku ich obecności,
- pozalimfatyczna lokalizacja zmian (cecha E),
- wiek powyżej 45 lat.

Dla choroby w wyższych stopniach zaawansowania wyodrębniono 7
niezależnych negatywnych czynników rokowniczych:
- niski poziom albumin w surowicy krwi (poniżej 4g%),
- stężenie hemoglobiny poniżej 10.5 g%,
- płeć męska,
- IV stadium zaawansowania schorzenia,
- wiek powyżej 45 lat,
- leukocytoza (podwyższona liczba krwinek białych we krwi obwodowej) –
powyżej 15 tysięcy,
- limfopenia (obniżona liczba limfocytów we krwi obwodowej) – poniżej
600 – w liczbach bezwzględnych lub poniżej 8% składu odsetkowego.
Im więcej negatywnych czynników rokowniczych u konkretnego pacjenta,
tym jego rokowanie jest gorsze.

Leczenie
W zależności od stadium zaawansowania, w leczeniu
chłoniaka Hodgkina stosuje się różne schematy
terapeutyczne, obejmujące chemioterapię i radioterapię lub
połączenie obu tych metod. W większości ośrodków
leczenie oparte jest o obowiązujące standardy, opracowane
przez krajowych ekspertów do spraw onkologii i hematologii
klinicznej. W niektórych placówkach możliwe jest jednak
również poddanie pacjenta niestandardowemu leczeniu w
ramach badań klinicznych nad nowymi schematami
terapeutycznymi. Udział w badaniu klinicznym wymaga
każdorazowo pisemnej zgody chorego.

• Radioterapia radykalna (czyli nastawiona na wyleczenie)
jest metodą z wyboru we wczesnych stadiach
zaawansowania ziarnicy bez niekorzystnych czynników
rokowniczych (CS I-II). Naświetla się wówczas duże
powierzchnie ciała przy pomocy specjalnej techniki
wielkopolowej, określanej mianem naświetlania
płaszczowego (ang. mantle field). Radioterapia obejmuje
struktury limfatyczne zlokalizowane powyżej przepony i/lub
pole w kształcie odwróconej litery „Y”.

• W przypadkach bardziej zaawansowanych metodą z wyboru jest
radykalna chemioterapia. Schematy leczenia oparte są na wielu lekach
cytotoksycznych. „Złotym standardem” w leczeniu ziarnicy złośliwej
jest schemat ABVD. Określenie pochodzi od nazw wchodzących w
jego skład leków: A – adriamycyna, B – bleomycyna, V – winkrystyna, D
– dakarbazyna. U osób starszych, obciążonych chorobami układu
krążenia, opcją terapeutyczną może być starszy schemat MOPP
(obejmujący chlorometynę, winkrystynę, prokarbazynę i prednizon),
który w mniejszym stopniu uszkadza serce. Schematu MOPP nie stosuje
się zazwyczaj u osób młodych. Jest to związane z jego odległymi
działaniami niepożądanymi – powoduje on trwałą bezpłodność i
zwiększa ryzyko wystąpienia wtórnych nowotworów. Skutki te są
istotne, zważywszy na, związane z leczeniem radykalnym, założenie
wyleczalności ziarnicy. Jeśli odpowiedź na radykalną chemioterapię jest
niesatysfakcjonująca, w drugim rzucie można zastosować radioterapię.

• Leczenie skojarzone obejmuje łączne zastosowanie chemioterapii i
radioterapii. Stosuje się je u chorych we wczesnych stadiach
zaawansowania z niekorzystnymi czynnikami rokowniczymi.
W przypadku niepowodzenia leczenia chemicznego (progresja
schorzenia pomimo leczenia, szybki nawrót), stosuje się
chemioterapię drugiego rzutu. Leczenie w przypadku nawrotu jest
dosyć agresywne, ponieważ przy pierwszym nawrocie całkowite
wyleczenie nadal jest możliwe. W programach drugiego rzutu mają
zastosowanie ratunkowe programy chemioterapii
konwencjonalnej. Stosuje się również leczenie przy pomocy
chemioterapii wysokodawkowej oraz przeszczepianie szpiku i
komórek macierzystych. Można zastosować również radioterapię,
jeśli nie stosowano jej wcześniej, lub w trakcie poprzedniego
leczenia nie osiągnięto maksymalnych dopuszczalnych dawek.

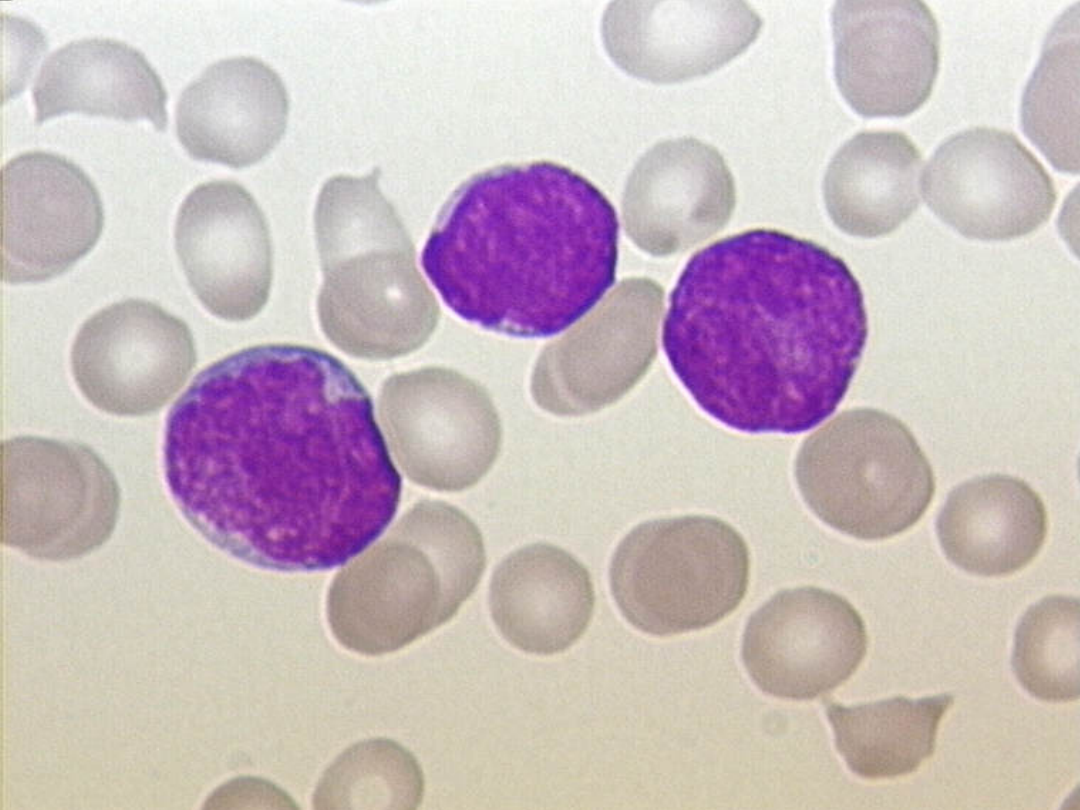
• Białaczka (łac. leukaemia) - nazwa grupy chorób
nowotworowych układu krwiotwórczego. Nazwa historycznie
wywodzi się od białawego koloru próbki krwi chorego na ostrą
białaczkę. Białaczka charakteryzuje się ilościowymi i
jakościowymi zmianami leukocytów we krwi, szpiku i narządach
wewnętrznych (śledzionie, węzłach chłonnych). Występuje
częściej u mężczyzn niż u kobiet w proporcji 3:2.
• Zmienione leukocyty powstają z komórek macierzystych w
wyniku tzw. transformacji białaczkowej. Dochodzi do trwałych
zmian cytokinetycznych, metabolicznych i antygenowych. Ich
przyczyną może być kilka współdziałających ze sobą czynników,
np. retrowirusy, predyspozycje osobnicze (geny), czynniki
zewnętrzne np. promieniowanie jonizujące, środki chemiczne,
zanieczyszczenie środowiska, zakażenia. Czynniki te ułatwiają
transformację białaczkową lub osłabiają układ immunologiczny.

Podział białaczek
• ostra białaczka szpikowa (AML)
• przewlekła białaczka szpikowa (CML)
• ostra białaczka limfoblastyczna (ALL)
• przewlekła białaczka limfatyczna (CLL)

Leczenie
• Leczenie białaczki zależy w dużym stopniu od jej
rodzaju, zaawansowania oraz stanu ogólnego
osoby chorej. Ogólnie można je podzielić na
leczenie radykalne, dążące do wyleczenia czyli
wyeliminowania patologicznej populacji komórek
z organizmu oraz leczenie paliatywne, mające
opanować postęp choroby.

• indukcja remisji - zredukowanie liczby komórek białaczkowych do liczby, z
którą układ immunologiczny sobie poradzi, kontroluje ją.
– polichemioterapia
– prowadzenie 5-7 kuracji powtarzanych z przerwami
– podawanie leków dostosowanych do biorytmu komórek białaczkowych.
• leczenie intensyfikacyjne - stosowanie kilku cykli polichemioterapii przy
użyciu zwiększonych dawek leków w maksymalnie krótkim czasie.
• podtrzymywanie remisji - ma na celu zapobieganie zwiększaniu liczby
komórek białaczkowych utrzymywania ich w stanie podporządkowania
układowi immunologicznemu:
– redukcja
– immunoterapia
• leczenie wspomagające:
– zapobieganie i leczenie zakażeń
– leczenie skazy krwotocznej
– leczenie niedokrwistości
– właściwe odżywianie

• Ważną metodą leczenia przyczynowego
białaczek jest przeszczepienie szpiku
kostnego

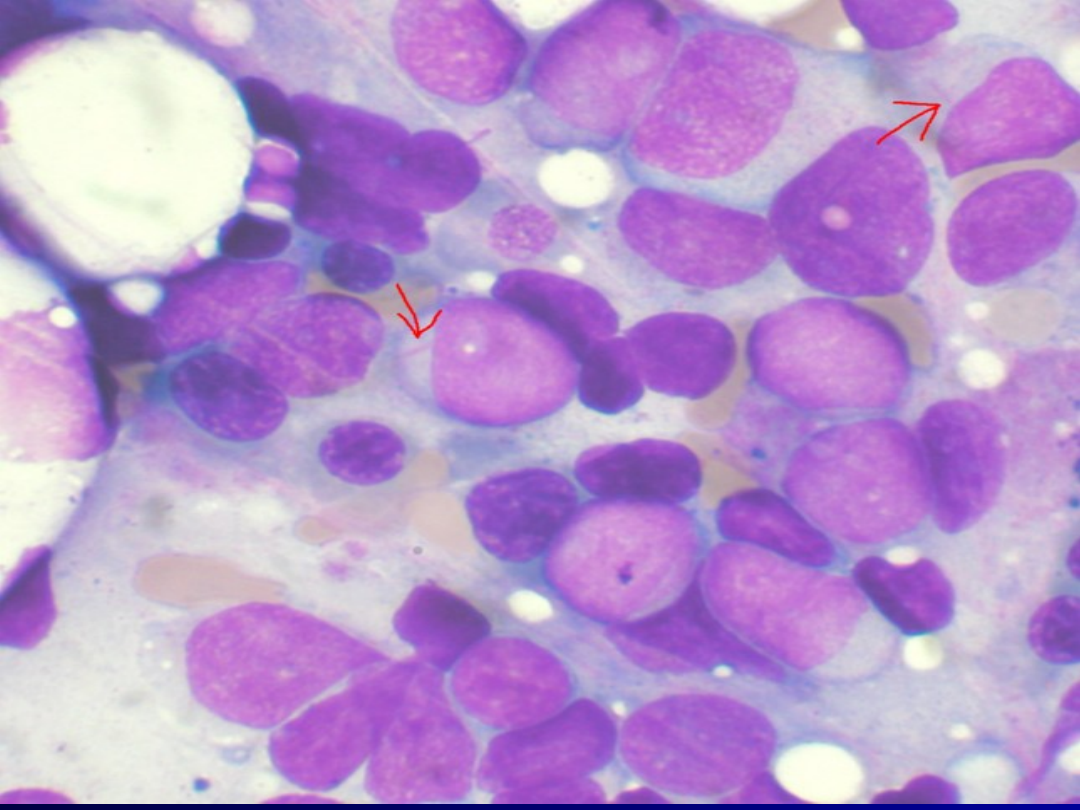
• Ostra białaczka szpikowa (łac. myelosis leukaemica
acuta, ang. acute myeloid leukemia lub acute myelogenous
leukemia, AML, acute non-lymphoblastic leukemia, ANLL) –
grupa chorób spowodowana rozplemem nowotworowym
prekursorów komórek krwi. Charakteryzują się one
zaburzeniem proliferacji i dojrzewania komórek z
nagromadzeniem form niedojrzałych (np. mieloblastów) w
szpiku, a także ich naciekaniem różnych narządów i tkanek.
Zmiany komórkowe rozpoczynają się od grupy komórek, w
których nastąpiła zmiana programu genetycznego.
• W 80% ostra białaczka szpikowa dotyczy osób dorosłych,
pozostałe 20% przypadków występuje u dzieci. Są
najczęstszymi białaczkami okresu niemowlęcego.

Epidemiologia
• AML stanowi 15-20% ostrych
białaczek u dzieci. U dorosłych w
wieku 30-35 lat zapadalność roczna
wynosi około 1:100.000, po 65. roku
życia jest dziesięciokrotnie wyższa i
wynosi 10:100.000.

Etiologia
• Część przypadków wiąże się z
narażeniem na udowodnione czynniki
ryzyka:
• narażenie na promieniowanie jonizujące
• ekspozycja na benzen
• przebyta chemioterapia (leki alkilujące,
inhibitory topoizomerazy)

• Klasyfikacja ostrych białaczek szpikowych
• Powszechnie przyjęto klasyfikację morfologiczną FAB (francusko-
amerykańsko-brytyjską), opartą na kryteriach cytochemicznych i
morfologicznych:
• M0 - ostra białaczka szpikowa, z komórkami o bardzo niskim stopniu
zróżnicowania, nie dającymi się określić dostępnymi metodami
• M1 - ostra białaczka mieloblastyczna, bez cech dojrzewania
• M2 - ostra białaczka mieloblastyczna, z dojrzewaniem
• M3 - ostra białaczka promielocytowa
• M4 - ostra białaczka mielomonocytowa
• M5a - ostra białaczka monocytowa, słabo zróżnicowana
• M5b - ostra białaczka monocytowa, dobrze zróżnicowana
• M6 - ostra erytroleukemia
• M7 - ostra białaczka megakariocytowa

Objawy i przebieg
• Początek choroby jest nagły. Choroba zaczyna się jako
zespół niespecyficznych objawów, na który składają się:
• zakażenia (owrzodzenia błony śluzowej jamy ustnej,
nawracająca angina, zapalenia płuc) przebiegające z
gorączką i osłabieniem
• niedokrwistość (bladość, widoczne zażółcenie skóry,
osłabienie, napadowe kołatanie serca)
• bóle kostno-stawowe związane z rozrostem w szpiku
• objawy skazy krwotocznej (plamica skóry i błon śluzowych,
krwotoki z nosa, błon śluzowych, owrzodzenia i
)
• W badanu przedmiotowym stwierdza się spleno- i
hepatomegalię.

• Odchylenia w badaniach laboratoryjnych
• Liczba leukocytów we krwi obwodowej wzrasta nawet do
800 tys. w mm³ (przeważają formy bardzo młode i dojrzałe,
a brak jest form pośrednich - tzw. przerwa leukemiczna).
Może także spadać, nawet do 1 tys. w mm³. Objawy ogólnie
mogą być bardzo łagodne, wręcz niezauważalne, wtedy
dopiero morfologia wykazuje nieprawidłowości.
• Komórki białaczkowe naciekają narządy wewnętrzne i węzły
chłonne, powiększa się (choć nie zawsze) wątroba i
śledziona, spada masa ciała i dochodzi do wyniszczenia
organizmu.

Najczęstsze przyczyny śmierci osób chorych na
ostrą białaczkę szpikową to:
• zakażenia (sepsa)
• krwawienia (np. do ośrodkowego układu
nerwowego)
• niewydolność ważnych dla życia narządów
• W miarę rozwoju choroby, komórki opanowują
cały szpik i rozrastają się poza nim, np. w
wątrobie lub śledzionie.

Rozpoznanie
• Decydujące są badania immunofenotypu komórek
nowotworowych i badania cytochemiczne.
Różnicowanie
• W diagnostyce różnicowej AML należy uwzględnić:
• mononukleozę zakaźną
• ALL
• przełom blastyczny w CML
• inne przyczyny pancytopenii.

• Leczenie
• W ostrych białaczkach szpikowych zawsze ostatecznym etapem
leczenia jest dokonanie allogenicznego lub autologicznego
przeszczepu szpiku. Jednak najpierw należy zlikwidować możliwie
jak najwięcej komórek nowotworowych. Przeprowadza się więc
intensywne leczenie cytostatykami, aż do osiągnięcia remisji. W
przeciwieństwie do LLA stosuje się jednolite schematy lecznicze.
Obecnie optymalnymi są: "DAV"(daunorubicyna, arabinozyd
cytozyny, etopozyd) lub "TAD" (6-tioguanina, arabinozyd cytozyny,
daunorubicyna). Następnie przeprowadza się leczenie
kondycjonujące przed przeszczepem. Stosuje się wtedy cytostatyki
o działaniu silnie immunosupresyjnym, w celu zniszczenia układu
odpornościowego biorcy, żeby zminimalizować ryzyko odrzucenia
przeszczepu. Stosuje się zwykle bardzo duże dawki cyklofosfamidu
lub ewentualnie chlorambucyl. Leczenie powinno odbywać się
wyłącznie w specjalistycznych ośrodkach hematologicznych.
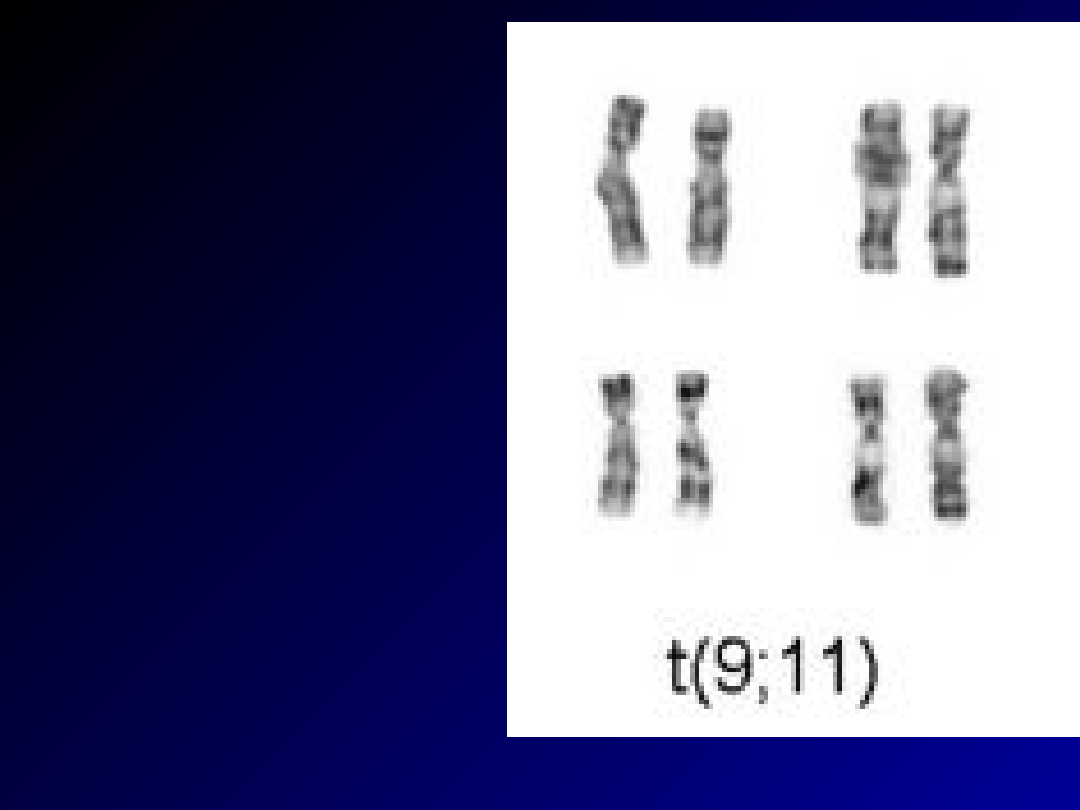
• Immunofenotyp w
ostrych białaczkach
szpikowych
• Translokacja
chromosomalna (9;11)
występująca w AML

• CD 13, 15, 65
• t(8,21) w M2 - korzystny
• t(15,17) w M3 - pośredni
• t(9;22) w M1 - zły
• inv(16), del(16) w M4 - korzystny

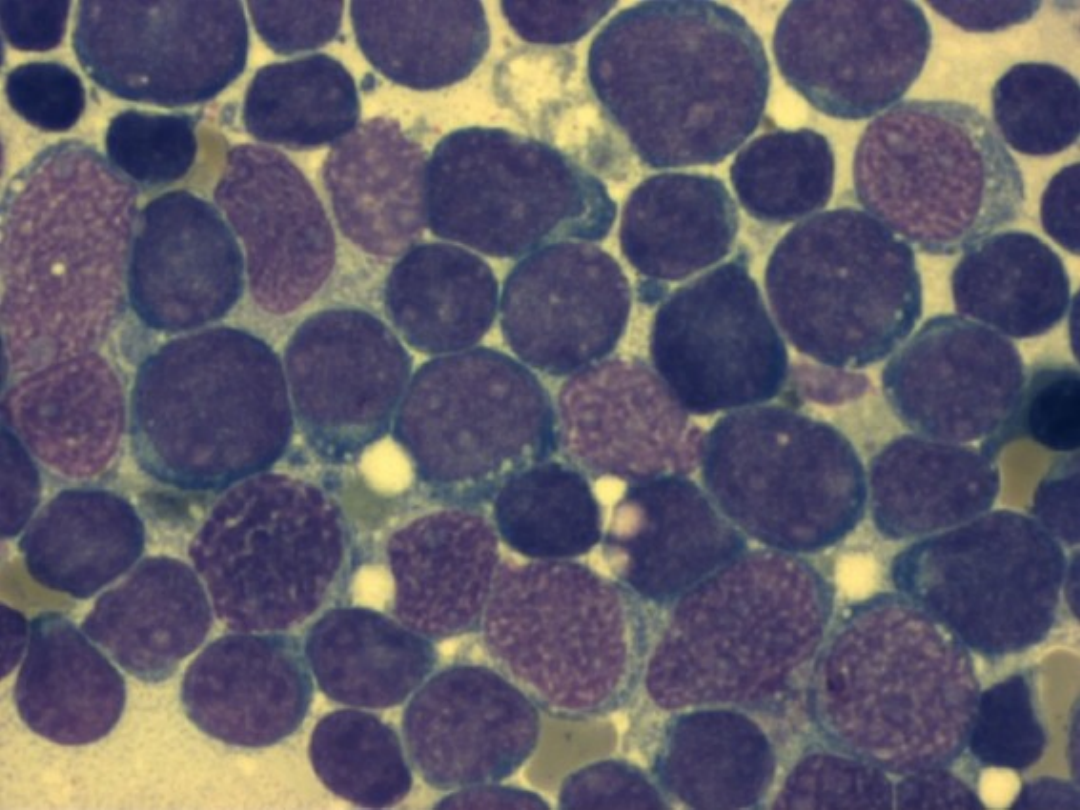
• Przewlekła białaczka szpikowa (łac. myelosis leukaemica
chronica, ang. chronic myeloid leukemia, CML) jest zespołem
mieloproliferacyjnym polegającym na rozroście klonalnym
przekształconej nowotworowo komórki macierzystej szpiku
kostnego.
• Historia
• Przewlekła białaczka szpikowa została opisana w 1845 roku
przez Rudolfa Virchowa (1821-1902) i był to pierwszy w
historii opis choroby nowotworowej szpiku kostnego -
białaczki. Początkowo Virchow sądził, że ma do czynienia z
ciężką infekcją bakteryjną, manifestującą się olbrzymią liczbą
leukocytów we krwi obwodowej. Ponieważ krew opisywanego
przez niego pacjenta miała białawy odcień, nazwał tę
chorobę mianem "białaczki".

• Patogeneza
• W większości przypadków przyczyna rozwoju tej
choroby nie jest znana. Jedynym czynnikiem
etiologicznym, którego znaczenie zostało
bezsprzecznie udowodnione, jest promieniowanie
jonizujące (stąd gwałtowny wzrost zachorowań na
tę chorobę w Japonii po atomowych atakach na
Hiroszimę i Nagasaki).
• Ponieważ nie stwierdzono jednoczesnego
występowania CML u bliźniąt jednojajowych,
przyjmuje się, iż jest to schorzenie nabyte.

• Biologia molekularna
• Molekularną podstawą CML jest mutacja genowa: następuje
połączenie genu BCR (Breakpoint Cluster Region, locus 22q11.21;
jego produktem jest kinaza serynowo-treoninowa) z genem ABL (gen
mysiej białaczki Abelsona, locus 9q34.1; jego produktem jest kinaza
tyrozynowa). W efekcie powstaje gen fuzyjny BCR/ABL odpowiadający
za produkcję nieprawidłowego białka (tzw. kinazy tyrozynowej bcr-
abl). Kinaza tyrozynowa bcr-abl wykazuje stałą aktywność, co
prowadzi do wzmożonej proliferacji (namnażania) macierzystych
komórek szpikowych. Ów gen fuzyjny najczęściej pojawia się na
nieprawidłowym chromosomie – tzw. chromosomie Philadelphia, ale
nie jest to regułą.
• Stwierdzenie obecności chromosomu Philadelphia lub produktu genu
BCR/ABL w rozmazie szpiku kostnego jest konieczne do potwierdzenia
rozpoznania przewlekłej białaczki szpikowej.

Epidemiologia
• Na CML przypada około 25% białaczek u dorosłych. Roczna
zapadalność wynosi 1-1,5:100 000. Nieco częściej chorują
mężczyźni niż kobiety (1,3:1). Najczęściej chorują ludzie w
wieku 30-40 lat, lecz może występować także u dzieci (u
których stanowi 1-3% nowotworów układu krwiotwórczego).
Objawy
• U około 20-40% pacjentów początek choroby jest
bezobjawowy i choroba jest rozpoznawana np. stwierdzenia
hepatosplenomegalii w badaniu fizykalnym lub
nieprawidłowości w rutynowych badaniach laboratoryjnych
(leukocytoza, niedokrwistość, trombocytoza).

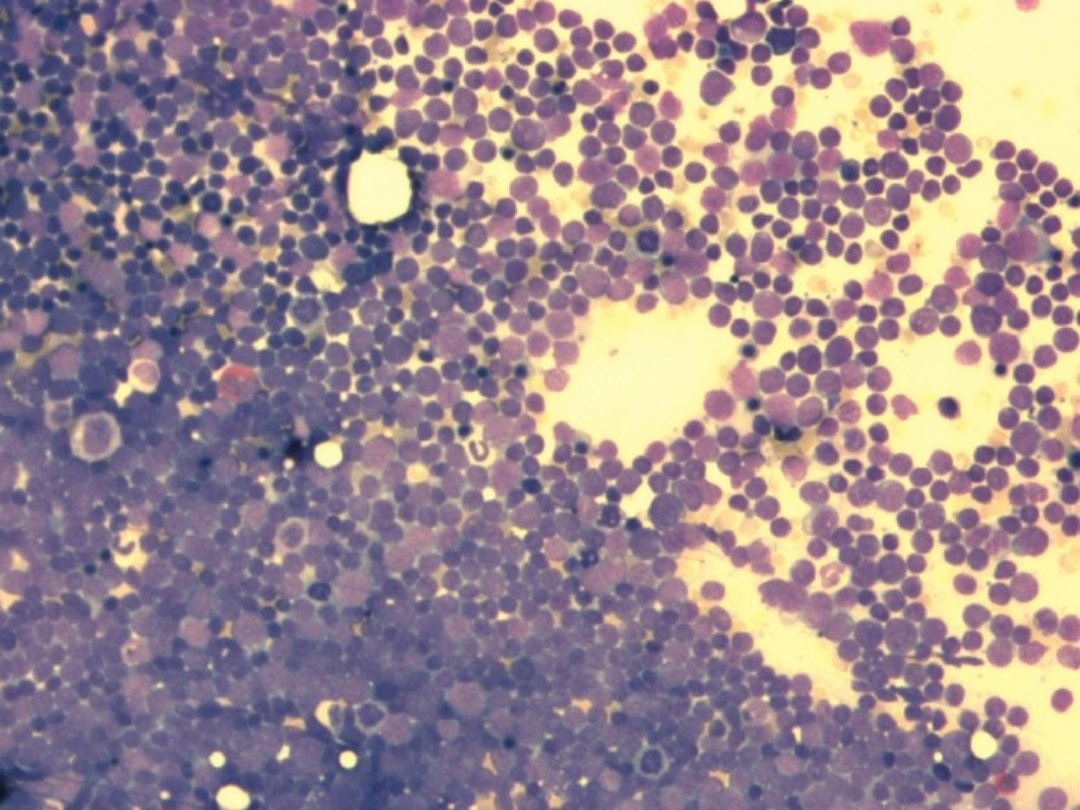
Nieprawidłowości w badaniach laboratoryjnych
Krew obwodowa
• wysoka leukocytoza - w chwili rozpoznania zazwyczaj ok.
100 000/mm³ (choć może sięgać nawet 700 000/mm³),
• w rozmazie: blasty (których odsetek jest proporcjonalny do
wielkości leukocytozy, ale zazwyczaj wynosi około 10%),
promielocyty, metamielocyty, rzadziej erytroblasty.
Charakterystyczne cechy rozmazu CML to: występowanie
we krwi obwodowej komórek linii neutrofilopoetycznej we
wszystkich etapach rozwoju, bazofilia (mogąca pojawić się
na kilka lat przed wzrostem leukocytozy) oraz
nadpłytkowość. Wartości hemoglobiny są zazwyczaj
prawidłowe.

Szpik
• biopsja aspiracyjna: konieczna do
przeprowadzenia badania cytogenetycznego, tj.
oceny kariotypu komórek szpiku. Szpik jest
zazwyczaj bogatokomórkowy, ze zwiększonym
odsetkiem komórek linii neutrofilopoetycznej i
megakariopoetycznej, przytłumiających komórki
linii erytropoetycznej;
• trepanobiopsja: zmiany jak w aspiracie. Ponadto
stwierdza się zwiększone włóknienie retikulinowe i
angiogenezę (tworzenie nowych naczyń).

Badanie cytogenetyczne
• Obecność chromosomu Philadelphia,
czyli translokacji t(9;22)(q34;q11).
Inne zmiany cytogenetyczne
pojawiają się w bardziej
zaawansowanych etapach.
Badanie molekularne
• Obecny gen BCR/ABL w badaniu PCR.

Inne badania laboratoryjne
• zmniejszona aktywność fosfatazy alkalicznej
granulocytów (FAG) - często w ogóle
niewykrywalna,
• zwiększone stężenie witaminy B12 i kwasu
moczowego w surowicy.

Objawy podmiotowe i przedmiotowe
• Objawy związane z dużą leukocytozą (>200 000-300
000/mm³, występujące u 10% chorych)
• utrata masy ciała (związana z przyspieszonym metabolizmem),
• objawy leukostazy (czyli zaburzenia przepływu krwi w
mikrokrążeniu spowodowane dużą liczbą leukocytów - leukocyty
"zatykają" drobne naczynia krwionośne): zaburzenia czynności
ośrodkowego układu nerwowego (zaburzenia świadomości),
zaburzenia widzenia, ból głowy, objawy hipoksemii związane z
zaburzeniami przepływu krwi w naczyniach płucnych, priapizm
(bolesny wzwód prącia mogący być pierwszym objawem CML).
• podwyższona temperatura ciała
• nocne poty

• Hepatosplenomegalia (powiększenie
śledziony i wątroby, obserwowane u 30-40%
chorych w chwili rozpoznania)
• ból w lewym podżebrzu,
• uczucie pełności w jamie brzusznej (spowodowane
powiększeniem śledziony) jako późny objaw.
• Objawy związane z niedokrwistością
• osłabienie
• bladość powłok skórnych i błon śluzowych
• łatwa męczliwość

Przebieg naturalny (czyli bez leczenia)
Nieleczona przewlekła białaczka szpikowa przebiega w trzech
(rzadziej dwóch) etapach:
• Faza przewlekła:
– Faza przewlekła choroby trwa ok. 3-4 lata.
• Faza akceleracji
– W tej fazie choroby następuje przyspieszenie produkcji
nieprawidłowych białych krwinek.
• Faza przełomu blastycznego
– W fazie przełomu blastycznego dochodzi do wzrostu liczby komórek
blastycznych, co przypomina ostrą białaczkę. Na tym etapie choroby u
50% pacjentów komórki blastyczne mają fenotyp mieloblastów, u 30% -
limfoblastów, zaś u 10% - megakarioblastów. U pozostałych 10%
dochodzi do włóknienia szpiku. Fazy: akceleracji i przełomu
blastycznego charakteryzują się nagromadzeniem aberracji
cytogenetycznych, opornością na leczenie i złym rokowaniem.

Celem leczenia jest niedopuszczenie do progresji choroby
(przejścia z fazy przewlekłej do bardziej zaawansowanych
okresów).

Rozpoznanie
Kryteria
• Rozpoznanie przewlekłej białaczki szpikowej możliwe jest wyłącznie po stwierdzeniu
obecności chromosomu Philadelphia badaniem cytogenetycznym lub genu BCR/ABL
metodą FISH lub PCR
Zmodyfikowane kryteria rozpoznania fazy akceleracji i przełomu blastycznego
wg WHO:
Kryteria fazy akceleracji
• 10-19% blastów we krwi obwodowej lub szpiku,
• bazofilia >20%,
• małopłytkowość <100 000/mm³,
• nadpłytkowość >1000 000/mm³,
• dodatkowe aberracje chromosomowe (klonalna ewolucja cytogenetyczna),
• powiększenie śledziony lub zwiększenie leukocytozy oporne na leczenie.
• Obecność co najmniej jednego z wymienionych objawów jest konieczna do rozpoznania
fazy akceleracji CML.

Kryteria przełomu blastycznego
• >20% blastów,
• pozaszpikowe nacieki białaczkowe
• Obecność co najmniej jednego z wymienionych
objawów jest konieczna do rozpoznania fazy
przełomu blastycznego CML.

Leczenie
• Celem leczenia jest osiągnięcie trzech rodzajów remisji
choroby: remisji hematologicznej (doprowadzenie
parametrów krwi obwodowej do stanu zbliżonego do
normy), remisji cytogenetycznej (zmniejszenie ilości
komórek szpikowych zawierających chromosom
Philadelphia - najlepiej do 0) oraz remisji molekularnej
(zmniejszenie liczby cząsteczek kinazy tyrozynowej bcr-abl -
najlepiej do 0).

Leczenie farmakologiczne
• Hydroksymocznik
• Jest to lek stosowany w początkowej fazie leczenia. Ma on działanie
cytoredukcyjne, tj. zmniejsza ilość leukocytów, nie wpływa jednak na
przebieg choroby (nie usuwa komórek z chromosomem Philadelphia)
oraz nie wydłuża przeżycia. Hydroksymocznik działa cytotoksycznie i
antymitotycznie (hamuje podziały komórkowe) poprzez blokowanie
enzymu reduktazy rybonukleotydowej, przekształcającej rybonukleotydy
do deoksyrybonukleotydów (kluczowy etap syntezy DNA).
• W wyniku wzmożonego rozpadu komórek, w trakcie terapii
hydroksymocznikiem obserwuje się wzrost stężenia kwasu moczowego w
surowicy krwi, co może powodować efekty toksyczne. Aby im zapobiec,
profilaktycznie podaje się allopurynol (inhibitor oksydazy ksantynowej,
hamujący przemiany kwasu moczowego).
• Ze względu na teratogenność hydroksymocznika, przez cały okres jego
przyjmowania oraz przez 3 miesiące po zakończeniu terapii kobiety w
wieku rozrodczym powinny stosować antykoncepcję hormonalną.

Inhibitory kinazy tyrozynowej bcr-abl
• Obecnie są to leki pierwszego wyboru w terapii CML. Leki z grupy
inhibitorów kinazy tyrozynowej bcr-abl przyłączają się do cząsteczki
tej kinazy w miejscu wiążącym ATP. Uniemożliwia to przenoszenie
grupy fosforanowej z ATP na tyrozynę białka substratowego i tym
samym blokuje zdolność kinaz do aktywacji białek przekazujących
sygnał proliferacyjny do jądra komórkowego oraz wywołuje apoptozę
komórek białaczkowych. Dopuszczenie imatinibu (leku z tej grupy)
przez FDA na rynek w Stanach Zjednoczonych w 2001 było
przełomem w leczeniu przewlekłej białaczki szpikowej. Badanie IRIS
(International Randomized Study of Interferon and ST1571) wykazało,
że w ciągu 60 miesięcy (5 lat) przyjmowania imatinibu przeżywalność
pacjentów z CML wynosiła 89%, co było wynikiem znacznie lepszym w
porównaniu z dotychczas dostępnymi terapiami. 93% chorych
przyjmujących imatinib pozytywnie odpowiadało na ten lek.

W chwili obecnej dostępne są następujące leki z
grupy inhibitorów kinazy tyrozynowej bcr-abl:
• imatinib (nazwa handlowa: Glivec)
• dasatynib (nazwa handlowa: Sprycel): lek
przeznaczony dla pacjentów opornych na imatinib
• nilotinib: obecnie badana jest jego przydatność
kliniczna w toku badania ENACT (Expanding
Nilotinib Access in Clinical Trials).

Interferon alfa
• Obecnie, ze względu na nasilone objawy niepożądane oraz
dostępność imatinibu, stosowanie interferonu alfa w
monoterapii lub w skojarzeniu z cytostatykami
(hydroksymocznik, arabinozyd cytozyny, daunorubicyna)
nie jest wskazane.
Allogeniczny przeszczep szpiku (alo-BMT)
• Ten wariant leczenia powinno się rozważać u pacjentów <45
roku życia mających dawcę rodzinnego. Wprawdzie nadal
jest to jedyna metoda umożliwiająca całkowite wyleczenie,
to jednak ze względu na znaczne ryzyko oraz skuteczność
inhibitorów kinazy tyrozynowej bcr-abl stosuje się ją coraz
rzadziej.

Ciąża
• W leczeniu CML u kobiet w ciąży dopuszcza się
stosowanie interferonu alfa. Celem szybkiej
cytoredukcji (obniżenia leukocytozy) stosuje się
zabieg leukaferezy. Nie wolno stosować
hydroksymocznika i busulfanu (ze względu na
terarogenność) oraz imatinibu.

Rokowanie
• Średni czas przeżycia chorych leczonych wyłącznie
hydroksymocznikiem wynosi 3-4 lata. Wśród chorych leczonych
interferonem alfa odsetek 10-letnich przeżyć wolnych od
choroby wynosi 60-80%. Wśród leczonych imatinibem przez 60
miesięcy odsetek przeżyć wolnych od progresji choroby i od
wystąpienia fazy akceleracji lub kryzy blastycznej wynosi
odpowiednio 84% i 93%. Całkowita przeżywalność w tym
okresie wynosiła 89%. Odsetek chorych, u których dochodzi do
progresji CML wskutek wystąpienia oporności na imatinib
(najczęściej z powodu mutacji genu ABL) zmniejsza się z
każdym rokiem terapii (średnio wynosi 4% rocznie) i w
czwartym roku leczenia wynosi 1,5%. Odsetek wyleczeń
chorych poddanych alo-BMT (od dawcy rodzinnego) wynosi 60-
80%.

• Chromosom Philadelphia został odkryty i opisany w 1960 roku
przez Petera Nowella z Uniwersytetu w Pensylwanii oraz Davida
Hungerforda z Institute for Cancer Research.
• W 1973 roku Janet D. Rowey z Uniwersytetu w Chicago
udowodniła, że translokacja pomiędzy chromosomem 9 i 22
(t(9;22)(q34;q11)) stanowi przyczynę powstania tej anomalii.
• Chromosom Philadelphia występuje w ponad 95% przewlekłych
białaczek szpikowych. Spotyka się go również w ostrych
białaczkach limfoblastycznych - (25-30% u dorosłych, <10% u
dzieci), niekiedy również w ostrych białaczkach szpikowych.
Wystąpienie chromosomu Ph w ostrej białaczce limfoblastycznej
rokuje znacznie gorzej niż ostra białaczka limfoblastyczna bez tej
translokacji. Paradoksalnie brak chromosomu Ph w przewlekłej
białaczce szpikowej wiąże się ze znacznie gorszym rokowaniem.
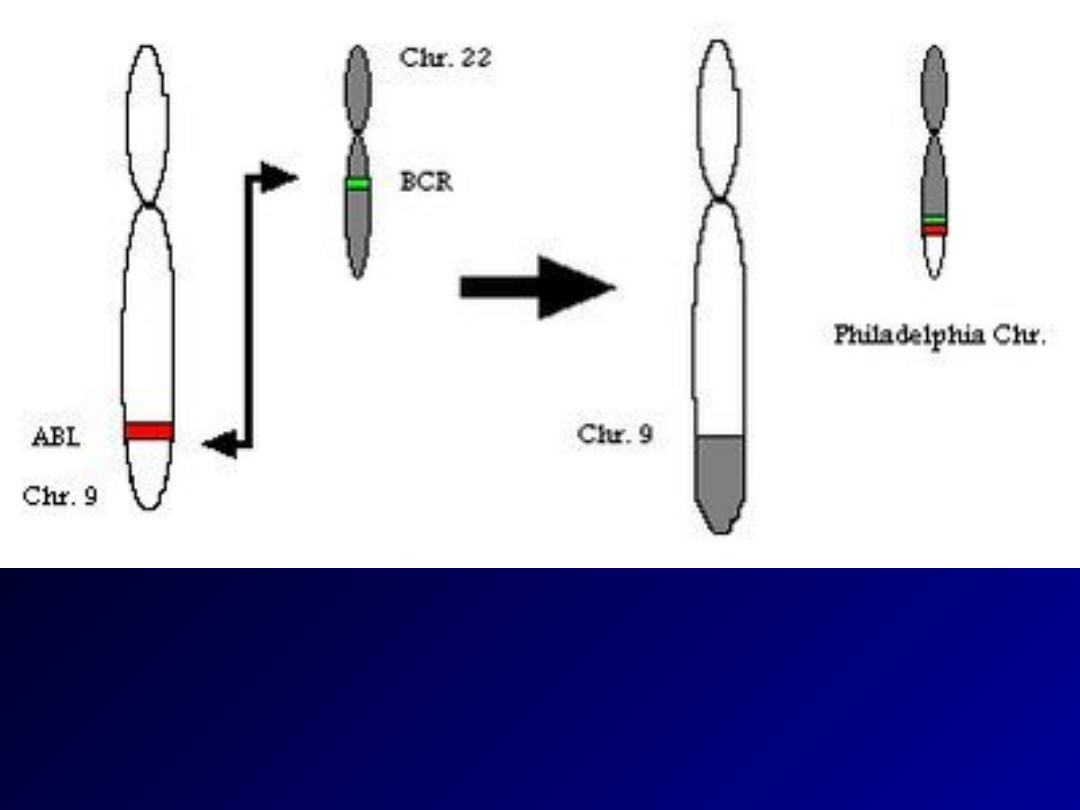
Mechanizm powstawania chromosomu Philadelphia

• Defekt molekularny polegający na translokacji (przeniesienie fragmentu
jednego chromosomu na drugi) t(9;22)(q34;q11), powoduje powstanie genu
fuzyjnego bcr-abl. Fragment bcr (ang. breakpoint cluster region) znajdujący się
na chromosomie 22 w rejonie q11, zostaje połączony z genem abl znajdującym
się na chromosomie 9 w rejonie q34. Gen abl jest protoonkogenem kodującym
białko cytoplazmatyczne i jądrowe z rodziny kinaz tyrozynowych, które jest
odpowiedzialne za różnicowanie, podział, adhezję i odpowiedź na uszkodzenia
komórek. W warunkach normalnych ekspresja tego genu, a zatem produkcja
białka, podlega ścisłej regulacji. Po połączeniu z fragmentem bcr, powstały gen
znajduje się ciągle w pozycji włączonej (staje się onkogenem) i wymyka się
spod kontroli komórki. Produkowane nowe białko o ciężarze 210 kDa lub 185
kDa przyczynia się do wzrostu częstotliwości podziałów komórkowych.
Dodatkowo blokując naprawę DNA, powoduje szybkie gromadzenie się mutacji
w nowych pokoleniach komórek. Wzmożona produkcja białka bcr/abl upośledza
również zdolność komórek do apoptozy oraz do interakcji i adhezji do
podścieliska. Wszystko to prowadzi do wzrostu masy nowotworu i w
konsekwencji doprowadza do kryzy blastycznej, która nieleczona kończy się
śmiercią pacjenta.

• W późnych latach 90. opracowano lek, który
blokuje działanie powstałej kinazy tyrozynowej -
Imatinib. Jego podawanie prowadzi do
zahamowania rozwoju nowotworu, pozwalając
pacjentom uzyskać całkowite remisje. Nie
doprowadza on jednak do całkowitego
wyleczenia. W Polsce dostępny jest on pod nazwą
handlową Glivec. Obecnie kolejne firmy
farmaceutyczne wprowadzają na rynek
konkurencyjne preparaty blokujące kinazę bcr-abl
w innym mechanizmie, np. dasatinib.

• Ostra białaczka limfoblastyczna (łac. leucaemia
lymphoblastica acuta, lymphadenosis leucaemica
acuta, skrót LLA, ALL) – w chorobie występuje
rozrost tkanki limfatycznej i naciekanie jej w różnych
okolicach ciała. Węzły chłonne ulegają
powiększeniu, są niebolesne.
• Liczba leukocytów może być prawidłowa, niższa lub
wyższa od normy, a w rozmazie 90-95% stanowią
limfocyty. Występują objawy niedokrwistości i
osłabienie. W przypadku obniżenia liczby płytek krwi
występują cechy skazy krwotocznej – wybroczyny i
skłonność do powstawania sińców.
• Wymienionym objawom towarzyszą często bóle
brzucha, stawów, gorączka.
• Wątroba i śledziona są powiększone.
Rozmaz
szpiku
kostnego
u pacjenta
z ALL

• Leczenie
• Podstawową metodą leczenia ALL jest chemioterapia.
Leczenie odbywa się w specjalistycznym ośrodku
hematologicznym. Odpowiedź na leczenie cytostatykami
jest bardzo dobra, szczególnie u dzieci (ok. 70-80%
wyleczeń). Leczenie ALL składa się z 4 etapów i trwa łącznie
ok. 3 lat. Protokół leczenia chorych z ALL zależy od
kwalifikacji do grup zaawansowania na podstawie objawów
klinicznych, wyników badań diagnostycznych i reakcji na
wstępne leczenie. W przypadku ALL u dzieci od 2002 roku w
Europie stosowany jest protokół ALL-IC (trzy grupy ryzyka:
SR – standard risk, ryzyko standardowe, IR – intermediate
risk, ryzyko pośrednie, HR – high risk, wysokie ryzyko).

• Ogólny schemat leczenia:
• I etap: leczenie indukujące. Stosowane są:
– winkrystyna,
– antracyklina (dauno-lub doksorubicyna),
– L-asparaginaza,
– prednizon.
• II etap: leczenie konsolidujące:
– cyklofosfamid,
– arabinozyd cytozyny,
– metotreksat, podawany do płynu mózgowo-rdzeniowego jako profilaktyka zajęcia
ośrodkowego układu nerwowego,
– 6-merkaptopuryna.
• III etap: leczenie reindukujące; powtórzenie zestawu leków z I etapu
• IV etap: leczenie podtrzymujące, do 2 lat, nie jest wymagana
hospitalizacja:
– 6-merkaptopuryna,
– metotreksat.
• W przypadku zajęcia przez proces nowotworowy ośrodkowego układu
nerwowego dodatkowo stosuje się radioterapię
Cytogenetyka
Cytogenetyka jest badaniem charakterystycznych, dużych
zmian w chromosomach komórek nowotworowych, które
zyskuje coraz większe znaczenie w określeniu rokowania
w ALL.
Zmiana cytogenetyczna
Kategoria
ryzyka
chromosom Philadelphia
Złe rokowanie
t(4;11)(q21;q23)
Złe rokowanie
t(8;14)(q24.1;q32)
Złe rokowanie
Złożony kariotyp (więcej niż 4
nieprawidłowości)
Złe rokowanie
Niska hipodiploidia lub prawie triploidia
Złe rokowanie
Wysoka hiperdiploidia
Dobre
rokowanie
del(9p)
Dobre
rokowanie
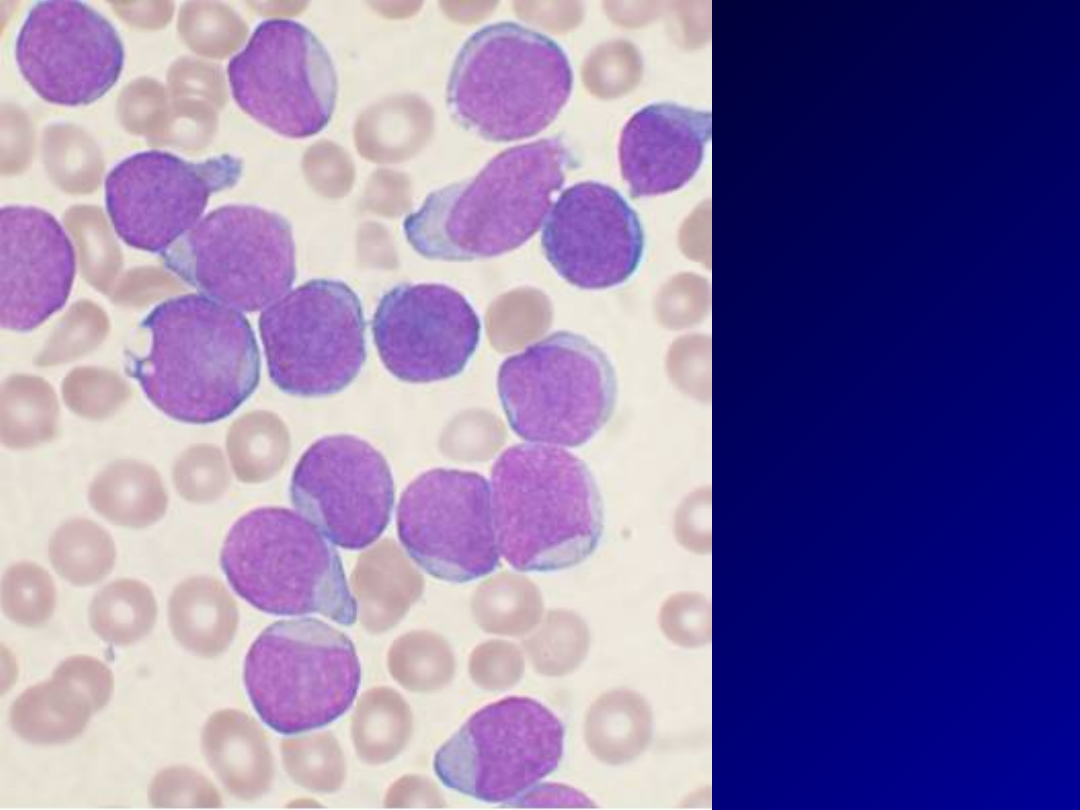
Aspirat szpiku
barwiony metodą
Wrighta od
pacjenta z ostrą
białaczką
limfoblastyczną z
komórek
prekursorowych B

• Przewlekłe białaczki limfatyczne (łac. lymphadenosis
leucaemica chronica, ang. chronic lymphocytic leukemia lub
chronic lymphoid leukemia), określana także skrótem LLC i CLL
(częściej) - grupa chorób hematologicznych należących do
klonalnych chorób limfoproliferacyjnych. Występują głównie u osób
starszych po 60 roku życia. Częściej u mężczyzn niż u kobiet. Mają
łagodniejszy przebieg niż reszta odmian białaczek i przy dobrej
odpowiedzi na leczenia rokują kilkunastoletnie przeżycie.
• Objawiają się powiększeniem węzłów chłonnych, wątroby,
śledziony, zmęczeniem, osłabieniem, niedokrwistością, dusznością,
obrzękiem kostek, wysypką. Niekiedy mogą nie dawać żadnych
objawów, szczególnie na początku choroby. W końcowym okresie
występują nacieki nowotworowe prawie we wszystkich narządach,
a chory umiera z powodu niedokrwistości, skazy krwotocznej i
powikłań. Dochodzi do rozplemu limfocytów i limfoblastów.

Do przewlekłych białaczek limfatycznych należą:
• przewlekła białaczka limfocytowa B-komórkowa
• białaczka włochatokomórkowa
• białaczka prolimfocytowa
• białaczka z dużych ziarnistych limfocytów

• Przewlekła białaczka limfocytowa B-komórkowa
(chronic lymphocytic leukemia, CLL) jest chorobą
nowotworową limfocytów występujących we krwi, szpiku
kostnym, układzie limfatycznym, a także innych narządach.
Ten rodzaj białaczki jest najczęstszy w Europie.
Ryzyko zachorowania rośnie wraz z wiekiem. Zwykle
chorują osoby między 65 a 70 rokiem życia, częściej
mężczyźni. Przyczyny schorzenia nie są znane. Pewne
znaczenie w rozwoju CLL mają niekiedy czynniki
genetyczne.

Objawy białaczki limfocytowej B-komórkowej
•
Ponad połowa pacjentów z CLL nie ma żadnych objawów
choroby, a jedynym niepokojącym sygnałem jest zwiększony
poziom limfocytów. Objawy występujące u pozostałych
chorych są niecharakterystyczne: gorączka, wzmożona
potliwość w nocy, spadek masy ciała, ogólne osłabienie i
męczliwość, bóle brzucha i uczucie pełności wynikające z
powiększenia narządów jamy brzusznej (śledziona, wątroba).
Ponadto dochodzi do powiększenia węzłów chłonnych,
migdałków, czasem również zajęcia procesem chorobowym
skóry. Zwiększa się skłonność do zakażeń. Może rozwinąć się
niedokrwistość.

• Odstępstwa w badaniach pomocniczych to m.in.
wspomniany wzrost poziomu limfocytów (limfocytoza, około
30tys./µl) czy, w zaawansowanych postaciach choroby,
niedokrwistość i spadek liczby płytek (małopłytkowość).
Oprócz morfologii krwi wykonuje się również biopsję szpiku,
trepanobiopsję, badania cytogenetyczne i molekularne.
Przebieg przewlekłej białaczki limfocytowej u około 30%
pacjentów jest łagodny, a pacjenci żyją 10-20 lat. U
pozostałych chorych schorzenie może doprowadzić do
zgonu w ciągu 2-3 lat. Niekiedy CLL może przekształcać się
w bardziej agresywne chłoniaki, w przypadku których
rokowanie jest gorsze.

• Leczenie białaczki limfocytowej B-komórkowej
• Leczenie białaczki polega na podawaniu leków
cytostatycznych, czasem w połączeniu z
glikokortykisteroidami. Stosuje się: chlorambucyl,
fludarabinę, kladrybinę, cyklofosfamid, rytuksymab,
alemtuzumab, prednizon. W przypadku znacznego
powiększenia śledziony można rozważyć naświetlania tego
narządu lub jego usunięcie (splenektomia).
Chorzy na CLL umierają najczęściej z powodu powikłań:
zakażeń (zapalenie płuc i sepsa), krwawień i ogólnego
wyniszczenia organizmu.

• Białaczka włochatokomórkowa (hairy cell leukemia,
HCL) jest schorzeniem polegającym na nowotworowym
rozroście limfocytów B lub rzadziej limfocytów T. Komórki
zmienione nowotworowo obecne są we krwi, szpiku
kostnym, układzie limfatycznym, czasem również w innych
narządach (płuca, przewód pokarmowy, mózg, rdzeń
kręgowy, nerki czy kości).
Nazwa choroby pochodzi od wyglądu chorych limfocytów -
posiadają one długie wypustki, które przypominają włosy.
Białaczka włochatokomórkowa występuje najczęściej około
50 roku życia, częściej wśród mężczyzn. Nie chorują na nią
dzieci.

Przyczyny białaczki włochatokomórkowej
• Przyczyny choroby nie są znane. Prawdopodobnie
pewną rolę w rozwoju białaczki mogą odgrywać:
promieniowanie rentgenowskie, infekcje wirusowe
(tzw. wirus Epsteina-Barra), kontakt z
rozpuszczalnikami organicznymi oraz czynniki
genetyczne.

• Objawy białaczki włochatokomórkowej
•
Część pacjentów chorych na białaczkę włochatokomórkową
nie skarży się na żadne objawy. Inni zgłaszają ogólne
osłabienie i szybkie męczenie. Chorzy zauważają ponadto
spadek masy ciała. Inne objawy to: bóle brzucha, uczucie
pełności w jamie brzusznej, zwiększona skłonność do
krwawień i zakażeń. W przebiegu tej białaczki może
dochodzić do powiększenia wątroby, śledziony (stąd
dolegliwości brzuszne) i węzłów chłonnych. Zdarza się, że
limfocyty zmienione nowotworowo umiejscawiają się
również w skórze.

Badania dodatkowe wykazują wiele
nieprawidłowości. Dochodzi do obniżenia poziomu
czerwonych i białych krwinek oraz płytek krwi
(pancytopenia). U niektórych chorych poziom
białych krwinek jest podwyższony (leukocytoza).
Badania laboratoryjne krwi ukazują niekiedy
zwiększony poziom mocznika i wzrost aktywności
aminotransferaz wątrobowych (AspAT, AlAT). W
ramach badań dodatkowych wykonuje się także
biopsję szpiku, trepanobiopsję i specjalistyczne
badania cytogenetyczne

• Leczenie białaczki włochatokomórkowej
•
Leczenie białaczki włochatokomórkowej polega na
stosowaniu analogów puryn: kladrybina,
pentostatyna i inne. Czasem podawany jest
również interferon alfa lub rytuksymab. U
niektórych pacjentów należy usunąć operacyjnie
powiększoną śledzionę. Leczenie daje najczęściej
dobre rezultaty.



















Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
- Slide 41
- Slide 42
- Slide 43
- Slide 44
- Slide 45
- Slide 46
- Slide 47
- Slide 48
- Slide 49
- Slide 50
- Slide 51
- Slide 52
- Slide 53
- Slide 54
- Slide 55
- Slide 56
- Slide 57
- Slide 58
- Slide 59
- Slide 60
- Slide 61
- Slide 62
- Slide 63
- Slide 64
- Slide 65
- Slide 66
- Slide 67
- Slide 68
- Slide 69
- Slide 70
- Slide 71
- Slide 72
- Slide 73
- Slide 74
- Slide 75
- Slide 76
- Slide 77
- Slide 78
- Slide 79
- Slide 80
- Slide 81
- Slide 82
- Slide 83
- Slide 84
- Slide 85
- Slide 86
- Slide 87
- Slide 88
- Slide 89
- Slide 90
- Slide 91
- Slide 92
- Slide 93
- Slide 94
- Slide 95
- Slide 96
- Slide 97
- Slide 98
- Slide 99
- Slide 100
- Slide 101
- Slide 102
- Slide 103
- Slide 104
- Slide 105
- Slide 106
- Slide 107
- Slide 108
- Slide 109
- Slide 110
- Slide 111
- Slide 112
- Slide 113
- Slide 114
- Slide 115
- Slide 116
- Slide 117
- Slide 118
- Slide 119
- Slide 120
- Slide 121
- Slide 122
- Slide 123
- Slide 124
- Slide 125
- Slide 126
- Slide 127
- Slide 128
- Slide 129
- Slide 130
- Slide 131
- Slide 132
- Slide 133
- Slide 134
- Slide 135
- Slide 136
- Slide 137
- Slide 138
- Slide 139
- Slide 140
- Slide 141
- Slide 142
- Slide 143
- Slide 144
- Slide 145
- Slide 146
- Slide 147
- Slide 148
- Slide 149
- Slide 150
- Slide 151
- Slide 152
- Slide 153
- Slide 154
- Slide 155
- Slide 156
- Slide 157
- Slide 158
- Slide 159
- Slide 160
- Slide 161
- Slide 162
- Slide 163
- Slide 164
- Slide 165
- Slide 166
- Slide 167
- Slide 168
- Slide 169
- Slide 170
- Slide 171
- Slide 172
- Slide 173
- Slide 174
- Slide 175
- Slide 176
- Slide 177
- Slide 178
- Slide 179
- Slide 180
- Slide 181
- Slide 182
- Slide 183
- Slide 184
- Slide 185
- Slide 186
- Slide 187
- Slide 188
- Slide 189
- Slide 190
- Slide 191
- Slide 192
- Slide 193
- Slide 194
- Slide 195
- Slide 196
- Slide 197
- Slide 198
- Slide 199
- Slide 200
- Slide 201
- Slide 202
- Slide 203
- Slide 204
- Slide 205
- Slide 206
- Slide 207
Wyszukiwarka
Podobne podstrony:
ch ukl krwiotworczego
Fizjologia ukł Krwiotwórczego
choroby wirus i bakter ukł odd Bo
APD 9 ukł synchroniczne
PA2 4 podstawy ukł sekw
Zaburzenia ukł pozapiramidowego (1)
ukł kostny KD
Stres a ukł krąż Sałabun Sękowska
Obw ukł nerw
PIELĘGNOWANIE CHORYCH w schorz ukł moczowego
ukl wspolczulny zapis 2003
Rozwoj ukl‚adu pokarmowego
Wyklad V Ukl moczowy
BF ukł nerw
więcej podobnych podstron