
MECHANIZMY TOLERANCJI
CENTRALNEJ W AUTOAGRESJI
Iwona Lesiewicz

AUTOTOLERANCJA
Zespół mechanizmów, dzięki którym-mimo
istnienia potencjału autoimmunizacyjnego-nie
dochodzi do aktywacji komórek autoreaktywnych
i do patologicznej odpowiedzi z niszczeniem
struktur organizmu.
W razie jej załamania rozwija się choroba
autoimmunizacyjna będąca stanem
patologicznym, w którym dochodzi do
zaatakowania struktur organizmu i niszczenia ich
w procesie nieprawidłowo przebiegającej
odpowiedzi immunologicznej.

W zjawiskach autoimmunizacyjnych
uczestniczą:
autoantygeny-
antygeny obecne na prawidłowych
komórkach ustroju, w ich cytoplazmie lub
wytwarzane i wydzielane przez prawidłowe
komórki ustroju
autoreaktywne limfocyty T-
rozpoznają epitopy
pochodzące z autoantygenu w połączeniu z
autologiczną cząsteczką MHC. Th CD4+ stanowią
główne zagrożenie autoimmunizacją, gdyż pod
ich kontrolą są inne komórki układu
odpornościowego, przede wszystkim limf.B i
limf.Tc.

autoreaktywne limfocyty B-
rozpoznają
autoantygeny rozpuszczalne bez połączenia z
cząsteczką MHC, prezentują je autoreaktywnym
limf.T
autoprzeciwciała-
tworzone przez autoreaktywne
limf.B, wiążą autoantygeny;przez aktywację
mechanizmów efektorowych mogą powodować
niszczenie tkanek i narządów.
Limfocyty autoreaktywne i autoprzeciwciała
stanowią prawidłową składową „zdrowego”
układu immunologicznego.

MECHANIZMY ZAPEWNIAJĄCE
TOLERANCJĘ NA WŁASNE
ANTYGENY
CENTRALNE
•
selekcja limf.T w grasicy
•
selekcja limf.B w szpiku kostnym
OBWODOWE
•
sekwestracja lub ignorancja
•
delecja klonalna
•
anergia
•
aktywna supresja

RÓŻNICOWANIE LIMF.T W GRASICY.
SELEKCJA POZYTYWNA I NEGATYWNA.
Grasica
jest nieodzowna do roznicowania sie
niedojrzalych komorek prekursorowych w komorki
o charakterystyce limfocytow T.
Dzieci z syndromem Di-George, tzn. urodzone bez
grasicy, lub myszy genetycznie pozbawione
grasicy nie posiadaja dojrzalych limfocytow T.

W wyniku grasiczo-zaleznych procesow
roznicowania sie komorek, pojawiaja sie dwie
wazne funkcje fizjologiczne limfocytow T:
1)
pojawiaja sie dojrzale komorki T rozpoznajace
antygen tylko wtedy, gdy jest on polaczony z
kompleksem MHC (tzn. pojawiaja sie limfocyty,
ktorych funkcja jest pod nadzorem glownego
kompleksu zgodnosci tkankowej);
2)
pojawiaja sie dojrzale limfocyty T nie reagujace
na wlasny antygen (sa tolerancyjne na wlasny
antygen).

Najbardziej istotne znaczenie kontaktu z
komorkami grasicy dla rozwoju komorek T
ma kontakt z komorkami epitelium kory
grasicy, oraz grasiczymi komorkami
dendrytycznymi umiejscowionymi w
przejsciu miedzy kora i rdzeniem grasicy.
Grasicze komorki dendrytyczne sa blisko
spokrewnione z komorkami
dendrytycznymi prezentujacymi antygen w
szpiku kostnym.
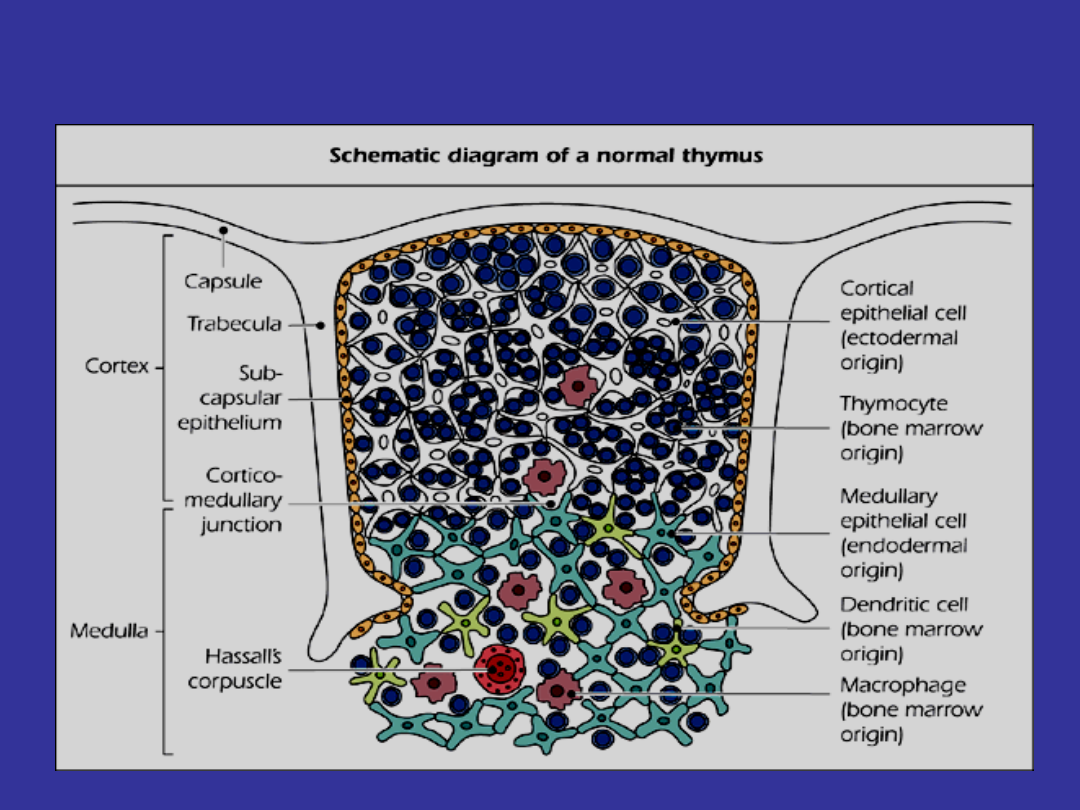
Budowa grasicy; typy komorek

Prekursorowa komorka T wchodzaca do grasicy
posiada pierwotna konfiguracje genow TCR
kodujacych wszystkie lancuchy. W grasicy
przechodzi ona proces uporzadkowanej re-aranzacji
genow. Jezeli komorka T podczas dojrzewania okaze
sie niezdolna do wyprodukowania lancuchow o
odpowiedniej specyficznosci antygenowej, to
umiera ona w wyniku apoptozy.

•
Wazne jest, ze w rezultacie przypadkowej rekombinacji
genow w procesie powstawania receptora, moga pojawic
sie grasicze limfocyty T wykazujace powinowactwo
receptora TCR do wszystkich antygenow bialkowych,
zarowno obcych jak i wlasnych.
•
Gdyby wszystkie te komorki opuscily grasice, doszlo by do
reakcji autoimmunoagresji. Aby uchronic sie przed tym,
komorki T CD4+CD8+, zanim opuszcza grasice, roznicuja
sie dalej, w procesie tzw.
selekcji grasiczej.
•
Pierwszym etapem selekcji grasiczej komorek T CD4+CD8+
jest
selekcja pozytywna
.

•
W tym etapie, komorki CD4+CD8+ reaguja z kompleksem
MHC na powierzchni komorek epitelialnych kory grasicy.
•
Komorki T nie wykazujace powinowactwa do MHC (tzn. nie
wchodzace w reakcje z MHC) gina w procesie apoptozy- tzw.
śmierć z zaniedbania
na skutek braku sygnałów z receptora
TCR hamujących apoptozę dzięki ekspresji genów
kodujących białka Bcl-2 i Bcl-Xl.
•
W wyniku interakcji z MHC nastepuje dalsza proliferacja
komorek CD4+CD8+ z jednoczesnym spadkiem expresji
genow RAG-1 i RAG-2, co wiaze sie z zahamowaniem dalszej
re-aranzacji genow kodujacych polipetydy alfa/beta.

MHC eksponowane na komorkach epitelium kory
grasicy wystepuje najczesciej w polaczeniu z
wlasnymi peptydami. Jednakze na tym etapie
rozwoju limfocyty T jeszcze nie sa
zaprogramowane aby rozpoznawac antygen.
Rezultatem pozytywnej selekcji w grasicy jest
populacja komorek T alfa/beta “nauczonych”
rozpoznawac czasteczki MHC znajdujace sie na
powierzchni komorek epitelium kory grasicy.

Selekcja pozytywna dostarcza
tymocyty posiadajace ekspresje TCR
specyficznych zarowno do antygenu
obcego jak i wlasnego. Aby nie
dopuscic do tego, by komorki T
reagowaly na wlasny antygen zanim
opuszcza one grasice, limfocyty T
CD4+CD8+ przechodza dodatkowy
etap, okreslany jako
selekcja
negatywna.

Proces selekcji negatywnej zachodzi w kontakcie z
palczastymi komorkami dendrytycznymi,
zgrupowanymi w miejscu polaczenia czesci
korowej z rdzeniem grasicy. Kreceptory TCR, czyli
czasteczki CD4 oraz CD8 na tymocycie reaguja z
eksponowanymi na komorkach dendrytycznych
kompleksami MHC klasy I i II polaczonymi z
peptydami
(restrykcja MHC
). Peptydy te pochodza
z wlasnych bialek danego organizmu. Limfocyty T
posiadajace receptory TCR wykazujace duże
powinowactwo do kompleksu MHC-peptyd
pochodzenia wlasnego, sa eliminowane w
procesie apoptozy.Przeżywają te, które mają małe
bądż średnie powinowactwo.

Tak wiec, negatywna selekcja usuwa
komorki T CD4+CD8+, ktore po
opuszczeniu grasicy moglyby reagowac na
wlasne skladniki bialkowe, jednakże zbyt
duża awidność nie musi prowadzić do
apoatozy dzięki procesowi
redagowania
receptorów
polegającemu na utrzymaniu
w tych limfocytach ekspresji RAG1 i RAG2
co umożliwia ponowną rearanżacje genów
kodujących TCR.

SELEKCJA NEGATYWNA
LIMFOCYTÓW B W SZPIKU
KOSTNYM
Limfocyty B,podobnie jak limf.T,
przechodzą procesy selekcji. Mają one
zabezpieczać przed powstaniem
limfocytów autoreaktywnych. Ze względu
jednak na ich zależność od limf.Th, proces
ten nie musi być tak dokładny jak w
grasicy.

Zaledwie 1/3 komórek rozwijających się w
kierunku limf.B osiąga dojrzałość-reszta
ginie z powodu błędnej rearanżacji genów
lub dlatego, że ich pre-BCR miał kontakt z
autoantygenem.Ważna tutaj jest awidność
autoantygenu do receptora
immunoglobulinowego.Duża siła wiazania
kieruje na drogę apoptozy.Optymalne i
tutaj jest rozpoznawanie antygenu z
umiarkowanym powinowactwem.

Eliminowanie może odbywac sie w
dwojaki sposob:
•
Jeżeli niedojrzała komórka B połączy się ze
“swoim” antygenem znajdujacym sie na
błonach komórek szpiku kostnego (połączy
się z
antygenem komórkowym
szpiku
kostnego), to podlega ona apoptozie.
•
Natomiast, jezeli niedojrzala komórka B
połączy sie z
antygenem wolnym
(nie
komorkowym; rozpuszczonym) w szpiku
kostnym, to nie jest ona eliminowana –
przechodzi w stan anergii.
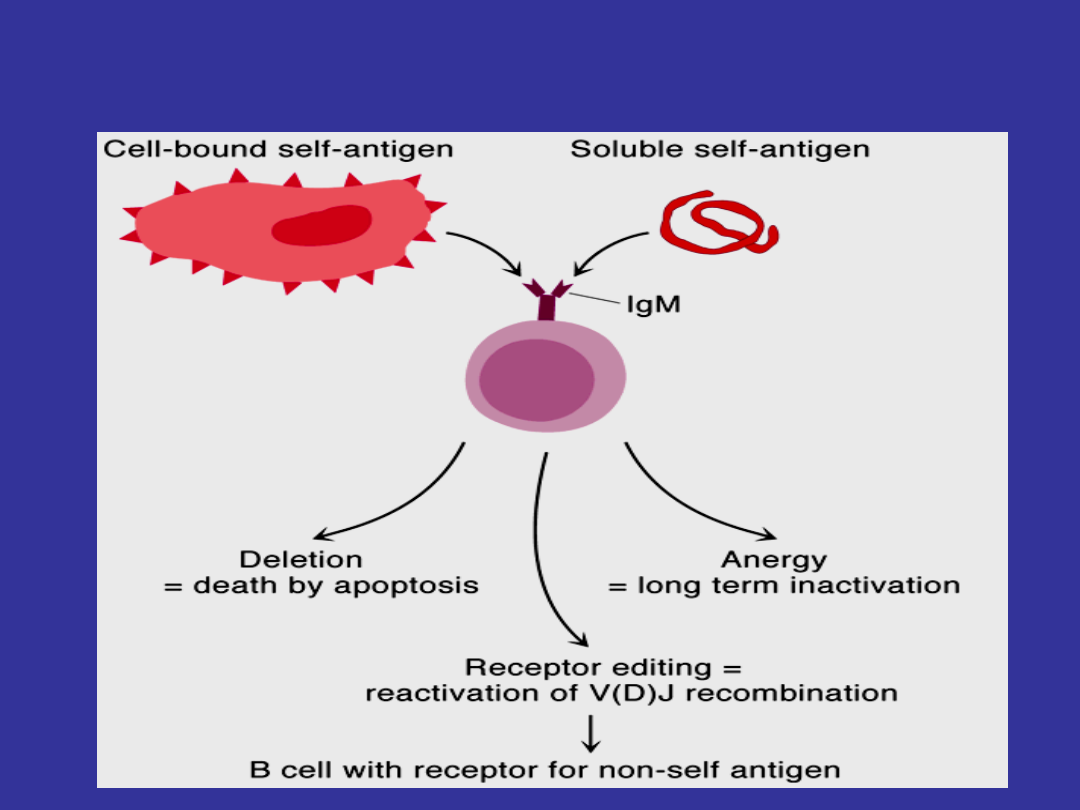
Interakcje niedojrzalych komorek B z
antygenem “self”

Dziękuję za uwagę.
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
Wyszukiwarka
Podobne podstrony:
Mechanizmy tolerancji centralnej na autoantygeny, studia, immunologia
Obwodowe mechanizmy tolerancji na autoantygen, studia, immunologia
Jak założyć centralny zamek, Mechanika Samochodowa
Mechanizmy zapewniajace tolerancje na wlasne antygeny3
CENTRA LOGISTYCZNE Część I, Studia PWR Tranposrt Mechaniczny Politechnika Wrocławska, SEMESTR V, Log
BANK CENTRALNY I JEGO FUNKCJE
Mechanika techniczna(12)
Mechanika Semest I pytania egz
wykl 8 Mechanizmy
Bank centralny 5
Magazyny i centra logistyczne
mechanizm mycia i prania
Europejski Bank Centralny
MECHANIKA II DYN
METODY KOMPUTEROWE W MECHANICE 2
więcej podobnych podstron