
Linie
komórkowe

Linia komórkowa
•Jest to populacja komórek
powstająca z hodowli
pierwotnej po pierwszym
pasażu

Pasażowanie
• Pasażowaniem nazywa się
przeniesienie komórek
z dotychczasowego
naczynia hodowlanego do nowego
• Pasażowaniu poddaje się komórki
przed osiągnięciem konfluencji

Konfluentna hodowla
•Konfluentną nazywa się
hodowlę, w której komórki
pokrywają ścisłą warstwą
całą powierzchnię dna
naczynia hodowlanego

Po 3 pasażu zwykle linia
komórkowa staje się stabilna,
co oznacza, że jej komórki mają
określone tempo proliferacji
Linia komórkowa ma zwykle
szybsze tempo wzrostu niż
hodowla pierwotna

Linie komórkowe uzyskane
z normalnych,
diploidalnych komórek i
tkanek
mogą być
hodowane tylko przez
określony
czas

Linie komórkowe uzyskane z
normalnych, diploidalnych
komórek i tkanek
posiadają
ograniczoną liczbę pokoleń
tzw. okres przeżycia – life –
span;
możliwa jest tylko
określona liczba pasaży

Linie komórkowe,
które mają
ograniczony czas
życia nazywa się
finite cell lines

Finite cell lines
• Rosną one przez konkretną
liczbę pokoleń, osiągając zwykle
od 20 – 80 podwojeń populacji
• Potem komórek nie da się już
dłużej pasażować i linia
komórkowa zamiera

Continuous cell lines – linie
ciągłe
• Istnieją takie rodzaje komórek, z
których można wyprowadzić linie
o
nieograniczonym czasie życia, czyli
tzw. linie ciągłe
• Są to komórki nowotworowe
izolowane z guzów

Komórki nowotworowe
izolowane z guzów
• Komórki te maja praktycznie
nieograniczoną zdolność
proliferacji i linie
uzyskane z tego typu komórek
można pasażować nieskończoną
liczbę razy
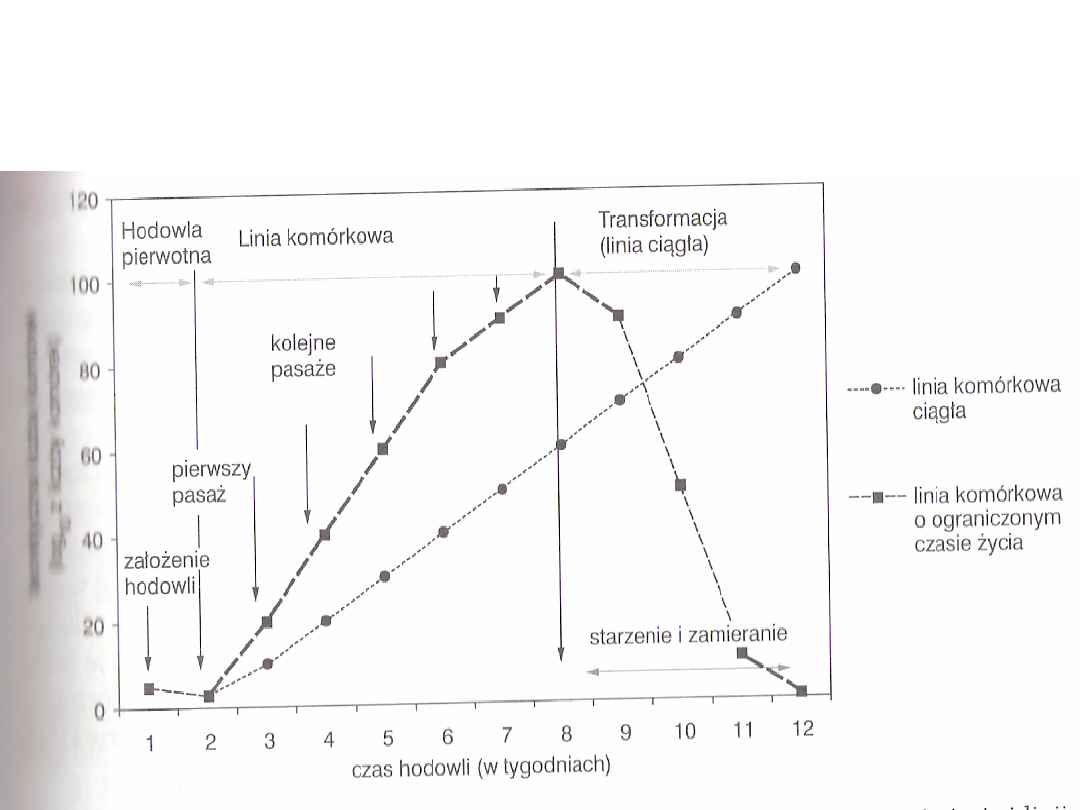
Krzywa wyprowadzania i wzrostu linii
komórkowej o ograniczonym czasie życia i
linii ciągłej

Ocena wzrostu komórek
w hodowli
• Cykl wzrostu komórek w hodowli
in vitro dzieli się na 3 fazy
»Faza
lag
»Faza
log
»Faza
stacjonarna
(plateau)

Faza lag
•Rozpoczyna się
bezpośrednio po pasażu,
po wysianiu komórek

Faza lag
• Jest to okres adaptacji komórek (dotyczy
to również hodowli pierwotnych), podczas
którego komórki odbudowują elementy
glikokaliksu, czyli warstwy pokrywającej
od zewnątrz błonę komórkową
• Warstwa ta jest złożona głównie
z łańcuchów oligo- i
polisacharydowych; zostaje zniszczona
przez trypsynę podczas pasażowania

Faza lag
•W tej fazie komórki
przyczepiają się i
rozpłaszczają (w procesie
tym bierze udział
cytoszkielet)

Faza lag
•Komórki w tej fazie nie
dzielą się, a nawet ich liczba
może maleć, bo część
komórek zniszczonych nie
przyczepia się i obumiera w
tej fazie

Faza lag
• Wzrasta ilość enzymów, głównie
polimeraz DNA
• Komórki wchodzą w fazę G1
• Długość fazy lag jest różna dla
różnych typów komórek

Faza lag
•W przypadku wzrostu
komórek linii ciągłych
rosnących w
zawiesinie nie ma tej fazy

Faza log – faza
logarytmicznego wzrostu
• Czas największego wzrostu
komórek
• Komórki dzielą się intensywnie
(w czasie mitozy stają się
okrągłe i odrywają się
od podłoża, a po podziale ponownie
się przyklejają)

Faza log – faza
logarytmicznego wzrostu
•Faza ta kończy się jednym
lub dwoma podwojeniami
populacji komórek i
osiągnięciem konfluencji

Faza log – faza
logarytmicznego wzrostu
• Komórki w tej fazie cechuje duża
żywotność i wysokie tempo
metabolizmu
• Długość fazy log zależy od
gęstości wyjściowe hodowli

Faza stacjonarna
(plateau)
•Komórki osiągają
konfluencję i
przestają się dzielić

Faza stacjonarna
(plateau)
• W przypadku komórek
prawidłowych oznacza to, że cała
dostępna powierzchnia naczynia
jest zajęta, a więc
dochodzi do zahamowania
kontaktowego wzrostu

Faza stacjonarna
(plateau)
• Część komórek zaczyna umierać,
więc ilość komórek prawie się nie
zmnienia, sporadycznie obserwuje
się jeszcze podziały komórkowe
• Taka sama liczba komórek
proliferuje i umiera

Faza stacjonarna
(plateau)
•Taka hodowla
najszybciej
wykorzystuje medium

Faza stacjonarna
(plateau)
• Komórki wówczas trzeba
koniecznie przepasażować,
bo dłuższe przetrzymywanie
komórek w konfluencji może
doprowadzić do
transformacji, albo do wyjścia
komórek z cyklu wejścia
w fazę G0

Komórek w fazie G
0
nie
da się pasażować, taka
hodowla obumiera

Najlepiej jest pasażować
komórki przed
osiągnięciem konfluencji,
czyli przy tzw.
semikonfluencji, kiedy
wciąż są one jeszcze w
fazie logarytmicznego
wzrostu

Banki linii komórkowych
• Na świecie istnieją tzw. BANKI
LINII KOMÓRKOWYCH, gzie
można zakupić wiele uzyskanych
i scharakteryzowanych linii
komórkowych

Banki linii komórkowych
• Europejska Kolekcja Hodowli
Komórkowych (ECAEE – The
European Collection of Cell
Cultures) – Wielka
Brytania, 1984
• Amerykańska Kolekcja Hodowli
Komórkowych (ATCC)

Przeciwciała
monoklonalne

Hybrydomy
• Powstają przez fuzję komórki
nowotworowej mysiej linii
szpiczaka z limfocytami B
pochodzącymi ze śledziony
myszy immunizowanej
określonym antygenem

Hybrydoma
• Dziedziczy
nieśmiertelność
, czyli
zdolność do stałej proliferacji po
komórce szpiczaka, natomiast
zdolność do produkcji przeciwciał
skierowanych przeciw
antygenowi, którym uczulono
myszy dziedziczy po uczulonym
limfocycie B
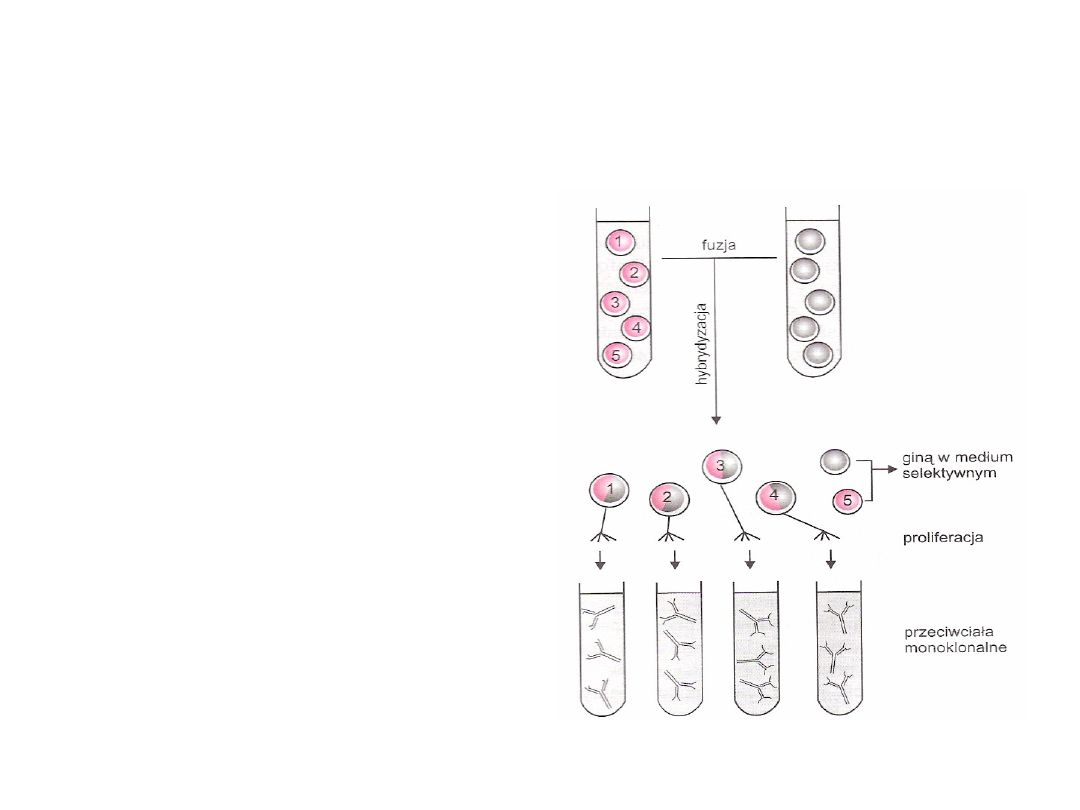
Otrzymywanie przeciwciał
monoklonalnych
• Swoistość
przeciwciał
określa limfocyt
B
• Komórka
szpiczaka nadaje
hybrydzie
nieśmiertelność

Wydajność metod (np. z
użyciem glikolu
polietylenowego PEG)
prowadzących do fuzji wynosi
1 – 3%, to znaczy, że
na 100 reagujących komórek
nie więcej niż 3 utworzą
hybrydę

Przeżycie komórek hybrydoma w
hodowli warunkuje dostarczenie
przez limfocyt B transferazy
fosforybozylu hipoksantyny
(HGPRT) lub kinazy tymidynowej
(TK), koniecznych do syntezy
DNA, a brakujących w komórkach
szpiczaka

Zastosowanie pożywek
selektywnych zawierających
hipoksantynę i tymidynę
pozwala na wzrost komórek
hybrydoma, natomiast komórki
szpiczaka i limfocyty B, które nie
podległy fuzji obumieraj

Komórki hybrydoma
proliferują nieograniczenie
długo w
hodowli, zachowując stałą
zdolność produkcji
określonego przeciwciała

Przeciwciała chimeryczne
• PM chimerowe mysio/ludzkie, w
którym tylko fragmenty F(ab)
pozostały mysie, natomiast
pozostała część cząsteczki
zawierająca zarówno fragmenty
łańcucha ciężkiego jak i lekkiego
pochodziła z cząsteczki
immunoglobuliny ludzkiej

Przeciwciało
chimeryczne
•Wykazywało dłuższy t
0.5
w krążeniu i
zmniejszoną
antygenowość

PM humanizowane
• Przeniesienie na cząsteczkę
ludzkiej immunoglobuliny
jedynie niewielkich fragmentów
części hiperzmiennej fragmentu
F(ab) mysiej immunoglobuliny
doprowadziło do powstania
humanizowanych PM
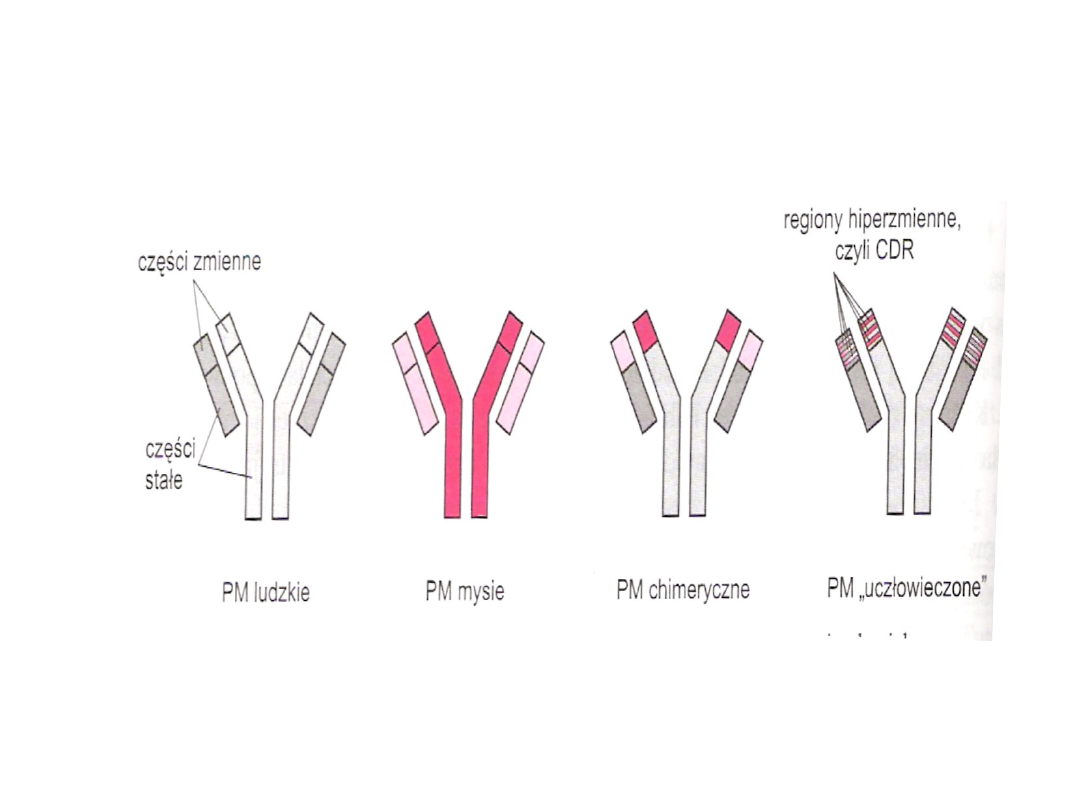
PM chimeryczne i uczłowieczone

PM ludzkie
• Są też sposoby uzyskiwania
ludzkich PM; jest to trudna
proceduta
• Hybrydyzacja z użyciem ludzkich
limfocytów B wiąże się z
trudnościami uzyskiwania
produkcji przeciwciał o wysokiej
selektywności

PM ludzkie
• Jedną z metod otrzymywania
ludzkich PM jest
wykorzystanie
transgenicznych szczepów
myszy

PM -
szczegółowo

PM
• Uzyskiwanie PM
• Hodowla hybrydoma
• Oczyszczanie uzyskanych PM

Metoda uzyskiwania PM
• Uczulanie myszy i pobieranie
komórek śledziony
• Hodowla komórek plasmocytoma
• Przygotowanie roztworu PEG
• Przeprowadzenie fuzji komórek
• Podłoża selaktywne i ich działanie
• Selekcja klonów i kontrola
produkcji PM

Uczulanie myszy i
pobieranie komórek
śledziony
• Sposób uczulania zwierząt zależy
od typu antygenu, jego
antygenowości oraz
eksperymentalnych schematów
uczuleń wypracowanych w
danym laboratorium

Uczulanie myszy i
pobieranie komórek
śledziony
• Jako antygen stosuje się
zawiesinę wyizolowanych całych
komórek, które wykazują
ekspresję danej determinanty
(np. CD34, CD25), fragmentów
błony z danym
antygenem lub oczyszczony
antygen

Uczulanie myszy i
pobieranie komórek
śledziony
• Gdy antygenowość zawiesiny jest
wysoka to zwierzętom podaje się
dootrzewnowo przygotowaną
zawiesinę
• Jeżeli antygenowość np.
oczyszczonych antygenów jest niska,
to można wzmocnić odpowiedź
używając tzw. adjuwantów

Uczulanie myszy i
pobieranie komórek
śledziony
• Istnieje kilka różnych
adjuwantów; najczęściej
używany jest niepełny adjuwant
Freunda (lekka parafina i
emulgatory, tworzące po
procesie homogenizacji gęstą,
trwałą emulsję)

Uczulanie myszy i
pobieranie komórek
śledziony
• Adjuwanty spełniają rolę
depozytu antygenu, co zwiększa
antygenowość, jak i pozwala na
immunizację mniejszą ilością
antygenu (np. trudnego do
uzyskania)

Uczulanie myszy i
pobieranie komórek
śledziony
• Szczep mysi, który uczula się
antygenem powinien być
pokrewny lub ten sam, od
którego pochodzi linia
nowotworowa szpiczaka
(plasmocytoma) używana do
hybrydyzacji

Hodowla komórek
plasmocytoma
• Do hybrydyzacji wykorzystuje
się linie nowotworowe
szpiczaka (plasmocytoma lub
myeloma) mysiego

Hodowla komórek
plasmocytoma
• Linie te charakteryzują się
»Brakiem produkcji
patalogicznych
immunoglobulin
(paraprotein)
»Brakiem enzymu
transferazy fosforybozylu
hipoksantyny (HGPRT)
koniecznej do syntezy puryn

Hodowla komórek
plasmocytoma
• Brak produkcji paraprotein przez
komórki linii szpiczaka powoduje,
że komórki hybrydoma produkują
immunoglobuliny pochodzące
tylko z uczulonych
limfocytów B bez domieszki
paraprotein

Hodowla komórek
plasmocytoma
• Brak enzymu HGPRT pozwala na
wprowadzenie selektywnej pożywki
służącej do wyeliminowania z
hodowli niesfuzjowanych komórek
linii szpiczaka i pobudzenia wzrostu
komórek hybrydoma posiadających
ten enzym z materiału
genetycznego limfocytów B

Przygotowanie roztworu
glikolu polietylenowego
(PEG)
• Wykorzystanie glikolu
polietylenowego do fuzji opiera się
na jego właściwościach agregowania
komórek oraz modyfikowania błony
komórkowej tak, że w obrębie
warstw lipidowych tworzą się
cytoplazmatyczne mostki pomiędzy
komórkami

Przeprowadzenie fuzji
komórek
• Podstawowy cel fuzji komórek –
powstanie komórki
mieszańcowej, zawierającej
materiał genetycznych obu
partnerów

Przeprowadzenie fuzji
komórek
• Dziedziczy zdolność do produkcji
przeciwciał i do stałego wzrostu
• Fuzję komórek przeprowadza się
z udziałem PGE lub
przez elektrofuzję

Podłoża selektywne
• Eliminuje niesfuzjowane komórki
szpiczaka, które mogłyby
przerosnąć komórki hybrydoma
• Wspomagają proliferację
komórek hybrydoma, które
przeważnie mnożą się powoli i
słabo

Podłoża selektywne
• W technice tej wykorzystuje się
brak enzymu (HGPRT) w
komórkach szpiczaka nie
pozwalający im na wykorzystanie
hipoksantyny

Selekcja klonów i kontrola
produkcji PM
• Hodowla w miękkim agarze
polega na hodowli zawiesiny
komórek hybrydoma, a następnie
selekcji pojedynczych kolonii
hybrydoma

Selekcja klonów i kontrola
produkcji PM
• Metoda krańcowych rozcieńczeń
– polega na rozcieńczaniu
zawiesiny komórek hybrydoma,
tak aby w studzienkach były
pojedyncze komórki dające
początek koloniom (klonom)

Hodowla hybrydoma
• In vitro
• In vivo
• Hodowla laboratoryjna
i przemysłowa

Oczyszczanie uzyskanych
PM
• Precypitacja z użyciem
siarczanu amonu
• Filtracja w żelu
• Chromatografia jonowymienna
• Chromatografia powinowactwa

Zastosowanie PM
• Do celów naukowych
• Do diagnostyki
»Niedobory odporności
pierwotnej i wtórnej
»Schorzenia nowotworowe

Zastosowanie PM
• Do leczenia
»Schorzenia
nowotworowe
»Transplantologia
»Schorzenia
autoimmunizacyjne

Zastosowanie PM
• Techniki badawcze
wykorzystujące PM
»Immunohistochemia
»ELISA (enzyme-linked
immunoabsorbent assy)
»RIA (radioimmuno assy)
»Cytometria przepływowa

Rituksymab
• Przeciweciało monoklonalne
przeciwko antygenowi CD20
• Zastosowanie: chłoniaki
nieziarnicze, samoistna plamica
małopłytkowa

Rituksymab – działania
niepożądane
• Zespół uwalniania cytokin
(manifestuje się dusznością,
skurczem oskrzeli, gorączką,
dreszczami i obrzękiem
naczynioruchowym
• Zespół rozpadu guza

Rituksymab – działania
niepożądane
• Zespół rozpadu guza – to
zagrażający życiu zespół
zaburzeń metabolicznych
wynikających z szybkiego
rozpadu komórek
nowotworowych

Zespół rozpadu guza
• Nagły rozpad komórek
nowotworowych powoduje
uwalnianie dużych ilości K
+
,
puryn pochodzących z kwasów
nukleinowych (metabolizowanych
w wątrobie do kwasu
moczowego) i
fosforanów

Rituksymab – działania
niepożądane
• Zespół rozpadu guza – to
zagrażający życiu zespół
zaburzeń metabolicznych
wynikających z szybkiego
rozpadu komórek
nowotworowych

Zespół rozpadu guza
• Skutkiem jest kwasica
metaboliczna, hiperkalemia,
hiperurykemia
i hiperfosfatemia
• Fosforany wiążą we krwi jony Ca
2+
,
co prowadzi do hipokalcemii

Rituksymab – działania
niepożądane
• Zespół rozpadu guza – to
zagrażający życiu zespół
zaburzeń metabolicznych
wynikających z szybkiego
rozpadu komórek
nowotworowych

Zespół rozpadu guza
• Dochodzi do wytrącenia się
kryształów kwasu moczowego (w
cewkach nerkowych, cewkach
zbiorczych i drogach
moczowych) i Ca
3
(PO
4
)
2
(w
cewkach nerkowych i w miąższu
nerek), czego skutkiem może być
ostra niewydolność nerek

Rituksymab – działania
niepożądane
• Reakcje anafilaktyczne
• Zaostrzenie choroby wieńcowej lub
niewydolności serca
• Zaostrzenie przewlekłego
wirusowego zapalenia wątroby typu
B prowadzące do ostrej
niewydolności wątroby

Rituksymab
• Przed podaniem leku zaleca się
premedykację z użyciem leku
przeciwgorączkowego
i
przeciwhistaminowego (np.
paracetamol i difenhydramina)
oraz rozważenie premedykacji
glikokortykosteroidami

Trastuzumab
• Przeciwciało przeciwko
receptorowi ludzkiego
naskórkowego czynnika wzrostu
typu 2 (human epidermal growth
factor receptor type 2 – HER2)

Trastuzumab -
zastosowanie
•Rak piersi ze stwierdzoną
nadekspresją receptora
HER2

Trastuzumab – działania
niepożądane
• Reakcja anafilaktyczna
• Ostra niewydolność serca
(ryzyko kardiotoksyczności jest
duże w razie skojarzenia z
antracyklinami)

Trastuzumab
• Konieczna jest ocena
kardiologiczna chorego przed
leczeniem i w trakcie
stosowania leku
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
- Slide 41
- Slide 42
- Slide 43
- Slide 44
- Slide 45
- Slide 46
- Slide 47
- Slide 48
- Slide 49
- Slide 50
- Slide 51
- Slide 52
- Slide 53
- Slide 54
- Slide 55
- Slide 56
- Slide 57
- Slide 58
- Slide 59
- Slide 60
- Slide 61
- Slide 62
- Slide 63
- Slide 64
- Slide 65
- Slide 66
- Slide 67
- Slide 68
- Slide 69
- Slide 70
- Slide 71
- Slide 72
- Slide 73
- Slide 74
- Slide 75
- Slide 76
- Slide 77
- Slide 78
- Slide 79
- Slide 80
- Slide 81
- Slide 82
- Slide 83
- Slide 84
Wyszukiwarka
Podobne podstrony:
Przeciwciała monoklonalne3
ćw 3 PRZECIWCIAŁA MONOKLONALNE
przeciwciała monoklonalne
Przeciwciała monoklonalne, II rok, II rok CM UMK, Giełdy, 2 rok od Pawła, 2 semestr, immunologia, ma
PRZECIWCIAŁA MONOKLONALNE 2
Przeciwciała monoklonalne, biotechnologia Sem 5 Olsztyn, III rok, III rok BARDZO DOBRE !!!!
3. Przeciwciała monoklonane, Immunologia, immunologia 2016
przeciwciała monoklonalne(2)
Przeciwciała monoklonalne (PM)
Przeciwciałami monoklonalnymi, Farmacja materialy, Biotechnologia
Przeciwciała monoklonalne
przeciwciała monoklonalne
Przeciwciała monoklonalne3
ćw 3 PRZECIWCIAŁA MONOKLONALNE
Przeciwciała monoklonalne
Wykł 9 Kult 2010 Przeciwciała monoklonalne
PRZECIWCIAŁA MONOKLONALNE prezentacja 2010
Instrukcja demontażu reflektora przeciwmgielnego Citroen C5 MK III 2008 (1)
więcej podobnych podstron