
PRZECIWCIAŁA
MONOKLONALNE
1.
Wstęp.
2.
Co to są przeciwciała monoklonalne?
3.
Produkcja przeciwciał monoklonalnych.
4.
Mianownictwo przeciwciał monoklonalnych
5.
Mechanizmy działanie PM.
6.
Zastosowanie PM.
7.
Główne problemy terapii z użyciem PM.
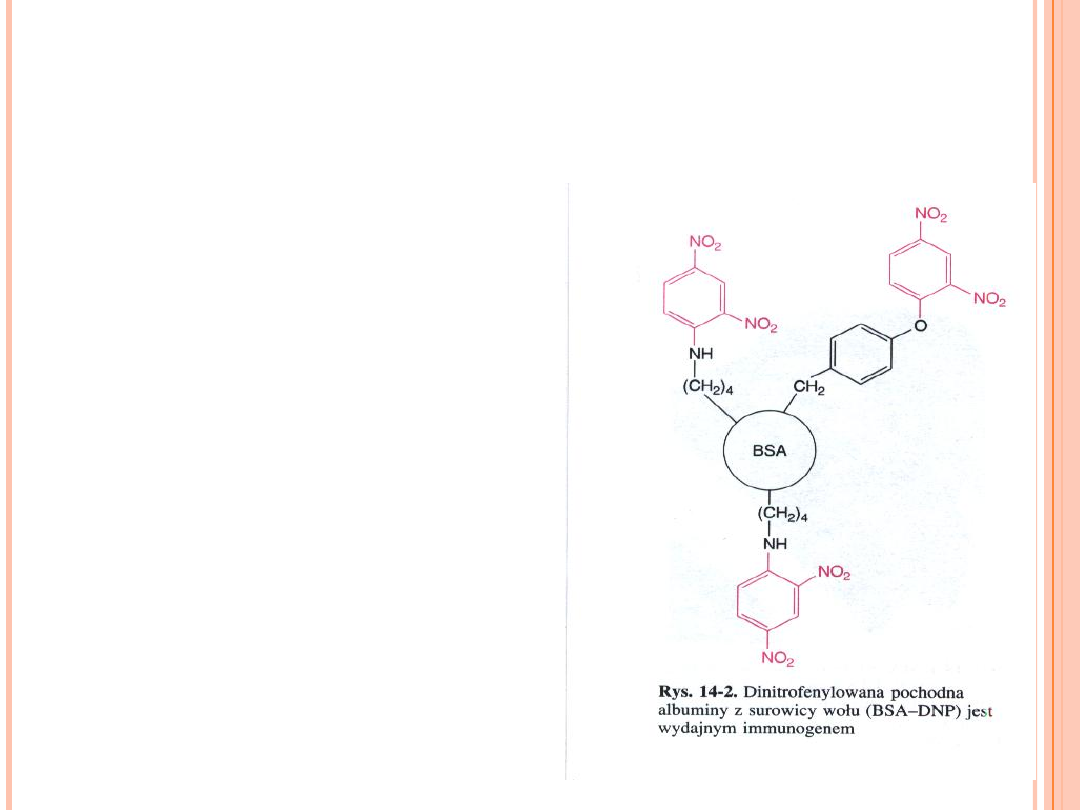
CO TO SĄ PRZECIWCIAŁA
MONOKLONALNE?
Cząsteczki przeciwciał o tej
samej swoistości są normalnie
heterogenne, ponieważ
pochodzą z różnych linii
komórek wytwarzających
przeciwciała.
Heterogenność jest przeszkodą
w wyjaśnianiu mechanizmów
procesów biologicznych.
Pierwsze trudności pokonano
dzięki wykorzystaniu komórek
szpiczaka mnogiego,
wytwarzających przeciwciała.
Szpiczak mnogi
charakteryzuje się tym, że pojedynczy,
zmieniony limfocyt lub komórka plazmatyczna dzieli
się w niekontrolowany sposób.
W rezultacie powstaje bardzo wiele komórek jednego
rodzaju.
Komórki te stanowią
klon
, ponieważ pochodzą od
jednej komórki i maja identyczne właściwości.
Nowotwór wytwarza zatem duże ilości przeciwciał
jednego rodzaju. Przeciwciała wytwarzane przez klon
komórek szpiczaka są normalnie pod względem
struktury
homogenne
.
Szpiczak może być przeszczepiony od jednej myszy do
drugiej, gdzie kontynuuje namnażanie.
Komórki nowotworowe wytwarzające
przeciwciała dają
ten sam
rodzaj
przeciwciał, pokolenie po pokoleniu.
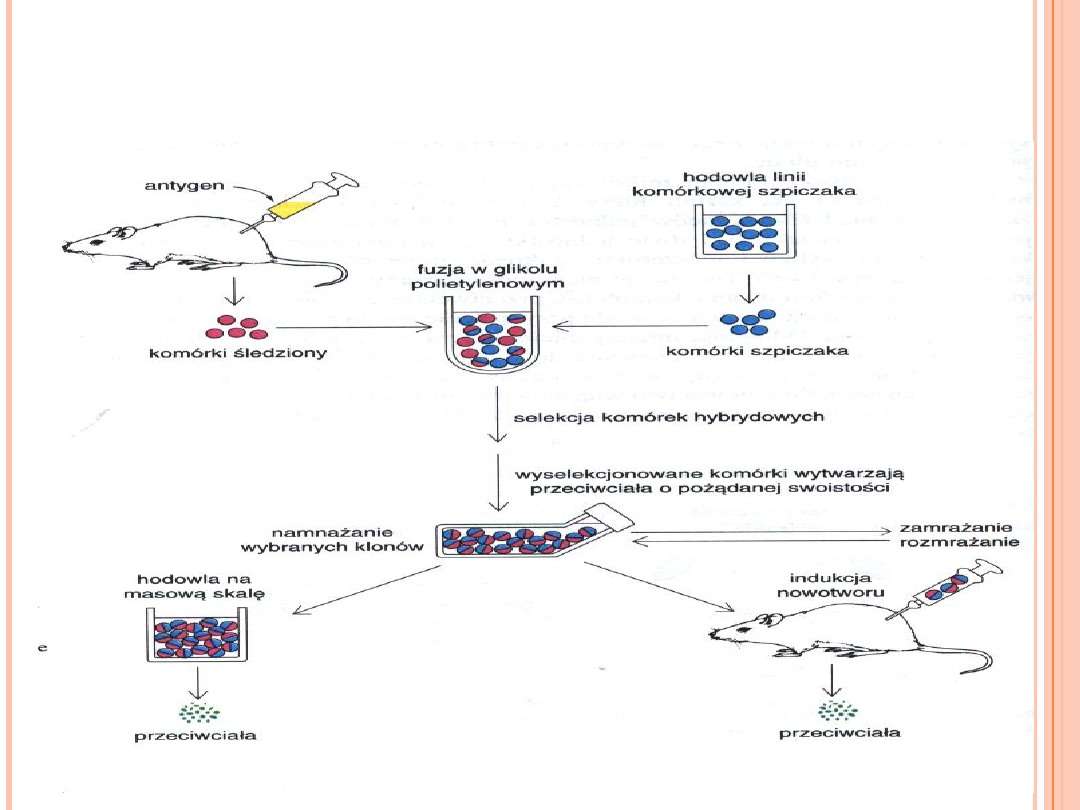
PRODUKCJA PRZECIWCIAŁ
MONOKLONALNYCH

Ograniczeniem w badaniu immunoglobulin wytwarzanych
przez komórki szpiczaka jest to, że odpowiadający im
antygen przeważnie nie jest znany.
W roku 1975 C.Milstein i G.Kohler odkryli, że wielką ilość
monoklonalnych przeciwciał
o niemal każdej swoistości
można uzyskać dzięki fuzji komórek wytwarzających
przeciwciała z komórkami szpiczaka.
Immunizuje się mysz antygenem i po kilku tygodniach
pobiera się od niej śledzionę.
Mieszaninę limfocytów i komórek plazmatycznych ze
śledziony poddaje się in vitro fuzji z komórkami szpiczaka.
Każda z powstałych komórek hybrydowych, zwanych
komórkami hybrydoma
, stale wytwarza homogenne
przeciwciała o swoistości określonej przez macierzystą
komórkę śledziony.
Powstałą populacje komórek hybrydoma przeszukuje się w
celu wyselekcjonowania komórek wytwarzających
przeciwciała o pożądanej swoistości.
Komórki dające oczekiwane przeciwciała można namnażać
in vitro lub wszczepiać myszom w celu wywołania szpiczaka.
Komórki te można również zamrażać i przechowywać przez
dłuższy czas.

MIANOWNICTWO PRZECIWCIAŁ
MONOKLONALNYCH
Na świecie istnieje kilkadziesiąt firm i koncernów biotechnologicznych tworzących PM z
zamiarem testowania ich w klinice. Pierwotnie tworzone PM miały (i często mają) różne
nazwy i identyfikacyjne skróty, nic nie mówiące o charakterze przeciwciała.
Od pewnego czasu istnieją zalecenia nadawania nazw PM, określające ich biologiczną rolę
oraz źródło. Podstawowym zaleceniem jest użycie w nazwie PM lub produktu wywodzącego
się z PM końcówki -mab, poprzedzonej jedno - lub dwuliterową wstawką, charakteryzującą
źródło (charakter) przeciwciała.
Końcówka:
- -ximab - mówi, że przeciwciało jest chimeryczne (najczęściej mysie-ludzkie) (np. rituximab),
- -zumab - wskazuje, że przeciwciało jest humanizowane (np. trastuzumab).
Ponadto aprobuje się, by potencjalna dziedzina zastosowania (lub tkankowe
oddziaływanie) PM była zakodowana w nazwie przeciwciała poprzez wstawienie dwóch lub
trzech liter przed końcem nazwy. Proponowane wstawki to:
- -vir-lub -vi - dla PM stosowanych w kontekście zakażeń wirusowych (np. palivizumab),
- -bac - lub -ba - dla PM stosowanych w zakażeniach bakteryjnych (np. nebacumab).
Dodatkowe zalecenia dotyczą kodowania w nazwie PM nowotworu docelowego, poprzez
użycie podstawnika zamiennego w miejsce wstawki -tum-. Wstawka -col- lub -co- jest
rezerwowana dla raka okrężnicy (np. edrecolomab), analogicznie -mel- - dla czerniaka, -mar-
- dla raka sutka.
Uznaje się za wskazane ujawnianie w nazwie PM także dodatkowych przyrostków, skrótów
toksyn,
nazw izotopów itp., w zależności od modyfikacji PM.

MECHANIZMY DZIAŁANIA PM
PM, podobnie jak przeciwciała zwykłe, oprócz
wysoce wybiórczej zdolności reagowania z
antygenem, angażują różne mechanizmy
efektorowe, których celem ostatecznym
jest
eliminacja
rozpoznawanej struktury
docelowej lub komórki.
Największe nadzieje wiązano z użyciem PM w
leczeniu nowotworów i w istocie najwięcej
zaaprobowanych w medycynie PM i
najwięcej prób klinicznych z użyciem PM
dotyczy onkologii. Wiążąc się z
odpowiednią cząsteczką (np. antygenem
związanym z nowotworem), PM mogą
niszczyć komórki nowotworowe
bezpośrednio:
- blokując receptor dla czynników wzrostu,
niezbędny do proliferacji komórek nowotworowych
-aktywując dopełniacz
- uczestnicząc w zjawisku cytotoksyczności
komórkowej zależnej od przeciwciał (ADCC)
- aktywując za pośrednictwem odpowiedniej
cząsteczki szlak apoptozy
-hamując rozwój w nim naczyń krwionośnych po
zablokowaniu receptora dla czynnika wzrostu
śródbłonka

ZASTOSOWANIE PRZECIWCIAŁ
MONOKLONALNYCH
Opracowanie metod produkcji przeciwciał monoklonalnych
metodą hybrydoma otworzyło nowe perspektywy badań w
biologii i medycynie.
Możliwa jest produkcja dużej ilości homogennych przeciwciał o
dokładnie określonej swoistości.
Przeciwciała monoklonalne służą też jako precyzyjne
odczynniki analityczne i preparatywna.
Transfuzje krwii stały się bezpieczniejsze po zastosowaniu
przeciwciał do sprawdzania krwii dawcy na obecność w niej
wirusów powodujących AIDS, żółtaczkę i innne chioroby
zakaźne.
Ocenia się również możliwość użycia PM do leczenia raka.
Co więcej,dzięki ogromnej różnorodności immunoglobulin,
można wytworzyć katalityczne przeciwciała o właściwościach
nie spotykanych wśród naturalnie występujących enzymów.

1.TRADYCYJNE PRZECIWCIAŁA
MONOKLONALNE
Kliniczne zastosowanie znalazły już PM przeciw cytomegalowirusowi, przeciw bakteriom:
Psudomonas aeruginosa, Escherichia coli i Klebsiella pneumoniae
PM są używane do wykrywania i określania stężeń leków, hormonów, enzymów, nawet
jeżeli występują one bardzo małych ilościach w płynach tkankowych
PM usprawniają również diagnostykę chorób zakaźnych. Dysponując przeciwciałami
przeciw określonym mikroorganizmom można skrócić czas potrzebny do wykrywania ich
obecności z kilku dni do kilku minut
Jednymi z najczęściej używanych PM są OKT3 skierowane przeciwko przeciw cząsteczkom
CD3 na limfocytach T. Indukując pobudzenie, a następnie niszczenie limfocytów T
wywołują one immunosupresję, czyli zmniejszenie reaktywności immunologicznej, co
wykorzystuje się np. w przeciwdziałaniu odrzucaniu przeszczepów
Odpowiednio wyznakowane PM przecie miozynie próbuje się stosować do dokładnego
umiejscawiania zawału serca
Fragmenty Fab PM przeciw digoksynie znalazły zastosowanie do leczenia zagrażającego
życiu zatrucia glikozydami naparstnicy

2.IMMUNOTOKSYNY
Immunotoksyny
powstają przez połączenie chemicznego przeciwciała z
jakąś toksyną. Do produkcji I. zastosowano najskuteczniejsze toksyny: roślinne,
bakteryjne, grzybowe. Niektóre z nich, np. rycyna, dyfterotoksyna, wykazują
ogromną aktywność, gdyż do zabicia komórki zdolna jest nawet jedna
cząsteczka toksyny.
Do zastosowania I. należy:
-usuwanie komórek białaczkowych ze szpiku autogennego przed
przeszczepianiem
-leczenie nowotworów
Z PM przeciwnowotworowymi sprzęga się różne leki przeciwnowotworowe
lub enzymy mające właściwości aktywowania nieczynnego proleku w aktywny
lek przeciwnowotworowy.
Można również PM opłaszczać liposomy wypełnione odpowiednim lekiem i
PM naprowadzaja te liposomy do właściwych tkanek i komórek.
Z kolei PM przeciw włóknikowi połączone z aktywatorem plazminogenu
mogą znaleźć zastosowanie w likwidacji zakrzepów w naczyniach krwionośych.

3.KONIUGATY PM Z
RADIOIZOTOPAMI
Ogólnie do celów diagnostyki używa się koniugatów z radioizotopami
emitującymi cząsteczki gamma, a w terapii nowotworów koniugatów z
radioizotopamii emitującymi cząsteczki beta.
Do umiejscawiania nawet małych ognisk nowotworowych używa się PM
przeciwnowotworowych sprzężonych z radioizotopamii.Metoda ta umożliwia
wykrywanie rozmieszczenia w organizmie ognisk nowotworowych.
Opracowano bardzo czułą metodę śródoperacyjnego wykrywania przerzutów
nowotworowych w obrębie jamy brzusznej z użyciem ręcznie sterowanego
detektora promienni gamma. Można go przesuwać bezpośrednio po
powierzchni narządów wewnętrznych i wykrywać ogniska niewykrywalne
innymi metodami.
Przeciwciała sprzężane z radioizotopamii próbuje się również stosować do
leczenia nowotworów. Atutem ich, w przypadku prób leczenia nowotworów
litych, jest zdolność do zabijania komórek oddalonych nawet o kilkadziesiąt
pokładów komórek od miejsc ich wiązania.

4.PRZECIWCIAŁA O PODWÓJNEJ
SWOISTOŚCI
Przeciwciała o podwójnej swoistości można uzyskać sprzęgając
chemicznie dwa różne przeciwciała. Chemicznie można również połączyć
fragmenty Fab pochodzące od różnych przeciwciał.PPS można też
wyprodukoać w tzw. podwójnych hybrydach, czyli hybrydach hybryd
(kwadroma) . Powstaja one w procesie fuzji dwóch hybryd, z których
każda wytwarza PM innej swoistości. Każdy z dwóch fragmentów Fab
takiego przeciwciała wiąże inny antygen. Jeden fragment może np.
wiązać komórkę nowotworową, a drugi toksynę.
PPS próbuje się już stosować w klinice, m.in. do leczenia: raka jajnika,
sutka, glejaków, ostrej białaczki szpikowej.
PPS można również stosować w szczepionkach. Wówczas jeden fragment
Fab wiąże antygen, przeciw któremu chcemy immmunizować organizm,
a drugi fragment Fab jest skierowany przeciw komórkom prezentującym
antygen.Ułatwia to odpowiedź na dany antygen.
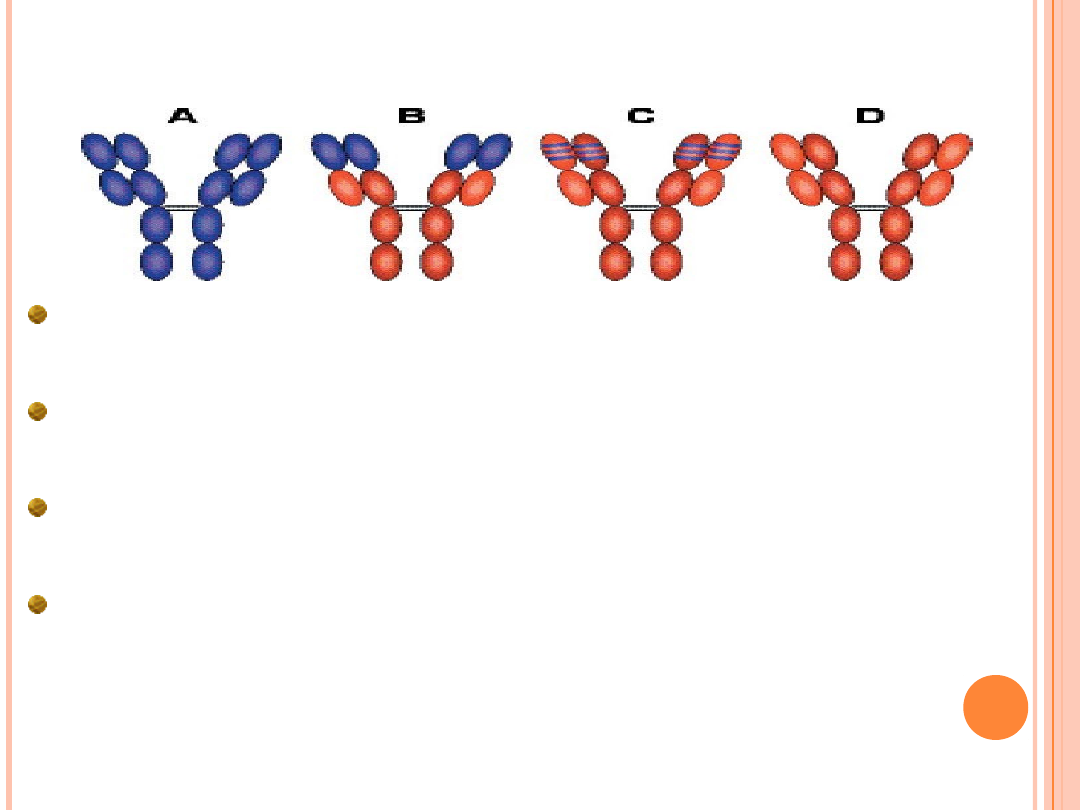
5.PRZECIWCIAŁA CHIMERYCZNE
Większość PM jest pochodzenia mysiego. Podawanie ich ludziom wywołuje odpowiedź
immunologiczną przeciw obcogatunkowemu białku, która ogranicza ich efektywność. Z pomocą
przyszła inżynieria genetyczna.
Można skonstruować geny immunoglobularne,których część V pochodzi od myszy, a część C od
człowieka.Udało się nawet otrzymać takie geny, których tylko sekwencje kodujące regiony
hiperzmienne pochodzą do myszy, a reszta genu od człowieka.
PM, których części zmienne łańcuchów H i L pochodzą od myszy, a części stałe od człowieka,
nazywamy tradycyjnie chimerycznymi, natomiast takie PM, których regiony hiperzmienne
pochodzą od myszy, a pozostałe sekwencje od człowieka, przyjęto nazywać „uczłowieczonymi” .
PCH nie wywołując przeciw sobie efektywnej odpowiedzi immunologicznej nie są szybko
eliminowane z krążenia. U ludzi znalazły one zastosowanie w :
-PCH anty-CD20 podaje się pacjentom z chłoniakami nieziarnyczymi
-otrzymano również PCH przeciw produktowi protoonkogenu HER-2/neu, który podlega
amplifikacji w niektórych nowotworach

6. PRZECIWCIAŁA
KATALITYCZNE
Choć w warunkach naturalnych przeciwciała nie spełniają funkcji enzymów,
to ich dopasowanie do antygenu przypomina dopasowanie enzymu do
substratu.
Udało się otrzymać przeciwciała, które stabilizują stan przejściowy
zmniejszając energię aktywacji danej reakcji chemicznej, przyspieszając ją
nawet milion razy. Noszą one nazwę abzymów lub przeciwciał katalitycznych.
Otrzymano już abzymy mające właściwości hydrolityczne (proteaz, lipaz), a
także zachowujące się jak specyficzne transferazy i ligazy.
Otrzymuje się je przez:
- uczulanie cząsteczek będącymi analogami stanu przejściowego określonej
reakcji chemicznej
- ukierunkowane mutacje w genach immunoglobularnych

7. PRZECIWCIAŁA
ANTYGENIZOWANE
Strategiczne znaczenie trzeciego regionu hiperzmiennego
łańcucha H immunoglobulin (CDR3) w wiązaniu antygenu
zależy m.in. od jego mobilności i dostępności do substancji
obecnych w roztworze, w którym znajduje się przeciwciało.
Okazało się, że jeżeli mało immunogenny epitop wbudować w
ten region, to staje się on bardziej immunogenny i skuteczniej
immunizuje zwierzęta.Takie przeciwciało z wbudowanym w
region CDR3 epitopem jakiegoś antygenu nazywamy właśnie
przeciwciałem antygenizowanym.
Otrzymuje się je wprowadzając do genu dla łańcuch ciężkiego
gen kodujacy dany epitop i uzyskuje ekspresję przeciwciała w
odpowiednich komórkach.

GŁÓWNE PROBLEMY TERAPII Z UŻYCIEM
PM
Mimo wielu zalet przeciwciał monoklonalnych ich użycie sprawia pewne
problemy. Wiąże się to z następującymi zagadnieniami:
ze względu na trudność w pozyskaniu i hodowli ludzkich linii szpiczakowych
oraz etyczne przeszkody w immunizacji ludzi do fuzji używa się komórek
mysich. Powoduje to, że produkowane są mysie przeciwciała, mogące
wywołać reakcję ludzkiego układu odpornościowego. Problem ten jest
rozwiązywany przez przeciwciała chimeryczne i "uczłowieczone". Próbuje się
także uzyskać transgeniczne myszy z wprowadzonymi ludzkimi genami dla
przeciwciał.
immunotoksyny mogą przypadkowo uszkadzać inne komórki organizmu, nie
tylko te, które są ich celem. Tutaj próbuje się unieszkodliwiać toksyny w ten
sposób, aby mogły działać jedynie na komórki, z którymi przeciwciało się
łączy swoiście. Stosuje się także immunotoksyny bazujące na przeciwciałach
o podwójnej swoistości, przeciwko np. dwóm różnym antygenom
nowotworowym.
przeciwciała monoklonalne są dużymi cząsteczkami i dlatego bardzo powoli
migrują do tkanek. Problem ten jest rozwiązywany przez próby wiązania
toksyn i leków z częściami zmiennymi przeciwciał.
otrzymywanie przeciwciał monoklonalnych wymaga stosunkowo dużych
nakładów finansowych, jednak rozwój inżynieriigenetycznej z pewnością
doprowadzi do znacznego zmniejszenia kosztów.
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
Wyszukiwarka
Podobne podstrony:
Przeciwciała monoklonalne3
cw 5 przeciwbólowe i msc znieczulające
Linie komórkowe i przeciwciała monoklonalne, 2008
przeciwciała monoklonalne
Przeciwciała monoklonalne, II rok, II rok CM UMK, Giełdy, 2 rok od Pawła, 2 semestr, immunologia, ma
PRZECIWCIAŁA MONOKLONALNE 2
Przeciwciała monoklonalne, biotechnologia Sem 5 Olsztyn, III rok, III rok BARDZO DOBRE !!!!
3. Przeciwciała monoklonane, Immunologia, immunologia 2016
przeciwciała monoklonalne(2)
Przeciwciała monoklonalne (PM)
Przeciwciałami monoklonalnymi, Farmacja materialy, Biotechnologia
Przeciwciała monoklonalne
przeciwciała monoklonalne
Przeciwciała monoklonalne3
Linie komórkowe i przeciwciała monoklonalne, 2008
Przeciwciała monoklonalne
Wykł 9 Kult 2010 Przeciwciała monoklonalne
więcej podobnych podstron