BVD/MD
Wirus biegunki bydła
i choroby błon
śluzowych ( Bovine
Viral Diarrhea-
Mucosal Disease)

BVD/MD
jest jedną z głównych
chorób zakaźnych, która przyczynia
się do olbrzymich strat
produkcyjnych w nowoczesnym
chowie bydła. W wielu przypadkach
choroba przebiega bezobjawowo
lub wśród objawów mało
specyficznych, co nastręcza
trudności z jej rozpoznaniem
.

Czynnik etiologiczny:
Pestivirus z rodziny Flaviviridae
BVD
MD

Budowa morfologiczna:
Jednoniciowy, dodatnio spolaryzowany wirus
RNA
Kształt sferyczny
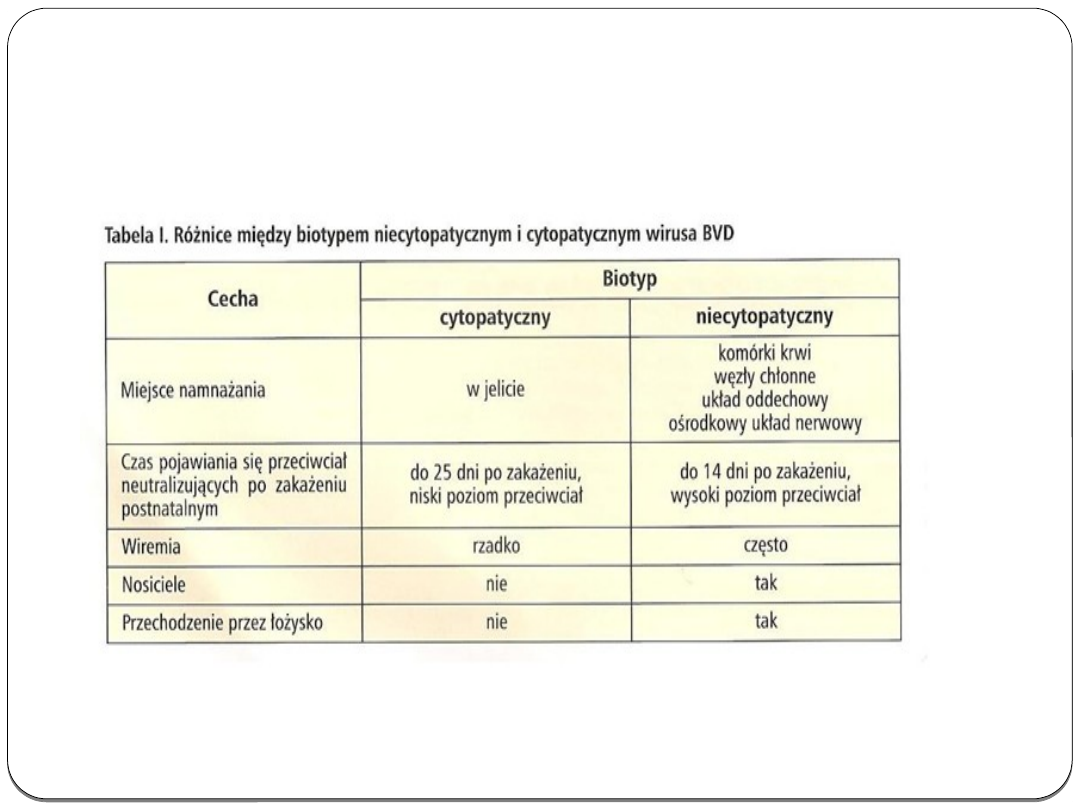
Występuje w dwóch biotypach (cytopatycznym i
niecytopatycznym) – różnicowanie jedynie w
hodowlach komórkowych
Bardzo wrażliwy na działanie środków
dezynfekcyjnych i działanie środków
powierzchniowo czynnych : preparaty
jodoforowe, związki fenolowe, aldehydy,
rozpuszczalniki organiczne
Wyróżniamy 2 biotypy wirusa BVD-
MD

Źródło wirusa:
I: zwierzęta zakażone trwale
wydalają wirus przez całe życie we
wszystkich wydalinach i wydzielinach
wysokie miano
transmisja :
a) kontakt bezpośredni (drogi oddechowe,
układ pokarmowy, kontakt płciowy)
b) pośredni (zabiegi weterynaryjne,
zootechniczne)

Źródło wirusa:
Otaczające powietrze
Wody płodowe
Skażone kojce
W Polsce obecność przeciwciał neutralizujących
wirus BVD-MD stwierdzono u 83% zwierząt. Gł.
bydło, ale można go stwierdzić też u owiec,
kóz, świń i dziko żyjących przeżuwaczy
(głównie sarny)

Źródło wirus:
II: zwierzęta w ostrej fazie zakażenia
Miano wydalanego wirusa jest niskie
Stwarzają minimalne ryzyko transmisji
wirusa
Wyjątek: kontakt z ciężarnymi samicami

Droga wirusa w organizmie
Pierwotnym miejscem namnażania- błona
śluzowa wokół miejsca wniknięcia.
Komórki docelowe- komórki limfoidalne
wyścielające jamę ustną, krtań oraz komórki
nabłonkowe mieszków migdałkowych.
Stamtąd wirus wędruje do krwi gdzie
występuje w stanie wolnym w osoczu lub w
stanie związanym z leukocytami (limfocyty,
monocyty). Wirus ma powinowactwo do
układu limfatycznego (w.chłonne szczególnie
kępki Peyera, grasica, śledziona)

Zakażenie ciężarnej samicy:
Najczęściej samica nie wykazuje objawów
klinicznych, jednak zakażenie w różnym stadium
rozwojowym płodu ma inny wpływ
immunologiczny i teratogenny.
I trymestr
I etap: płody we wczesnym stadiu rozwoju są
niewrażliwe. Wrażliwość pojawia się dopiero po
implantacji
II etap: 90-125 dnia infekcja dotyka
niedojrzałego immunologicznie płodu-
obumarcie i resorpcja

II etap: zakażenie niepatogennym biotypem
nie wpyłwa na rozwój, jednakże cielak taki
będzie stanowił rezerwuar wirusa, a w
późniejszym etpie życia zwierzęta takie
chorują na MD
II trymestr
płód nabywa immunokompetencji i zaczyna
aktywnie walczyć z wirusem. Zwierzęta takie
nie wykazują objawów klinicznych jeśli nie
doszło u nich do zaburzeń teratogennych.

Zaburzenia rozwoju płodu:
Infekcje między 80 a 150 dniem ciąży
najczęsciej prowadzą do zaburzeń
teratogennych dotyczących przede wszystkim
OUN i oczu. Oprócz w/w zaburzeń można
obserwować liczne wady rozwojowe
wynikające z wewnątrzmacicznego zakażenia
wirusem np: hipoplazja grasicy, skrócenia
żuchwy. Niejednokrotnie dochodzi też do
obumarcia płodu i poronienia, mumifikacji
między 100 a 180 dniem ciąży.

ZESTAWIENIE BVD i MD
Okres inkubacji 7dni
14 dni
Biegunka: kał płynny z domieszką
krwi, włóknika
Biegunka słabiej wyrażona, z
domieszką śluzu, ew.krwi
Zmiany zapalne błony śluzowej
jamy ustnej
Zmiany zapalne błony śluzowej
jamy ustnej, wyraźniejsze zmiany
w jelitach
Zapalenie spojówek, skąpy
wypływ z nosa, ślinienie
Narastający wypływ surowiczo-
śluzowy z nosa (strupy na
śluzawicy)
Szerzy się w stadzie bardzo
szybko – dotyczyć może nawet
100% pogłowia
Niska zakaźność i zachorowalność
Niska śmiertelność – do kilku
procent
Śmiertelność nawet do 90%
Leukocytoza nie jest wyraźna
Silna lukocytoza
BVD
MD

Obraz kliniczny
Po pojawieniu się BVD/MD w stadzie
seronegatywnym dochodzi do rozwoju
następujących objawów:
Wzrost odsetka nieskutecznych kryć
Ronienia
Porody słabych cieląt lub z wadami rozwojowymi
Podwyższona śmiertelność cieląt
Pierwsze przypadki choroby błon śluzowych
zwierząt

Postacie
Łagodna, subkliniczna wirusowa biegunka- przemijająca
gorączka, leukopenia, biegunki i serokonwersja.
Zespół krwotoczny (syndrom hemoragiczny)- znaczna
trombocytopenia, krwawa biegunka i wyciek z nosa,
wybroczynowość na błonach śluzowych oraz krwawienia z
miejsc injekcji.
Trwałe zakażenie (persistent infection- PI)- 93% cieląt
rodzą jałówki i krowy, które przechorowały zakażenie
wirusem, 7% cieląt rodzą matki zakażone trwale.
Charakteryzują je: permanentna wiremia, stałe wydalanie
wirusa do środowiska, brak lub niskie miano przeciwciał
neutralizujących. Z reguły brak objawów klinicznych lub
wolniejsze przyrosty. Wskaźnik zejść śmiertelnych w
pierwszym roku życia, może przekraczać 50%.

Postać ostra choroby
Charakteryzuje się:
Brak łaknienia
Osowienie
Osłabienie
Gorączka do 41 stopni
Na śluzawicy, brzegach dziąseł, jezyka, tylnej częsci
podniebienia twardego można stwierdzić zmiany
nadżerkowe
Z czasem dochodzi do wychudzenia, odwodnienia i
kwasicy.
Nadżerki pojawiają się także w szparze międzyracicznej
co doprowadza do kulawizny, a w konsekwencji
niechęci do poruszania się i zalegania zwierząt.

Postać ostra choroby:
W okresie 2, 3 dni od wystąpienia wcześniej
opisanych objawów klinicznych pojawia się
obfita, wodnista biegunka o nieprzyjemnym
zgniłym zapachu.
Zmniejszone przeżuwanie, w konsekwencji
czego mogą powstawać wzdęcia
Zejście śmiertelne następuje 3-10dnia od
pojawienia się pierwszych objawów
klinicznych.

Immunosupresyjny wpływ wirusa
zahamowanie produkcji interferonu, spadek
bezwzględnej liczby krążących limfocytów T
i B, zmniejszona produkcja przeciwciał
konsekwencją jest zwiększona podatność
organizmu na wtórne infekcje bakteryjne i
wirusowe oraz inwazje pasożytnicze
( Pasteurella spp. Salmonela spp. Wirus PI-
3, IBR/IPV, koronawirusy, rotawirusy,
coccidia).

Trwale zakażone zwierzę narażone na kontakt z
cytopatycznym biotypem wirusa BVD zostaje
nim nadkażone, co w konsekwencji prowadzić
może do śmiertelnej postaci choroby błon
śluzowych. Źródłem nadkażenia może być
mutacja wirusa w organizmie danego
zwierzęcia lub inne osobniki zakażone
zmutowanym biotypem wirusa. Od zwierząt z
chorobą błon śluzowych izoluje się biotyp
cytopatyczny i niecytopatyczny wirusa.
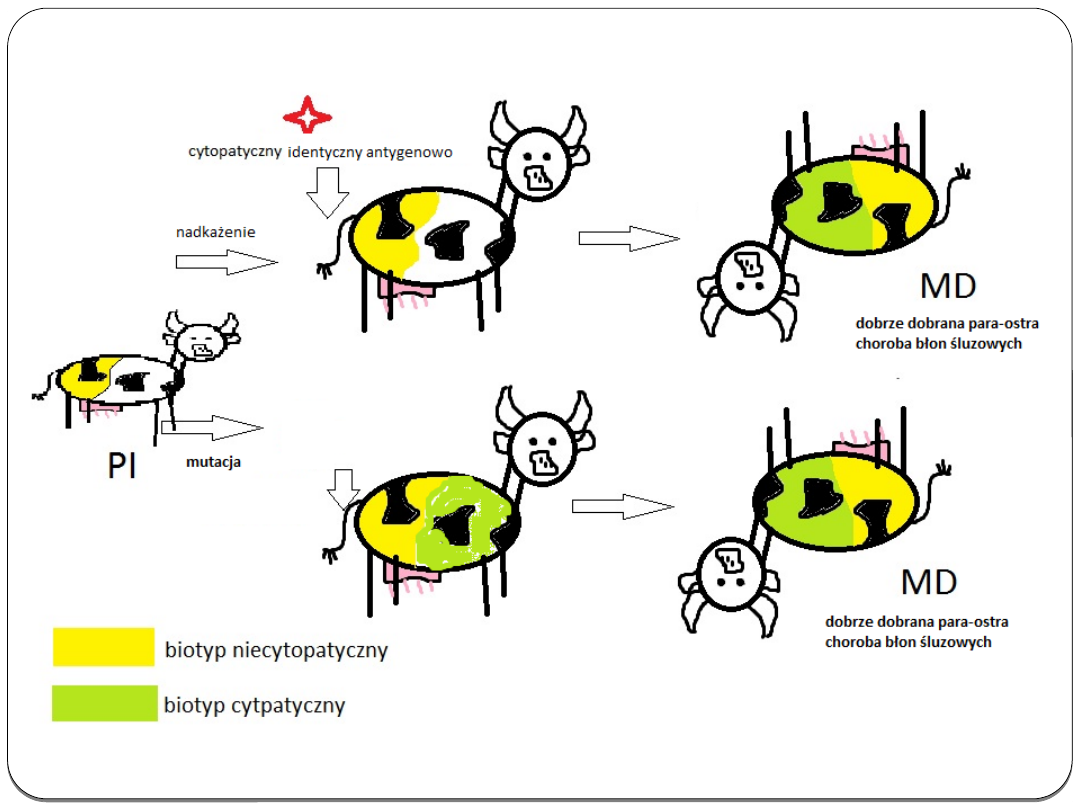
Rys.1

U trwale zakażonych zwierząt narażonych na
kontakt z częściowo homologicznym
cytopatycznym biotypem BVDV, może
rozwinąć się przewlekła choroba błon
śluzowych. Nadkażenie heterologicznym BVDV
trwale zakażonych zwierząt nie prowadzi do
rozwoju choroby b łon śluzowych lecz
powoduje powstanie odporności i produkcję
przeciwciał przeciwko tej formie wirusa.
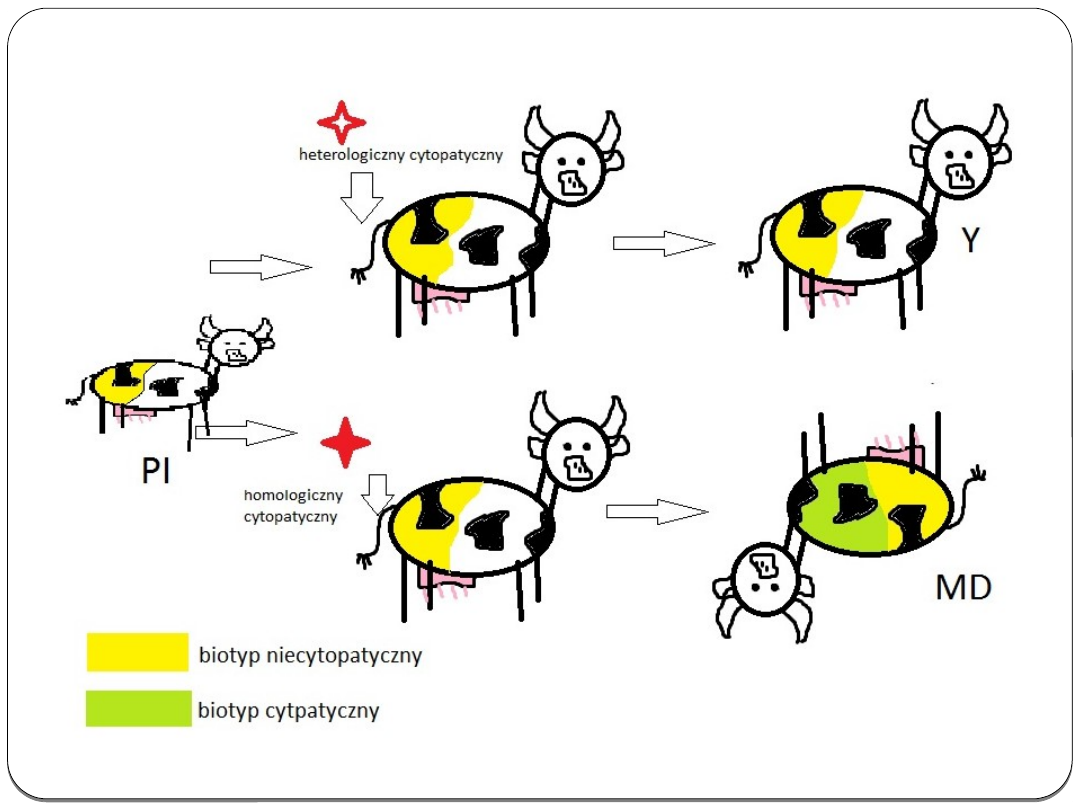
Rys. 2

Zmiany
anatomopatologiczne:
W obu przypadkach są bardzo podobne
U padłych zwierząt w błonie śluzowej jamy
ustnej znajdują się rozlane, nbieżutowe
zapalenia, drobne ogniska martwicowe,
czewrone nadżerki na śluzawicu, policzkach,
dziąsłach, pdłużne brudnobrązowe nadżerki
w przełyku.
Trawieniec przekrwiony, obrzękły, w błonie
śluzowej liczne płaskie owrzodzenia.
Podobne zmiany w jelitach+ dyfteroidalny
nalot

Zmiany
anatomopatologiczne:
Powiększone kępki Peyera-mogą ulegać
martwicy
Skóra-nadżerki i owrzodzenia (głowa i dolna
powierzchnia ogona , okolice narządu
rodnego)
Sporadycznie zapalenia i zmętnienie
rogówki
Przy zakażeniu wtórnym może dojść do
zapalenia płuc i do zwyrodnienia narządów
miąższowych.
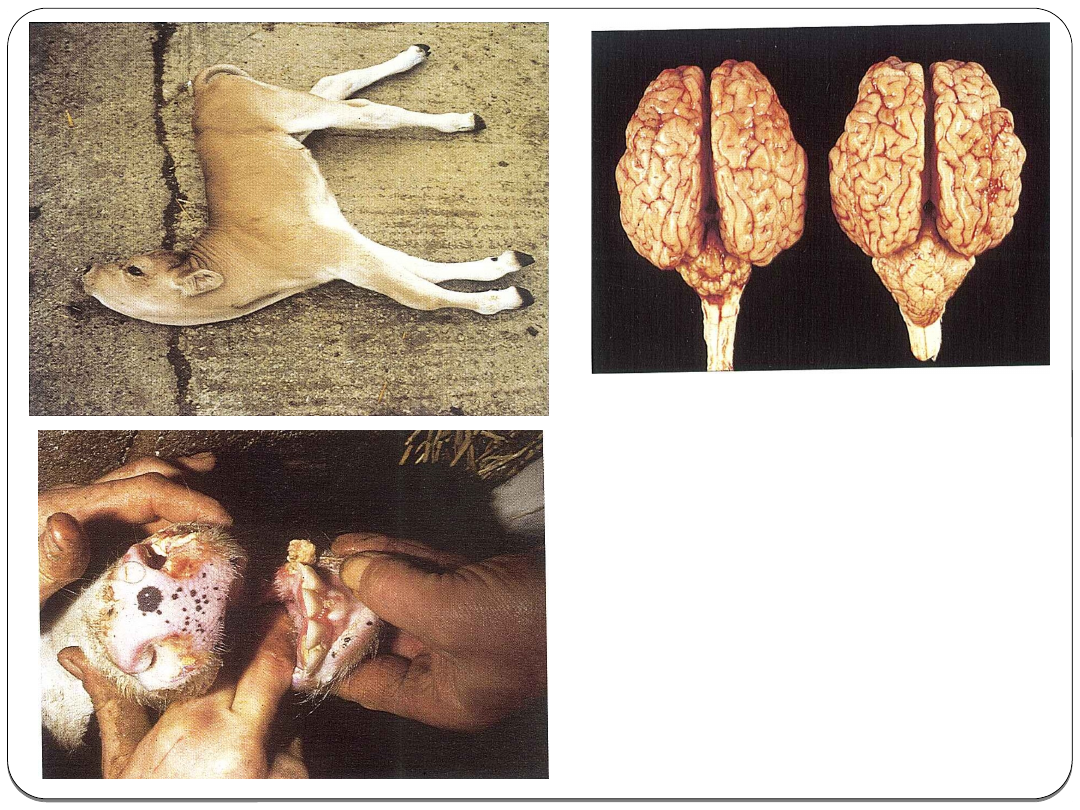
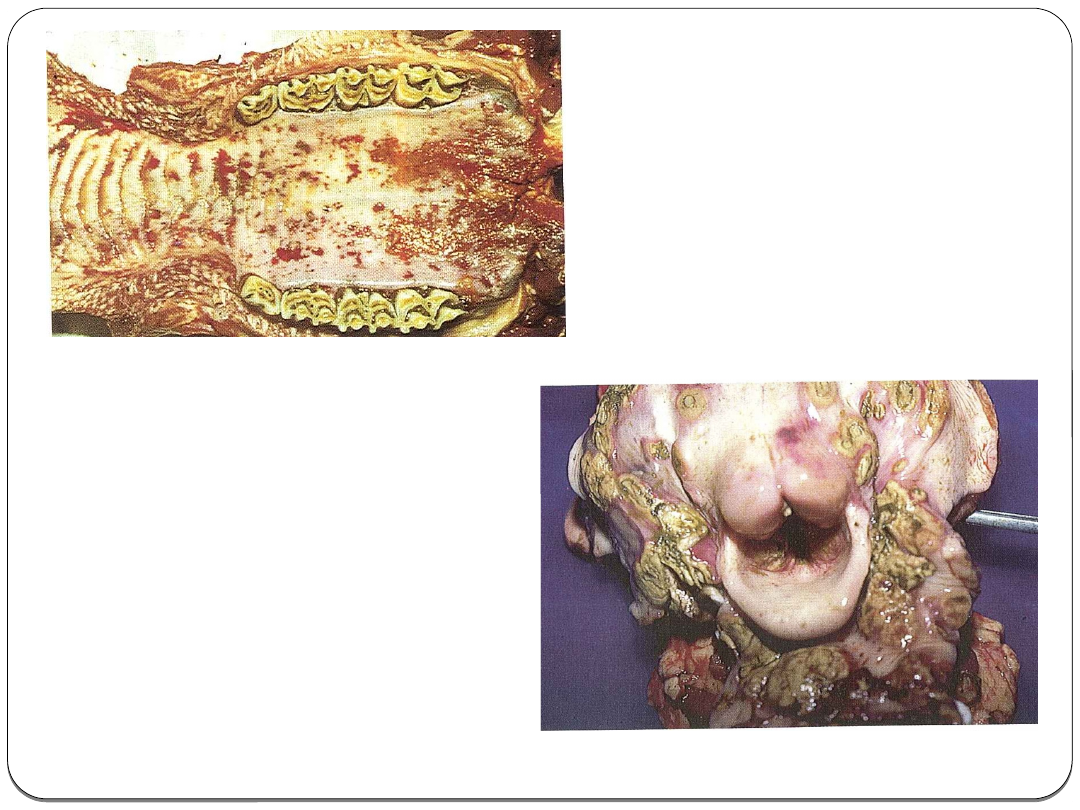
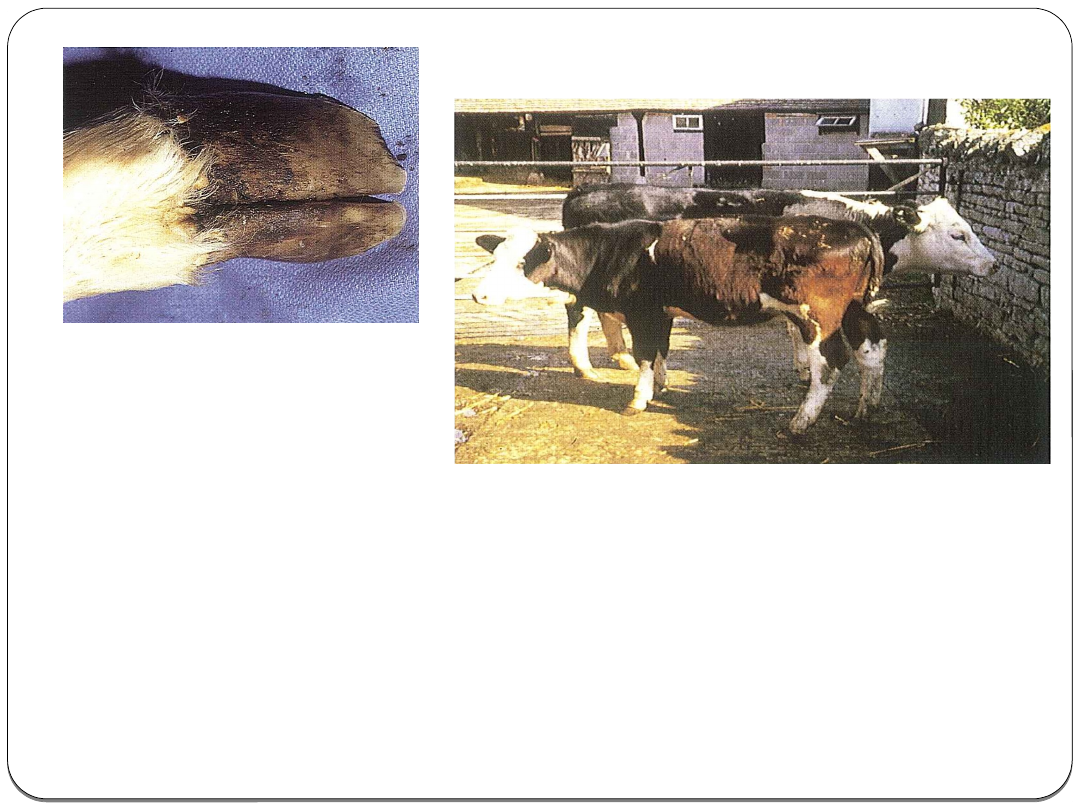

Diagnostyka różnicowa
Ze względu na podobieństwo objawów do wielu innych
chorób, diagnostyka różnicowa jest utrudniona.
Wymienione niżej objawy występują także w innych
jednostkach chorobowych:
Zaburzenia rozwojowe: zaburzenia genetyczne,ZNS,
choroby dziedziczne, choroba niebieskiego języka,
Akabane.
Biegunki: zaburzenia trawienia, salmonelloza,
gasroenteritis odpasożytnicze, kokcydioza, dyzenteria
zimowa.
Skaza krwotoczna: ostre zatrucie orlicą pospolitą,
furazolidonem, rodentocydami kumarynowymi lub
mykotoksykozy i zaawansowane choroby wątroby.

W przypadku zmian na błonach śluzowych różnice
są łatwiej zauważalne.
Złośliwa gorączka nieżytowa- zmiany na wszystkich
błonach znajdujących się w obrębie głowy, na pierwszym
planie znajdują się objawy keratoconjunctivitis.
Stomatitis papulosa- silniejsze zmiany na błonach
śluzowych.
Pryszczyca- typowe zmiany pęcherzykowe (afty).
Zakaźne zapalenie nosa i tchawicy bydła- zmiany
ograniczają się przede wszystkim do dróg oddechowych.
Dermatitis okolicy racic- zmiany ograniczone wyłącznie
do tego obszaru.
Ponadto zmiany w obrębie przewodu pokarmowego mogą
powstać w skutek kontaktu ze stężonymi kwasami.

Diagnostyka stad
Różnicowanie stad zakażonych od niezakażonych
W stadach zakażonych- różnicowanie zwierząt trwale
zakażonych od zwierząt w ostrej fazie choroby oraz
wykrywanie zwierząt uodpornionych oraz podatnych na
zakażenie
Badania laboratoryjne w kierunku wykrycia:
przeciwciał (serologiczne)
antygenu
materiału genetycznego wirusa lub żywego wirusa
(wirusologiczne)
Podejmowane w przypadku wystąpienia w stadzie zachorowań
z objawami klinicznymi za strony przewodu pokarmowego lub
układu oddechowego (gdy terapia antybiotykowa nie przynosi
efektów) lub w przypadku zaburzeń w rozrodzie.

Diagnostyka stad
Badanie serologiczne
Wykonywane w grupie zwierząt zdrowych i chorych.
Test seroneutralizacji- metoda ilościowa
Test ELISA- metoda jakościowa
W okresie ostrych zachorowań w stadzie- badanie par
surowic:
Dwukrotnie pobieramy próbki krwi od tych samych zwierząt;
1. W ostrej fazie zakażenia, 2. Po trzech tygodniach od
wyzdrowienia.
W przypadku stwierdzenia 4-krotnego wzrostu miana
przeciwciał lub pojawienia się przeciwciał o wysokim mianie w
próbkach od zwierząt seroujemnych, potwierdzamy obecność
BVD-MD.

Diagnostyka indywidualna
Badanie wirusologiczne- bezpośrednia
identyfikacja obecność żywego wirusa (test
izolacji w hodowli komórkowej), jego
antygenu lub fragmentu genomu (ELISA
antygenowa, RT-PCR) w badanej próbce.
Materiał do badań: pełna krew, surowica,
wymaz ze spojówek i nosa oraz narządy
padłych zwierząt ( zwłaszcza: nerka,
śledziona, kępki Peyera, grasica).
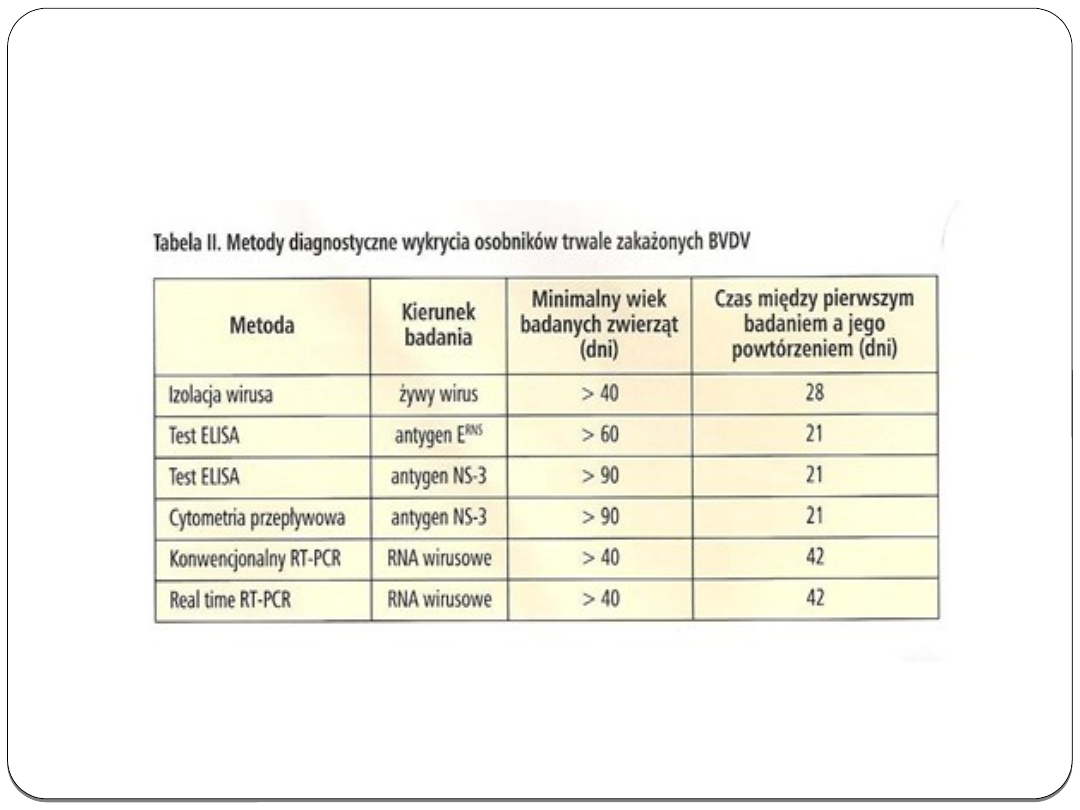
Diagnostyka osobników zakażonych
trwale

Zabezpieczenie materiału
Materiał do badań przesyłamy w osobnych,
plastikowych, opisanych pojemnikach lub
woreczkach foliowych, termosach, pudełkach
styropianowych
Zabezpieczony przed wysychaniem, światłem i
wysoką temperaturą (suchy lód)
Wymazy po pobraniu umieszczamy w płynach
odżywczych (konserwacja wirusów) – np. płyn
Parkera
Należy dołączyć pismo przewodnie:
dane właściciela, liczba i gatunek zwierząt, objawy,
kierunek badania, spis próbek, podpis i uwagi lek. wet.

Monitoring i zasady zwalczania
Zaleca się monitorowanie cyrkulacji wirusa w stadzie w
oparciu o określenie poziomu specyficznych przeciwciał w
zbiorczej próbie mleka. U krów które nie są w laktacji stosuje
się testy serologiczne wykrywające obecność przeciwciał.
Program szczepień utrudnia monitoring wirusa! Istnieje
konieczność użycia testów różnicujących przeciwciała bądź
nastawienie monitoringu na wykrywanie antygenu (ELISA).
Wykrycie antygenu, wysoki poziom specyficznych przeciwciał
w próbie zbiorczej lub wzrost przeciwciał u bydła powyżej 8
miesiąca życia, wskazuje na siewstwo wirusa i obecność
sztuk trwale zakażonych lub cierpiących na ostrą infekcję.

Eradykacja
- wykrywanie i sukcesywne eliminowanie PI.
- identyfikacja trwale zakażonych nosicieli:
pobieranie próbek krwi od wszystkich zwierząt powyżej 6 miesiąca życia
cielęta muszą być badane przed pierwszym pobraniem siary lub zaraz po
ukończeniu 6 miesiąca życia
(uwaga: wynik negatywny może być spowodowany interferowaniem
matczynych przeciwciał z wirusem)
Po miesiącu przerwy pobiera się drugą próbę krwi od wszystkich zwierząt, u
których w pierwszym badaniu wykryto BVD.
Dwukrotny wynik pozytywny- zwierzęta trwale zakażone.
- w stadach wolnych, badamy zbiorcze próby mleka lub próby krwi pobrane
losowo od przynajmniej 5 sztuk
- próby pobieramy co 6 miesięcy, z czasem odstęp się ten wydłuża
- w wolnym stadzie powinno się badać każde nowo narodzone cielę i
kontynuować badanie aż do momentu kiedy nie stwierdzi się obecności wirusa
przez minimum rok.

Zakazy obowiązujące w zakażonym
stadzie
sprzedaży zwierząt (Austria wyłącznie
samic ciężarnych)
wypasu na wspólnych pastwiskach
udziału w wystawach hodowlanych
przewożenia zwierząt w grupie
wprowadzania nowych zwierząt
Szczepienia
Podwyższenie odporności stada poprzez wykonywanie szczepień.
By szczepionka była skuteczna w jej skład musi wchodzi zarówno
typ 1 jak i 2 wirusa.
Szczepionki żywe modyfikowane:
Jałówki - szczepienie w 5-6 miesiącu życia, powtórzenie na 60
dni przed inseminacją.
Krowy dorosłe – corocznie na 2-4 tyg. przed inseminacją.
Szczepionki inaktywowane:
Krowy i jałówki powinny otrzymać kolejną dawkę szczepionki
przed kolejną ciążą, w połowie laktacji lub ciąży i powtórnie w
okresie zasuszenia.
Szczepienie cieląt należy przeprowadzić trzykrotnie w 12, 14 i
18 tygodniu życia.

Szczepienia
Ze względu na niedoskonałość zarówno
szczepionek zabitych (konieczność odszczepiania),
jak i żywych (możliwość zakażania zarówno
zwierząt szczepionych jak i płodów krów
ciężarnych), Niemcy połączyli stosowanie obydwu
szczepionek w jednym programie. Użycie
szczepionki zabitej w pierwszym etapie akcji
zapewnia bezpieczeństwo stosowania. Szczepionka
żywa nie niesie wówczas ze sobą ryzyka zakażania
płodu szczepem szczepionkowym wirusa drogą
łożyskową, gwarantując jednocześnie znaczący
wzrost miana przeciwciał neutralizujących wirusa.
Szczepionki przeciwko BVD
Bovidec
Inaktywowana
Bovilis BVD-MD
Inaktywowana
Preg Sure BVD (PL)
Inaktywowana
Mucobovin (PL)
Inaktywowana
Vacoviron
Żywa
Rispoval 3-BRSV-PI3-BVD (PL)
Rekombinowana BRSV, PI3-
żywa, BVD-inaktywowana

Szczepienia- Bovilis BVD
Czynne uodpornianie krów i jałówek (w wieku, co
najmniej 8 miesięcy)
zabezpieczenie płodów przed śródmacicznym
zakażeniem BVDV
Zasady:
o
Całe pogłowie może być szczepione po
osiągnięciu wieku 8 miesięcy
o
Dwukrotne szczepienie z zachowaniem odstępu 4
tygodni
o
Drugą dawkę należy podać nie później niż na 4
tygodnie przed rozpoczęciem ciąży
o
Szczepienie przypominające- jednokrotne
szczepienie co 6 miesięcy

Szczepienia
Rispoval 3- BRSV- PI3- BVD
Aktywna immunizacja cieląt w celu
zmniejszenia wydalania wirusa oraz
zmniejszenia leukopenii wywoływanej na
skutek infekcji wirusem BVD typ 1
•
Zasady:
o
Pierwsze podanie: od 12 tygodnia życia
Drugie podanie: 3 do 4 tygodnie później
o
Szczepione przynajmniej 3 tygodnie przed
okresem stresu
o
lub wysokiego narażenia na zakażenie
o
Jeśli wymagana jest ochrona przeciwko
wirusowi BVD typ 1, ponowne szczepienie
po 6 miesiącach
Document Outline
- Slide 1
- Slide 2
- Czynnik etiologiczny: Pestivirus z rodziny Flaviviridae
- Budowa morfologiczna:
- Wyróżniamy 2 biotypy wirusa BVD-MD
- Źródło wirusa:
- Źródło wirusa:
- Źródło wirus:
- Droga wirusa w organizmie
- Zakażenie ciężarnej samicy:
- Slide 11
- Zaburzenia rozwoju płodu:
- ZESTAWIENIE BVD i MD
- Obraz kliniczny
- Postacie
- Postać ostra choroby
- Postać ostra choroby:
- Immunosupresyjny wpływ wirusa
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Zmiany anatomopatologiczne:
- Zmiany anatomopatologiczne:
- Slide 25
- Slide 26
- Slide 27
- Diagnostyka różnicowa
- Slide 29
- Diagnostyka stad
- Diagnostyka stad
- Diagnostyka indywidualna
- Diagnostyka osobników zakażonych trwale
- Zabezpieczenie materiału
- Monitoring i zasady zwalczania
- Eradykacja
- Zakazy obowiązujące w zakażonym stadzie
- Szczepienia
- Szczepienia
- Szczepionki przeciwko BVD
- Szczepienia- Bovilis BVD
- Szczepienia Rispoval 3- BRSV- PI3- BVD
Wyszukiwarka
Podobne podstrony:
BVD MD
BVD-MD BVD-MD 3, Weterynaria, bydła + konie + trzoda chlerwna
BVD-MD 2, Weterynaria, bydła + konie + trzoda chlerwna
Infekcje BVD MD w stadach bydła mogą się okazać przyczyną poważnych strat ekonomicznych tjx
BVD MD
BVD MD konsp 11
Wirus BVD MD bydła
Szczepienia przeciw BVD MD
BVD MD PASTERELOZA cw bydlo
Zakażenia wirusem BVD MD
08 md wykl8
MD 3
MD cw 1 id 290131 Nieznany
md elementy teorii liczb
MD cw 05
MD wykl 06 id 290158 Nieznany
Einfacher MD Vorverstaerker
więcej podobnych podstron