
Kataliza asymetryczna
Tradycyjna synteza
gwarantuje jedynie
otrzymanie mieszaniny
racemicznej!!!
Cz�steczki chiralne
Cz�
steczki achiralne
Enancjomery - mają
identyczne właściwości
chemiczne, zatem nie mogą
być bezpośrednio
rozdzielone
konwencjonalnymi
metodami, takimi jak
destylacja, krystalizacja,
chromatografia na
konwencjonalnych fazach
stacjonarnych
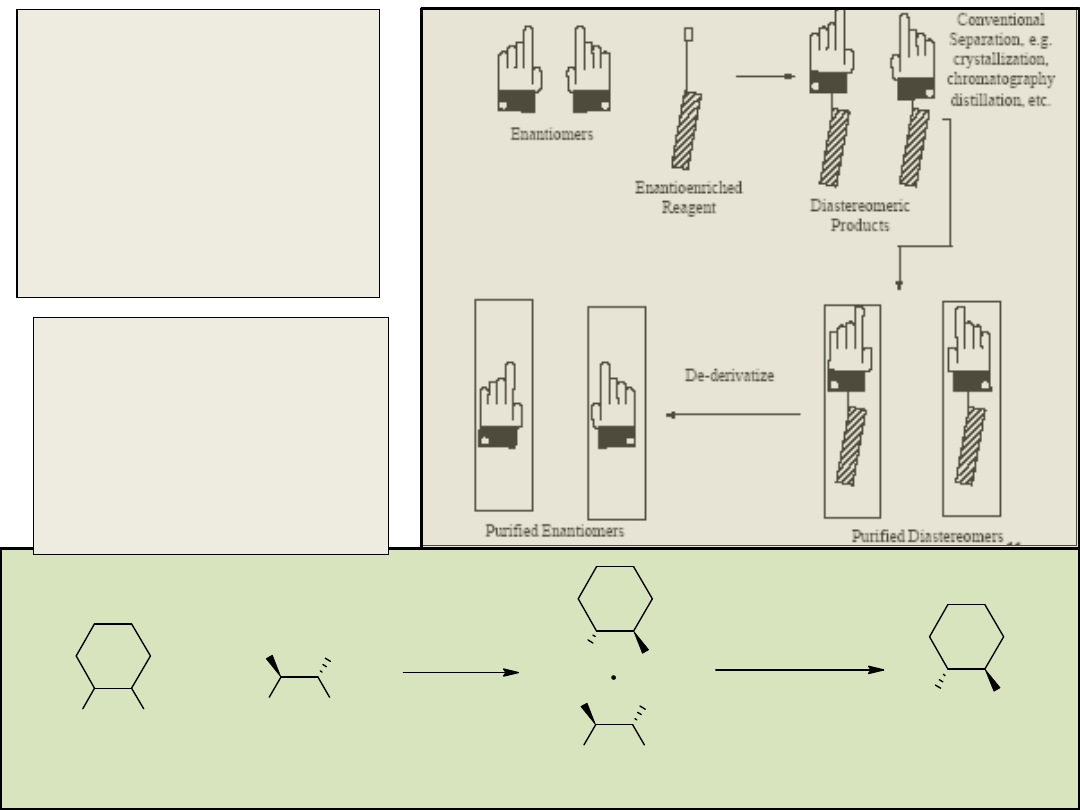
Rozdział enancjomerów z
mieszaniny racemicznej
wymaga użycia
zewnętrznych
enancjomerycznie czystych
lub wzbogaconych
enancjomerycznie
reagentów lub innych
czynników.
+
NH
3
+
N
H
3
+
O
2
C
CO
2
O
H
OH
-
-
H
2
O, AcOH
90 do 5
o
C
NH
2
N
H
2
HO
2
C
CO
2
H
O
H
OH
NaOH, benzen, rt
NH
2
N
H
2
100
minor
major
minor
major
%e.e
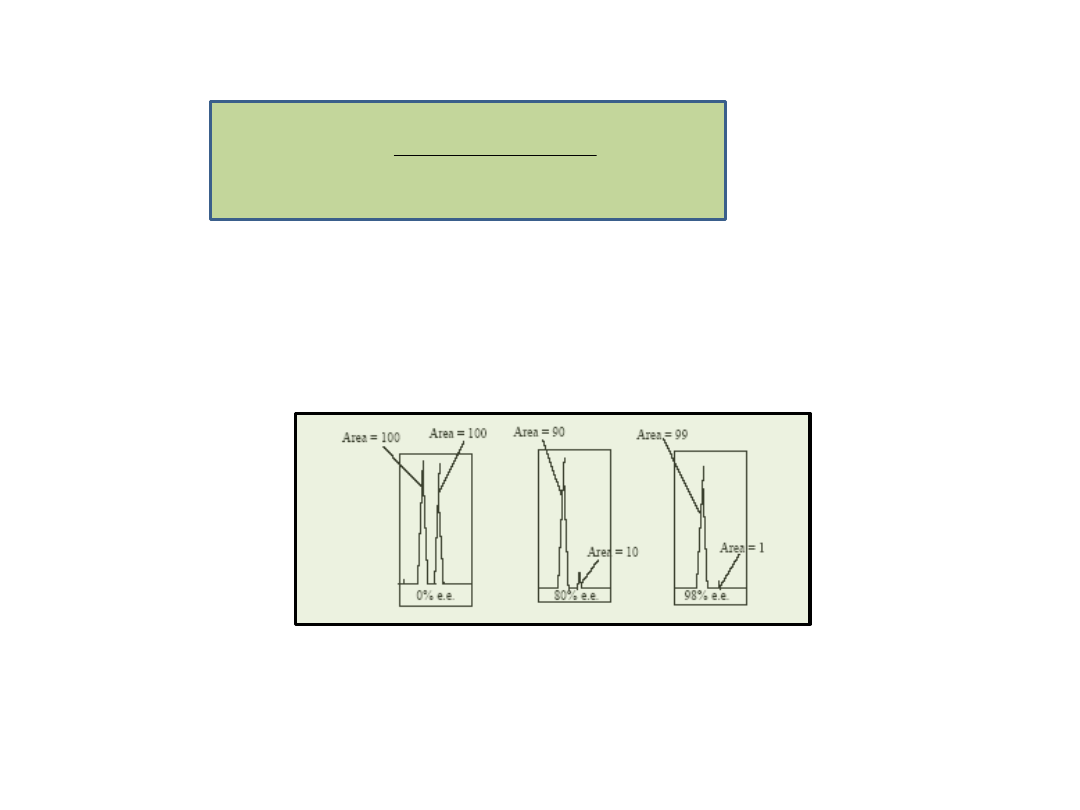
Sposoby określania e.e.:
• Chromatografia gazowa i cieczowa z wykorzystaniem kolumn z
chiralną faza stacjonarną
•
1
H-NMR z dodatkiem chiralnych reagentów
Nadmiar enancjomeryczny - e.e. (%):
R
X
R
A
A
reagent
chiral catalyst
R
X
R
A
B
R
X
R
A
B
lub
meso
chiral, enantioenriched
reagent
chiral catalyst
lub
racemic
enantioenriched
R
A
R
1
R
A
R
+
R
A
R
1
+
R
B
R
1
R
B
R
1
enantioenriched
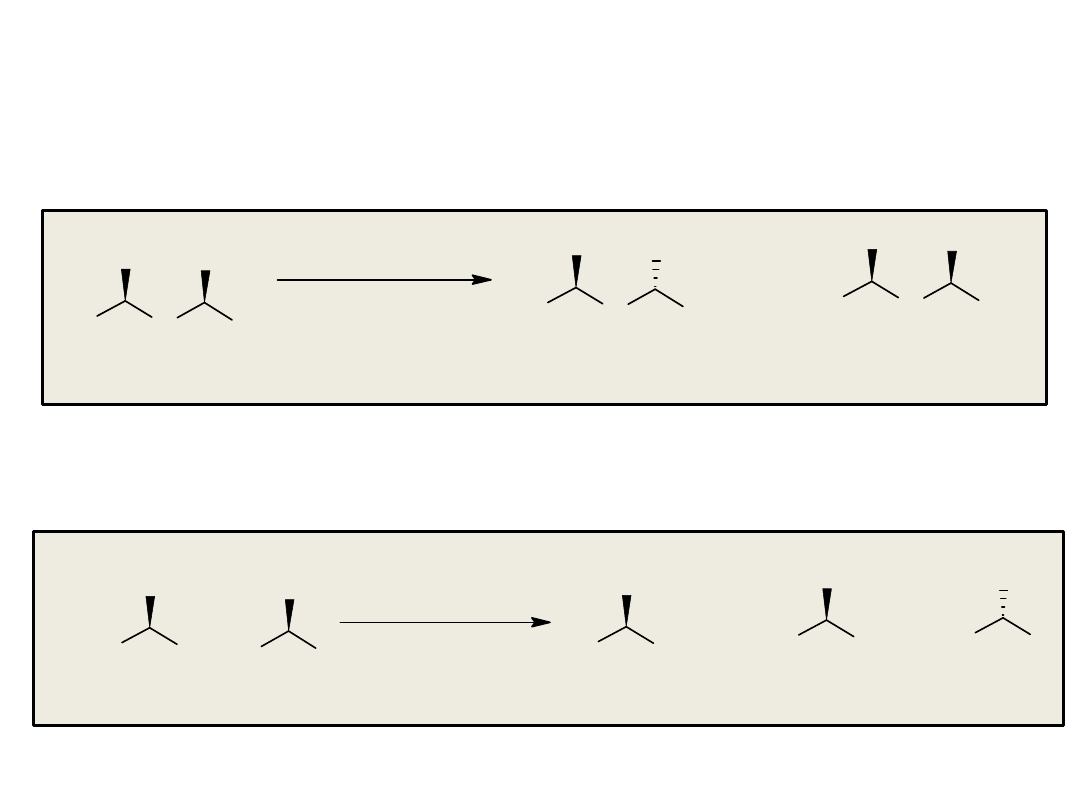
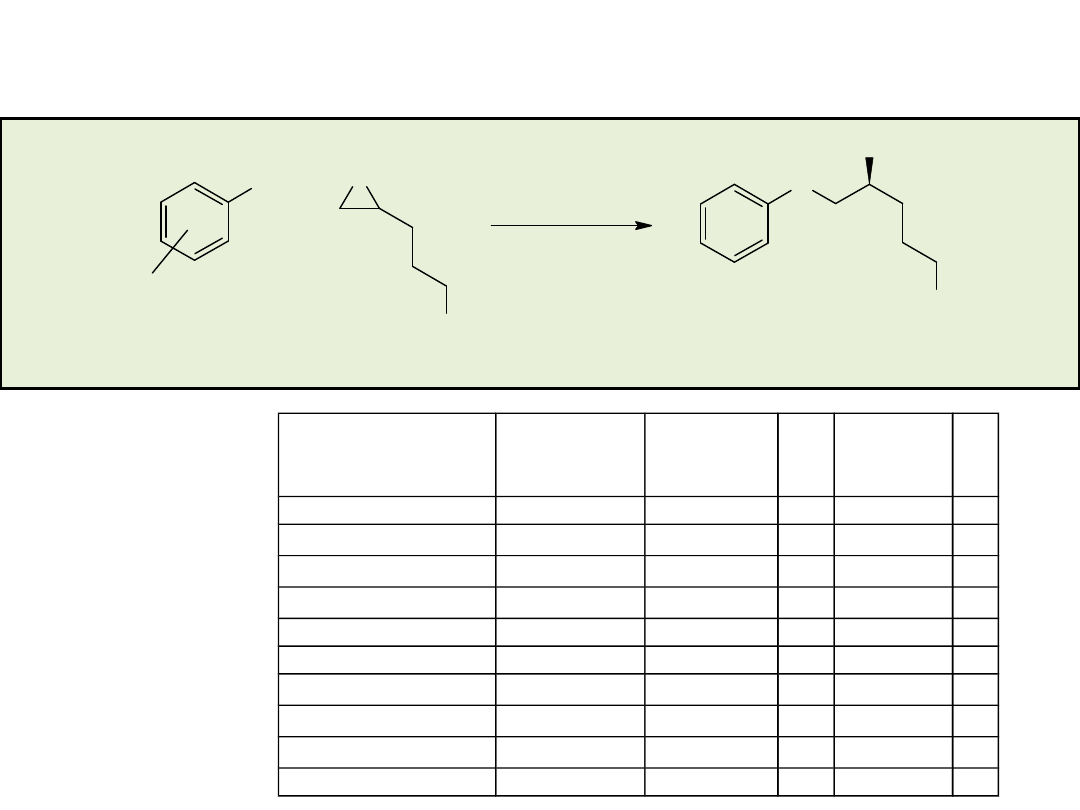
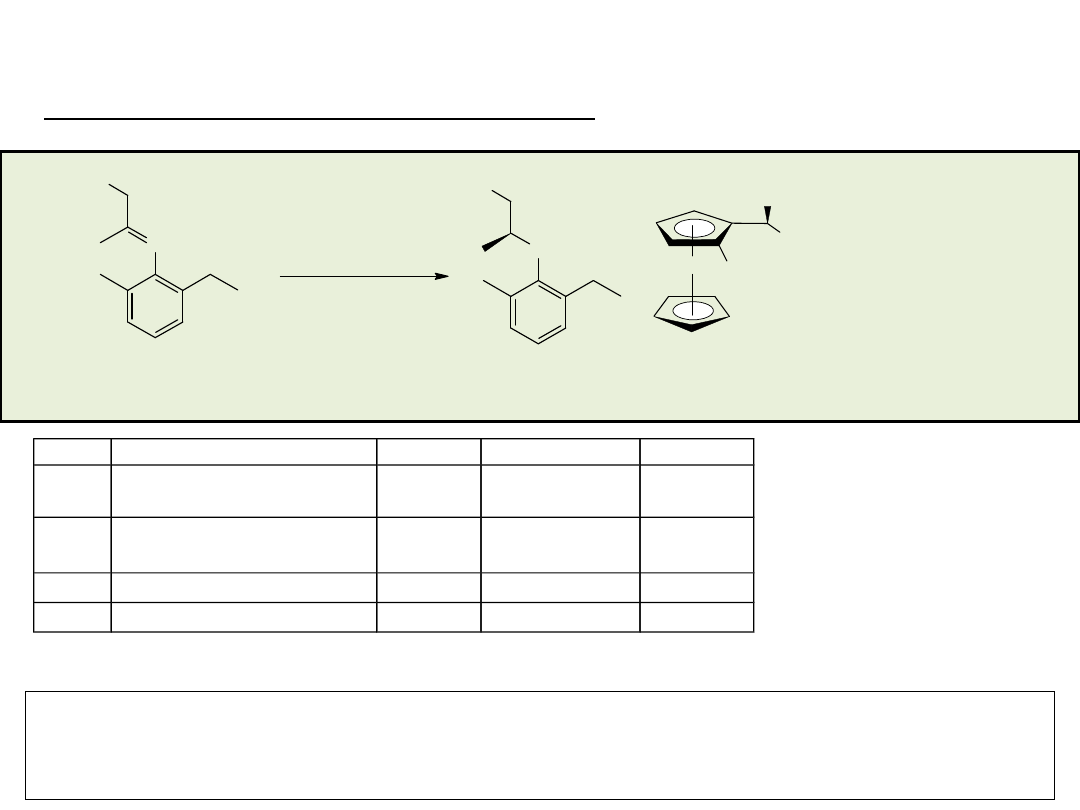
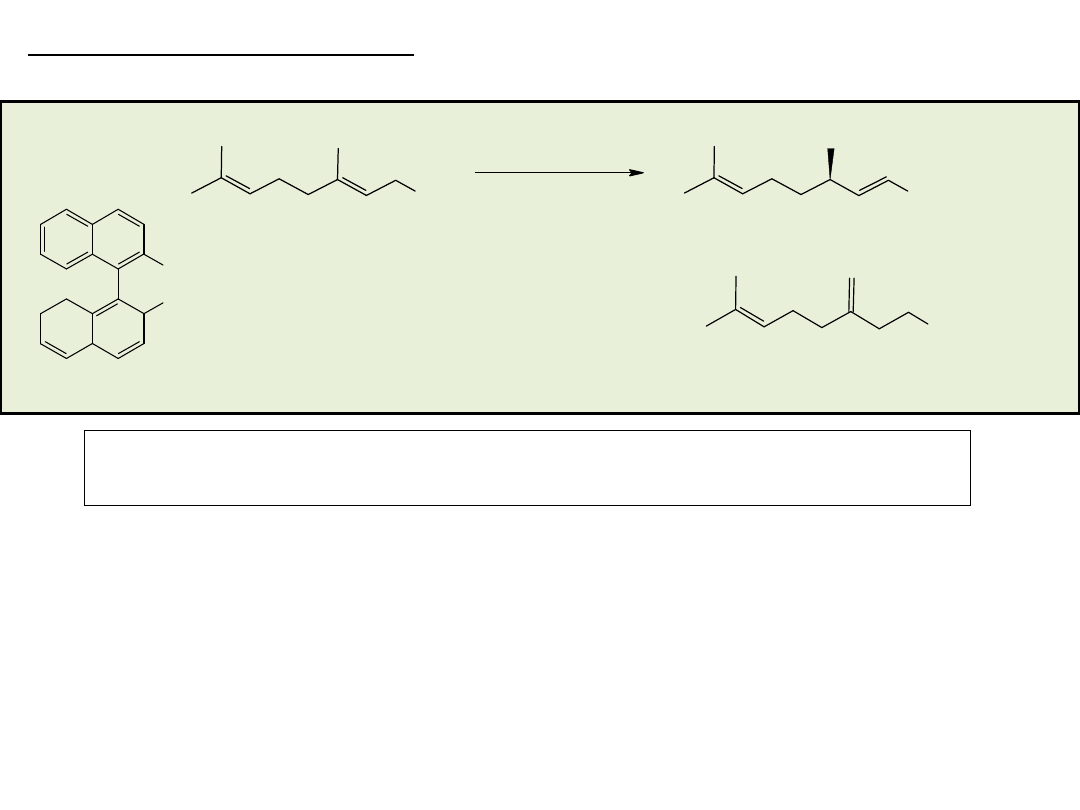
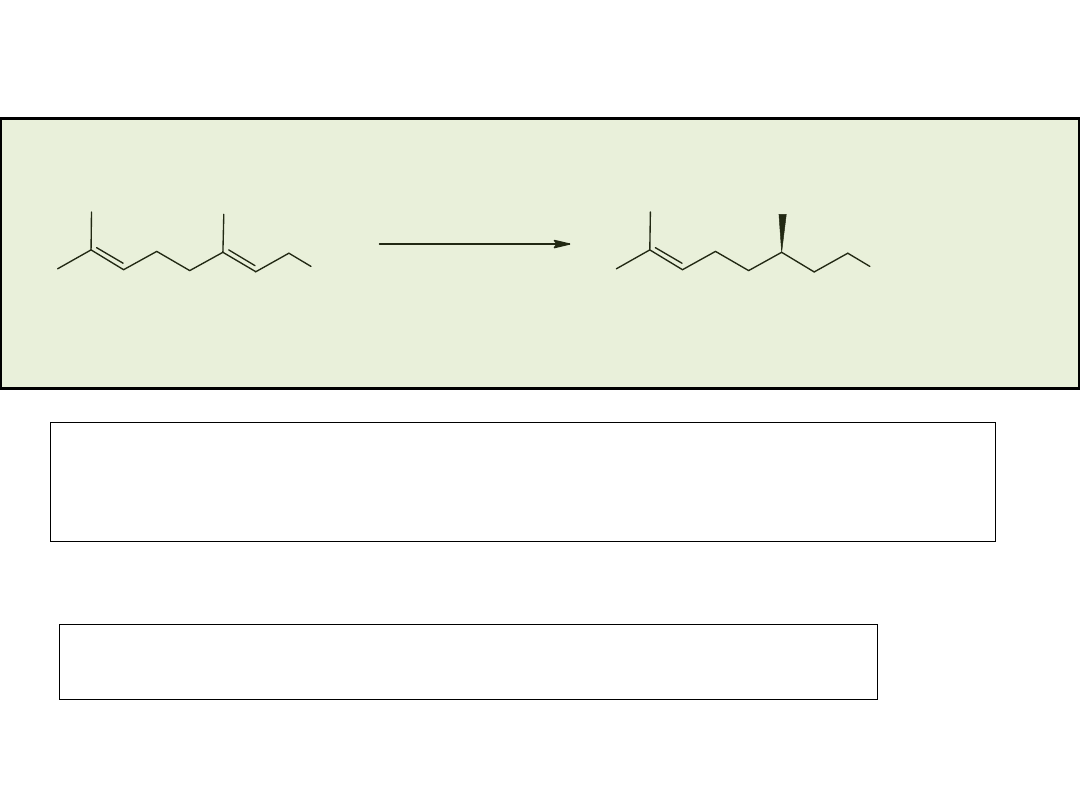
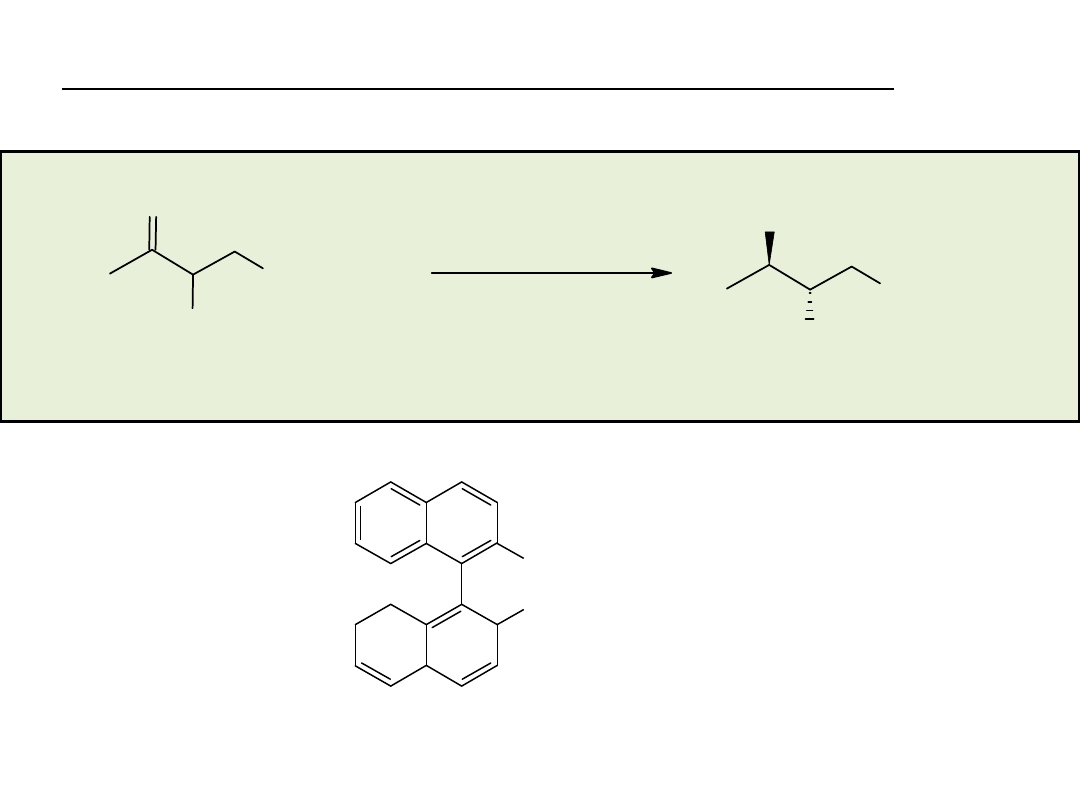
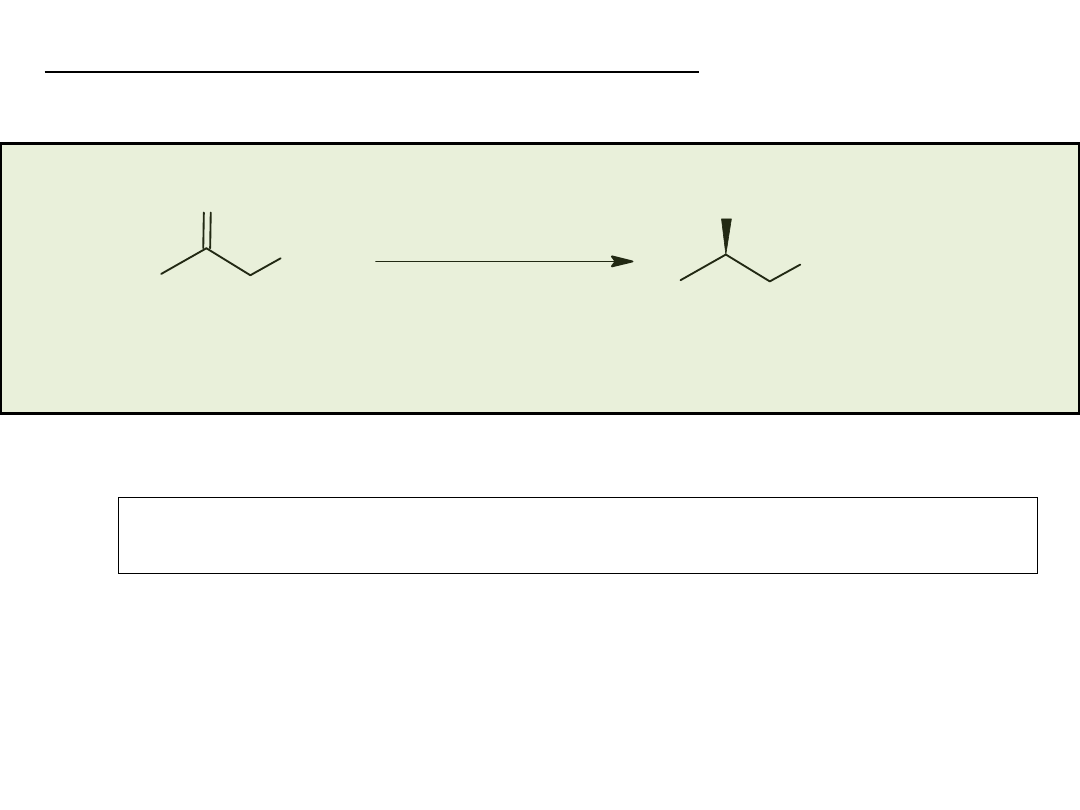
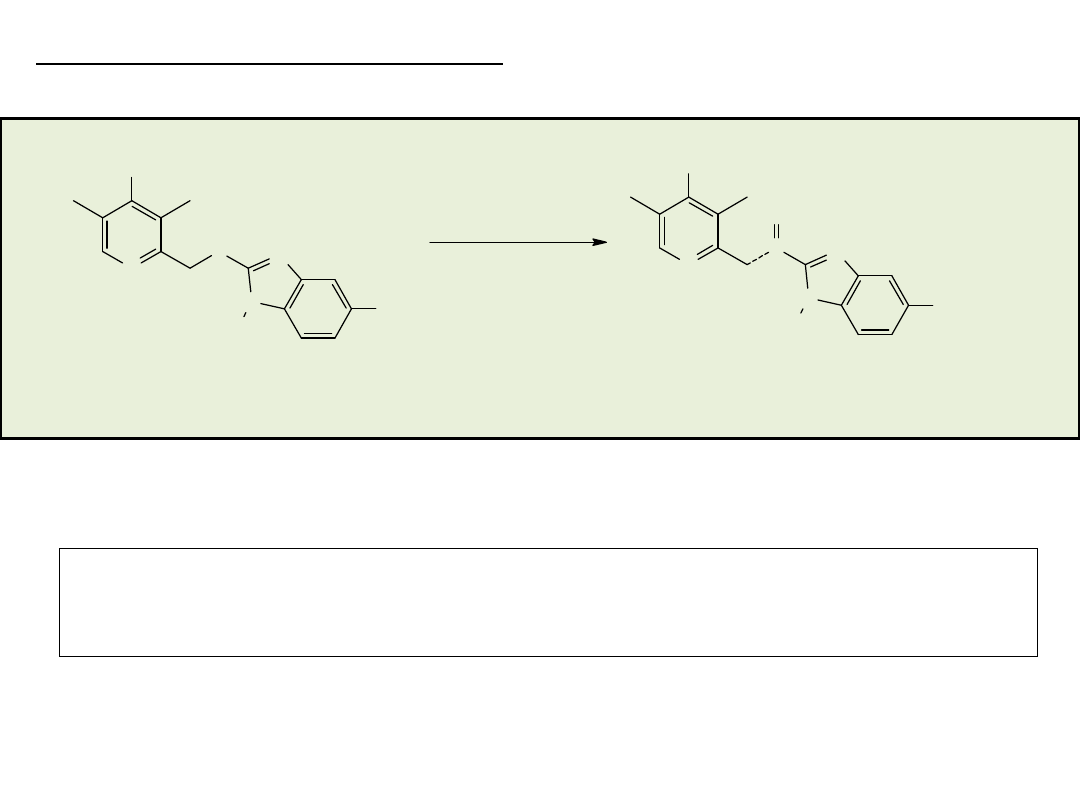
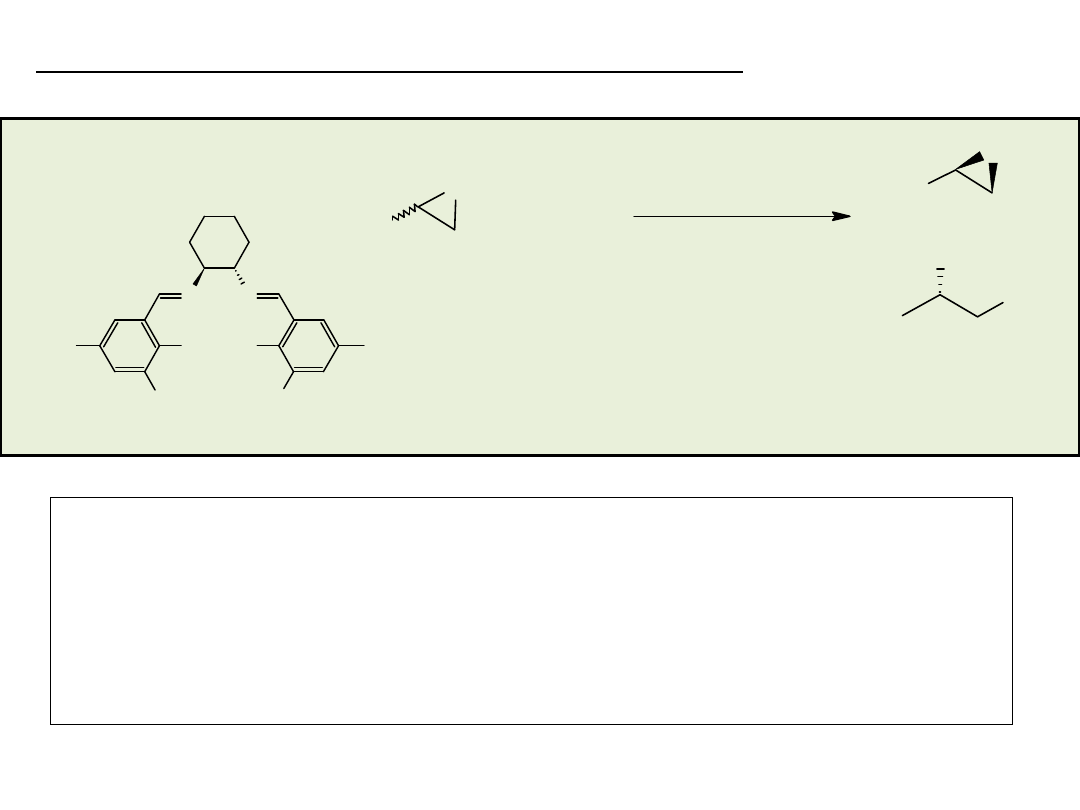
Synteza enancjosymetryczna na drodze reakcji
stereospecyficznego podstawienia nukleofilowego
przy węglu o hybrydyzacji sp
3
• rozdział kinetyczny (kinetic resolution)
• desymetryzacja (desymmetrization)
X
X
P
P
CH
3
CH
3
CH
3
C
H
3
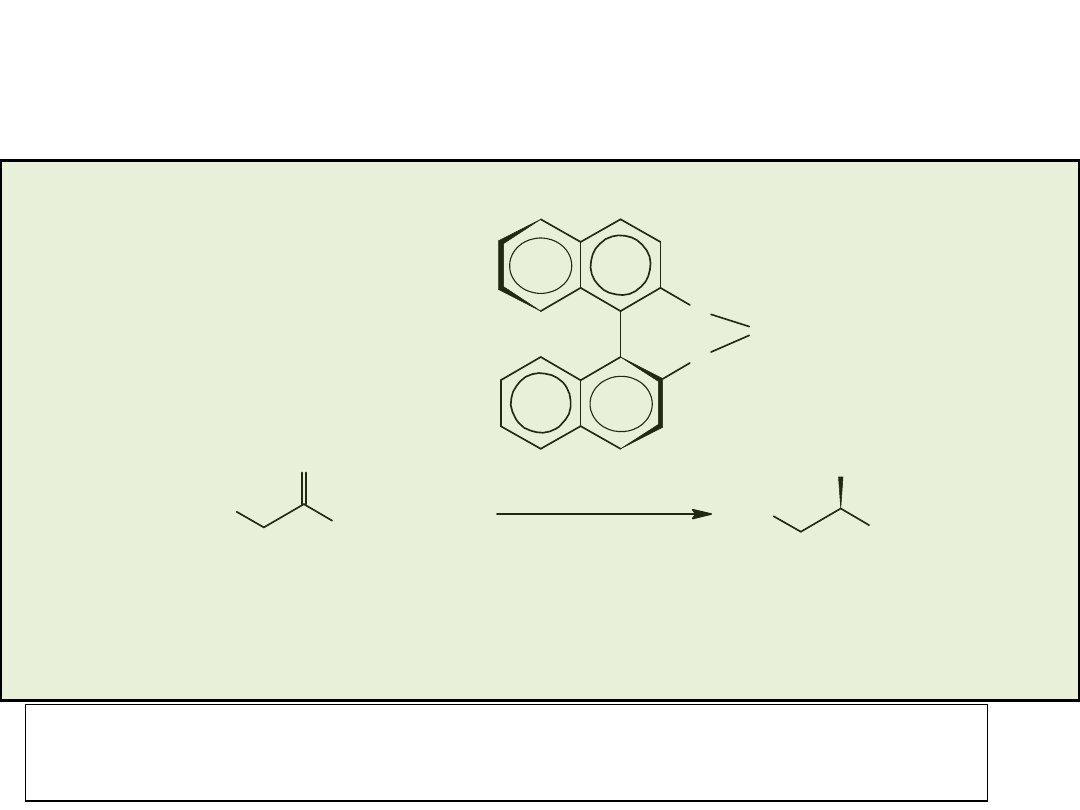
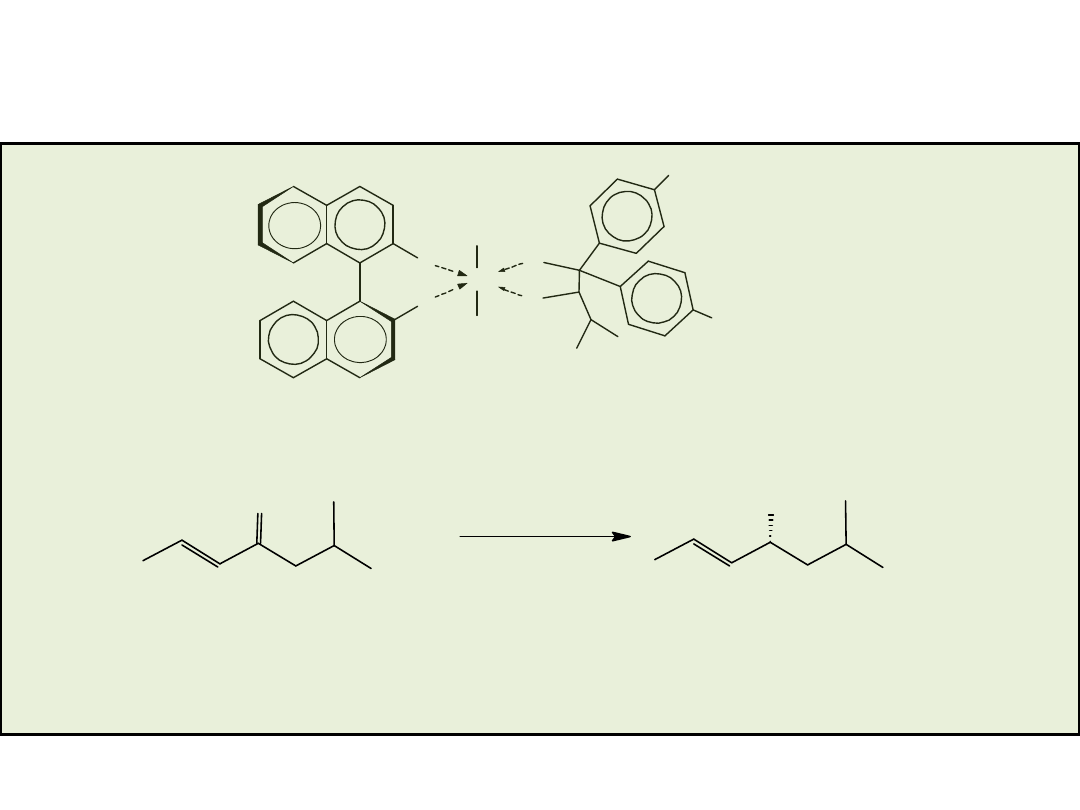
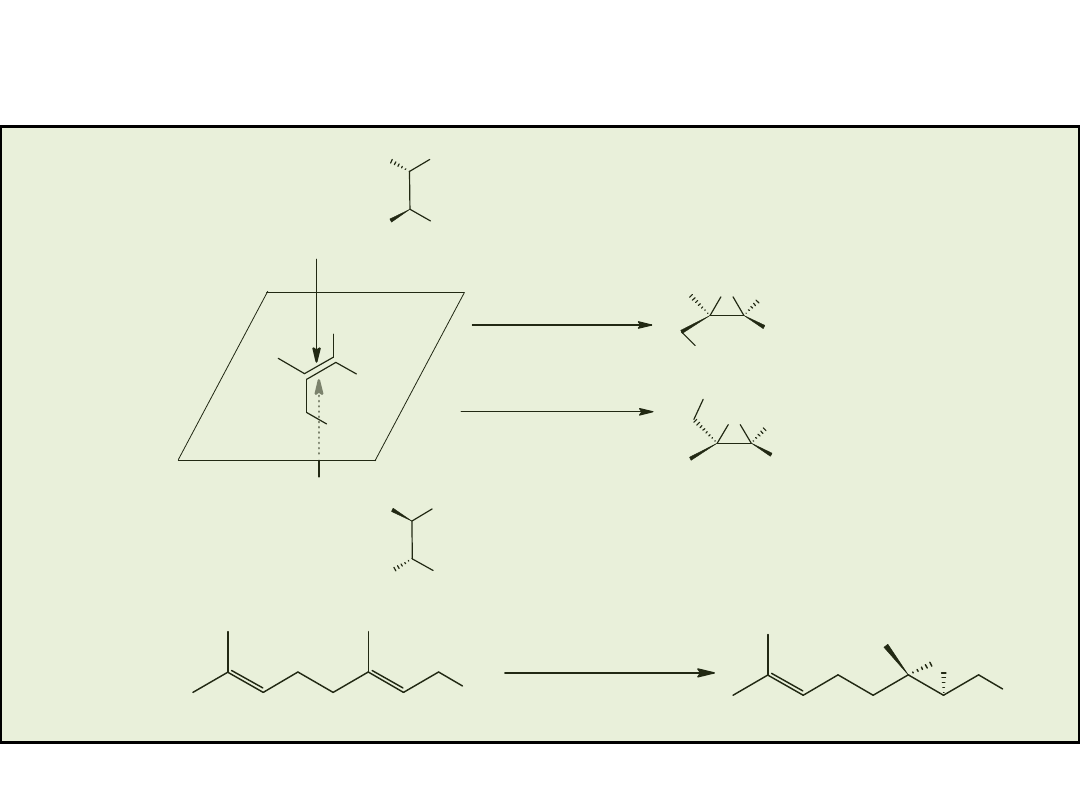
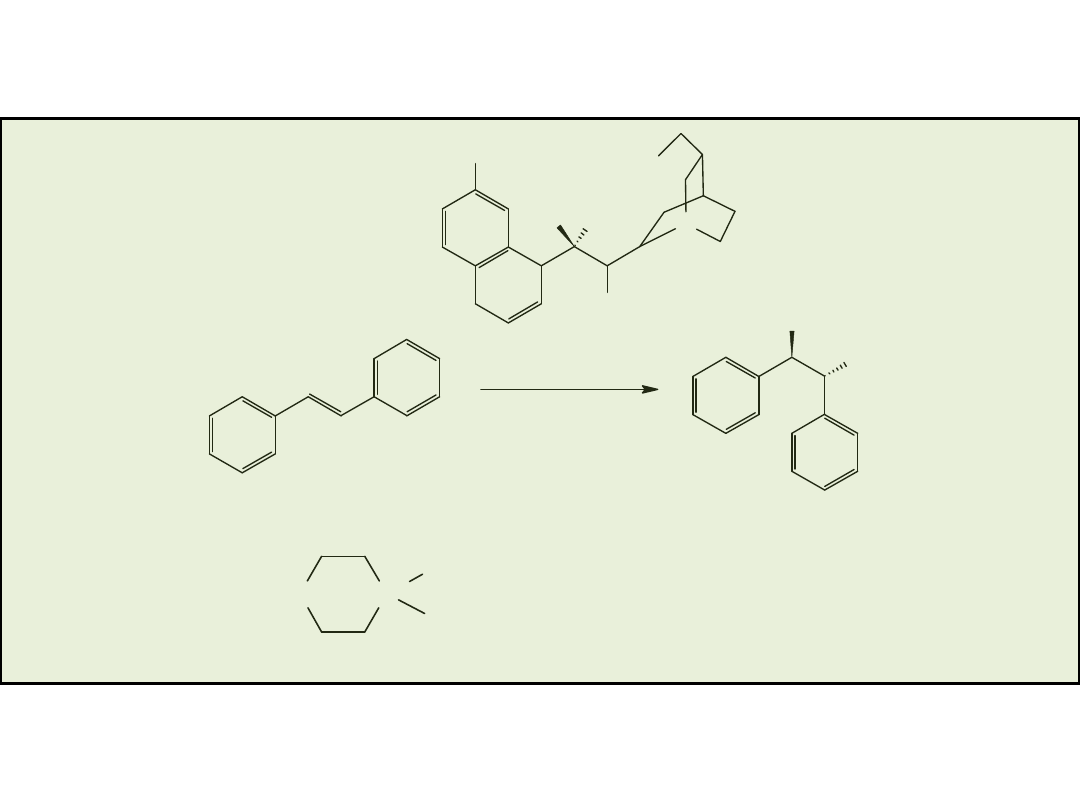
Przykłady „uprzywilejowujących” chiralnych ligandów (privileged chiral ligands)
X=OH BINOL
X=PPh
2
BINAP
Diels-Alder
Allilacja
aldehydów
(aldehyde
allylation)
Hydrogenacja (hydrogenation)
Izomeryzacja alkenów (alkene
isomerization)
Reakcja Hecka
MeDuPhos
Hydrogenacja (hydrogenation)
Hydrofosfinacja
(hydrophosphination)
Hydroacylacja
(hydroacylation)
Hydrosililacja
(hydrosilylation)
Diels-Alder
Allilacja
aldehydów
(aldehyde
allylation)
Alkoholiza estrów (ester alcoholysis)
Diels-Alder
Cyklopropanacja
(cyclopropanation)
Azyrydynacja (aziridination)
Addycja sprzężona (conjugate
addition)
O
O
OH
OH
Ph
Ph
Ph
Ph
C
H
3
C
H
3
N
O
N
O
t-Bu
t-Bu
C
H
3
CH
3
TADDOL
Bis(oxazoline)
C
H
3
CH
3
C
H
3
CH
3
M
Redukcja alkenów (alkene reduction)
Redukcja imin (imine reduction)
Polimeryzacja Zieglera-Natty
Epoksydacja (epoxidation)
Otwarcie
pierścienia
epoksydowego (ring opening
epoxides)
Reakcja Diels-Aldera
Cyjanowanie
imin
(imine
cyanation)
N
N
t-Bu
t-Bu
O
O
t-Bu
t-Bu
H
H
M
C
H
2
N
N
OH
OMe
Ligand
Brintzinger’a
salen
Acylacja (acylation)
Heterogeniczna hydrogenacja
(heterogenous hydrogenation)
Katalizator przeniesienia
fazowego (phase transfer
catalyst)
Pochodna
alkaloidu
chinonoweg
o
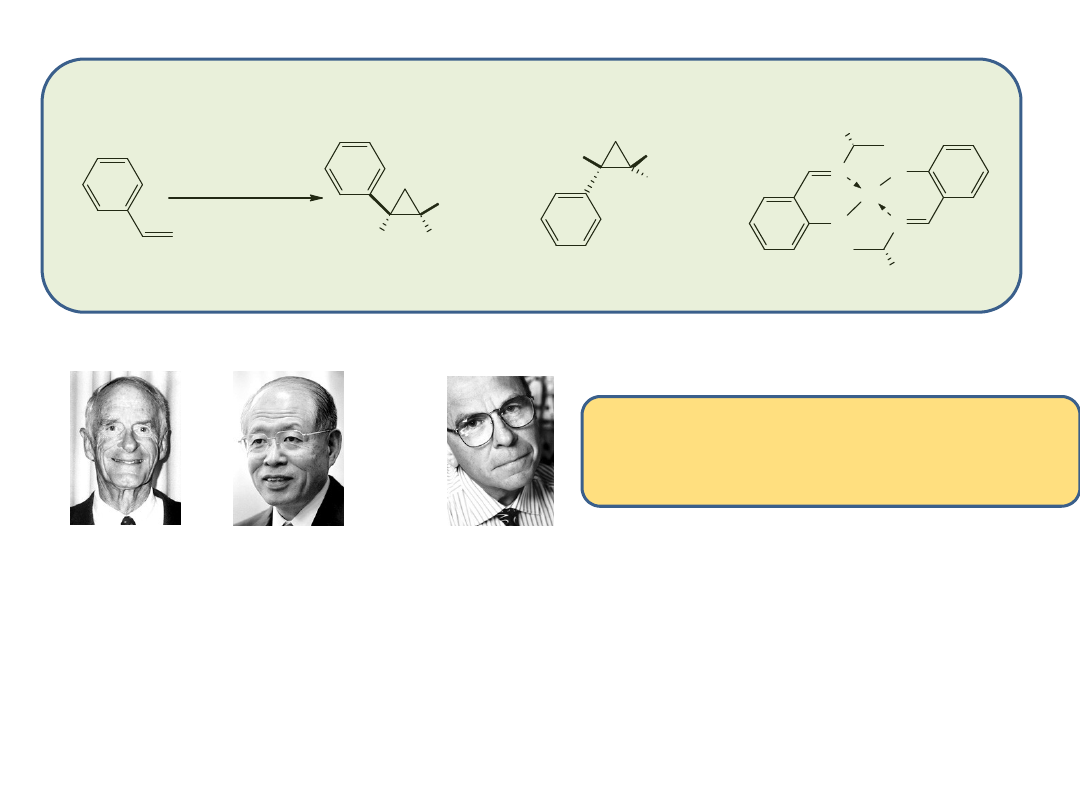
Nagroda Nobla z Chemii – 2001
„za
osiągnięcia
z
zakresu
katalitycznej
syntezy asymetrycznej”
William S. Knowles
(ur. 1917)
Ryoji Noyori
(ur. 1938-)
K. Barry Sharpless
(ur. 1941)
1/4
„Za prace dotyczące wykorzystania
chiralnych układów katalitycznych w
asymetrycznym uwodornieniu”
„ za prace z zakresu
wykorzystania chiralnych
układów katalitycznych w
reakcjach asymetrycznego
utlenienia”
H
H
COOC
2
H
5
H
H
COOC
2
H
5
1mol % chiral Cu cat
+ N
2
CHCOOC
2
H
5
+
10 % ee
6 % ee
O
Cu
N
C
6
H
5
O
N
C
6
H
5
Chiral Cu catalyst
1/4
1/2
Pierwszy przykład (Nozaki, Noyori et al., 1966)
9
C CH
2
COOH
Rh-catalyst
CH CH
3
COOH
*
(+)-kwas hydratropowy
15% ee
:P CH
3
C
6
H
5
C
3
H
7
Uwodornienia prochiralnej pochodnej styrenu (Knowles,
1968 r.)
(-)-metylopropylofenylofosfina, 69%
ee
Katalizator - modyfikowany kompleks Wilkinsona, w którym
trifenylofosfinę zastąpiono optycznie czynną (-)-
metylopropylofenylofosiną
Synteza asymetryczna aminokwasu L-DOPA (3,4-di
hydroksyfenyloalaniny) (firma Monsanto w 1974 r.)
O
O
COOH
NHAc
Me
Ac
+ H
2
[Rh((R,R)-DiPAMP)COD]
+
BF
4
-
catalyst
O
O
COOH
H
NHAc
Me
Ac
95% ee
H
3
O
+
O
H
COOH
H
NHAc
O
H
L-DOPA
COD
P
P
O
Me
(R,R)-DiPAMP
Pierwsza przemysłowa synteza asymetryczna
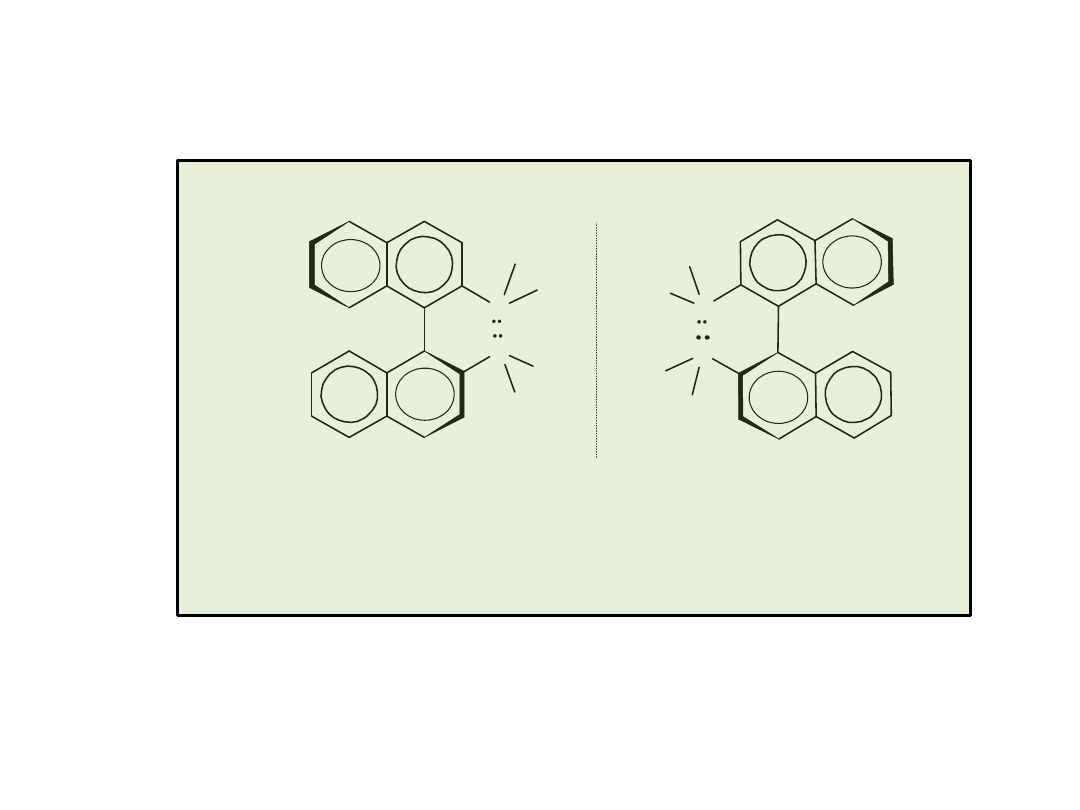
Chiralne atropoizomery difosfiny
(S)-BINAP
(R)-BINAP
P
P
Ph
Ph
Ph
Ph
P
P
Ph
Ph
Ph
Ph
(1980 r., Noyori i Takaya)
(S)-BINAP-Ru(OCOCH
3
)
2
P
P
Ru
O
O
O
O
Ph
2
Ph
2
O
COOH
Me
+ H
2
(S)-BINAP-Ru(OCOCH
3
)
2
(0,5 % mol.
MeOH
O
COOH
Me
Uwodornienie ,- i ,- nienasyconych kwasów
karboksylowych
Enancjoselektywność uwodornienia w obecności kompleksów rodu jest o wiele
większa, niż przy wykorzystaniu kompleksów rutenu.
Enancjoselektywne uwodornienie funkcjonalizowanych
ketonów w obecności kompleksów zawierających halogen,
typu [RuX(arene)(BINAP)]X lub RuX
2
(BINAP) (X=Cl, Br, I):
Ar= aryl; L=ligand; X=Cl, Br lub I
P
P
RuX
2
L
2
Ar
2
Ar
2
(R)-BINAP-Ru(II)
+ H
2
CH
3
O
H
O
CH
3
O
H
OH
Katalizatory
rutenowe
gwarantują
prawie
100%
enancjoselektywność przy przemianie estrów β-oksokwasów w estry
β-hydroksykwasów.
Ar= 3,5-(CH
3
)
2
C
6
H
4
P
P
Ru
Cl
Cl
N
H
2
N
H
2
OMe
OMe
Ar
2
Ar
2
O
+ H
2
K
2
CO
3
(CH
3
)
2
CHOH
OH
90% ee
fragment konstrukcyjny
Vitaminy E
Enancjoselektywne uwodornienie enonu do chiralnego
alkoholu allilowego w obecności kompleksu
RuCl
2
(ksylylbinap)(diamina) i słabej zasady K
2
CO
3
Stosunek substratu do katalizatora wynosił około 100000:1.
"O"
D-(-)-DET
(2S, 3S)
t-BuOOH, CH
2
Cl
2
, -20
o
C
sita molekularne 4Å
COOEt
O
H
O
H
COOEt
R
1
OH
R
2
R
3
"O"
D-(-)-DET
L-(+)-DET
O
R
1
R
2
R
3
OH
O
R
2
R
1
R
3
OH
wyd. 70-90%
90 ee
COOEt
O
H
O
H
COOEt
L-(+)-DET
(2R, 3R)
L-(+)-DET, Ti(Oi-Pr)
4
OH
OH
O
t-BuOOH, CH
2
Cl
2
sita molekularne 4
Å
Enancjoselektywna epoksydacja alliloalkoholi
(epoksydacja Sharpless’a)
NMO (1,2 equiv)
OsO
2
(0,2%)
aceton-woda
0
o
C, 15 h (89%)
OH
OH
CH
3
H
N
H OAc
0,13 equiv
NMO =
N
+
O
O
-
CH
3
Katalityczna cis-dihydroksylacja olefin w kierunku
chiralnych wicynalnych dioli
w którym:
1.
R
1
, R
2
=CH
3
;
2.
R
1
=H, R
2
=CH
3
;
3.
R
1
=CH
3
,
R
2
=t-Bu;
4.
R
1
=H, R
2
=t-Bu;
Katalizator
Wydajność
epoksydu
%
ee
%
Konfiguracja
epoksydu
(S,S)-1
54
49
1S,2R-(-)
(S,S)-2
87
80
1S,2R-(-)
(S,S)-3
56
55
1S,2R-(-)
(S,S)-4
81
92
1S,2R-(-)
Ph
CH
3
+ NaOCl
(aq)
O
Ph
CH
3
CH
2
Cl
2
kat
Cl
O
N
N
O
Mn
t-Bu
R
2
t-Bu
R
2
R
1
R
1
Asymetryczna epoksydacja olefin
Czas (h)
18
28
18
36
16
46
30
Wydajnoś
ć (%)
80
80
80
80
90
72
65
ee (%)
88
94
98
95
95
81
82
O
N
N
O
Cr
t-Bu
t-Bu
t-Bu
t-Bu
H
H
Cl
O
R
R
Me
3
SiN
3
2%-mol. 1, Et
2
O
C
H
3
N
3
C
H
3
OSiMe
3
+
O
O
O
O
N
O
Fmoc
N
O
COCF
3
O
O
Me
Me
1
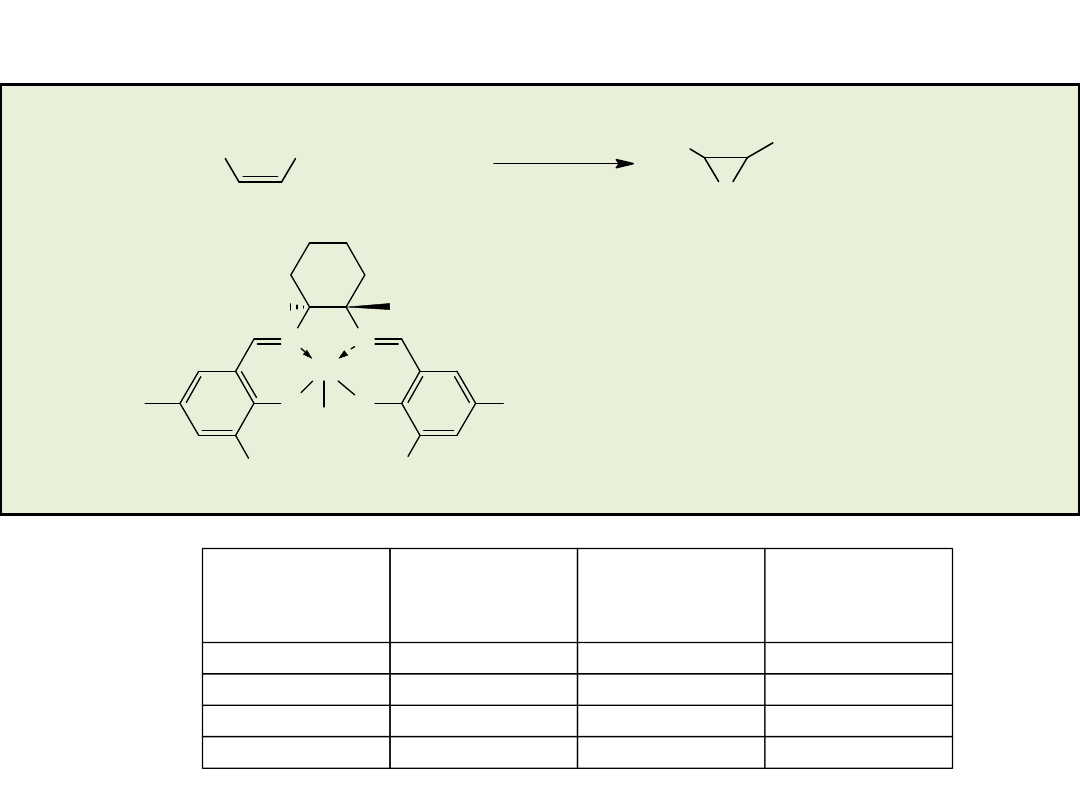
Asymetryczna addycja azydotrimetylosilanu do związków epoksydowych
Epoksyd
Me
3
SiN
3
(równoważni
k)
Czas
(h)
Konwers
ja
(%)
ee
(%)
Tlenek
styrenu
0,70
67
76
98 (R)
Epichlorohyd
ryna
0,60
21
80
97 (S)
O
Ph
O
CH
2
Cl
O
N
N
O
Cr
t-Bu
t-Bu
t-Bu
t-Bu
H
H
N
3
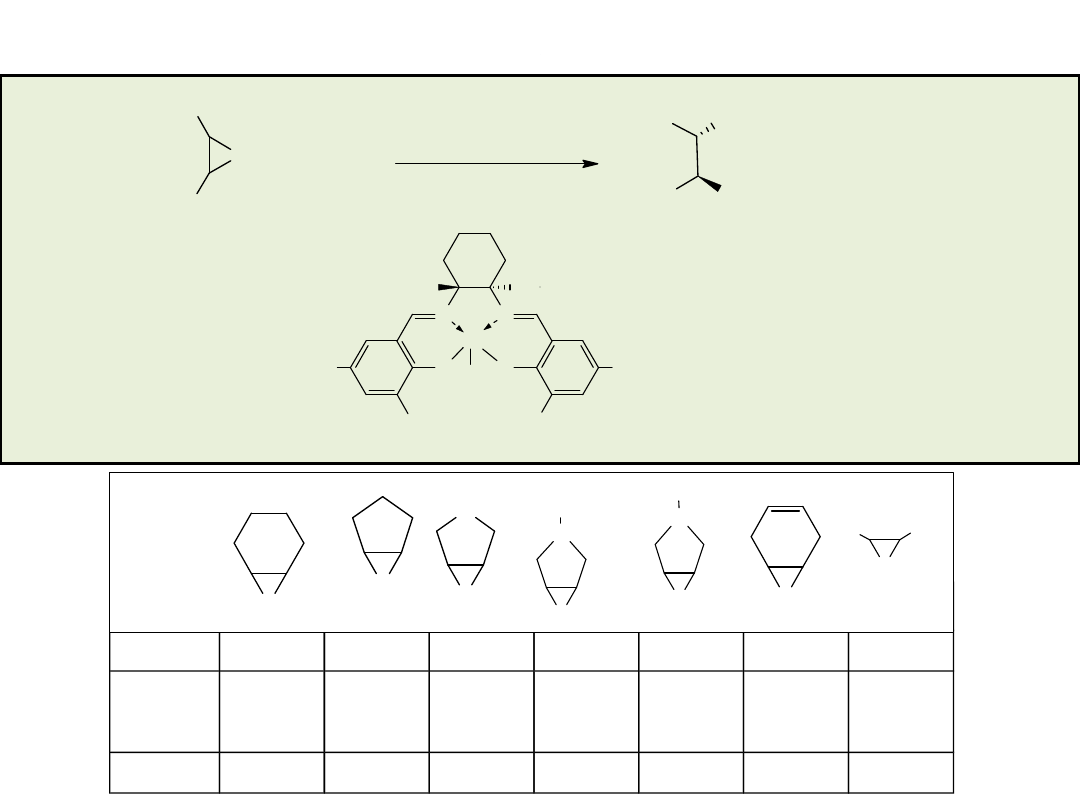
Kinetyczny rozdział racemicznych terminalnych
związków epoksydowych w reakcji z Me
3
SiN
3
w
obecności (R,R)-1
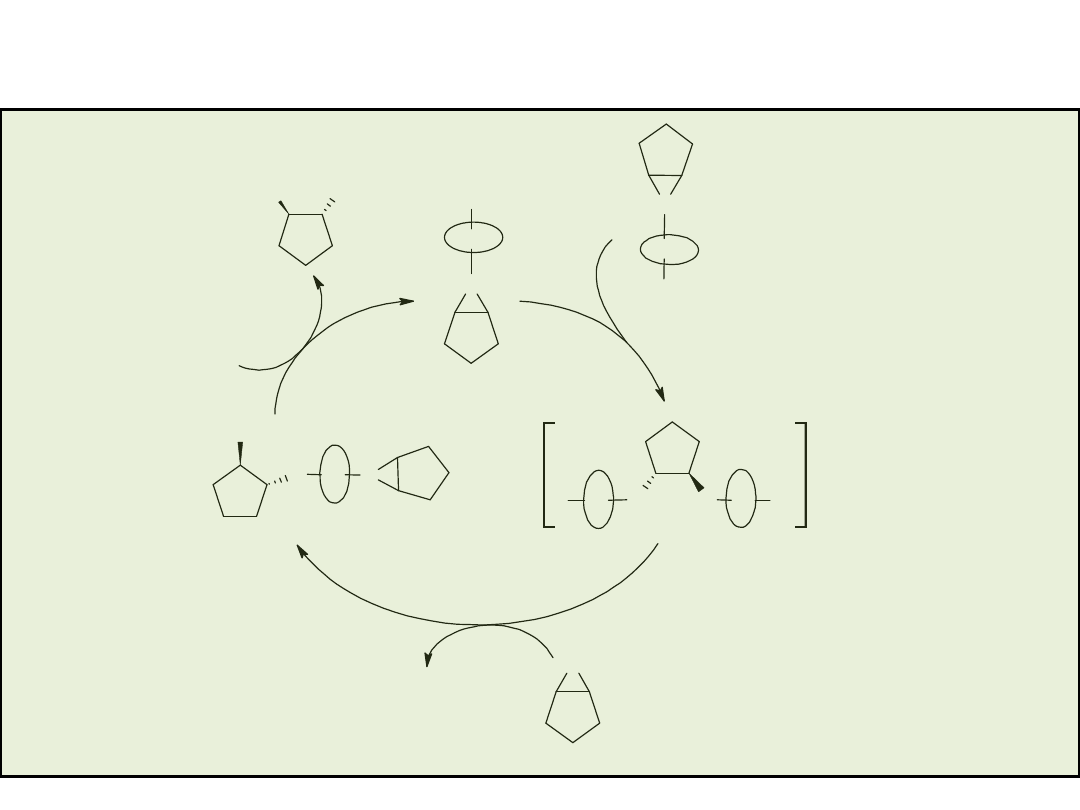
Mechanizm addycji Me
3
SiN
3
N
3
OH
O
Cr
N
3
O
Cr
N
3
N
3
O Cr N
3
Cr
L
O
O
N
3
Cr O
2
.
L
HN
3
1b
.
L
1b
.
L
O
N
N
O
Cr
t-Bu
t-Bu
t-Bu
H
H
N
3
O
O
O
O
O
N
N
O
Cr
t-Bu
t-Bu
t-Bu
H
H
N
3
n
R
Stężenie
Czas
(godz.
)
Epoksyd
Diol
k
rel
(S,S)-3
(%mol)
Woda
(równ.)
ee (%)
Wyd.
(%)
ee (%)
Wyd.
(%)
CH
3
0,2
0,55
12
>98
44
98
50
>4
00
CH
2
Cl
0,3
0,55
8
98
44
86
38
50
(CH
2
)
3
C
H
3
0,42
0,55
5
98
46
98
48
29
0
(CH
2
)
5
C
H
3
0,42
0,55
6
99
45
97
47
26
0
Ph
0,8
0,70
44
98
38
98
39
20
CH=CH
2
0,64
0,50
20
84
44
94
49
30
CH=CH
2
0,85
0,70
68
99
29
88
64
30
O
N
N
O
Co
t-Bu
t-Bu
t-Bu
t-Bu
H
H
OAc
O
R
H
2
O
O
R
O
H
OH
R
( S , S ) - 3
+
+
(�)
3
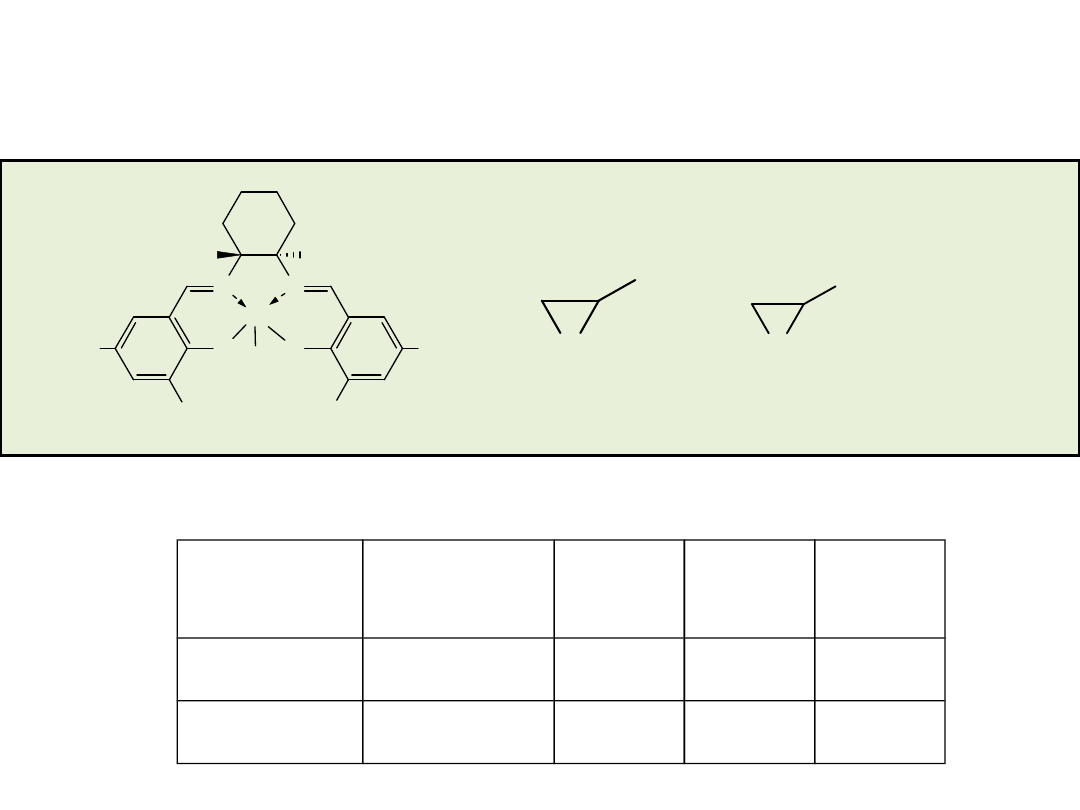
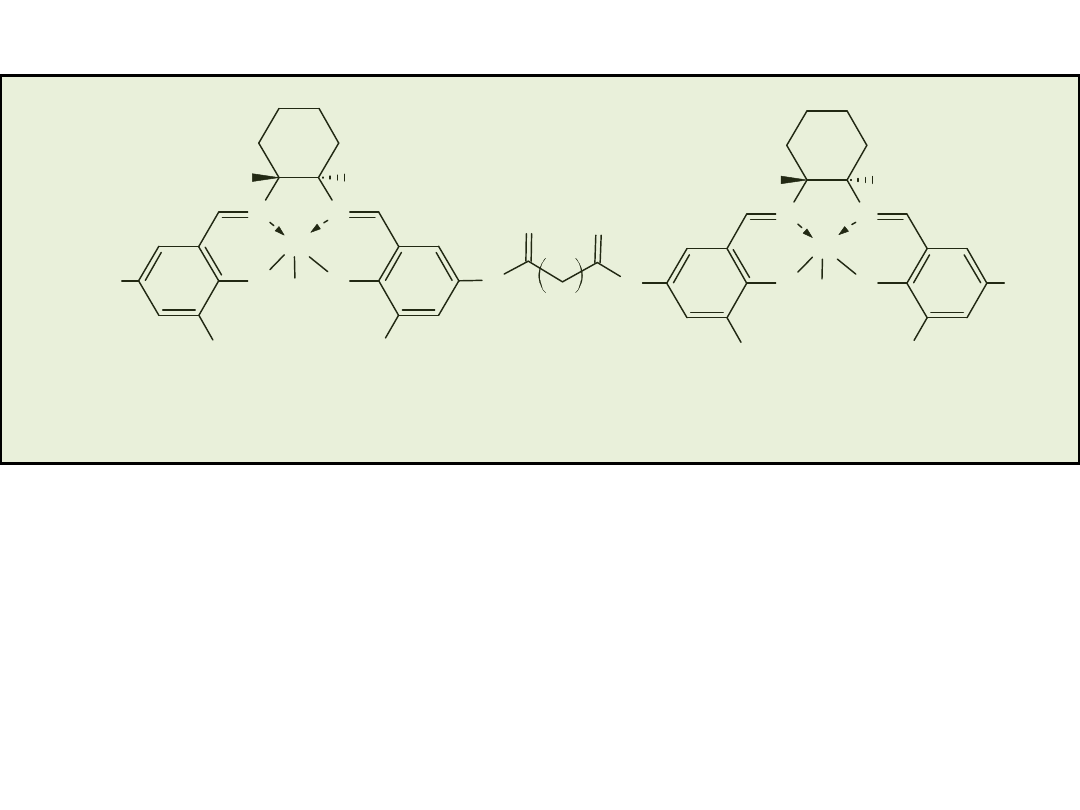
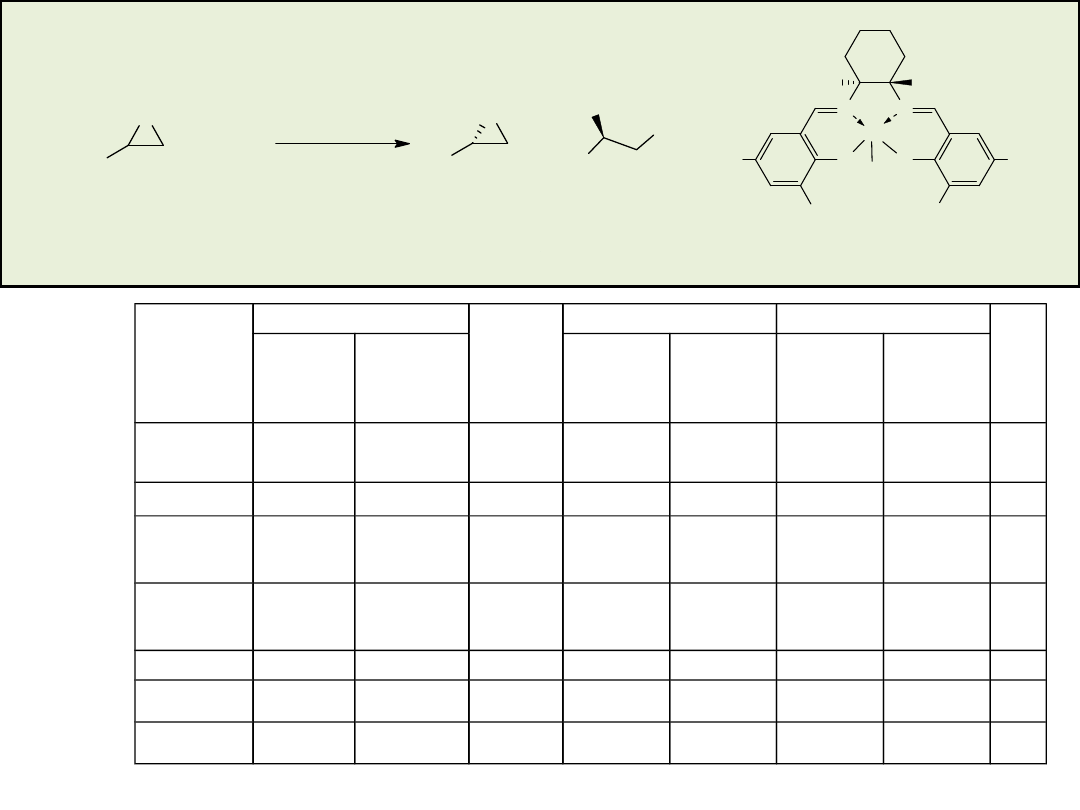
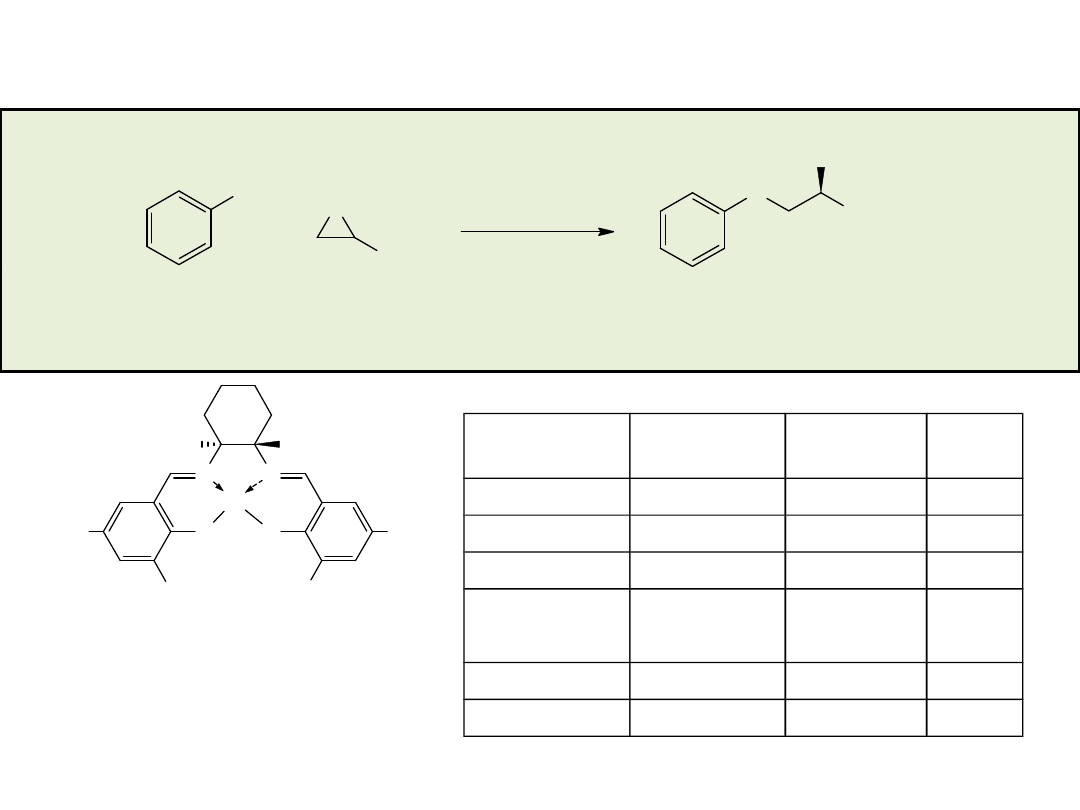
Hydrolityczny kinetyczny rozdział (HKR) terminalnych epoksydów
O
Cl
+
(�)
2%-mol. (R,R)-3
THF 24 h
O
Cl
(S)
Cl
OH
OH
(R)
0,50 r�wn. H
2
O, 4�
C:
0,55 r�wn. H
2
O, 4�
C:
0,30 r�wn. H
2
O, -10�
C:
96% ee, wyd. 44%
>99% ee, wyd. 42%
63% ee
96% ee, wyd. 50%
89% ee, wyd. 52%
98,7% ee, wyd. 27%
OH
+
O
R
(R,R)-4
O
R
OH
1,00 r�wnowa�nik
2,20 r�wnowa�nika
O
N
N
O
M
t-Bu
t-Bu
t-Bu
t-Bu
H
H
M = Co[OC(CF
3
)
3
](H
2
O)
4
Asymetryczne przyłączenie fenoli do związków
epoksydowych
R
Temperat
ura [°C]
Wydajno
ść [%]
ee
[%]
(CH
2
)
3
CH
3
25
97
98
CH
2
Cl
-15
97
99
CH
2
O(allil)
4
93
97
C(O)CH
2
C
H
3
-20
96
96
CO
2
CH
3
-20
98
96
C
6
H
5
-25
-
-
R
Równoważ
nik
Temperat
ura [°C]
Cza
s
[h]
Wydajno
ść [%]
ee
[%
]
H
0,044
25
12
97
98
p-CH
3
0,044
25
12
95
97
m-CH
3
0,044
25
16
99
99
o-CH
3
0,044
25
120
<5
-
p-Br
0,044
-15
12
92
99
o-Br
0,088
-30
48
98
92
p-OCH
3
0,088
4
18
75
99
p-NO
2
0,088
-20
18
93
91
p-(CH
2
)
2
NHBoc
0,044
25
12
86
99
1-naftol
0,044
25
96
-
-
Kinetyczny rozdział 1,2-epoksyheksanu reakcji z pochodnymi
fenolu w obecności kompleksu (R,R)-4
OH
+
O
CH
3
(R,R)-4
O
OH
CH
3
R

Przypomnienie:
TON (turnover number) = mol produktu/mol katalizatora;
określa produkcyjność katalizatora, determinuje koszt
katalizatora.
TOF
(turnover
frequency)
=
mol
produktu/mol
katalizatora/czas reakcji, h
-1
; charakteryzuje aktywność
katalizatora, wpływa na zdolność produkcyjną.

KATALIZA ASYMETRYCZNA
PROCESY PRZEMYSŁOWE

Commercial Applications
Relatively few enantioselective catalytic reactions are used on an
industrial scale today.
A major reason for this fact is that the application of enantioselective
catalysts
on a technical scale presents some very special challenges and
problems.
Chiral ligands and many metal precursors are expensive and/or not
easily available.
Typical costs for chiral diphosphines are US $ 100–500/g for laboratory
quantities
and US $ 5000 to >20000/kg on a large scale.
In addition, many other aspects have to be considered when
developing an enantioselective
catalytic reaction for industrial use:
– Catalyst separation, stability and poisoning
– Handling problems
– Recycling/regeneration of the catalyst
– Space time yield
– Process sensitivity
– Toxicity of metals and reagent
– Safety aspects as well as the need for high pressure equipment
As follows some processes heve been selected to illustrate both the
range of catalytic
reactions and their importance in key enabling reaction steps in the
manufacture
of specific products.
R
R’
TON
TOF, H-1
ee
Ph
3,5-ksylil
1 000
000
>300 000
79
p-
CF
3
Ph
3,5-ksylil
800
400
82
Ph
4-t-Bu-C
6
H
4
5 000
80
87
Ph
4-(n-Pr)
2
-N-3,5-ksylil 100 000
28 000
83
N
CH
3
O
NH
CH
3
O
Ir/PPF-PXyl
2
50
o
C, 80 bar
ee 80%
TON 2000000, TOF >400000 h
-1
PR
2
CH
3
PR'
2
Fe
PPF-PXyl
2
, R'=Xyl, R=Ph
SKALA ŚREDNIA DO DUŻEJ
Metalochlor jest aktywnym składnikiem Dualu, jednego z najważniejszych
herbicydów do zwalczania traw przy uprawie kukurydzy i innych płodów
rolnych.
(S)-Metachlor (Dual Magnum) (Ciba-
Geigy/Novartis/Solvias/Syngenta)
L-mentol (>1000 ton/rok)
7-hydroksycitronellal (10
ton/rok)
D- i L-citronellol (40
ton/rok)
7-metoksycitronellal (10
ton/rok)
3,7-dimetyloktanal (7
ton/rok)
NEt
2
NEt
2
Rh(binap)
2
+
100
o
C
ee 97%
TON 400 000
recykling katalizatora
(2% strat)
TOF 440 h
-1
NEt
2
trucizna katalizatora
PPh
2
PPh
2
binap
(-)-Menthol (Takasago)
Inne produkty otrzymywane na bazie tej technologii:
W latach 1983-1996 Takasago wyprodukowała 28 7000 ton (-)-
mentolu zużywając tylko 250 kg chiralnego ligandu BINAP’u
Citronellol (Takasago, Roche) – uwodornienie geraniolu
OH
OH
Ru(OOCCF
3
)
2
/binap
20
o
C, 100 bar
ee 97%
TON 50 000
TOF 500 h
-1
Reakcja wymaga specyficznego prekursora rutenowego i jest
wysoce chemoselektywna. Proces jest prowadzony przez
Tekasago w skali 300 t/rok.
Citronellol jest używany jako produkt pośredni w syntezie
witaminy E
RuI
2
cymene/tolbinap
ee 97%, de >94%
TON 1000
TOF 200 h
-1
NHCOPh
O
COOMe
NHCOPh
OH
COOMe
P(p-Tol)
2
P(p-Tol)
2
tolbinap
Półprodukty do antybiotyków Penem (Takasago)
Produkowane w ilości 50-120 ton/rok
Półprodukt do Oxafloxazin (Takasago)
Ru
2
Cl
4
Et
3
N/tolbinap
50
o
C, 25 bar
ee 94%
TON 2000, TOF 300 h
-1
OH
O
OH
OH
(R)-1,2-propanodiol jest półproduktem do syntezy (S)-oxafloxazin,
środka bakteriobójczego.
Esomeprasol (AstraZeneca)
N
S
N
N
OMe
H
OMe
Ti/det
~ 30
o
C
ee 92-93%
TON 3-4; TOF 3-4 h
-1
N
S
N
N
OMe
H
OMe
O
det: diethyl tartrate
Esomeprasol jest S enancjomerem Omeprazolu, najlepiej sprzedającej
się substancji antywrzodowej. Produkowany jest rocznie w
wielotonażowej skali.

Glicydol (PPG-Sipsy)
OH
Ti/dipt
< 0
o
C
ee 88-90%
TON>40; TOF <1 h
-1
OH
O
dipt: diisopropyl tartate
Pierwszą instalację do produkcji glicydolu w wielkiej skali, bazującą
na technologii asymetrycznej epoksydacji Sharpless’a, uruchomiła
pod koniec lat 80-tych XX wieku firma Arco Chemical.
Glicydol jako blok budulcowy (building block) C
3
jest związkiem o
wielu zastosowaniach.
OH
OH
Co/salen
5-25
o
C
k
rel
~400
TON (recykl) > 1500;
TOF ~ 40 h
-1
R
O
R
O
+ H
2
O
OH
N
N
O
H
t-Bu
t-Bu
t-Bu
t-Bu
salen
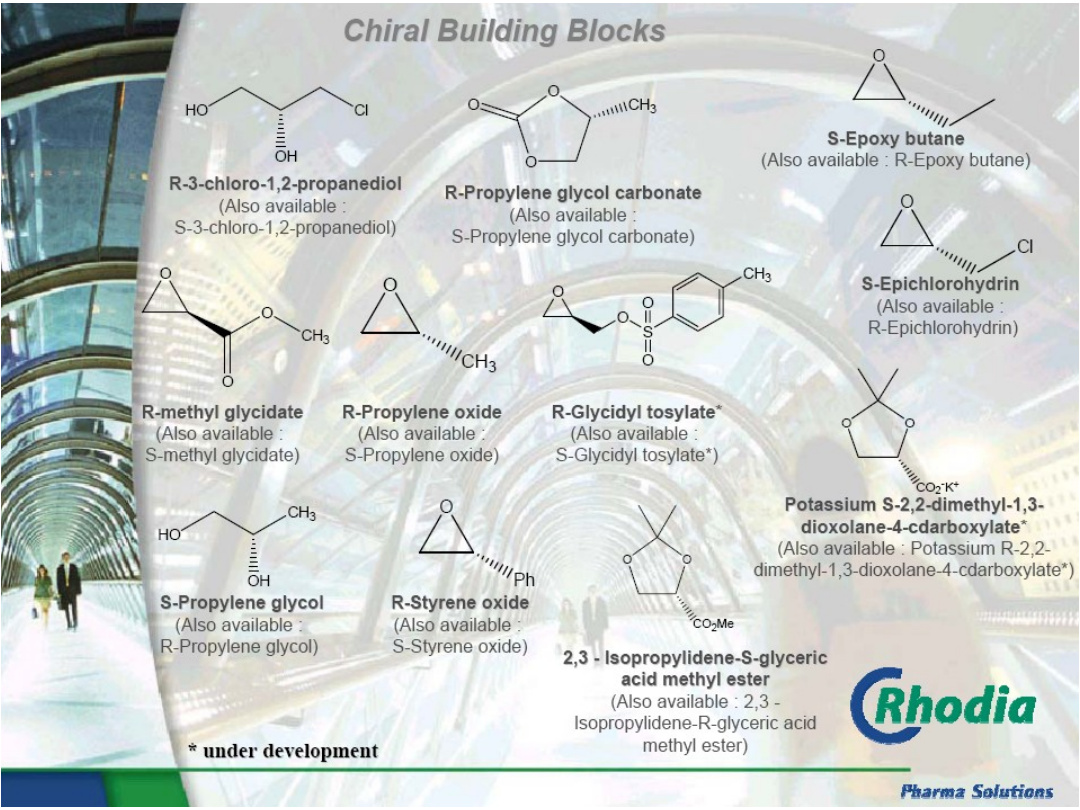
Epoxide and Diol building blocks (ChiREx)
Produkcja chiralnych epoksydów i 1,2-dioli w reakcji
hydrolitycznego
kinetycznego
rozdziału racemicznych
epoksydów (Jacobsen’s hydrolytic kinetic resolution) jest
jedną z najnowszych technologii syntezy asymetrycznej.
Proces służy do rozdziału tlenku propylenu, tlenku styrenu i
epichlorohydryny w multi 100 kg skali.
Rh/PPF-P(t-Bu)
2
80
o
C, 10 bar
de 99%
TON 2000
NH
N
O
O
O
NH
N
O
O
O
H
H
PR
2
CH
3
PR'
2
Fe
PPF-P(cy)
2
, R=Ph, R'=c-Hex
PPF-P(t-Bu)
2
, R=Ph, R'=t-Bu
PPF-PPh
2
, R=Ph, R'=Ph
Biotina (Lonza)
(rozpuszczalna w wodzie witamina)
Rh
+
/eniphos
25
o
C, 3 bar
ee 83%
TON 15 000, TOF 5000 h
-1
N
OH
O
O
H
H
N
OH
O
O
H
N
Ph
2
P
N
PPh
2
H
H
eniphos
Aspartam (Enichem/Anic)
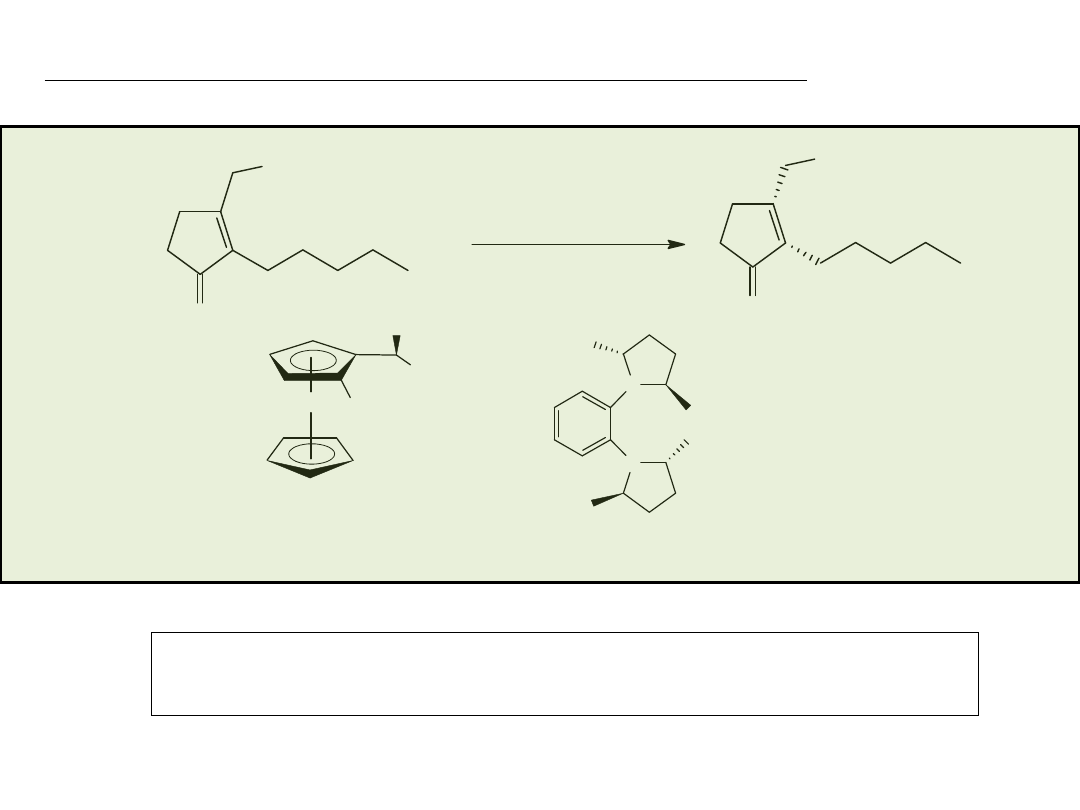
COOMe
O
COOMe
O
Ru/PPF-PCy
2
lub
Me-duphos
temp. pok., 90 bar
ee 90%
TON 2000; TOF200 h
-1
P
P
Me-duphos
PPh
2
CH
3
P(c-hex)
2
Fe
PPF-PCy
2
(+)-cis-Methyl dihydrojasmonate (Firmenich)
Methyl dihydrojasmonates są wszechobecnymi
perfumeryjnymi komponentami.
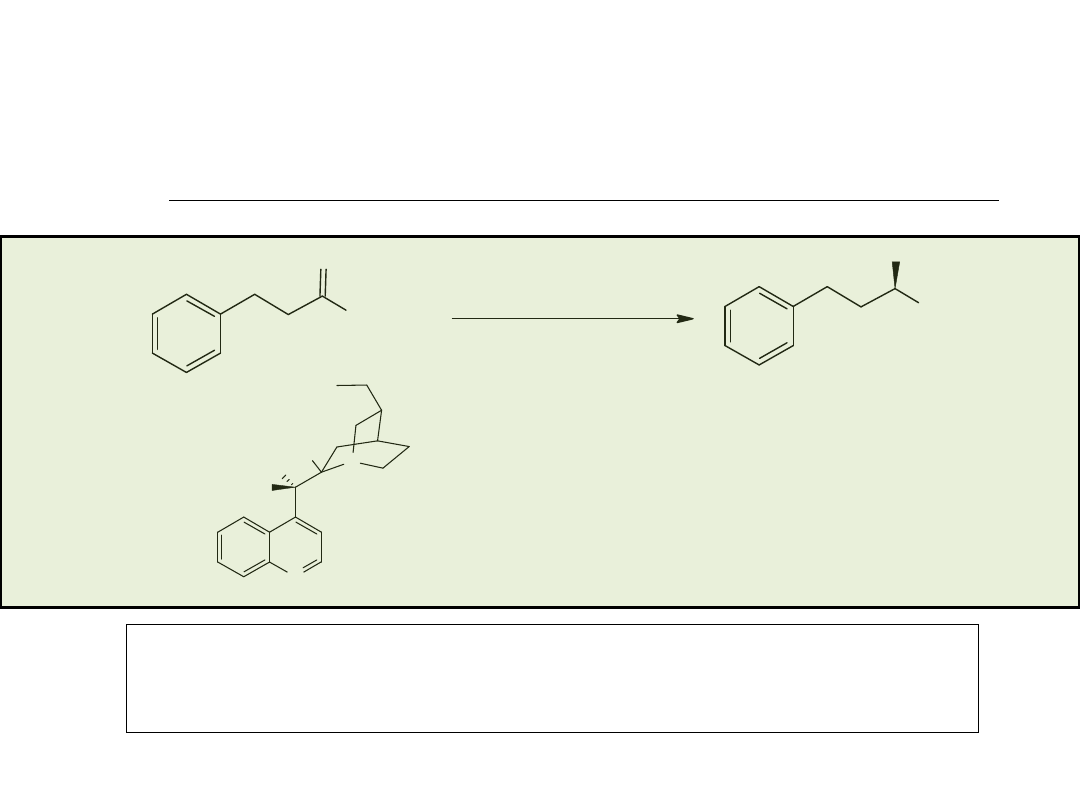
Pt-Al
2
O
3
/HCd (MeO-HCd)
25
o
C., 60 bar
ee 82(92)%
TON 4000; TOF 1000 h
-1
COOEt
O
COOEt
OH
N
N
O
H
H
H
HCd
PROCESY PRODUKCYJNE W MAŁEJ SKALI
Heterogeniczne uwodornienie 2-okso-4-fenylomaślanu
etylu, HPB ester (Ciba-Geigy/Solvias, Ciba LSM/Solvias)
Ester etylowy kwasu hydroksy-4-fenylomasłowego tzw. HPB
ester, jest ważnym półproduktem w syntezie kilku
inhibitorów ACE (leki nasercowe).
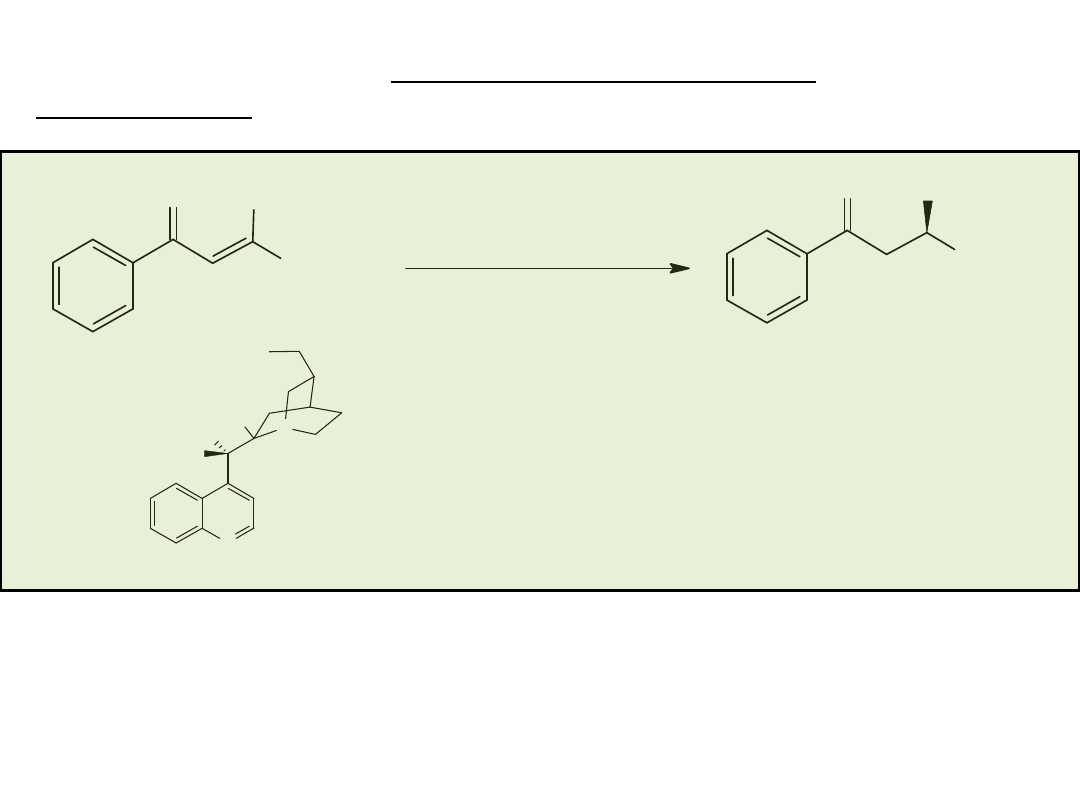
Pt-Al
2
O
3
/HCd
25
o
C., 10-60 bar
ee 70-86)%
TON 400; TOF 150 h
-1
COOEt
OH
O
COOEt
OH
O
N
N
O
H
H
H
HCd
Heterogeniczne uwodornienie 2,4-diokso-4-
fenylomaślanu etylu (Ciba-Geigy/Solvias, Ciba
LSM/Solvias)
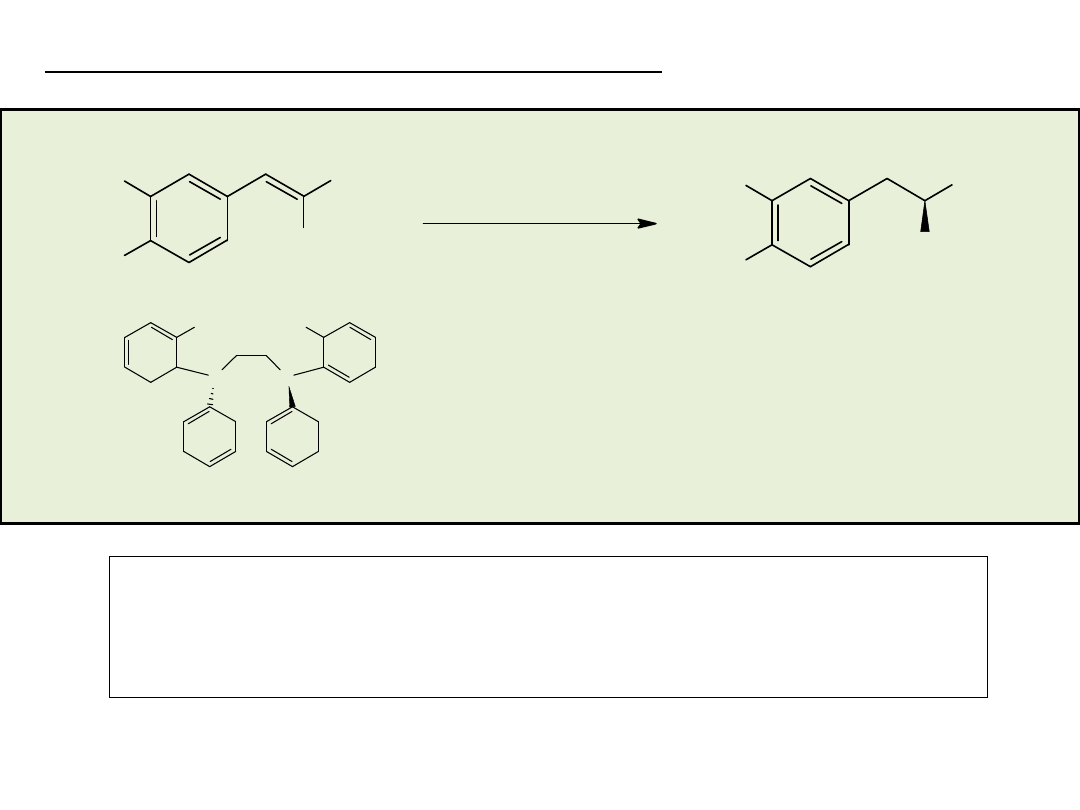
MeO
AcO
NHAc
COOH
MeO
AcO
NHAc
COOH
Rh/dipamp
25
o
C, 10 bar
ee 95%
TON 20 000; TOF 1000 h
-1
P
P
OMe
MeO
dipamp
L-Dopa (Monsanto, VEB Isis-Chemie)
Na podstawie odkryć Knowles’a Monsanto produkuje od wielu
lat L-dopa, lek na chorobę Parkinsona, w skali ok. 1 tony
rocznie. Instalacja firmy niemieckiej VEB Isis-Chemie jest
podobnej skali.
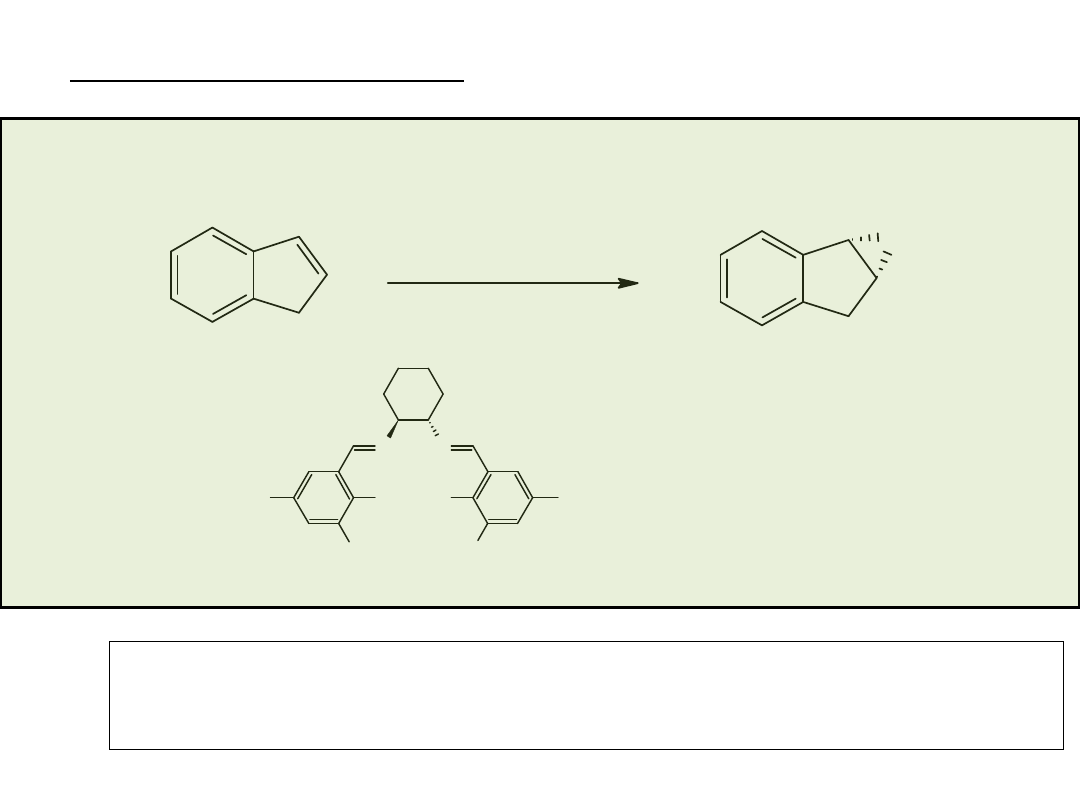
Mn/salen/P
3
NO
H
2
O-PhCl, 5
o
C
ee 88%
TON>250; TOF 250 h
-1
O
OH
N
N
O
H
t-Bu
t-Bu
t-Bu
t-Bu
salen
Tlenek indenu (ChiRex)
Epoksydacja indenu jest korzystną drogą do otrzymywania cis-1-
amino-2-indanolu, półproduktu w syntezie Crixivan’u (inhibitora HIV-
protease wytwarzanego przez Merck).
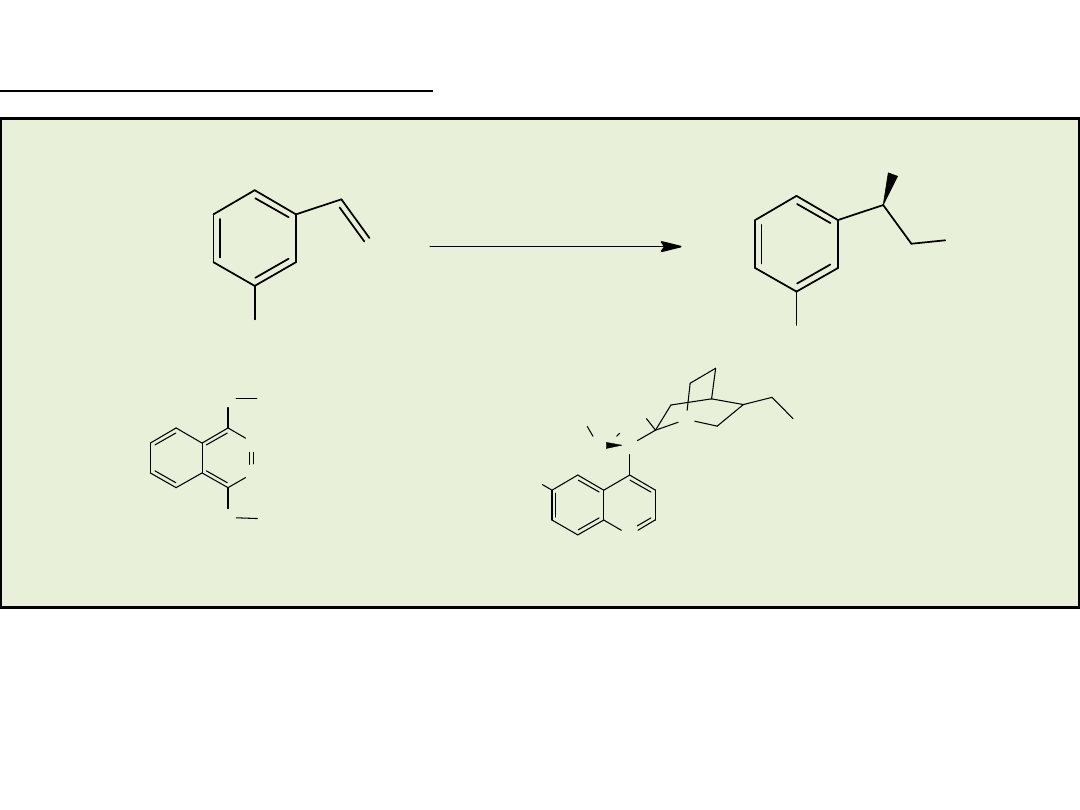
Os/(DHQD)
2
PHAL
20
o
C
ee 95%
TON>500
TOF 50-100 h
-1
Cl
Cl
OH
OH
(DHQD)
2
PHAL
N
C
9
N
O
H
H
Phal
MeO
PHAL
N
N
O
O
C
9
C
9
Diol building blocks (ChiRex)
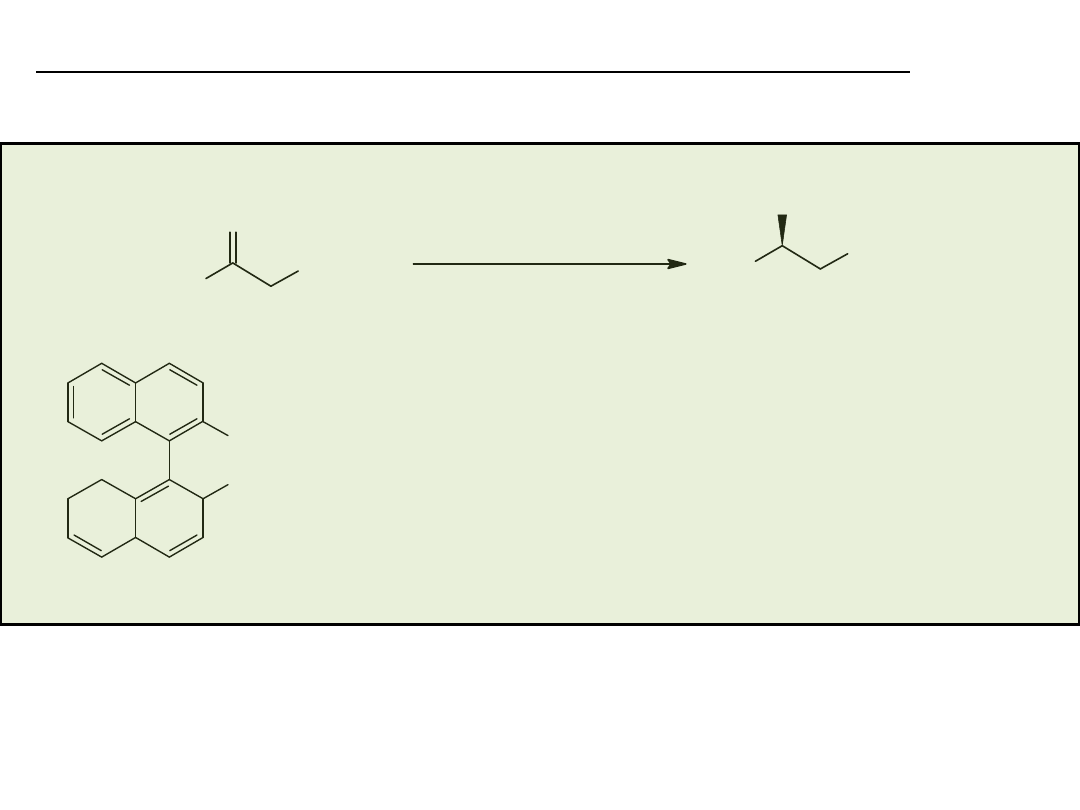
RuCl
2
/binap
80
o
C., 6-70 bar
ee 98-99%
TON 10 000-20 000
TOF 12 000 h
-1
R
COOR'
O
R
COOR'
OH
PPh
2
PPh
2
binap
b-Hydroxy ester building blocks (NSC Technologies)
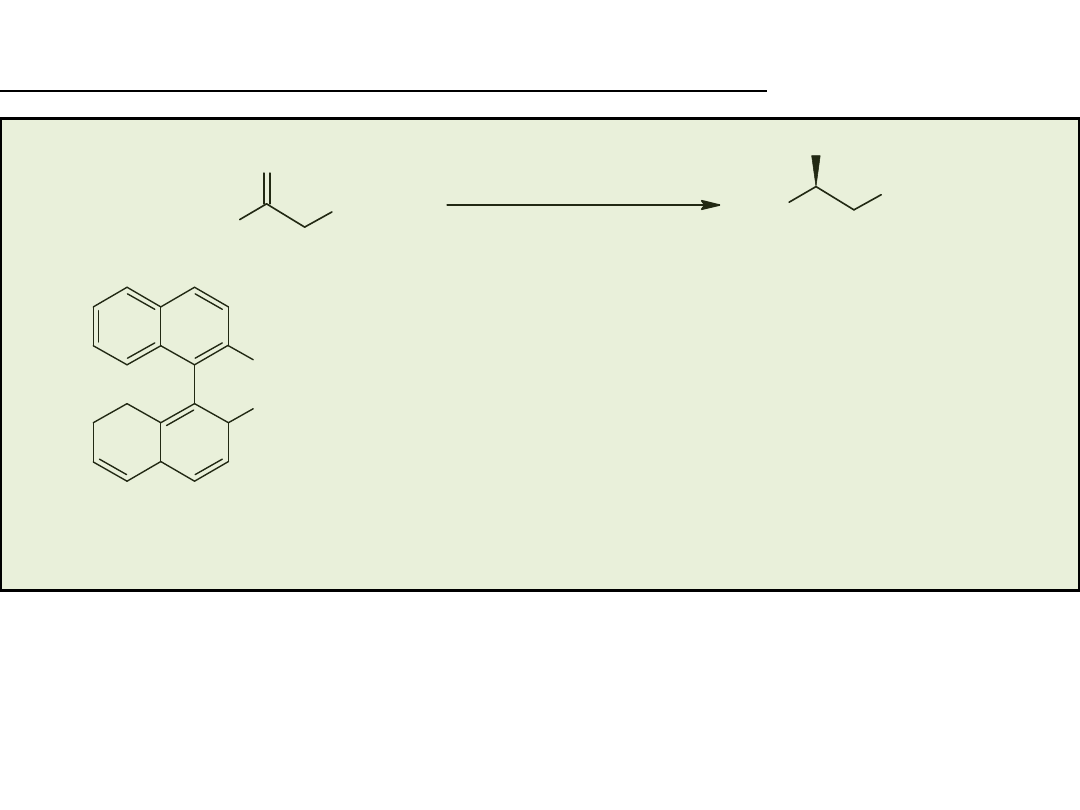
RuCl
2
/binap
80
o
C., 6-70 bar
ee 98-99%
TON 10 000-20 000
TOF 12 000 h
-1
R
COOR'
O
R
COOR'
OH
PPh
2
PPh
2
binap
b-Hydroxy ester building blocks (NSC Technologies)
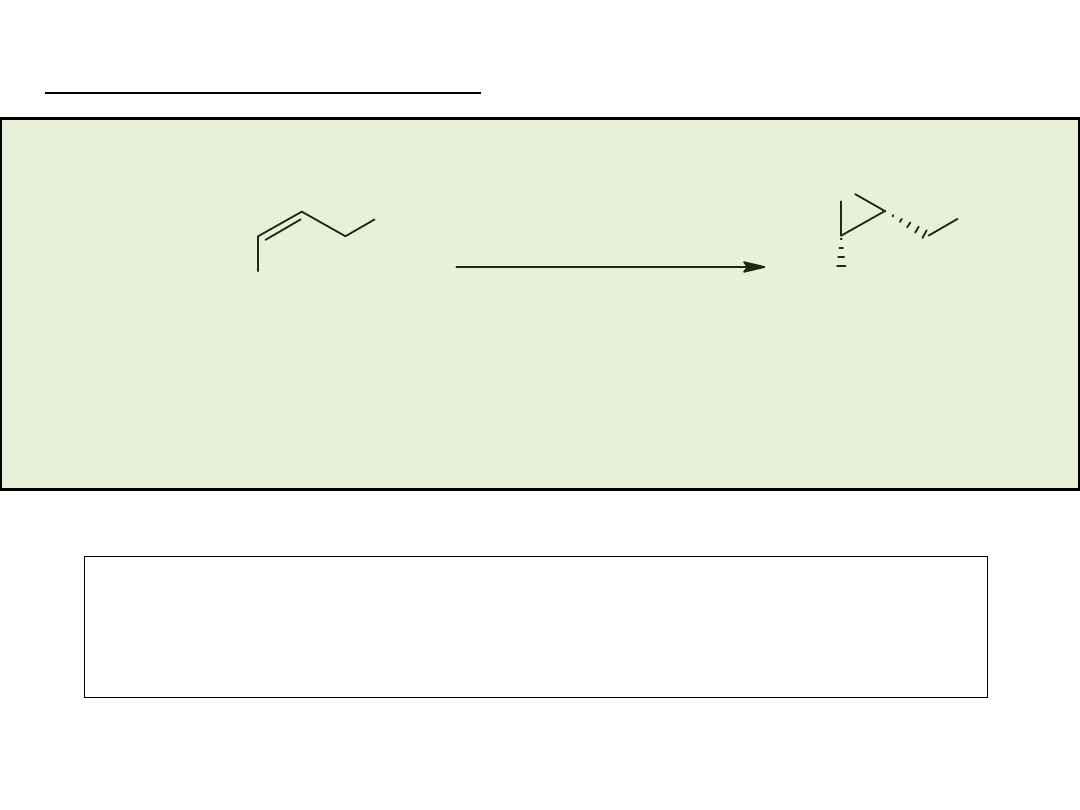
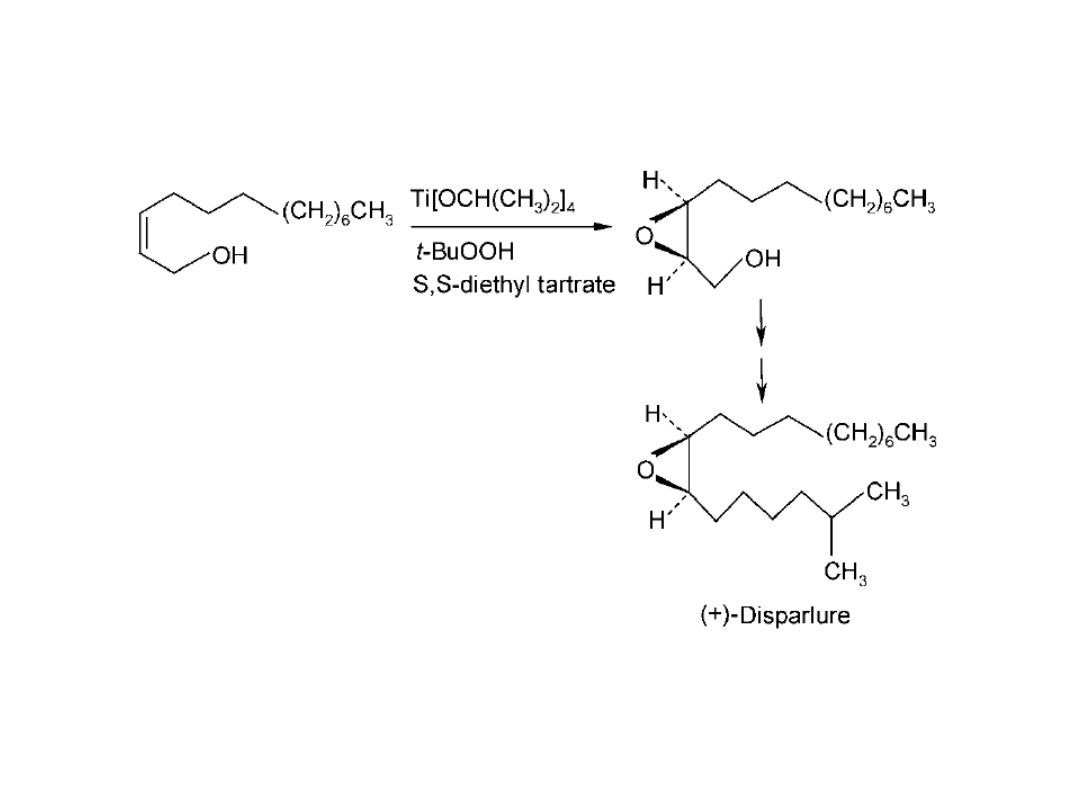
dipt:
diisopropyl
tartrate
(winian
diizopropylowy)
Disparlure (J.T. Baker Co.)
Ti/dipt
<0
o
C.
ee 91%
TON 10
C
10
H
21
OH
C
10
H
21
OH
O
n-
n-
Synteza feromonu brudnicy nieparki, jednego z najgroźniejszych
szkodników sadów (gąsienice tego motyla zjadają liście i kwiaty
drzew jabłoni) stworzyła możliwość efektywnej ochrony sadów
przed tym szkodnikiem.
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
- Slide 41
- Slide 42
- Slide 43
- Slide 44
- Slide 45
- Slide 46
- Slide 47
- Slide 48
- Slide 49
- Slide 50
- Slide 51
Wyszukiwarka
Podobne podstrony:
Kataliza asymetryczna organokataliza(1)
Asymetria Informacyjna 2
Przeciwciała katalityczne u zdrowych ludzi i pacjentów z
bez katalizatora
Kataliza Monograficzny gr1 wyniki
Chemia kataliza, Szkoła, penek, Przedmioty, Chemia, Laboratoria
miary asymetrii, Socjologia I rok
Miary zróżnicowania, asymetrii, koncentracji (9 03)
04 Kinetyka reakcji chemicznych i kataliza
Projektowanie nowych białek o zadanych właściwościach katalitycznych
oś Katalizatory
ELEMENTY KATALIZY, NAUKA, WIEDZA
modelowanie DFT w katalizie heterogenicznej
adsorpcja zestaw ziolo, sem 1, Kataliza (magdapliki), EGZ
Zagrożenia asymetryczne
asymetria funkcjonalna mozgu py Nieznany (2)
więcej podobnych podstron