
METODY
MIARECZKOWE
METODY
MIARECZKOWE
PRZYGOTOWAŁA:
LEWANDOWSKA KAMILA
PRZYGOTOWAŁA:
LEWANDOWSKA KAMILA

PODSTAWOWE TERMINY I POJĘCIA
PODSTAWOWE TERMINY I POJĘCIA
• Metody miareczkowe – służą do
oznaczania analitów w roztworach.
Sygnałem analitycznym jest objętość
titrantu, czyli roztworu używanego do
miareczkowania, którego stężenie
czyli miano zostało wyznaczone
(nastawione)
z
wymaganą
dokładnością.
• Metody miareczkowe – służą do
oznaczania analitów w roztworach.
Sygnałem analitycznym jest objętość
titrantu, czyli roztworu używanego do
miareczkowania, którego stężenie
czyli miano zostało wyznaczone
(nastawione)
z
wymaganą
dokładnością.

• Titrant – roztwór odczynnika o ściśle
określonym
stężeniu,
czyli
mianie.
Stężenie takiego roztworu powinno być
określane minimum do 4 cyfr znaczących.
• Analit w chemii analitycznej jest to
składnik
próbki,
który
podlega
oznaczaniu. Analit może być składnikiem
roztworu,
mieszaniny
gazów,
czy
składnikiem ciała stałego. Przykładem
mogą być odpowiednio jony chlorkowe
oznaczane w roztworze soli kuchennej,
tlen oznaczany w powietrzu, czy żelazo
oznaczane w stali
• Titrant – roztwór odczynnika o ściśle
określonym
stężeniu,
czyli
mianie.
Stężenie takiego roztworu powinno być
określane minimum do 4 cyfr znaczących.
• Analit w chemii analitycznej jest to
składnik
próbki,
który
podlega
oznaczaniu. Analit może być składnikiem
roztworu,
mieszaniny
gazów,
czy
składnikiem ciała stałego. Przykładem
mogą być odpowiednio jony chlorkowe
oznaczane w roztworze soli kuchennej,
tlen oznaczany w powietrzu, czy żelazo
oznaczane w stali

• Roztwór mianowany - jest to roztwór
związku chemicznego o precyzyjnie
zmierzonym
stężeniu.
Roztwory
mianowane pełnia zasadnicza role we
wszystkich miareczkowych metodach
analizy. Roztwory te musza mieć
odpowiednie właściwości, powinny być
znane metody ich przygotowania i
sposoby wyrażania stężeń (znane
stężenie
molowe
określonego
składnika lub znane miano). Roztwory
mianowane są dostępne w handlu
(„odważki analityczne”, „fiksanale”).
• Roztwór mianowany - jest to roztwór
związku chemicznego o precyzyjnie
zmierzonym
stężeniu.
Roztwory
mianowane pełnia zasadnicza role we
wszystkich miareczkowych metodach
analizy. Roztwory te musza mieć
odpowiednie właściwości, powinny być
znane metody ich przygotowania i
sposoby wyrażania stężeń (znane
stężenie
molowe
określonego
składnika lub znane miano). Roztwory
mianowane są dostępne w handlu
(„odważki analityczne”, „fiksanale”).

• Odważka analityczna to określona
ilość czystej substancji (w postaci
odważki
substancji
stałej
lub
precyzyjnie odmierzonej objętości
roztworu umieszczona w ampułce),
przeznaczona
do
przygotowania
roztworu mianowanego. Po otwarciu
ampułki
wystarczy
spłukać
ją
ilościowo do kolby miarowej o
podanej objętości i po dopełnieniu
woda do kreski otrzymuje sie roztwór
o żądanym stężeniu.
• Odważka analityczna to określona
ilość czystej substancji (w postaci
odważki
substancji
stałej
lub
precyzyjnie odmierzonej objętości
roztworu umieszczona w ampułce),
przeznaczona
do
przygotowania
roztworu mianowanego. Po otwarciu
ampułki
wystarczy
spłukać
ją
ilościowo do kolby miarowej o
podanej objętości i po dopełnieniu
woda do kreski otrzymuje sie roztwór
o żądanym stężeniu.

•
Fiksanal - odważka analityczna odczynnika
chemicznego (w postaci stałej lub roztworu),
przechowywana w ampułce, wykonanej ze szkła
lub
tworzywa
syntetycznego
w
formie
umożliwiającej
ilościowe
przeniesienie
odczynnika
do
kolby
miarowej.
Fiksanal
umożliwia szybkie sporządzenie roztworów o
ustalonym stężeniu danego odczynnika, z bardzo
niewielkim błędem, dzięki czemu mianowanie
roztworu w przypadku niektórych rodzajów analiz
może zostać pominięte. Najczęściej stosowane
fiksanale zawierają kwas solny (HCl) lub
wodorotlenek sodu (NaOH), ale spotyka się
również
inne
kwasy,
zasady,
sole
do
sporządzania roztworów wzorcowych kationów
metali do analizy śladowej itd.
•
Fiksanal - odważka analityczna odczynnika
chemicznego (w postaci stałej lub roztworu),
przechowywana w ampułce, wykonanej ze szkła
lub
tworzywa
syntetycznego
w
formie
umożliwiającej
ilościowe
przeniesienie
odczynnika
do
kolby
miarowej.
Fiksanal
umożliwia szybkie sporządzenie roztworów o
ustalonym stężeniu danego odczynnika, z bardzo
niewielkim błędem, dzięki czemu mianowanie
roztworu w przypadku niektórych rodzajów analiz
może zostać pominięte. Najczęściej stosowane
fiksanale zawierają kwas solny (HCl) lub
wodorotlenek sodu (NaOH), ale spotyka się
również
inne
kwasy,
zasady,
sole
do
sporządzania roztworów wzorcowych kationów
metali do analizy śladowej itd.

Rys: Fiksanal zawierający 24, 820 g pięciowodnego
tiosiarczanu sodu.
Rys: Fiksanal zawierający 24, 820 g pięciowodnego
tiosiarczanu sodu.

• Mianowanie, czyli nastawianie
miana – postępowanie mające na
celu wyznaczenie miana roztworu do
miareczkowania.
Miano
titratu
ustawia się bezpośrednio na odważki
substancji
podstawowych
lub
bezpośrednio na inny mianowany
roztwór titrat, który spełnia wówczas
rolę substancji odniesienia
• Mianowanie, czyli nastawianie
miana – postępowanie mające na
celu wyznaczenie miana roztworu do
miareczkowania.
Miano
titratu
ustawia się bezpośrednio na odważki
substancji
podstawowych
lub
bezpośrednio na inny mianowany
roztwór titrat, który spełnia wówczas
rolę substancji odniesienia

Biureta
jest
to
sprzęt laboratoryjny
o kształcie zazwyczaj
długiej i cienkiej rurki
szklanej,
z
precyzyjną
skalą
objętości, która jest
od dołu zakończona
kranikiem
i
precyzyjnie
wykonanym
"dzióbkiem".
Podstawowym
zadaniem
biurety
jest
precyzyjne
odmierzanie cieczy w
czasie
miareczkowania,
chociaż bywa ona
używana także do
innych celów - np.
szybkiego
przygotowywania
roztworów
mianowanych.
Biureta
jest
to
sprzęt laboratoryjny
o kształcie zazwyczaj
długiej i cienkiej rurki
szklanej,
z
precyzyjną
skalą
objętości, która jest
od dołu zakończona
kranikiem
i
precyzyjnie
wykonanym
"dzióbkiem".
Podstawowym
zadaniem
biurety
jest
precyzyjne
odmierzanie cieczy w
czasie
miareczkowania,
chociaż bywa ona
używana także do
innych celów - np.
szybkiego
przygotowywania
roztworów
mianowanych.
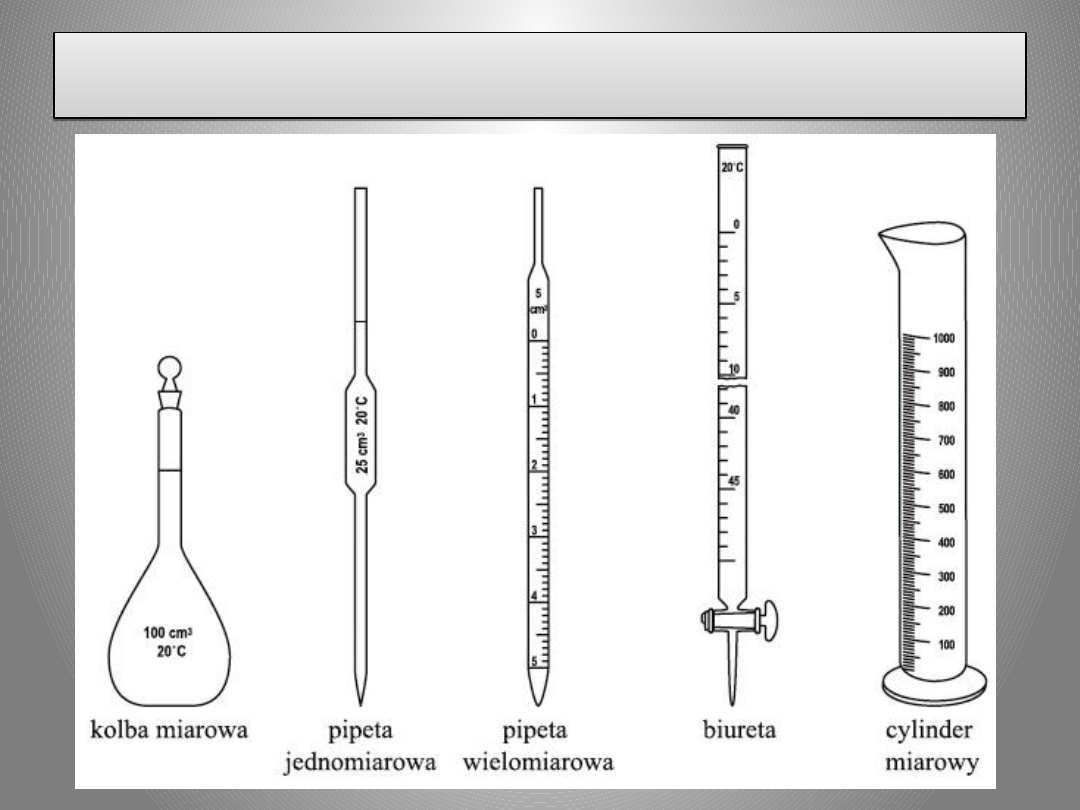
SPRZĘT LABORATORYJNY
SPRZĘT LABORATORYJNY

• Analiza miareczkowa jest działem
analizy ilościowej, której podstawą
jest miareczkowanie.
• Analiza miareczkowa jest działem
analizy ilościowej, której podstawą
jest miareczkowanie.

• Miareczkowanie
to
czynność
polegająca na dodawaniu titranta tj.
roztworu zawierającego reagent o
znanym
stężeniu,
do
roztworu
zawierającego jeden lub więcej
oznaczanych składników. Roztwór
titranta
dodaje
się
z
biurety
stopniowo,
małymi
porcjami
(miarami), stąd nazwa – analiza
miareczkowa.
• Miareczkowanie
to
czynność
polegająca na dodawaniu titranta tj.
roztworu zawierającego reagent o
znanym
stężeniu,
do
roztworu
zawierającego jeden lub więcej
oznaczanych składników. Roztwór
titranta
dodaje
się
z
biurety
stopniowo,
małymi
porcjami
(miarami), stąd nazwa – analiza
miareczkowa.

• Aby móc oznaczyć daną substancję
w roztworze trzeba znaleźć sposób,
który pozwoli łatwo wyznaczyć punkt,
w którym cały oznaczony składnik
przereagował z titrantem. W tym
punkcie
należy
zakończyć
miareczkowanie i zmierzyć (odczytać
na biurecie) objętość titrata.
• Aby móc oznaczyć daną substancję
w roztworze trzeba znaleźć sposób,
który pozwoli łatwo wyznaczyć punkt,
w którym cały oznaczony składnik
przereagował z titrantem. W tym
punkcie
należy
zakończyć
miareczkowanie i zmierzyć (odczytać
na biurecie) objętość titrata.

• Punkt
miareczkowanie
(objętość
titranta),
który
odpowiada
(teoretycznie) stechiometrycznemu
przereagowaniu
oznaczanego
składnika z dodawanym titrantem
nazywa
się
punktem
równoważności miareczkowania
(PR).
Istnieją
różne
sposoby
pozwalające
na
ustalenie
tego
punktu.
• Punkt
miareczkowanie
(objętość
titranta),
który
odpowiada
(teoretycznie) stechiometrycznemu
przereagowaniu
oznaczanego
składnika z dodawanym titrantem
nazywa
się
punktem
równoważności miareczkowania
(PR).
Istnieją
różne
sposoby
pozwalające
na
ustalenie
tego
punktu.

• Punkt
miareczkowania
(objętość
titranta),
w
którym
wystąpi
odpowiednia zmiana , świadcząca o
osiągnięciu
lub
nieznacznym
przekroczeniu
punktu
równoważności,
nazywa
się
punktem
końcowym
miareczkowania (PK). W idealnym
przypadku, do którego dążymy,
punkt równoważności pokrywa się z
punktem końcowym.
• Punkt
miareczkowania
(objętość
titranta),
w
którym
wystąpi
odpowiednia zmiana , świadcząca o
osiągnięciu
lub
nieznacznym
przekroczeniu
punktu
równoważności,
nazywa
się
punktem
końcowym
miareczkowania (PK). W idealnym
przypadku, do którego dążymy,
punkt równoważności pokrywa się z
punktem końcowym.

• Znając objętość roztworu titranta
odpowiadającą punktowi końcowemu
miareczkowania
(PK)
oraz
jego
dokładne stężenie, na podstawie
stechiometrii
reakcji
będącej
podstawą miareczkowania, wyznacza
się
zawartość
(stężenie)
oznaczanego składnika.
• Znając objętość roztworu titranta
odpowiadającą punktowi końcowemu
miareczkowania
(PK)
oraz
jego
dokładne stężenie, na podstawie
stechiometrii
reakcji
będącej
podstawą miareczkowania, wyznacza
się
zawartość
(stężenie)
oznaczanego składnika.

• Czasami
do
wyznaczenia
PK
wykorzystuje
się
krzywą
miareczkowania.
Krzywa
miareczkowania
jest
obrazem
graficznym
zależności
pomiędzy
pewnym
parametrem
charakteryzującym
przebieg
miareczkowania (np. pH) a objętością
dodanego titranta wyrażoną w ml.
• Czasami
do
wyznaczenia
PK
wykorzystuje
się
krzywą
miareczkowania.
Krzywa
miareczkowania
jest
obrazem
graficznym
zależności
pomiędzy
pewnym
parametrem
charakteryzującym
przebieg
miareczkowania (np. pH) a objętością
dodanego titranta wyrażoną w ml.

• Ze
względu
na
typ
reakcji
zachodzącej
podczas
miareczkowania,
pomiędzy
oznaczaną substancją a roztworem
titranta,
metody
miareczkowe
dzielimy na:
Alkacymetrię
Redoksometrię
Miareczkowanie stąceniowe
Kompleksometrię
• Ze
względu
na
typ
reakcji
zachodzącej
podczas
miareczkowania,
pomiędzy
oznaczaną substancją a roztworem
titranta,
metody
miareczkowe
dzielimy na:
Alkacymetrię
Redoksometrię
Miareczkowanie stąceniowe
Kompleksometrię

• Alkacymetria – opiera się na
reakcjach zobojętniania (kwas –
zasada) i obejmuje dwa działy:
alkalimetrię (oznaczanie substancji
przez miareczkowanie mianowanym
roztworem zasady) oraz acydymetrię
(oznaczanie
substancji
przez
miareczkowanie
mianowanym
roztworem kwasu).
• Alkacymetria – opiera się na
reakcjach zobojętniania (kwas –
zasada) i obejmuje dwa działy:
alkalimetrię (oznaczanie substancji
przez miareczkowanie mianowanym
roztworem zasady) oraz acydymetrię
(oznaczanie
substancji
przez
miareczkowanie
mianowanym
roztworem kwasu).

• Redoksometria – opiera się na
reakcjach utleniania i redukcji, i
obejmuje dwa działy: oksydymetrię
(oznaczanie
substancji
przez
miareczkowanie
mianowanymi
roztworami
utleniaczy),
reduktometrię (oznaczanie substancji
przez miareczkowanie mianowanymi
roztworami reduktorów). W obu
działach wyróżnia się dodatkowo
kilka grup metod miareczkowych,
których nazwy tworzy się od nazwy
stosowanego
titranta,
np.
manganometria, jodometria.
• Redoksometria – opiera się na
reakcjach utleniania i redukcji, i
obejmuje dwa działy: oksydymetrię
(oznaczanie
substancji
przez
miareczkowanie
mianowanymi
roztworami
utleniaczy),
reduktometrię (oznaczanie substancji
przez miareczkowanie mianowanymi
roztworami reduktorów). W obu
działach wyróżnia się dodatkowo
kilka grup metod miareczkowych,
których nazwy tworzy się od nazwy
stosowanego
titranta,
np.
manganometria, jodometria.

• Miareczkowanie stąceniowe –
opiera się na reakcji wytrącania
trudno rozpuszczalnych osadów w
wyniku łączenia jonów titranta i
oznaczanej substancji.
• Miareczkowanie stąceniowe –
opiera się na reakcji wytrącania
trudno rozpuszczalnych osadów w
wyniku łączenia jonów titranta i
oznaczanej substancji.

• Kompleksometria - opiera się na
tworzeniu rozpuszczalnych, słabo
zdysocjowanych (trwałych) związków
kompleksowych. Najważniejszym jej
działem jest kompleksonometria, w
której
titrantami
są
roztwory
kompleksów tworzących z metalami
kompleksy chelatowe.
• Kompleksometria - opiera się na
tworzeniu rozpuszczalnych, słabo
zdysocjowanych (trwałych) związków
kompleksowych. Najważniejszym jej
działem jest kompleksonometria, w
której
titrantami
są
roztwory
kompleksów tworzących z metalami
kompleksy chelatowe.

• Ze względu na sposób prowadzenia
miareczkowania można wyróżnić dwa
sposoby:
Bezpośredni
Pośredni
• Ze względu na sposób prowadzenia
miareczkowania można wyróżnić dwa
sposoby:
Bezpośredni
Pośredni

• Miareczkowanie
bezpośrednie
polega na tym, że oznaczana
substancja reaguje bezpośrednio –
stechiometrycznie
i
szybko
z
dodawanym
titratem.
W
miareczkowaniu tym używa się
jednego roztworu mianowanego –
titranta.
• Miareczkowanie
bezpośrednie
polega na tym, że oznaczana
substancja reaguje bezpośrednio –
stechiometrycznie
i
szybko
z
dodawanym
titratem.
W
miareczkowaniu tym używa się
jednego roztworu mianowanego –
titranta.

• Miareczkowanie pośrednie polega
na dobraniu takiej substancji trzeciej,
która reagując stechiometrycznie i
ilościowo z oznaczanym składnikiem
tworzy związek, reagujący następnie
stechiometrycznie z titrantem.
• Miareczkowanie pośrednie polega
na dobraniu takiej substancji trzeciej,
która reagując stechiometrycznie i
ilościowo z oznaczanym składnikiem
tworzy związek, reagujący następnie
stechiometrycznie z titrantem.

• Szczególnym
rodzajem
miareczkowania pośredniego jest
miareczkowanie odwrotne. Polega
ono na tym, że do badanego
roztworu dodaje się odmierzoną ilość
roztworu mianowanego (titrant I) w
nadmiarze, a następnie nadmiar tego
odczynnika
odmiareczkowuje
się
innym
odpowiednio
dobranym
roztworem mianowanym (titrant II).
Podobne są więc dwa roztwory
mianowane.
• Szczególnym
rodzajem
miareczkowania pośredniego jest
miareczkowanie odwrotne. Polega
ono na tym, że do badanego
roztworu dodaje się odmierzoną ilość
roztworu mianowanego (titrant I) w
nadmiarze, a następnie nadmiar tego
odczynnika
odmiareczkowuje
się
innym
odpowiednio
dobranym
roztworem mianowanym (titrant II).
Podobne są więc dwa roztwory
mianowane.

• Miareczkowanie odwrotne stosuje się
w przypadku wolno przebiegających
reakcji lub gdy trudno jest dobrać
odpowiedni
wskaźnik
do
miareczkowania bezpośredniego.
• Miareczkowanie odwrotne stosuje się
w przypadku wolno przebiegających
reakcji lub gdy trudno jest dobrać
odpowiedni
wskaźnik
do
miareczkowania bezpośredniego.

SPORZĄDZANIE I
MIANOWANIE
ROZTWORÓW
WZORCOWYCH
SPORZĄDZANIE I
MIANOWANIE
ROZTWORÓW
WZORCOWYCH

• Roztwory odczynników o dokładnie
znanym
stężeniu
używane
do
miareczkowania
jako
titranty,
nazywamy roztworami wzorcowymi,
mianowanymi, podstawowymi lub
standardowymi. Roztwory wzorcowe
otrzymujemy w dwojaki sposób.
• Roztwory odczynników o dokładnie
znanym
stężeniu
używane
do
miareczkowania
jako
titranty,
nazywamy roztworami wzorcowymi,
mianowanymi, podstawowymi lub
standardowymi. Roztwory wzorcowe
otrzymujemy w dwojaki sposób.

1. Przez
dokładne
odważenie
substancji,
której
roztwór
sporządzamy i rozpuszczenie jej w
wodzie (lub innym rozpuszczalniku)
tak, aby otrzymać ściśle określoną
objętość roztworu.
1. Przez
dokładne
odważenie
substancji,
której
roztwór
sporządzamy i rozpuszczenie jej w
wodzie (lub innym rozpuszczalniku)
tak, aby otrzymać ściśle określoną
objętość roztworu.

2. Przez sporządzenie roztworu danej
substancji o przybliżonym stężeniu i
zmianowanie
go
za
pomocą
odpowiedniej substancji wzorcowej.
2. Przez sporządzenie roztworu danej
substancji o przybliżonym stężeniu i
zmianowanie
go
za
pomocą
odpowiedniej substancji wzorcowej.

• Ad 1. jeżeli substancja, której
roztwór
wzorcowy
(mianowany)
chcemy
sporządzić,
jest
wystarczająco czysta i trwała (tzn.
spełnia
wymagania
stawiane
substancjom wzorcowym), wówczas
miano roztworu „nastawiamy” przez
odważenie odpowiedniej porcji tej
substancji na wadze analitycznej,
ilościowe przeniesienie jej do kolby
miarowej, rozpuszczenie w wodzie i
dopełnienie do żądanej objętości.
Wyznaczone w ten sposób miano
nazywa się bezwzględnym.
• Ad 1. jeżeli substancja, której
roztwór
wzorcowy
(mianowany)
chcemy
sporządzić,
jest
wystarczająco czysta i trwała (tzn.
spełnia
wymagania
stawiane
substancjom wzorcowym), wówczas
miano roztworu „nastawiamy” przez
odważenie odpowiedniej porcji tej
substancji na wadze analitycznej,
ilościowe przeniesienie jej do kolby
miarowej, rozpuszczenie w wodzie i
dopełnienie do żądanej objętości.
Wyznaczone w ten sposób miano
nazywa się bezwzględnym.

• UWAGA! Rozpuszczaniu substancji
towarzyszą często efekty cieplne
egzo- lub endotermiczne, dlatego
przed ostatecznym dopełnieniem
roztworu w kolbie miarowej do kreski
należy doprowadzić do wyrównania
temperatur roztworu i otoczenia.
Należy również dokładnie wymieszać
zawartość kolby. (Przed dopełnieniem
do
kreski
mieszamy
ruchem
okrężnym,
zaś
po
dopełnieniu,
odwracamy wielokrotnie zamkniętą
szczelnie korkiem kolbę dnem do
góry i na dół).
• UWAGA! Rozpuszczaniu substancji
towarzyszą często efekty cieplne
egzo- lub endotermiczne, dlatego
przed ostatecznym dopełnieniem
roztworu w kolbie miarowej do kreski
należy doprowadzić do wyrównania
temperatur roztworu i otoczenia.
Należy również dokładnie wymieszać
zawartość kolby. (Przed dopełnieniem
do
kreski
mieszamy
ruchem
okrężnym,
zaś
po
dopełnieniu,
odwracamy wielokrotnie zamkniętą
szczelnie korkiem kolbę dnem do
góry i na dół).

• Ad 2. jeżeli substancja, której
roztwór
wzorcowy
(mianowany)
chcemy
sporządzić,
nie
ma
odpowiedniego stopnia czystości, lub
jest higroskopijna, czy też po
rozpuszczeniu
roztwór
zmienia
stężenie, wówczas odważamy tę
substancję na wadze technicznej i
sporządzamy jej roztwór o stężeniu
przybliżonym.
Roztwór
ten
mianujemy zaraz po sporządzeniu
lub po odstaniu przez odpowiedni
okres czasu potrzebny do ustalenie
się stężenia.
• Ad 2. jeżeli substancja, której
roztwór
wzorcowy
(mianowany)
chcemy
sporządzić,
nie
ma
odpowiedniego stopnia czystości, lub
jest higroskopijna, czy też po
rozpuszczeniu
roztwór
zmienia
stężenie, wówczas odważamy tę
substancję na wadze technicznej i
sporządzamy jej roztwór o stężeniu
przybliżonym.
Roztwór
ten
mianujemy zaraz po sporządzeniu
lub po odstaniu przez odpowiedni
okres czasu potrzebny do ustalenie
się stężenia.

• Mianowanie
roztworu
polega
na
kilkakrotnym
zmiareczkowaniu
tym
roztworem porcji odpowiedniej substancji
wzorcowej. Miano roztworu wzorcowego
wyznaczone
przez
zmiareczkowanie
substancji wzorcowej tylko wtedy jest
bezwzględne,
gdy
punkt
końcowy
miareczkowania pokrywa się w granicach
błędu
doświadczalnego
z
punktem
równoważności. Nie zawsze tak bywa.
Miano wyznaczone wtedy nazywamy
roboczym i jest ono obarczone błędem
systematycznym, związanym z daną
metodą oznaczenia miareczkowego.
• Mianowanie
roztworu
polega
na
kilkakrotnym
zmiareczkowaniu
tym
roztworem porcji odpowiedniej substancji
wzorcowej. Miano roztworu wzorcowego
wyznaczone
przez
zmiareczkowanie
substancji wzorcowej tylko wtedy jest
bezwzględne,
gdy
punkt
końcowy
miareczkowania pokrywa się w granicach
błędu
doświadczalnego
z
punktem
równoważności. Nie zawsze tak bywa.
Miano wyznaczone wtedy nazywamy
roboczym i jest ono obarczone błędem
systematycznym, związanym z daną
metodą oznaczenia miareczkowego.

• UWAGA!
Roztwory
mianowane
przechowuje
się
w
butelkach
szczelnie zamkniętych, często z
ciemnego szkła, aby zabezpieczyć
przed działaniem światła, lub z
tworzywa sztucznego. Roztworów
mianowanych butelki do biurety lub
zlewki a nie zużytych nie wlewa się
z powrotem do butelki, w której
są przechowywane.
• UWAGA!
Roztwory
mianowane
przechowuje
się
w
butelkach
szczelnie zamkniętych, często z
ciemnego szkła, aby zabezpieczyć
przed działaniem światła, lub z
tworzywa sztucznego. Roztworów
mianowanych butelki do biurety lub
zlewki a nie zużytych nie wlewa się
z powrotem do butelki, w której
są przechowywane.

OGÓLNE ZASADY
MIANOWANIA
OGÓLNE ZASADY
MIANOWANIA

• Należy podkreślić z naciskiem, że od
dokładności zmianowania roztworów
titrantów
zależy
dokładność
oznaczeń miareczkowych przy użyciu
tych
roztworów.
Dokładność
i
precyzja nastawiania miana powinny
być większe niż zwykłych oznaczeń
miareczkowych.
• Aby
to
osiągnąć
stosuje
się
następujące zasady:
• Należy podkreślić z naciskiem, że od
dokładności zmianowania roztworów
titrantów
zależy
dokładność
oznaczeń miareczkowych przy użyciu
tych
roztworów.
Dokładność
i
precyzja nastawiania miana powinny
być większe niż zwykłych oznaczeń
miareczkowych.
• Aby
to
osiągnąć
stosuje
się
następujące zasady:

1.
Należy stosować odpowiednio dobraną, o
sprawdzonej
czystości,
substancję
wzorcową.
2.
Odważki substancji wzorcowej stosowanej
do mianowania roztworów powinny być
odpowiednio duże, tak aby błąd względny
ważenia był jak najmniejszy.
3.
Objętość mianowanego roztworu, zużyta
do zmiareczkowania porcji (odważki)
substancji wzorcowej, nie powinna być
zbyt mała (najlepiej 40-50 ml tak aby
błąd względny wyznaczenia tej wielkości
był niewielki.
1.
Należy stosować odpowiednio dobraną, o
sprawdzonej
czystości,
substancję
wzorcową.
2.
Odważki substancji wzorcowej stosowanej
do mianowania roztworów powinny być
odpowiednio duże, tak aby błąd względny
ważenia był jak najmniejszy.
3.
Objętość mianowanego roztworu, zużyta
do zmiareczkowania porcji (odważki)
substancji wzorcowej, nie powinna być
zbyt mała (najlepiej 40-50 ml tak aby
błąd względny wyznaczenia tej wielkości
był niewielki.

4. Miareczkowanie należy powtórzyć
kilkakrotnie (3-5 razy), przez co
zmniejsza się błąd przypadkowy
mianowania. W miarę możności
należy unikać nastawiania miana
roztworu
przez
miareczkowanie
próbek (odważonych porcji) innego
roztworu
wzorcowego,
np.
nastawienie miana roztworu NaOH
na roztwór HCl. Przy takim sposobie
mianowania błędy przypadkowe są
większe.
4. Miareczkowanie należy powtórzyć
kilkakrotnie (3-5 razy), przez co
zmniejsza się błąd przypadkowy
mianowania. W miarę możności
należy unikać nastawiania miana
roztworu
przez
miareczkowanie
próbek (odważonych porcji) innego
roztworu
wzorcowego,
np.
nastawienie miana roztworu NaOH
na roztwór HCl. Przy takim sposobie
mianowania błędy przypadkowe są
większe.

SUBSTANCJE WZORCOWE
SUBSTANCJE WZORCOWE

• Substancje
wzorcowe
są
to
substancje
o
odpowiednich
właściwościach służące bądź to
sporządzania roztworów titrantów,
których miano jest dokładnie znane
bezpośrednio z odważonej ilości
substancji, bądź też do mianowania
roztworów wzorcowych służące jako
titranty.
• Substancje
wzorcowe
są
to
substancje
o
odpowiednich
właściwościach służące bądź to
sporządzania roztworów titrantów,
których miano jest dokładnie znane
bezpośrednio z odważonej ilości
substancji, bądź też do mianowania
roztworów wzorcowych służące jako
titranty.

• Przykładem substancji wzorcowej
służącej do sporządzenia roztworu
mianowanego przez odważenie porcji
substancji i rozpuszczenie jej w
odpowiedniej ilości wody w kolbie
miarowej, może być bromian (V)
potasu KBrO
3.
Natomiast szczawian
sodu,
Na
2
C
2
O
4,
jest
przykładem
substancji wzorcowej stosowanej do
mianowania roztworu manganianu
potasu, przez zmiareczkowanie tym
roztworem odważek Na
2
C
2
O
4.
• Przykładem substancji wzorcowej
służącej do sporządzenia roztworu
mianowanego przez odważenie porcji
substancji i rozpuszczenie jej w
odpowiedniej ilości wody w kolbie
miarowej, może być bromian (V)
potasu KBrO
3.
Natomiast szczawian
sodu,
Na
2
C
2
O
4,
jest
przykładem
substancji wzorcowej stosowanej do
mianowania roztworu manganianu
potasu, przez zmiareczkowanie tym
roztworem odważek Na
2
C
2
O
4.

• Najważniejsze wymagania dotyczące
właściwości substancji wzorcowych
są następujące:
• Najważniejsze wymagania dotyczące
właściwości substancji wzorcowych
są następujące:

1. Ilościowy przebieg właściwej dla
danej substancji wzorcowej reakcji
chemicznej.
2. Łatwość
otrzymania
substancji
wzorcowej
w
stanie
wysokiej
czystości.
3. Trwałość
w
warunkach
laboratoryjnych
–
substancja
wzorcowa
nie
powinna
być
higroskopijna oraz nie powinna
wietrzeć.
4. Duża masa molowa.
5. Dobra rozpuszczalność w wodzie.
1. Ilościowy przebieg właściwej dla
danej substancji wzorcowej reakcji
chemicznej.
2. Łatwość
otrzymania
substancji
wzorcowej
w
stanie
wysokiej
czystości.
3. Trwałość
w
warunkach
laboratoryjnych
–
substancja
wzorcowa
nie
powinna
być
higroskopijna oraz nie powinna
wietrzeć.
4. Duża masa molowa.
5. Dobra rozpuszczalność w wodzie.

6. Uniwersalność tj. możliwość
wykorzystania tej substancji jako
wzorca w różnych działach analizy
miareczkowej. Substancją, która w
dużej mierze spełnia ten warunek
jest wodorojodan (V) potasu,
KH(IO
3
)
2.
6. Uniwersalność tj. możliwość
wykorzystania tej substancji jako
wzorca w różnych działach analizy
miareczkowej. Substancją, która w
dużej mierze spełnia ten warunek
jest wodorojodan (V) potasu,
KH(IO
3
)
2.

• Substancja ta może służyć do mianowania
roztworów zasad:
KH(IO
3
)
2
+ NaOH → KIO
3
+ NaIO
3
+H
2
O
tiosiarczanu (VI) sodu:
KH(IO
3
)
2
+ 10 KI + 11HCl → 6I
2
+ 6H
2
O +
11KCl
oraz tiosiarczanu srebra: po
zredukowaniu
do
jodu
i
usunięciu
nadmiaru
czynnika
redukującego,
otrzymany roztwór jodku o dokładnie
znanym stężeniu może być zastosowany
do mianowania roztworów azotanu, a
także do mianowania roztworów KMnO
4.
• Substancja ta może służyć do mianowania
roztworów zasad:
KH(IO
3
)
2
+ NaOH → KIO
3
+ NaIO
3
+H
2
O
tiosiarczanu (VI) sodu:
KH(IO
3
)
2
+ 10 KI + 11HCl → 6I
2
+ 6H
2
O +
11KCl
oraz tiosiarczanu srebra: po
zredukowaniu
do
jodu
i
usunięciu
nadmiaru
czynnika
redukującego,
otrzymany roztwór jodku o dokładnie
znanym stężeniu może być zastosowany
do mianowania roztworów azotanu, a
także do mianowania roztworów KMnO
4.
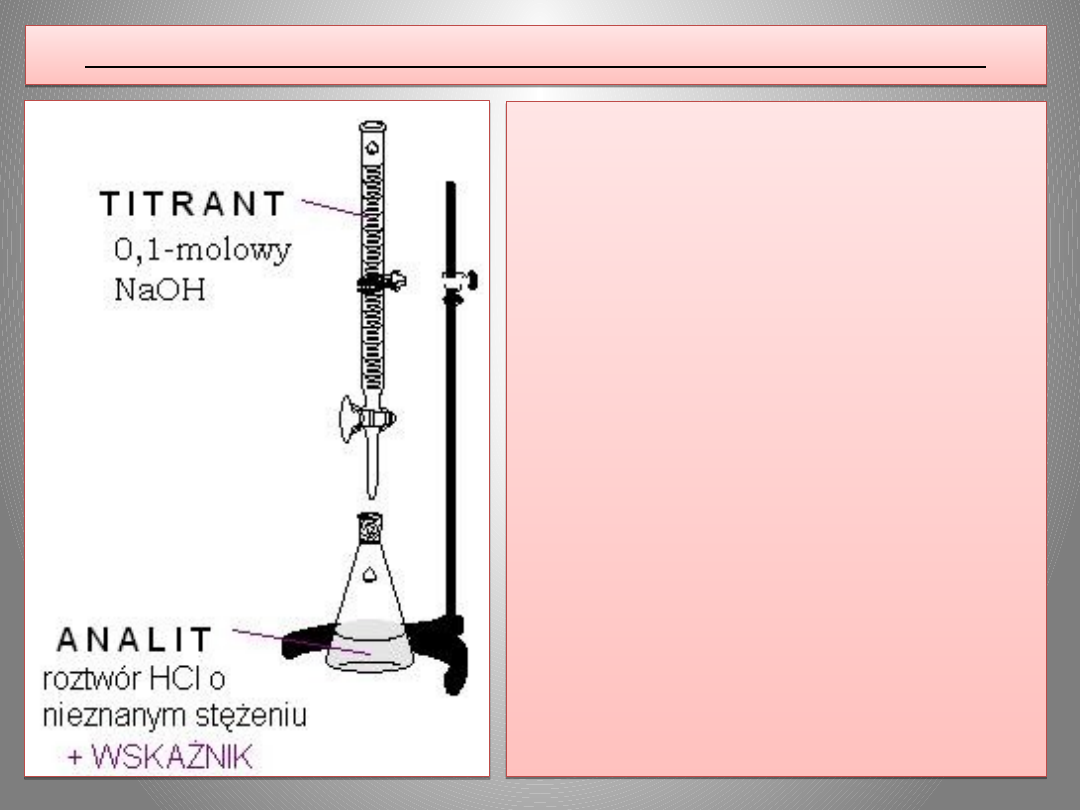
OPIS ĆWICZENIA – MIARECZKOWANIE W OBECNOŚCI WSKAŹNIKA
OPIS ĆWICZENIA – MIARECZKOWANIE W OBECNOŚCI WSKAŹNIKA
Pobrać 10 ml nieznanego kwasu do
czystej erlenmajerki, w której będzie
wykonywane oznaczenie. Dolać ok. 20 ml
wody destylowanej. W biurecie umieścić
0,1000-molowy roztwór wodorotlenku
sodowego.
Wykonać miareczkowanie nieznanego
kwasu w obecności barwnego wskaźnika
(fenoloftaleiny,
oranżu
metylowego).
Podczas miareczkowania mieszać ręcznie
roztwór. Erlenmajerki umieścić na białej
kartce, co ułatwi zaobserwowanie zmiany
barwy roztworu. Odczytać objętość
dodanego titranta, przy którym nastąpiła
zmiana barwy roztworu. Z uzyskanych
wyników obliczyć stężenie molowe
nieznanego kwasu z dokładnością
do czterech miejsc znaczących.
Usunąć
pozostałości
roztworu
wodorotlenku z biurety przepłukując ją
wodą destylowaną.
Pobrać 10 ml nieznanego kwasu do
czystej erlenmajerki, w której będzie
wykonywane oznaczenie. Dolać ok. 20 ml
wody destylowanej. W biurecie umieścić
0,1000-molowy roztwór wodorotlenku
sodowego.
Wykonać miareczkowanie nieznanego
kwasu w obecności barwnego wskaźnika
(fenoloftaleiny,
oranżu
metylowego).
Podczas miareczkowania mieszać ręcznie
roztwór. Erlenmajerki umieścić na białej
kartce, co ułatwi zaobserwowanie zmiany
barwy roztworu. Odczytać objętość
dodanego titranta, przy którym nastąpiła
zmiana barwy roztworu. Z uzyskanych
wyników obliczyć stężenie molowe
nieznanego kwasu z dokładnością
do czterech miejsc znaczących.
Usunąć
pozostałości
roztworu
wodorotlenku z biurety przepłukując ją
wodą destylowaną.
LITERATURA
LITERATURA
Document Outline
- METODY MIARECZKOWE
- PODSTAWOWE TERMINY I POJĘCIA
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- SPRZĘT LABORATORYJNY
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- SPORZĄDZANIE I MIANOWANIE ROZTWORÓW WZORCOWYCH
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- OGÓLNE ZASADY MIANOWANIA
- Slide 38
- Slide 39
- Slide 40
- SUBSTANCJE WZORCOWE
- Slide 42
- Slide 43
- Slide 44
- Slide 45
- Slide 46
- Slide 47
- Opis ćwiczenia – miareczkowanie w obecności wskaźnika
- LITERATURA
Wyszukiwarka
Podobne podstrony:
Ćw 13 Metody miareczkowania wirusów Test hemaglutynacji
13. Miareczkowanie amperometryczne, Technologia Chemiczna, Rok III, Semestr II, Instrumentalne metod
Miareczkowe metody wytrąceniowe Argentometria
Miareczkowe metody wytrąceniowe Argentometria
11 miareczkowanie metody kompleksometryczne
T 3[1] METODY DIAGNOZOWANIA I ROZWIAZYWANIA PROBLEMOW
10 Metody otrzymywania zwierzat transgenicznychid 10950 ppt
metodyka 3
organizacja i metodyka pracy sluzby bhp
metodyka, metody proaktywne metodyka wf
epidemiologia metody,A Kusińska,K Mitręga,M Pałka,K Orszulik 3B
GMO metody wykrywania 2
Metody i cele badawcze w psychologii
E learning Współczesne metody nauczania
Tradycyjne metody nauczania w medycynie 2
więcej podobnych podstron