
Wojewódzki Konkurs Przedmiotowy
z Chemii
dla uczniów gimnazjów
województwa śląskiego
w roku szkolnym 2011/2012
KOD UCZNIA
Etap:
Data:
Czas pracy:
szkolny
23 listopada 2011r.
90 minut
Informacje dla ucznia
1.
Na stronie tytułowej arkusza w wyznaczonym miejscu wpisz swój kod ustalony przez komisję.
2.
Sprawdź, czy arkusz konkursowy zawiera 8 stron.
Zestaw składa się z trzech części:
•
część I – zawiera test wyboru,
•
część II – zawiera cztery zadania rachunkowe,
•
część III – zawiera cztery zadania problemowo – laboratoryjne.
3.
Czytaj uważnie wszystkie teksty i zadania.
4.
Rozwiązania zapisuj długopisem lub piórem. Nie używaj korektora.
5.
W zadaniach zamkniętych podane są cztery odpowiedzi: A, B, C, D. Wybierz tylko jedną
odpowiedź i zaznacz ją znakiem X bezpośrednio na arkuszu.
6.
Staraj się nie popełniać błędów przy zaznaczaniu odpowiedzi, ale jeśli się pomylisz, błędne
zaznaczenie otocz kółkiem X i zaznacz inną odpowiedź znakiem X.
7.
Rozwiązania zadań otwartych zapisz czytelnie w wyznaczonych miejscach. Pomyłki przekreśl.
8.
Przygotowując odpowiedzi na pytania, możesz skorzystać z miejsca na stronie 8, opatrzonego
napisem Brudnopis. Zapisy w brudnopisie nie będą sprawdzane i oceniane.
9.
Możesz korzystać z: układu okresowego, tabeli rozpuszczalności, kalkulatora.
10.
Nie możesz używać korektora.
Liczba punktów możliwych do uzyskania:
Liczba punktów umożliwiająca kwalifikację do kolejnego etapu:
60
48
Wypełnia komisja konkursowa
Podpisy przewodniczącego i członków komisji:
1.
Przewodniczący - ..............................................
2.
Członek - ...........................................................
3.
Członek - ...........................................................
Część I - test
Część II
Część III
Nr zadania
1 – 18
1
2
3
4
5
6
7
8
Razem
Liczba punktów
możliwa
do zdobycia
18
5
4
4
5
4
4
4
12
60
Liczba punktów
uzyskana przez
uczestnika konkursu

1
Część I
TEST WYBORU – 18 punktów
Test zawiera zadania, w których podano propozycje czterech odpowiedzi: A), B), C), D).
Tylko jedna odpowiedź jest prawidłowa. Prawidłową odpowiedź zaznacz znakiem
X
.
W razie pomyłki błędną odpowiedź otocz kółkiem i ponownie zaznacz znakiem
X
odpowiedź
właściwą.
Za każdą poprawną odpowiedź można uzyskać 1 punkt.
1.
Który z trójwartościowych metali tworzy siarczan(VI), jeśli masa cząsteczkowa tej soli
wynosi 400 u.
A) chrom,
C) mangan,
B) glin,
D) żelazo.
2. W atomie K
39
19
znajduje się:
A) 20 protonów i 19 neutronów,
C) 20 protonów i 20 elektronów,
B) 19 protonów i 20 elektronów,
D) 19 protonów i 20 neutronów.
3. Tlenki azotu i tlenki siarki wywołują w atmosferze niekorzystne dla środowiska zjawisko; jest
nim:
A) efekt cieplarniany,
C) eutrofizacja zbiorników wodnych,
B) dziura ozonowa,
D) kwaśne deszcze.
4. Zapis 2N
2
O
3
można odczytać:
A) dwie cząsteczki tlenku azotu(III),
B) dwie cząsteczki tlenku azotu(V),
C) cztery atomy tlenu i 10 atomów azotu,
D) cztery atomy azotu i 10 atomów tlenu.
5. Do probówki z wodą i dwiema kroplami fenoloftaleiny wrzucono kawałek sodu.
Zaobserwowano, że w probówce:
A) wytrącił się osad,
B) roztwór zabarwił się na malinowo,
C) wydzielił się gaz,
D) roztwór zabarwił się na malinowo i wydzielił się gaz.
6. Żeby rozdzielić mieszaninę wody, soli kuchennej i piasku zastosowano następujące metody:
A) sączenie i odparowanie,
C) sedymentacja i dekantacja,
B) destylacja i filtracja,
D) ekstrakcja
7. Oranż metylowy w roztworach o odczynie kwasowym przyjmuje barwę:
A) czerwoną,
C) żółtą,
B) zieloną,
D) malinową

2
8. Izotopy danego pierwiastka mają:
A) różną liczbę protonów,
C) różną liczbę neutronów,
B) różną liczbę elektronów,
D) różny ładunek jądra.
9. Wytrącanie osadu w wodzie wapiennej można zauważyć po wprowadzeniu do niej:
A) chlorowodoru,
C) amoniaku,
B) tlenku węgla(II),
D) tlenku węgla(IV).
10. Do całkowitego zobojętnienia 6 cząsteczek NaOH potrzeba:
A) 3 cząsteczek H
3
PO
4
,
C) 2 cząsteczek H
3
PO
4
,
B) 1 cząsteczki H
3
PO
4
,
D) 6 cząsteczek H
3
PO
4
.
11. Rozmieszczenie elektronów w atomie pewnego pierwiastka jest następujące: K
2
L
8
M
3
.
Wskaż liczbę elektronów walencyjnych tego pierwiastka:
A) 1,
B) 2,
C) 3,
D) 4.
12. Obecna w sieci krystalicznej gipsu palonego i alabastru woda to:
A) woda destylowana,
C) woda higroskopijna,
B) woda mineralna,
D) woda krystalizacyjna.
13. Wietrzenie skał może zachodzić pod wpływem różnych czynników fizycznych i chemicznych.
Do wietrzenia chemicznego najbardziej przyczyniają się:
A) tlen i dwutlenek węgla,
C) woda i dwutlenek węgla,
B) woda i tlen,
D) azot i woda.
14. Podczas tworzenia szronu występuje proces:
A) krzepnięcia,
C) sublimacji,
B) skraplania,
D) resublimacji.
15. Zmieszano 20 g cukru i 80 g wody. Stężenie procentowe otrzymanego roztworu wynosi:
A) 20%,
B) 10%,
C) 5%,
D) 30%.
16. Rozpuszczalność pewnej soli wynosi 15 g /100 g H
2
O. W 50 g wody rozpuszczono 5 g tej
soli. Otrzymano roztwór:
A) nienasycony,
C) przesycony,
B) nasycony,
D) koloidalny.
17. W wyniku dysocjacji elektrolitycznej, każde 2 cząsteczki FeCl
3
tworzą:
A) 3 aniony Cl i 1 kation Fe
3+
,
B) 6 anionów Cl i 2 kationy Fe
3+
,
C) trzy razy więcej anionów niż kationów,
D) odpowiedzi B) i C) są prawidłowe.

3
18. Jaki wzór ma sól, która w roztworze dysocjuje na jony Na
+
i CrO
4
2-
?
A) NaCrO
4
B) Na(CrO
4
)
2
C) Na
2
CrO
4
D) CrO
4
Na
Część II
ZADANIA RACHUNKOWE – 18 punktów
Zadanie 1 (5 punktów)
W wyniku reakcji chromu z 24 g tlenu powstało 76 g tlenku chromu. Wykonaj odpowiednie
obliczenia i uzupełnij poniższy tekst.
Z 24 g tlenu przereagowało …................ g chromu.
Stosunek wagowy chromu do tlenu wynosi …......................................,
a powstały tlenek ma wzór sumaryczny …............................................ .
Zapisz równanie reakcji, o której mowa w zadaniu.
Równanie reakcji: …......................................................................................................
Obliczenia:
Zadanie 2 (4 punkty)
Ile gramów jodu należy odważyć, aby po zmieszaniu z 300 cm
3
alkoholu o gęstości 0,78 g/cm
3
otrzymać roztwór o stężeniu 10%?
4
Zadanie 3 (4 punkty)
Stężenie procentowe, nasyconego w temperaturze 20
o
C, wodnego roztworu KCl wynosi 25,4%.
Oblicz, ile gramów KCl można maksymalnie rozpuścić w 200 g wody o temperaturze 20
o
C.
Oblicz rozpuszczalność KCl w podanej temperaturze.
Wynik podaj z dokładnością do pierwszego miejsca po przecinku.
Obliczenia:
Masa KCl: …............................
Rozpuszczalność KCl w temperaturze 20
o
C:
….....................................................................................
Zadanie 4 (5 punktów)
Minerał zawiera 38% limonitu ( Fe
2
O
3
· 3H
2
O). Oblicz masę minerału zawierającego 5 g żelaza.
Wynik podaj z dokładnością do drugiego miejsca po przecinku.
Obliczenia:

5
Część III
ZADANIA PROBLEMOWO – LABORATORYJNE - 24 punkty.
Zadanie 5 (4 punkty)
W czterech naczyniach rozpuszczono w wodzie substancje chemiczne, które dysocjują na jony.
Ustal, jakie substancje wprowadzono do każdego naczynia i uzupełnij tabelę, podając wzory
sumaryczne tych substancji.
Numer naczynia
Jony znajdujące się w roztworze
Wzór sumaryczny substancji
I
Na
+
i CO
3
2-
II
Al
3+
i Cl
-
III
NH
4
+
i CO
3
2-
IV
Fe
3+
i SO
4
2-
Zadanie 6 (4 punkty)
Tlenek pewnego dwuwartościowego metalu po wprowadzeniu do wody tworzy wodorotlenek
o masie cząsteczkowej 171u.
Wykonując odpowiednie obliczenia, ustal, jaki to metal. Zapisz równanie reakcji chemicznej,
o której mowa w zadaniu.
Obliczenia:
Symbol metalu: ….............................
Równanie reakcji:......................................................................................................................
6
Zadanie 7 (4 punkty)
Poniżej podano cztery stwierdzenia dotyczące izotopu
34
16
X.
Oceń każde z nich, wpisując obok literę „P”, gdy zdanie jest prawdziwe lub literę „F”, gdy jest
fałszywe.
1) W jądrze izotopu pierwiastka X znajduje się 16 protonów i 16 neutronów.
2) Pierwiastek X leży w 16 grupie i 4 okresie układu okresowego.
3) Jądro izotopu pierwiastka X zawiera 34 nukleony.
4) X
34
16
to jeden z izotopów siarki.
−−
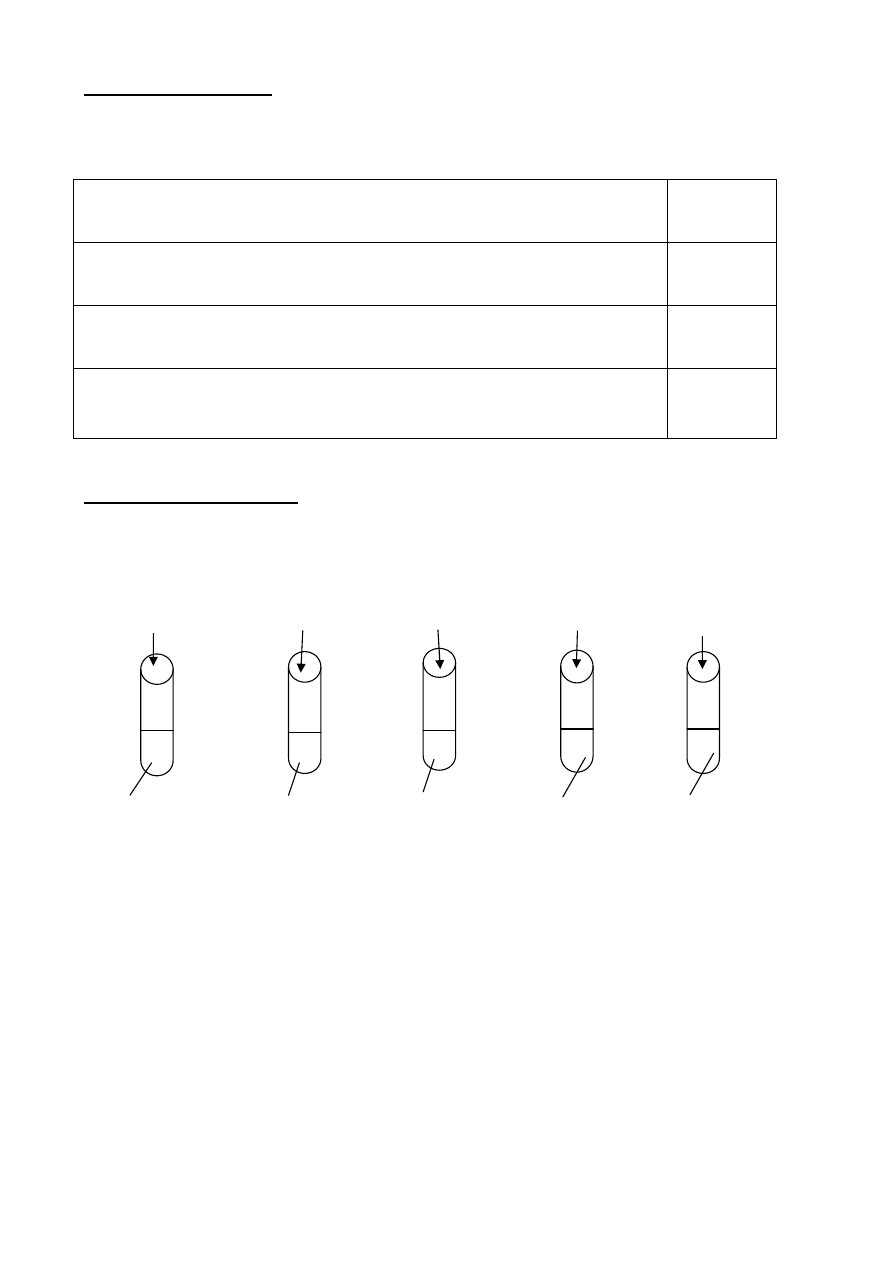
Zadanie 8 (12 punktów)
Przeprowadzono doświadczenia przedstawione na rysunku.
1)
2)
3) 4) 5)
HNO
3(aq)
H
2
SO
4(aq)
Zn K
2
CO
3(aq)
Al(NO
3
)
3(aq)
Na
2
CO
3(aq)
NaOH
(aq)
HCl
(aq)
BaCl
2(aq)
KOH
(aq)
A) Podaj numery probówek, w których zaobserwowano wydzielanie się gazu − ......................
B) Podaj numery probówek, w których zaobserwowano wytrącanie się osadu − ......................
C) Zapisz w formie cząsteczkowej równania reakcji zachodzących w probówkach nr 1 i 3
.......................................................................................................................................................
.......................................................................................................................................................
D) Zapisz w pełnej formie jonowej równania reakcji zachodzących w probówkach nr 2, 4 i 5
.....................................................................................................................................................
.......................................................................................................................................................
.......................................................................................................................................................

7
BRUDNOPIS
Wyszukiwarka
Podobne podstrony:
Etap szkolny 2011 2012
Etap szkolny 2011 2012 klucz
Nie jestem gorszy, Rok szkolny 2011-2012
informatyka szkolny 2011 2012
Edukacja, Rok szkolny 2011-2012, koło teatralne
spotkanie z rodzicami, Rok szkolny 2011-2012
metodologia pytania1, Rok szkolny 2011-2012
trening zastępowania agresji, Rok szkolny 2011-2012
Rola świąt Bożego Narodzenia w naszym życiu, Rok szkolny 2011-2012
scenariusz potrafie przygotowac, Rok szkolny 2011-2012
GODZINY WYCHOWAWCZE W KL. VI ROK SZKOLNY 20112012, Rok szkolny 2011-2012
Scenariusz przedstawienia do wiersza pt., Rok szkolny 2011-2012
Uzasadnienie oceny nideostatecznej, Rok szkolny 2011-2012
pwsp, Rok szkolny 2011-2012
pol-pozytywizm, Rok szkolny 2011-2012, wypracowania i pomoce, 7 - pozytywizm
ortografia trudna ale nienudna, Rok szkolny 2011-2012
więcej podobnych podstron