
zakażenia 6/2012
sterylizacja i dezynfekcja
2
www.zakazenia.org.pl
Dekontaminacja metodami
klasycznymi w placówkach
medycznych – skuteczność
Jakość czyszczenia i dezynfekcji powierzch-
ni metodami klasycznymi w placówkach me-
dycznych nie jest dostateczna. Problem efektyw-
ności procedur dekontaminacyjnych dotyczy
nie tylko szpitali w Polsce. Carling i wsp. [1]
badali skuteczność procedur mycia i czyszcze-
nia w szpitalach w Stanach Zjednoczonych.
Na różne powierzchnie szpitalne nanoszono
barwnik fluorescencyjny, niewidoczny gołym
okiem, natomiast świecący w świetle UV; był
on usuwany przez dokładne mycie. Stwierdzo-
no poważne błędy w czyszczeniu powierzchni:
klamki do drzwi były czyste średnio w 29,9%,
baseny w 25%, telefony w 49,2%.
Podobnie wyniki uzyskali Lemmen i wsp. [2],
którzy badali występowanie wielolekoopor-
nych drobnoustrojów Gram(–), takich jak:
Pseudomonas aeruginosa, Stenotrophomonas
maltophilia, Acinetobacter baumannii; bada-
cze ci wykryli je na powierzchniach respira-
torów, pomp infuzyjnych, klamek. Badania
Dentona i wsp. [3] wykazały korelację między
liczbą pacjentów zakażonych szczepem Aci-
netobacter spp. a częstością wykrywania tych
szczepów w mikrobiologicznych badaniach
środowiska szpitalnego. Gastmeier i wsp. [4]
badali pokrewieństwo i stopień różnorodności
bakterii w próbkach klinicznych oraz ich zdol-
ność do przetrwania w środowisku. Stwierdzili,
że im dłużej dany szczep jest w stanie przeżyć
w środowisku, tym częściej jest wykrywany
jako czynnik powodujący zakażenia u pacjen-
tów, co wskazuje na środowisko szpitalne jako
rezerwuar zjadliwych szczepów.
W placówkach medycznych powierzchnie
tzw. dotykowe często są skażone drobnoustroja-
mi i mogą uczestniczyć w przenoszeniu zakażeń
krzyżowych. Pojedynczy kontakt skóry rąk ze
skażoną powierzchnią w różnym stopniu przy-
czynia się do przeniesienia czynnika zakaźnego.
Najłatwiej są przenoszone na skórę Escherichia
coli, Salmonella spp. i Staphylococcus aureus [5].
W badaniach doświadczalnych z użyciem bak-
terii modelowych Gram(+) Micrococcus luteus
wykazano przenoszenie organizmu modelowego
z powierzchni na ręce, a następnie do ust w wy-
dr med. Patryk Tarka
Zakład Medycyny
Zapobiegawczej i Higieny
Warszawski Uniwersytet
Medyczny
kierownik zakładu:
prof. dr hab. med.
LONGINA
KŁOSIEWICZ-LATOSZEK
Adres do korespondencji:
Patryk Tarka
Zakład Medycyny
Zapobiegawczej i Higieny
Warszawski Uniwersytet
Medyczny
ul. Oczki 3
02–007 Warszawa
e-mail:
patryk.tarka@wum.edu.pl
tel. (22) 621 51 97
DEKONTAMINACJA POMIESZCZEŃ
I WYPOSAŻENIA MEDYCZNEGO
Z UŻYCIEM METOD DEZYNFEKCJI
FUMIGACYJNYCH.
PRZEGLĄD PIŚMIENNICTWA
DECONTAMINATION OF FACILITIES AND MEDICAL EQUIPMENT
USING THE FUMIGATION DISINFECTION METHOD.
REFERENCES REVIEW
Streszczenie
Systemy dezynfekcji fumigacyjnych są dostępne w Polsce od dłuższego czasu. Różnią się zarówno
składem preparatów używanych podczas procesu dezynfekcji, jak i technologią generowania mgły
lub gazu. Ponieważ nie ma normy europejskiej w zakresie badania aktywności takich procesów,
nasuwa się pytanie o skuteczność tych systemów. W artykule dokonano przeglądu piśmiennictwa
zagranicznego dotyczącego tego zagadnienia.
Summary
The fumigation disinfection system is used for a long period of time on the medical market in Poland.
It differs in the composition of the preparations used in this process, as well as in the technology of
mist and gas generation. Hence there is no European standard of such a research activity processes,
the question should be raised on how effective those systems are. The review article is the compiled
summary of foreign references on that subject.
Słowa kluczowe/Key words
sucha
mgła nadtlenku wodoru
➧
waporyzowany nadtlenek wodoru
➧
gazowy nadtlenek wodoru
dry-mist hydrogen peroxide (DMHP)
➧
vaporized hydrogen peroxide (VHP)
➧
hydrogen peroxide vapor
(HPV)
Patryk Tarka
©
Twoje Zdrowie Sp. z o.o.
tarka_dekontaminacja.indd 2
tarka_dekontaminacja.indd 2
2013-01-09 18:03:10
2013-01-09 18:03:10

zakażenia 6/2012
sterylizacja i dezynfekcja
www.zakazenia.org.pl
3
niku kontaktu [5]. Inne badania pokazują, że
jest możliwe przeniesienie norowirusów na pięć
dalszych powierzchni za pośrednictwem rąk [6],
a także modelowego bakteriophaga φX174 z po-
wierzchni na 14 innych osób [7].
Obecnie w Polsce i na świecie toczy się dys-
kusja na temat dezynfekcji powierzchni [8, 9].
W odniesieniu do powierzchni, z którymi pacjent
nie styka się bezpośrednio, jest zalecane mycie
z użyciem profesjonalnego detergentu [10].
Należy jednak pamiętać, że podczas mycia
drobnoustroje mogą zostać przeniesione na inne
powierzchnie, a tylko zastosowanie chemicz-
nego preparatu dezynfekcyjnego niszczącego
drobnoustroje temu zapobiega [11]. French
i wsp. [12] wykazali obecność szczepów
Staphylococcus aureus opornych na metycyli-
nę (MRSA) mimo mycia powierzchni; szczepy
te zostały usunięte z pomieszczeń dopiero po
zastosowaniu dezynfekcji fumigacyjnej nad-
tlenkiem wodoru. Inna praca [13] dotyczyła
zmniejszenia skażenia mikrobiologicznego
w pomieszczeniach przez dezynfekcję prepa-
ratami zawierającymi czwartorzędowe związ-
ki amoniowe. W pomieszczeniach, w których
przeprowadzono taką dezynfekcję, częstość
skażenia rąk drobnoustrojami była niższa.
Należy jednak podkreślić, iż zastosowanie
dezynfekcji nie gwarantuje całkowitej czysto-
ści mikrobiologicznej, nawet w odniesieniu do
form wegetatywnych bakterii, które łatwo ule-
gają zniszczeniu podczas dezynfekcji. Powodem
jest występowanie w szpitalach i laboratoriach
różnego sprzętu, brak kompatybilności sprzętu
z preparatem dezynfekcyjnym lub wrażliwość
na wilgoć. Inne przyczyny to niewłaściwe wyko-
nywanie obowiązków przez personel sprzątający
oraz błędy w technice dezynfekcyjnej, wynikające
z obawy przed uszkodzeniem drogiej aparatury,
co powoduje, że niektóre jej elementy w ogóle nie
są dezynfekowane i mogą mieć wpływ na prze-
noszenie się drobnoustrojów. W takiej sytuacji są
pomocne systemy dezynfekcji fumigacyjnej.
Systemy dezynfekcji fumigacyjnej
w Polsce
W Polsce dezynfekcję fumigacyjną defi-
niuje się jako [14]:
X
opryskiwanie powierzchni z jednoczesnym
odparowywaniem roztworu mikrobójcze-
go (opryskiwacze przenośne i jezdne);
X
rozpylanie w środowisku/pomieszczeniu
roztworu biobójczego w postaci mgły
mokrej (rozpylacze przenośne i jezdne);
X
zamgławianie pomieszczeń mgłą mikro-
zolową i mgłą suchą (atomizery, dyfuzo-
ry) –technologia tzw. suchej mgły;
X
gazowanie – technologia tzw. suchego
gazu.
W piśmiennictwie międzynarodowym
metody te określa się również jako bezdo-
tykowe automatyczne systemy dezynfekcji
pomieszczeń („non-touch” automated room
disinfection systems – NTD) [15]. Do tych
systemów zalicza się także: ozonowanie, ga-
zowanie dwutlenkiem chloru, naświetlanie
promieniowaniem UV – C, lecz metod tych
nie obejmuje tematyka artykułu.
W Polsce są dostępne poniżej wymienio-
ne systemy dezynfekcji fumigacyjnej.
X
Dekontaminacja metodą zamgławiania
(metoda mokra). W tej metodzie najczęś-
ciej jest stosowany nadtlenek wodoru
w niskim stężeniu ok. 5%, niekiedy z do-
datkiem związków srebra. W zagranicznej
literaturze technika ta jest określana jako:
dry-mist hydrogen peroxide (DMHP) lub
aerosolized hydrogen peroxide (aHP). Na
rynku istnieje kilka systemów opartych na
tej technologii:
– Aerosept AF, Aerosept Compact 250
(Medilab);
– Automate (Sani System);
– Glosair ASP (Johnson & Johnson),
dawniej Sterinis;
– Nocospray (Greenpol);
– Unik V1, Unik V2 (JTA);
– Sentinel (Anilab).
X
Dekontaminacja sucha, reprezentowana
przez system vaporized hydrogen pero-
xide (VHP) (Tehand). W tym systemie
zastosowano nadtlenek wodoru o stęże-
niu 35%.
X
Dekontaminacja sucha z minimalną
mikrokondensacją, reprezentowana
przez system hydrogen peroxide vapor
(HPV) (Klaromed).
Przebieg cykli dekontaminacji
systemów
aerosolized hydrogen
peroxide (aHP), vaporized
hydrogen peroxide (VHP), hydrogen
peroxide vapor (HPV)
Waporyzowany nadtlenek wodoru (VHP
– vaporized hydrogen peroxide) [16]:
System VHP zazwyczaj jest stosowany
w formie zamkniętego cyklu, podczas którego
powietrze zostaje usunięte z pomieszczenia
Zastosowanie
dezynfekcji nie
gwarantuje cał-
kowitej czystości
mikrobiologicz-
nej, nawet w od-
niesieniu do form
wegetatywnych
bakterii, które
łatwo ulegają
zniszczeniu pod-
czas dezynfekcji.
tarka_dekontaminacja.indd 3
tarka_dekontaminacja.indd 3
2013-01-09 18:03:15
2013-01-09 18:03:15
zakażenia 6/2012
sterylizacja i dezynfekcja
4
www.zakazenia.org.pl
i poddane dekontaminacji. Strumień powie-
trza przepływa przez filtr HEPA (aby nie do-
puścić do skażenia systemu), po czym przez
katalizator rozkładający nadtlenek wodoru na
tlen i wodę. Następnie powietrze jest odwil-
gacane na osuszaczu i przepuszczane przez
waporyzator, gdzie 35-procentowy roztwór
nadtlenku wodoru zostaje doprowadzony do
postaci gazowej. Osuszone powietrze niosące
waporyzowną postać nadtlenku wodoru jest
ponownie wprowadzane do pomieszczenia.
Proces VHP podlega ścisłej kontroli, tak
aby wprowadzane do pomieszczenia powie-
trze zawierające nadtlenek wodoru było suche
(stężenia wody i nadtlenku wodoru są utrzy-
mywane poniżej punktu kondesacji). Użycie
suchego gazu gwarantuje równomierną dys-
trybucję w obrębie pomieszczenia oraz dużą
kompatybilność materiałową [16].
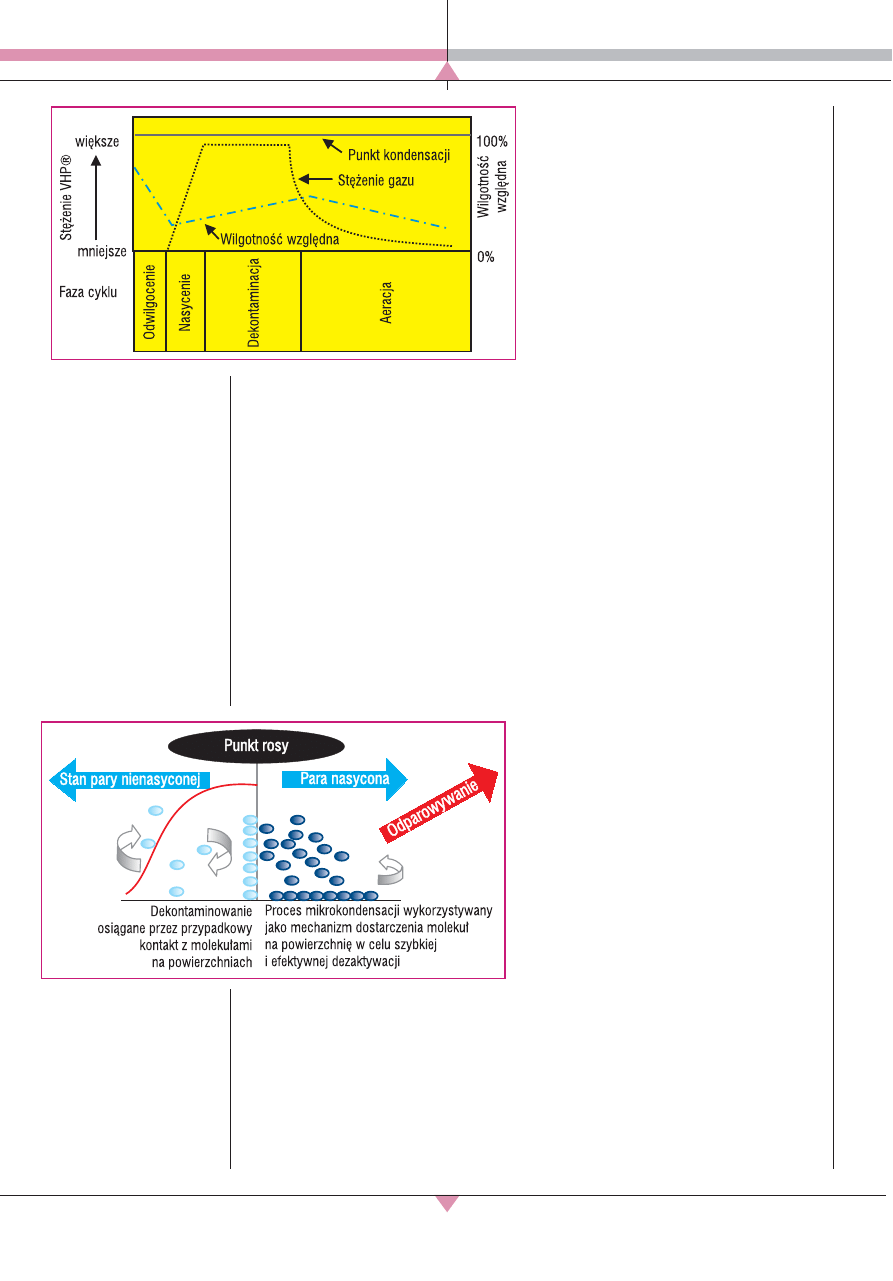
Cykl VHP dzieli się na cztery etapy [16]:
X
odwilgocenie – z pomieszczenia jest usu-
wana wilgoć; mniejsza wilgotność umoż-
liwia utrzymanie większego stężenia nad-
tlenku wodoru w postaci gazowej;
X
nasycenie – VHP jest gwałtownie wpro-
wadzane do pomieszczenia, tak aby moż-
liwie szybko osiągnąć pożądane stężenie
nadtlenku;
X
dekontaminacja – tempo wprowadzania
VHP jest ustalane na takim poziomie, aby
utrzymać stałe stężenie gazowej postaci
nadtlenku wodoru przez cały czas trwania
fazy, a czas dekontaminacji jest determi-
nowany przez wymagany poziom efektu
biobójczego, na który z kolei wpływa
utrzymywane stężenie VHP;
X
aeracja – wprowadzanie VHP zostaje
wstrzymane, a powietrze jest filtrowane
przez jednostkę VHP usuwającą z niego
nadtlenek wodoru; aeracja trwa dopóty,
dopóki poziom VHP w pomieszczeniu nie
zostanie uznany za bezpieczny (ryc. 1).
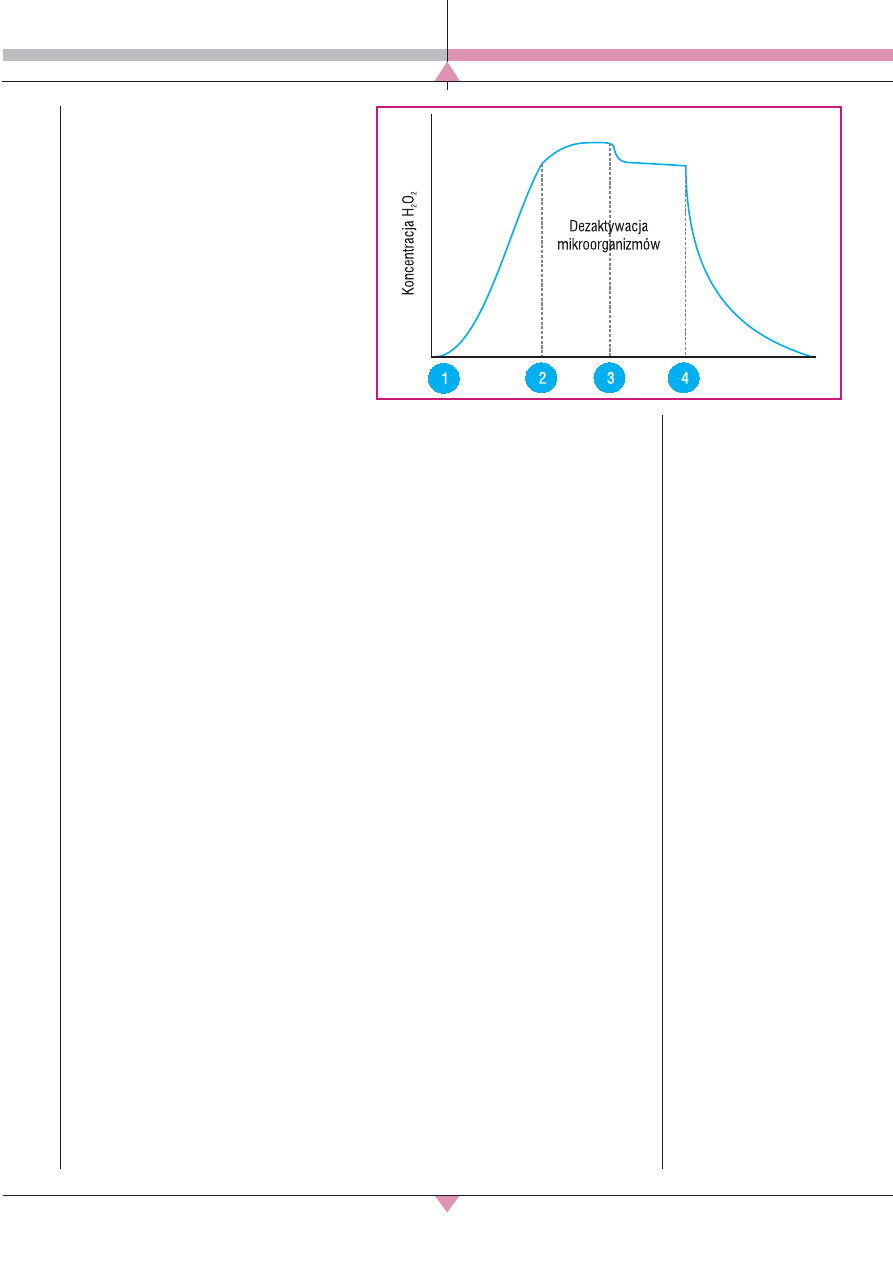
Gazowy nadtlenek wodoru (HPV – hydro-
gen peroxide vapor) [17]:
Jest to technologia, która umożliwia prze-
prowadzanie procesu powyżej punktu rosy.
Nasycona para kondensuje się na powierzch-
niach w postaci szczelnej mikrowarstwy.
Proces przeprowadzony tą metodą zapewnia
dużo większą skuteczność dezaktywacji pa-
togenów niż procesy oparte na metodzie aHP,
ponieważ mechanizm dekontaminacji nie
opiera się na przypadkowym kontakcie mole-
kuł z powierzchnią (ryc. 2). W tej technologii
nie istnieje potrzeba osuszania pomieszczenia
przed rozpoczęciem pracy urządzenia, a pro-
ces może być prowadzony w temperaturze
pokojowej, co zdecydowanie skraca czas
przygotowania i trwania cyklu [17].
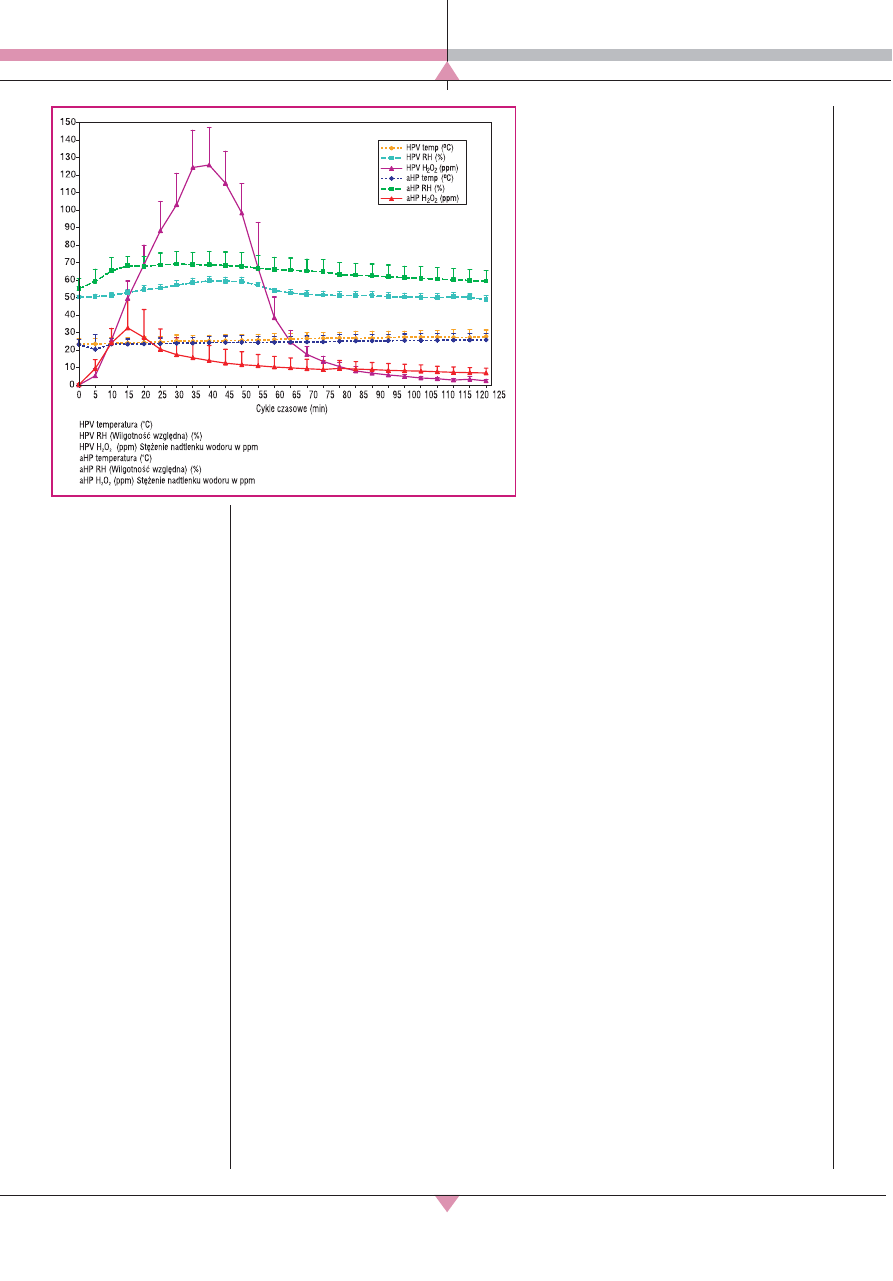
Cykl dekontaminacji składa się z czterech
faz, z których każda jest programowana au-
tomatycznie przez urządzenie na podstawie
wprowadzonej kubatury oraz aktualnych wa-
runków (ryc. 3) [17]:
X
faza kondycjonowania – urządzenie przy-
gotowuje się do pracy;
X
faza generowania par – z dyszy jest wy-
dzielana przegrzana para H
2
O
2
;
X
faza przetrzymania – następuje kondensa-
cja i dezaktywacja;
X
faza aeracji – rozkład nadtlenku wodoru
na wodę oraz tlen.
Aerozol nadtlenku wodoru (aHP – aero-
solized hydrogen peroxide) lub sucha mgła
nadtlenku wodoru (DMHP – dry-mist hy-
drogen peroxide)
W tych systemach nie występuje faza
przygotowania pomieszczenia do procesu
dezynfekcji fumigacyjnej. Natomiast należy
▲
Ryc.1. Przebieg dekon-
taminacji w systemie
VHP [16].
▲
Ryc. 2. Przebieg
mechanizmu konden-
sacji nadtlenku wo-
doru: lewa strona ryc.
– w technologii aHP,
prawa – w technologii
HPV [17].
tarka_dekontaminacja.indd 4
tarka_dekontaminacja.indd 4
2013-01-09 18:03:15
2013-01-09 18:03:15
zakażenia 6/2012
sterylizacja i dezynfekcja
www.zakazenia.org.pl
5
zwrócić uwagę, by temperatura pomiesz-
czenia nie była niższa niż tzw. pokojowa,
ponieważ może to być powodem mniejszej
skuteczności procesu. Jeżeli pomieszczenie
jest wyposażone w klimatyzację, powinna
zostać wyłączona podczas procesu zamgła-
wiania [18].
Preparat dezynfekcyjny w postaci mgły
jest dystrybuowany w pomieszczeniu
i powietrzu. Mgła osiada na powierzch-
niach znajdujących się w pomieszczeniu.
Po dyfuzji następuje właściwa faza bójcza
w wyniku kontaktu mgły z powierzchniami.
Po tym czasie pomieszczenie powinno być
przewietrzone celem usunięcia resztek mgły
preparatu dezynfekcyjnego. Najłatwiej moż-
na to zrobić, włączając klimatyzację. Dzię-
ki temu znacznie się przyspieszy ponowne
użycie dezynfekowanego pomieszczenia. Po
zakończeniu procesu nie powinien być wy-
czuwalny żaden drażniący zapach.
W trakcie procesu dezynfekcji fumigacyj-
nej metodą aHP może dojść do uruchomie-
nia czujników przeciwpożarowych, a także
detektorów tlenku etylenu, znajdujących się
w Centralnej Sterylizatorni.
Różnice w zakresie stężenia nadtlenku
wodoru oraz wilgotności wewnątrz pomiesz-
czenia, występujące między systemami aHP
i HPV, przedstawiono na rycinie 4.
Zastosowanie systemów
dezynfekcji fumigacyjnych
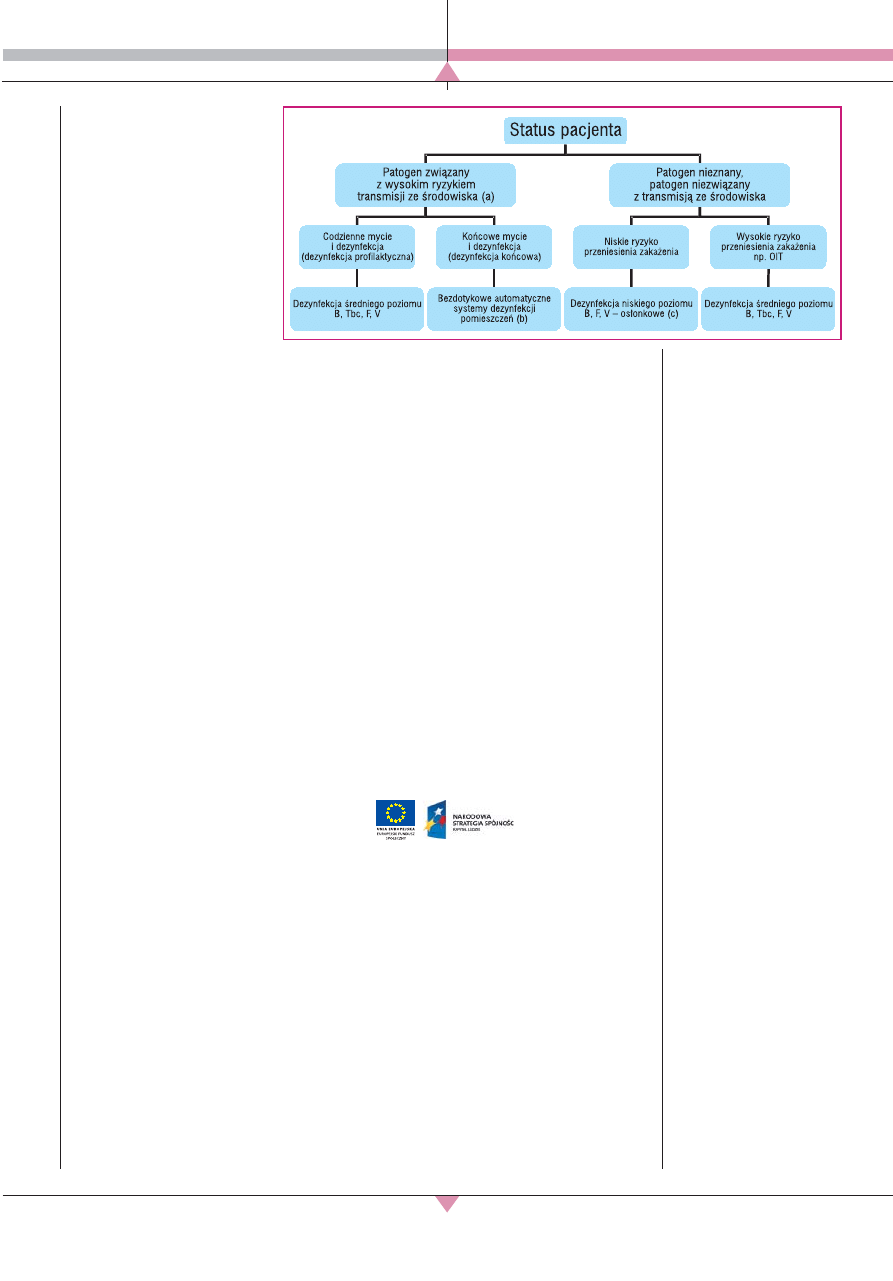
Propozycję wyboru metody dekontami-
nacji w zależności od czynników ryzyka
przedstawili Otter i wsp. [15] (ryc. 5). Zostało
udokumentowano ryzyko przeniesienia zaka-
żenia ze środowiska szpitalnego przez takie
drobnoustroje, jak: C. difficile, wankomycy-
nooporne Enterococcus, metycylinooporny
S. aureus, A. baumannii, P. aeruginosa oraz
norowirusy, dlatego w tych przypadkach za-
leca się stosowanie systemów NTD. Również
w obszarach wysokiego ryzyka zakażenia,
np. na OIT, może być celowe zastosowanie
takich systemów.
Skuteczność systemów
dekontaminacji w eliminacji
różnych patogenów
Wegetatywne formy bakterii
Metody dezynfekcji fumigacyjnych są sku-
teczne w wypadku skażenia środowiska szpi-
talnego MRSA [19] i Serratia spp. [20]. W ba-
daniach porównawczych Frencz i wsp. [21]
stwierdzili przed myciem w 74% prób środo-
wiskowych obecność szczepów MRSA, po
wykonaniu tylko mycia 60% prób wykazy-
wało obecność MRSA, natomiast po zastoso-
waniu dezynfekcji fumigacyjnej nadtlenkiem
wodoru stwierdzono obecność MRSA w jed-
nej próbie. Podobnie badania Ottera i wsp. [9]
wykazały skażenie MRSA i VRE odpowied-
nio w 40% i 6,7% powierzchni szpitalnych
przed myciem, po myciu stwierdzono zmniej-
szenie się skażenia, ale całkowite zniszczenie
szczepów chorobotwórczych zanotowano po
dezynfekcji nadtlenkiem wodoru.
Kristoffersen i wsp. [22] oraz French
i wsp. [23] badali przydatność systemu
Sterinis® do dekontaminacji pomieszczeń
skażonych MRSA w szpitalach i w do-
mach prywatnych. System ten był bardzo
skuteczny w dekontaminacji pomieszczeń
szpitalnych, natomiast w domach prywat-
nych okazał się mniej skuteczny, głównie ze
względu na słabszą penetrację czynnika de-
zynfekcyjnego w głąb tkanin, np. poduszek.
Chmielarczyk wraz zespołem prof. Heczko
uzyskali bardzo dobre wyniki w eliminacji
skażenia Acinetobacter baumannii na od-
dziale szpitalnym systemem VHP [24].
Metody oparte na aHP charakteryzują się
skutecznością na poziomie ok. 3 logarytmów,
natomiast metody oparte na systemach VHP
i HPV wykazują znacznie większą skutecz-
ność, tj. ponad 6 logarytmów [25].
Przetrwalniki bakteryjne (spory)
Dekontaminacja spor Clostridium diffi-
cile jest znacznie utrudniona z uwagi na ich
dużą oporność na czynniki dezynfekcyjne,
▲
Ryc. 3. Przebieg cyklu
dekontaminacji w techno-
logii HPV [17].
tarka_dekontaminacja.indd 5
tarka_dekontaminacja.indd 5
2013-01-09 18:03:15
2013-01-09 18:03:15
zakażenia 6/2012
sterylizacja i dezynfekcja
6
www.zakazenia.org.pl
łatwość rozprzestrzeniania się i kontamina-
cję wielu powierzchni w szpitalach. Przepro-
wadzono kilka badań na temat aktywności
sporobójczej systemów DMHP, VHP i HPV.
Andersen i wsp. [26], którzy zastosowali sy-
stem Sterinis® do dezynfekcji pomieszczeń
i wyposażenia medycznego oraz karetki
pogotowia, używając nośników sztucznie
skażonych sporami Bacillus atrophaeus,
uzyskali 87-procentową redukcję spor w za-
mkniętych pomieszczeniach oraz 100-pro-
centową na oddziałach chirurgicznych po
przeprowadzeniu trzech kolejnych cykli de-
kontaminacji systemem Sterinis®. Podobnie
system ten wykazał dużą skuteczność w de-
kontaminacji pomieszczeń zanieczyszczo-
nych sporami Clostridium difficile. Uzyska-
no 94-procentową skuteczność w eliminacji
spor [27]. Inaktywacja nie jest całkowita,
a stopień redukcji wynosi maksymalnie 3–4
logarytmy. Największą skutecznością w za-
kresie eliminacji spor (ponad 6 logarytmów)
charakteryzują się systemy VHP i HPV, i to
zarówno jeśli chodzi o spory wskaźnikowe,
np. Geobacillus stearothermpohilus, jak
i spory Clostridium difficile, w tym szczep
hiperwirulentnego ribotypu 027/NAP1/BI.
VHP zastosowano w dekontaminacji budyn-
ku administracji rządowej w Waszyngtonie
o kubaturze ok. 67 800 m
3
skażonego spo-
rami wąglika Bacillus antracis. Spory zosta-
ły dostarczone drogą pocztową przez urząd
w Brentwood. Skażenie sporami dotyczyło
całego budynku. Po procesie dekontaminacji
uzyskano całkowite zniszczenie przetrwalni-
ków Bacillus antracis [28].
Prątki gruźlicy
Dekontaminacja pomieszczeń skażonych
prątkami gruźlicy stwarza trudności. Z uwagi
na dużą zawartość lipidów prątki wykazu-
ją naturalną oporność na niektóre preparaty
dezynfekcyjne, prątki atypowe wykazują
jeszcze większą oporność niż prątki gruźli-
cze, ponadto obszar kontaminacji może być
duży i utrudniać właściwe dotarcie czynni-
ków dezynfekcyjnych do prątków, zwłasz-
cza w pomieszczeniach, w których jest wiele
sprzętów. W takiej sytuacji mogą być pomoc-
ne systemy dezynfekcji fumigacyjnych. Po-
twierdzają to wyniki dwóch badań.
Przeprowadzone przez Kahnerta i wsp. [29]
badanie dotyczyło dezynfekcji nośników
zawierających 8 x 10
4
– 2 · 3 x 10
6
CFU
M. tuberculosis H37Rv i M. tuberculosis Be-
ijing, umieszczonych w dezynfekowanym
pomieszczeniu. Po dezynfekcji waporyzo-
wanym nadtlenkiem wodoru (VHP) i inku-
bacji zakażonych nośników nie stwierdzono
wzrostu drobnoustrojów. Drugie podobne
badania przeprowadzili Hall i wsp. [30] z za-
stosowaniem systemu HPV (hydrogen pe-
roxide vapor). Nośniki zakażonych 3log
10
M. tuberculosis poddano działaniu gazowego
nadtlenku wodoru. Po inkubacji zakażonych
nośników także nie stwierdzono wzrostu prąt-
ków gruźlicy.
Natomiast badania Andersena i wsp. [31]
wykazały małą przydatność systemu opartego
na aHP do dekontaminacji nośników zanie-
czyszczonych M. tuberculosis. Wniosek: sto-
sowany w systemach VHP i HPV nadtlenek
wodoru w przeciwieństwie do metody aHP
jest skuteczny w redukcji prątków gruźlicy.
Wirusy
Wirusy mogą kontaminować powierzch-
nie szpitalne i wywoływać zakażenia szpi-
talne. Największe ryzyko przeniesienia
zakażenia z powierzchni wiąże się z wystę-
powaniem norowirusów i rotawirusów.
Systemy oparte na technologii VHP i HPV
były oceniane pod względem aktywności wi-
rusobójczej. Tuladhar i wsp. [32] badali ak-
tywność wirusobójczą systemu HPV wobec
poliovirusa, ludzkiego norowirusa, mysiego
norowirusa, rotawirusa, adenowirusa i wiru-
sa grypy typu A (H1N1), umieszczonych na
metalowych nośnikach. Redukcja > 4log
10
▲
Ryc. 4. Przebieg procesu
dezynfekcji fumigacyjnej
systemem aHP
i HPV [18].
tarka_dekontaminacja.indd 6
tarka_dekontaminacja.indd 6
2013-01-09 18:03:15
2013-01-09 18:03:15
zakażenia 6/2012
sterylizacja i dezynfekcja
www.zakazenia.org.pl
7
dotyczyła poliovirusa, ludzkiego
norowirusa, mysiego norowiru-
sa, rotawirusa, adenowirusa na-
tomiast redukcja wirusa grypy
wyniosła > 2 log
10
. Podobnie
badania McDonnella [33] oce-
niające aktywność wirusobójczą
systemu VHP wobec wirusa po-
lio i adeno, potwierdziły reduk-
cję miana o 3–4 log
10.
Grzyby
Grzyby pleśniowe stanowią
duże zagrożenie dla pacjentów
hematologicznych, zwłaszcza po przeszczepie-
niu szpiku kostnego. Pleśnie charakteryzują się
ekstremalnie wysoką opornością na promienio-
wanie ultrafioletowe (UV – C), dlatego jest ono
mało przydatne do ich inaktywacji. Systemy
dezynfekcji fumigacyjnych wykazują aktyw-
ność grzybobójczą i mogą być pomocne w de-
kontaminacji pomieszczeń skontaminowanych
zarodnikami grzybów pleśniowych [15].
Normy europejskie dla systemów NTD
Obecnie nie ma normy europejskiej doty-
czącej oceny działania systemów dezynfekcji
fumigacyjnych, natomiast we Francji funkcjo-
nuje norma francuska NF 72-281, która określa
działanie bakteriobójcze, grzybobójcze i spo-
robójcze podczas dezynfekcji powierzchni za
pomocą aerozoli. Ponieważ takie systemy stają
się coraz bardziej popularne, Komitet Tech-
niczny nr 216 ds. dezynfekcji i antyseptyki
Europejskiego Komitetu Normalizacyjnego
(CEN) uznał za konieczne opracowanie normy
europejskiej dotyczącej dezynfekcji metodami
fumigacyjnymi, opartej m.in. na normie fran-
cuskiej NF 72-281. Będzie to bardzo korzystne
dla użytkowników, gdyż stosowanie jednako-
wych metod badania umożliwi porównanie
systemów [34].
Podsumowanie
Metody NTD mogą stanowić znakomite
uzupełnienie walki z zakażeniami szpital-
nymi. Metody oparte na technologii aHP
charakteryzują się skutecznością na pozio-
mie 2–3 log w stosunku do wegetatywnych
form bakterii i grzybów. Działanie wobec
innych drobnoustrojów jest słabsze np.
spor i wymaga przeprowadzenia np. trzech
cykli.
Metody oparte na technologii VHP i HPV
cechują się zdecydowanie większą skutecz-
nością w zwalczaniu wegetatywnych form
bakterii, grzybów, prątków wirusów oraz
spor, tj. na poziomie 6 logarytmów, a także
większą kompatybilnością z dekontaminowa-
nym sprzętem.
Użycie systemów NTD powinno być
dobrze zorganizowane. Trzeba też się li-
czyć z niedostępnością pomieszczenia pod-
czas procesu dekontaminacji, co niekiedy
w praktyce może być niewykonalne. Należy
również brać pod uwagę kwestie kompatybil-
ności ze sprzętem medycznym znajdującym
się w dekontaminowanym pomieszczeniu.
Personel przeprowadzający dekontaminację
powinien być dobrze przeszkolony w obsłu-
dze systemu dekontaminacji oraz kwestiach
bezpieczeństwa. Systemy NTD powinny
być stosowane na powierzchniach wizualnie
czystych. Obecność materiału biologicznego
zmniejsza skuteczność procesu.
Artykuł powstał w ramach projektu grantowego „Na-
ukowcy dla gospodarki Mazowsza” współfinansowa-
nego ze środków Unii Europejskiej w ramach Europej-
skiego Funduszu Społecznego”
Piśmiennictwo:
1. Carling P. C., Von Beheren S., Kim P., Woods C.:
Intensive care unit environmental cleaning: an eva-
luation in sixteen hospitals using a novel assessment
tool for, the Healthcare Environmental Hygiene Stu-
dy Group. J. Hosp. Infect. 2008, 68, 39–44.
2. Lemmen S. W., Häfner H., Zolldann D.,
Stanzel S., Lütticken R.: Distribution of multi-re-
sistant Gram-negative versus Gram-positive bacte-
ria in the hospital inanimate environment, J. Hosp.
Infect. 2004, 56, 191–7.
3. Denton M., Wilcox M. H., Parnell P., Green D.,
Keer V., Hawkey P. M., Evans I., Murphy P.: Role of
environmental cleaning in controlling an outbreak of
Acinetobacter baumannii on a neurosurgical intensi-
ve care unit, J. Hosp. Infect. 2004, 56, 106–10.
▲
Ryc. 5. Proponow-
any diagram wyboru
sposobu dezynfekcji:
a) kluczowe patogeny
związane z transmisją ze
środowiska szpitalnego,
takie jak: C. difficile,
wankomycynooporne
enterococcus, metycyli-
nooporny S. aureus,
A. baumannii,
P. aeruginosa
oraz norowirusy;
b) systemy bezdotykowej
dezynfekcji mogące
być brane pod uwagę,
systemy te powinny być
zastosowane na wizual-
nie czyste powierzchnie,
wolne od zanieczyszczeń
organicznych;
c) stosunkowo mało jest
danych na temat tego, czy
dezynfekcja średniego
poziomu w środowisku
o niskim ryzyku może
ograniczyć rozprzestrze-
nianie się zakażeń [15].
tarka_dekontaminacja.indd 7
tarka_dekontaminacja.indd 7
2013-01-09 18:03:15
2013-01-09 18:03:15

zakażenia 6/2012
sterylizacja i dezynfekcja
8
www.zakazenia.org.pl
4. Gastmeier P., Schwab F., Bärwolff S., Rüden
H., Grundmann H.: Correlation between the genetic di-
versity of nosocomial pathogens and their survival time
in intensive care units, J. Hosp. Infect. 2006, 62, 181–6.
5. Kramer A., Schwebken I., Kampf G.: How long
do nosocomial pathogens persist on inanimate surfaces?
A systematic review, BMC Infect Dis. 2006, 130.
6. Barker J., Vipond I. B., Bloomfield S. F.:
Effects of cleaning and disinfection in reducing the
spread of Norovirus contamination via environmen-
tal surfaces. J. Hosp. Infect. 2004, 58, 42–9.
7. Rheinbaben F. v., Schünemann S., Groß T.,
Wolff M. H.: Transmission of viruses via contact in aho-
usehold setting: experiments using bacteriophage φX174
as a model virus, J. Hosp. Infect. 2000, 46, 61–6.
8. Rutala W. A. and D. J. Weber J. Hosp. Infect. 48,
Supplement 1.2001, 64–8 Surface disinfection:
should we do it? Reply to Professor F. Daschner
J. Hosp. Infect. 51, 2002, 309–1.
9. Gebel
J.:
Rutynowa dezynfekcja powierzchni
jako element higieny szpitalnej w Niemczech, Zaka-
żenia, 2006, 5, 16–20.
10. Grzesiowski P., Kowalski M., Lejbrandt E.,
Malara M., Pawletko R., Sobania M., Tymoczko A.,
Ziółko A.: Materiały konferencyjne. Ogólne zasady
utrzymania czystości w szpitalu, 2008.
11. Meyer B.: Dezynfekcja powierzchni zmy-
walnych w nieożywionym środowisku pacjenta – czy
dzięki temu można zmniejszyć częstość występowania
zakażeń szpitalnych? Zakażenia 2009, 3, 23–8.
12. French G. L, Otter J. A., Shannon K. P.,
Adams N. M. T., Watling D., Parks M. J.: Ta-
ckling contamination of the hospital environ-
ment by methycillin – resistant Staphyloccocus
aureus (MRSA);a comparison between conven-
tional terminal cleaning and hydrogen peroxide
vapor decontamination. J. Hosp. Infect. 2004,
57, 31–37.
13. Bhalla A., Pultz N. J., Gries D. M., Ray A. J.,
Eckstein E. C., Aron D. C., Donskey C. J: Acquis-
ition of nosocomial pathogens on hands after con-
tact with environmental surfaces near hospitalized
patients. Infect Control Hosp Epidemiol, 2004, 25
(2), 164–7.
14. Waszak B.: Techniki fumigacyjne w dekonta-
minacji szpitalnej [w:] Higiena w placówkach opieki
medycznej, Wydawnictwo Werlag Dashofer, Warsza-
wa 2008, część 3.
15. Otter J. A., Yezli S., Perl T. M, d, Barbut, F.,
French, G. L.: The role of ‘no-touch’ automated ro-
om disinfection systems in infection prevention and
control. J. Hosp. Infect, 83, (2013), 1–13.
16. McDonnell G., Czystość i sterylność – no-
we metody. Biuletyn Stowarzyszenia Kierowników
Szpitalnej Sterylizacji i Dezynfekcji. 2005/31/32,
15–30.
17. Książek T.: Dekontaminacja bloków opera-
cyjnych, http://www.blokoperacyjny.pl
18. Fu T. Y.: Gent P.: Kumar V.: Efficacy, effi-
ciency and safety aspects of hydrogen peroxide va-
pour and aerosolized hydrogen peroxide room dis-
infection systems, J Hosp Infect 2012, pp. 199–205.
19. Hardy K. J., Gossain, S., Henderson N., Dru-
gan C., Oppenheim B. A., Gao F., Hawkey P.M.; Rapid
recontamination with MRSA of the environment of an
intensive care unit after decontamination with hydrogen
peroxide vapour, J. Hosp. Infect. 66, 2007, 360–8.
20. Bates C. J., Pearse R.: Use of hydrogen
peroxide vapour for environmental control during
a Serratia outbreak in a neonatal intensive care unit,
J. Hosp. Infect. 2005, 61, 364–6.
21. French G. L, Otter J. A., Shannon K. P.,
Adams N. M. T., Watling D., Parks M. J.: Tackling
contamination of the hospital environment by methy-
cillin – resistant Staphyloccocus aureus (MRSA);
a comparison between conventional terminal cle-
aning and hydrogen peroxide vapor decontamination.
J. Hosp. Infect. 2004, 57, 31–7.
22. Kristoffersen K., Bartels M. D., Slotsbjerg
T., Rohde S. M., Lundgren B., Westh H.: P6.21 Eva-
luation of Sterinis® in Eliminating MRSA from the
Hospital Environment and a Private Home, J. Hosp.
Infect. 2006, 64, Sup. 1, 38.
23. French G. L, Otter J. A., Shannon K. P.,
Adams N. M. T., Watling D., Parks M. J.: Tackling
contamination of the hospital environment by methy-
cillin – resistant Staphyloccocus aureus (MRSA);
a comparison between conventional terminal cle-
aning and hydrogen peroxide vapor decontamina-
tion, J. Hosp. Infect. 2004, 57, 31–7.
24. Chmielarczyk A., Higgins P. G., Wojkow-
ska-Mach J., Synowiec E., Zander E., Romaniszyn
D., Gosiewski T., Seifert H,. Heczko P., Bulanda M.:
Control of an outbreak of Acinetobacter baumannii
infections using vaporized hydrogen peroxide. J Hosp
Infect. 2012, pp: 239–45.
25. Falagas M. E., Thomaidis P. C., Kotsantis I. K.,
Sgouros K., Samonis G., Karageorgopoulos D. E.:
Airborne hydrogen peroxide for disinfection of
the hospital environment and infection control:
a systematic review, J Hosp Infect 2011 pp.
171–7.
26. Andersen B. M., Rasch M., Hochlin K.,
Jensen H., Wismar P., Fredriksen E.: Decontamina-
tion of rooms, medical equipment and ambulances
using an aerosol of hydrogen peroxide disinfectant,
J. Hosp. Infect, 2006, 62, 149–55.
27. Shapey S., Machin K., Levi K., Boswell T. C.:
Activity of a dry mist hydrogen peroxide system aga-
inst environmental Clostridium difficile contamina-
tion in elderly care wards, J. Hosp. Infect. 2008, 70,
136–41.
28. Gustin E., Janick A., McVey I.: Facility De-
contamination of Anthrax Spores Utilizing Vaporized
Hydrogen Peroxide (VHP®), http://www.vhp.pl/pli-
ki_uploadowane/VHP%20anthrax%20ASM%20Po
ster.pdf
29. Kahnert A., Seiler P., Stein M., Aze B.,
McDonnell G., Kaufmann S. H. E.: Decontamination
with vaporized hydrogen peroxide is effective against
Mycobacterium tuberculosis, Lett Appl Microbiol.
2005, 40, (6), 448–52.
30. Hall L., Otter J. A., Chewins J., Wengenack
N. L.: Use of hydrogen peroxide vapour for deacti-
vation of Mycobacterium tuberculosis in a biological
safety cabinet and a room, J Clin Microbiol 2007 pp.
810–5.
31. Andersen B. M., Syversen G., Thoresen H.:
Failure of dry mist of hydrogen peroxide 5% to kill My-
cobacterium tuberculosis, J Hosp Infect 2010 pp. 80–3.
32. Tuladhar E., Terpstra P., Koopmans M.,
Duizer E.: Virucidal efficacy of hydrogen peroxide
vapour disinfection J Hosp Infect 2012 pp. 110–5.
33. McDonnell G., Eterpi M., Thomas V.: Dis-
infectants efficacy against hardy viruses dried onto
surfaces. Abstracts, 7th International Conference of
the Hospital Infection Society, 10–13 October 2010,
Liverpool, UK, J Hosp Infect 76S1, (2010), S1–S90.
34. Resolution 16/2011 – Methods of airborne
disinfection of surfaces – approved at the 21st Ple-
nary Meeting of CEN/TC 216, Bonn, 3–4 November
2011.
data przyjęcia pracy – 12.12.2012
data akceptacji – 31.12.2012
Metody oparte
na technologii
VHP i HPV ce-
chują się zdecy-
dowanie większą
skutecznością
w zwalczaniu
wegetatywnych
form bakterii,
grzybów, prąt-
ków wirusów
oraz spor,
tj. na poziomie
6 logarytmów,
a także większą
kompatybilnoś-
cią z dekontami-
nowanym sprzę-
tem.
tarka_dekontaminacja.indd 8
tarka_dekontaminacja.indd 8
2013-01-09 18:03:15
2013-01-09 18:03:15
Wyszukiwarka
Podobne podstrony:
tarka dekontaminacja
tarka dekontaminacja2
epi w10 zasady dekontaminacji malych i duzych powierzchni
DEKONTAMINACJA(1)
Historia Tarka Na Historie
Historia -Tarka, TARKA!!, H
dekontaminacja wstępna-wytyczne, Studia - ratownictwo medyczne, 3 rok, Medyczne czynności ratunkowe
Historia -Tarka, Interwencja zbrojna w Czechosłowacji, Interwencja zbrojna w Czechosłowacji
Historia -Tarka, Interwencja zbrojna w Czechosłowacji, Interwencja zbrojna w Czechosłowacji
dekontaminacja malych i duzych powierzchni 07
Ćwiczenie 2 Metody dekontaminacji, Mikrobiologia
Odkażanie, sterylizacja, DEKONTAMINACJA SPRZĘTU I ŚRODOWISKA
Tarka historiak Rath Vegh Istvan
59 MT 12 Zmechanizowana tarka
test z wypadków masowych +dekontaminacja, ratownicto 2012 2013, ratownictwo medyczne, medyczne czynn
Historia -Tarka, Historia powszechna po II wojnie światowej - rozpiska, Historia powszechna po II w
Szkol Dekontaminacja ratownictwo chemiczne
DEKONTAMINACJA POSZKODOWANYCH
więcej podobnych podstron