
Acta Sci. Pol., Biotechnologia 5(1-2) 2006, 95-103
WZROST DROśDśY W MODELOWYM SERZE
I ICH WPŁYW NA DEGRADACJĘ
BIAŁEK I TŁUSZCZU
Agata Czajgucka, Józefa Chrzanowska, Piotr Juszczyk,
Marek Szołtysik, Xymena Połomska, Maria Wojtatowicz*
1
Uniwersytet Przyrodniczy we Wrocławiu
Streszczenie.
W badaniach wykorzystano siedem szczepów drożdży, w tym:
Candida
famata
MI1a,
C. intermedia
BI2a,
C. kefyr
PII1b,
C. sphaerica
FII7a,
Geotrichum penicil-
latum
EII6a,
Saccharomyces kluyveri
BII3a i
Yarrowia lipolytica
PII6a wyizolowanych z
sera Rokpol. Drożdże wprowadzano aseptycznie do masy serowej (parakazeinian wapnia)
w ilości 10
5
j.t.k./g i inkubowano w temperaturze 25 °C przez okres 7 dni. Próbę kontrol-
ną stanowiły modelowe sery bez dodatku drożdży. Po inkubacji w serach oznaczano
ogólną liczbę drożdży oraz towarzyszące ich wzrostowi, zmiany degradacyjne białek i
tłuszczu.
Najlepszy wzrost w masie serowej typu „slurry” wykazywały drożdże
Y. lipolytica
PII6a.
Szczep ten powodował również najgłębsze zmiany degradacyjne tłuszczu i białek, co
prowadziło do nagromadzenia największej ilości wolnych kwasów tłuszczowych oraz
drobnocząsteczkowych związków białkowych.
Słowa kluczowe:
drożdże, modelowe sery, wzrost, proteoliza, lipoliza
WSTĘP
Mikroflora drożdżowa naturalnie występuje w większości typów serów i dzięki swo-
im uzdolnieniom proteolitycznym i lipolitycznym aktywnie uczestniczy w procesie
degradacji białek i tłuszczu mlecznego [Besançon i in. 1992, Roostita i Fleet 1996,
Guerzoni i in. 1998, van den Tempel i Jakobsen 1998, Welthagen i Viljoen 1998, van
den Tempel i Jakobsen 2000, Gdula i in. 2002]. Jest ona jednak mikroflorą dziką, nie-
kontrolowaną, przejawiającą dużą zmienność, tak pod względem składu jakościowego,
jak i liczebności. Dlatego jej wpływ na kształtowanie cech jakościowych gotowych
* Praca została wykonana w ramach grantu Ministerstwa Nauki i Informatyzacji 2 P06T 050 28.
Adres do korespondencji – Corresponding author: Józefa Chrzanowska, Katedra Technologii
Surowców Zwierzęcych i Zarządzania Jakością, Uniwersytet Przyrodniczy we Wrocławiu,
ul. C.K. Norwida 25/27, 50-375 Wrocław, e-mail: jch@wnoz.ar.wroc.pl

A. Czajgucka i in.
Acta Sci. Pol.
96
produktów jest tak trudny do jednoznacznego określenia. W podjętych badaniach spró-
bowano wyjaśnić oddziaływanie tych mikroorganizmów na składniki sera. W tym celu
wybrane szczepy drożdży, które zostały wcześniej wyizolowane z polskiego sera z prze-
rostem pleśniowym Rokpol i zidentyfikowane [Wojtatowicz i in. 2001], wprowadzono
indywidualnie do modelowego sera, jakim był parakazeinian przygotowany zgodnie z
procedurą podaną przez Wyder i Puhan [1999]. W serach tych kontrolowano następnie
zarówno wzrost drożdży, jak i zachodzące zmiany proteolityczne i lipolityczne.
MATERIAŁ I METODY
Mikroorganizmy. Przedmiotem badań było 7 szczepów drożdży:
Candida famata
MI1a (Cf MI1a),
C. intermedia
BI2a (Ci BI2a),
C. kefyr
PII1b (Ck PII1b),
C. sphaerica
FII7a (Cs FII7a),
Geotrichum penicillatum
EII6a (Gp EII6a),
Saccharomyces kluyveri
BII3a (Sk BII3a) i
Yarrowia lipolytica
PII6a (Yl PII6a), pochodzących z kolekcji Kate-
dry Biotechnologii i Mikrobiologii śywności Akademii Rolniczej we Wrocławiu. Droż-
dże przechowywano w temp. 4 ºC na skosach z podłożem YM-agar o składzie (g
×
L
-1
):
glukoza-10; bactopepton (Difco)–5; ekstrakt drożdżowy (Difco)-3; ekstrakt słodowy
(Difco)-3; agar-15.
Przygotowanie modelowych serów. Sery otrzymywano zgodnie z metodyką podaną
przez Wyder i Puhan [1999]. Do wytrąconego z krowiego mleka UHT o zawartości 2%
tłuszczu, przy użyciu podpuszczki, skrzepu parakazeinowego wprowadzano w sposób
aseptyczny poszczególne szczepy drożdży w ilości ok. 10
5
j.t.k.
×
g
-1
masy serowej. Sery
inokulowane każdym szczepem drożdży wykonywano w dwóch powtórzeniach i inku-
bowano w temperaturze 25 °C przez okres 7 dni. W masie serowej, na początku okresu
inkubacji i po jej zakończeniu, oznaczono liczbę drożdży, pH oraz zmiany proteolitycz-
ne i lipolityczne.
Oznaczanie ogólnej liczby drożdży. Liczbę komórek drożdży oznaczano na podłożu
OGY, o składzie (g
×
L
-1
): glukoza-20; ekstrakt drożdżowy (Difco)-5; chlorowodorek
oksytetracykliny
(Merck)-0,1;
agar
(Difco)-15. Płytki inkubowano w temperaturze 30 ºC
przez 72 godziny.
Oznaczanie związków azotowych. Azot ogólny w mleku i serze oznaczano metodą
Kjeldahla [Zmarlicki 1981]. Zawartość białka określano mnożąc zawartość azotu przez
współczynnik 6,38. Azot rozpuszczalny w serze oznaczano sporządzając 10% (w/v)
wyciąg wodny sera, który poddano godzinnej inkubacji w łaźni wodnej o temp. 40 ºC.
Tak otrzymaną mieszaninę po odwirowaniu (20 min, 4000 g) schłodzono do 4 ºC. Po
upływie 30 min całość filtrowano. W przesączu oznaczono zawartość azotu metodą
Kjeldahla (jak wyżej).
Oznaczanie wolnych grup aminowych. Zawartość wolnych grup aminowych we
frakcji wodnej sera i frakcji rozpuszczalnej w kwasie fosfowolframowym oznaczano
przy użyciu kwasu 2,4,6 trójnitrobenzenosulfonowego (TNBS, Sigma), według zmody-
fikowanej metody Kuchroo i in. [1983]. Wydzielanie frakcji związków azotowych roz-
puszczalnych w kwasie fosfowolframowym (PTA, Fluka) przeprowadzono według
metody Jarreta i in. [1982].
Oznaczanie wolnych kwasów tłuszczowych. Uwolnione z tłuszczu w serze kwasy
tłuszczowe oznaczano metodą miareczkową [Deeth i in.1975], a udział poszczególnych
wolnych kwasów metodą chromatografii gazowej według Deeth'a i in. [1983]. Ekstrak-
cję kwasów przeprowadzano dodając do 1 g sera 2,5 g bezwodnego Na
2
SO
4
, 0,1 mL

Wzrost drożdży w modelowym serze...
Biotechnologia
5(1-2) 2006
97
1 H H
2
SO
4
i 5 mL eteru dwuetylowego. Całość dokładnie mieszano i pozostawiono w
temp. 4
ºC na 1 godzinę. Po tym czasie dodawano 5 mL heksanu i po wymieszaniu
wirowano przy 2000 g przez 5 minut. Roztwór heksan – eter dwuetylowy nanoszono na
szklaną kolumnę chromatograficzną zawierającą 1 g obojętnego tlenku glinu zaktywo-
wanego wodą. Mieszaninę przepuszczano przez kolumnę z prędkością ok. 3mL
×
min
-1
.
Otrzymany eluat ponownie przepuszczano przez kolumnę, a następnie przemywano
5 ml mieszaniny eter dwuetylowy-heksan w stosunku 1:1 (v
×
v
-1
). Tlenek glinu z zaad-
sorbowanymi kwasami tłuszczowymi suszono przy zastosowaniu próżni i przenoszono
do probówek. Następnie dodawano 1ml eteru dwuizopropylowego zawierającego 6%
kwasu mrówkowego. Próby dokładnie mieszano, po czym wirowano przy 2000 g przez
5 min, w temp. 0 ºC. Po odwirowaniu oddzielano supernatant zawierający wolne kwasy
tłuszczowe i dodawano, jako wewnętrzne standardy, kwasy C
17:0
i C
5
w ilości
po
50 µg. Próby (1µL) wstrzykiwano na chromatograf gazowy PU 4410 firmy Philips.
Rozdział prowadzono w następujących warunkach: długość kolumny 105 m, temperatu-
ra kolumny 160 ºC, wypełnienie Ltx 2330, temperatura detektora 230 ºC, gaz nośny-hel.
WYNIKI I OMÓWIENIE
W tabeli 1 przedstawiono zmiany liczebności drożdży w masie serowej podczas in-
kubacji. Największy przyrost liczby komórek po 7 dniach zaobserwowano w przypadku
szczepów
Y. lipolytica
PII6a i
G. penicillatum
EII6a, których populacje osiągały ok.
10
8
j.t.k.
×
g
-1
. Pozostałe szczepy osiągały po tym czasie liczebność na poziomie niższym
o jeden rząd logarytmiczny (10
7
j.t.k.
×
g
-1
), z wyjątkiem drożdży
C. sphaerica
FII7a,
których wzrost w masie serowej był najmniejszy i wynosił 6,0-6,4x10
6
j.t.k.
×
g
-1
.
Tabela 1. Liczebność drożdży po 7 dniach inkubacji w masie serowej
Table 1. Total yeast count in cheese after 7 days of incubation
Liczba drożdży
Yeast count (cfu
×
g
-1
)
Szczep
Strain
Czas, Time = 0 d
Czas, Time= 7d
C. famata
MI1a
1,3x10
5
± 2,0x10
4
3,3 x10
7
± 2,0 x10
6
C. intermedia
BI2a
2,8 x10
5
± 3,0 x10
4
4,0 x10
7
± 2,0 x10
6
C. kefyr
PII1b
4,2 x10
5
± 3,0 x10
4
2,1 x10
7
± 2,0 x10
6
C. sphaerica
FII7a
3,6 x10
5
± 2,0 x10
4
6,2 x10
6
± 2,0 x10
5
G. penicillatum
EII6a
2,0 x10
5
± 3,0 x10
4
2,2 x10
8
± 2,0 x10
7
S. kluyveri
BII3a
3,1 x10
5
± 3,0 x10
4
4,3 x10
7
± 3,0 x10
6
Y. lipolytica
PII6a
2,9 x10
5
± 2,0 x10
4
2,5 x10
8
± 2,0 x10
7
Wartość średnia ± odchylenie standardowe, Mean value ± standard deviation
Wraz ze wzrostem drożdży zachodziły również w masie serowej zmiany pH. W
obecności większości szczepów drożdży (
C. famata
MI1a,
G.
penicillatum
EII6a,
Y.
lipolytica
PII6a,
C. kefyr
PII1b i
C. intermedia
BI2a) wartość pH ulegała podwyższeniu
od 5,70 do 5,84-5,97. Tylko dwa szczepy, tj.
S. kluyveri
BII3a i
C. sphaerica
FII7a
wpłynęły na niewielkie zakwaszenie środowiska; pH ulegało obniżeniu odpowiednio
do 5,60 i 5,63.
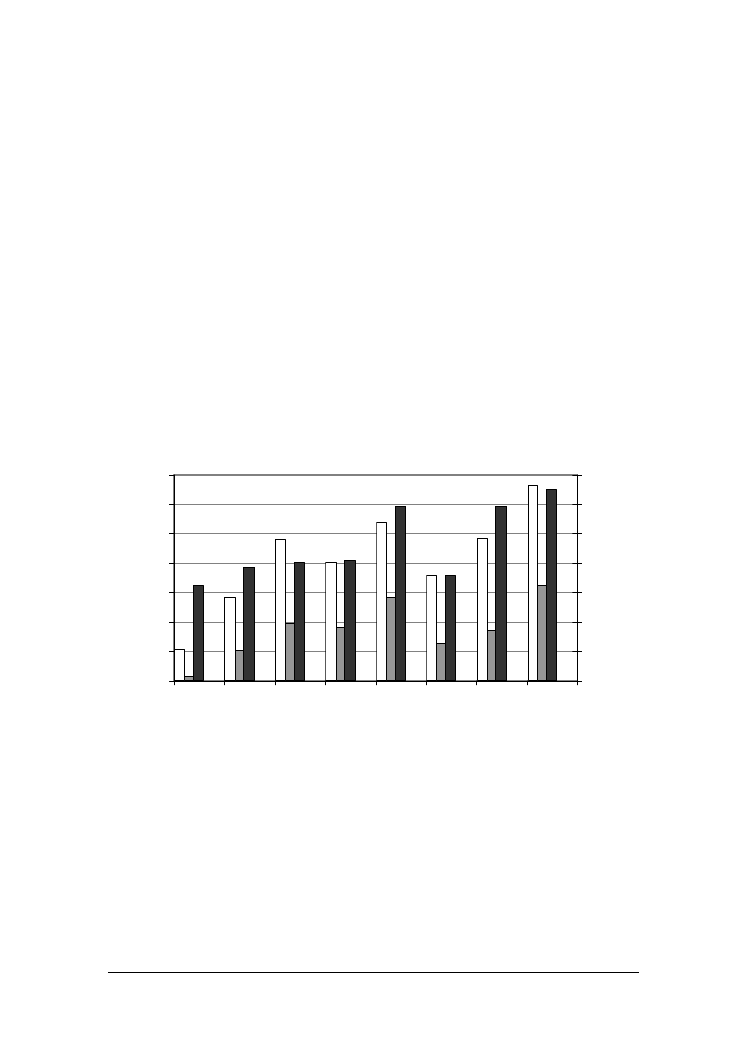
A. Czajgucka i in.
Acta Sci. Pol.
98
Zmiany proteolityczne w parakazeinie zaszczepionej poszczególnymi kulturami
drożdży mierzono poprzez pomiar zawartości N
rozp
. i wolnych grup aminowych (rys. 1).
Na początku inkubacji zawartość azotu rozpuszczalnego była na podobnym poziomie
(6,46-6,51% / N
og
.) we wszystkich analizowanych próbach. Po 7 dniach inkubacji naj-
większy jego poziom, 11,83 i 13,03%, obserwowano odpowiednio w obecności szcze-
pów:
C. sphaerica
FII7a i
Y. lipolytica
PII6a. Ilość uwolnionych grup aminowych we
frakcji rozpuszczalnej, tak w wodzie, jak i w kwasie fosfowolframowym, w serach
zaszczepionych tymi drożdżami, była również największa. W obecności drożdży
Y. lipolytica
PII6a zawartość wolnych grup aminowych we frakcji rozpuszczalnej w
wodzie wynosiła 3321 µmol/100g, a we frakcji rozpuszczalnej w kwasie fosfowolfra-
mowym 1654 µmol Gly/100 g, natomiast w obecności
C. sphaerica
FII7a, a odpowied-
nio 2713 i 1318 µmol/100 g. Stopień degradacji białka w serach podczas wzrostu pozo-
stałych szczepów drożdży był znacznie niższy
.
Po zakończeniu inkubacji zawartość
azotu rozpuszczalnego ukształtowała się w nich w granicach od 7,10 do 8,83%, nato-
miast wolnych grup aminowych we frakcji rozpuszczalnej w wodzie od 1321 do 2343
µmol Gly/100 g, a w kwasie fosfowolframowym od 490 do 988 µmol Gly/100 g
.
W
serze kontrolnym bez drożdży, zawartość wolnych grup aminowych utrzymywała się na
stałym poziomie przez cały okres inkubacji i wynosiła 513 i 51 µmol/100 g, odpowied-
nio we frakcji rozpuszczalnej w wodzie i kwasie fosfowolframowym.
0
500
1000
1500
2000
2500
3000
3500
Control
without
yeast
Cf
MI1a
Ci
BI2a
Ck
PII1b
Cs
FII7a
Gp
EII6a
Sk
BII3a
Yl
PII6a
0
2
4
6
8
10
12
14
W
SN
( %
of
N
to
tal)
Szczepy drożdży, Yeast strains
W
G
A
, F
A
G
[µ
M
G
ly
/
10
0g
]
Rys. 1. Zawartość wolnych grup (WGA) we frakcji sera rozpuszczalnej w wodzie i kwasie fos-
fowolframowym oraz azotu rozpuszczalnego w wodzie (WSN) po 7 dniach inkubacji z
kulturami drożdży
Fig. 1. Content of Free Amino Groups (FAG) soluble in: water (□), PTA (
■
) and Water Solu-
ble Nitrogen (■) after 7 days growth of yeast strains in cheese
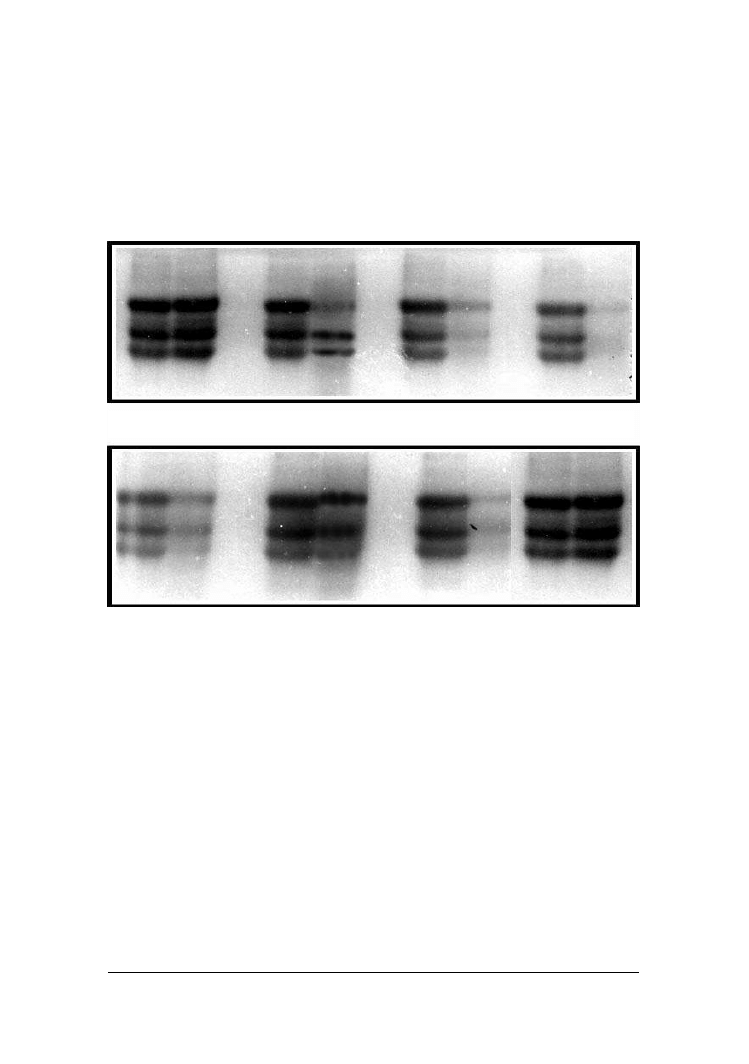
Zmiany degradacyjne parakazeinianu pod wpływem wprowadzonych do niego
drożdży analizowane przy użyciu metody elektroforezy w żelu poliakrylamidowym
przedstawiono na rysunku 2. Rozkład białek był najbardziej widoczny pod wpływem
drożdży
C. sphaerica
FII7a i
Y. lipolytica
PII6a. Po 7 dniach inkubacji sera z tymi
Wzrost drożdży w modelowym serze...
Biotechnologia
5(1-2) 2006
99
szczepami następował całkowity zanik frakcji α
S1
- i β kazeiny
.
Szczepy
C.
intermedia
BI2a,
C. kefyr
PII1b i
S. kluyveri
BII3a wykazywały znacznie mniejszą aktywność pro-
teolityczną. W ich obecności obserwowano rozkład głównie frakcji β -kazeiny
.
Brak
widocznych zmian degradacyjnych kazeiny stwierdzono w serach z dodatkiem
C. fama-
ta
MI1a i
G. penicillatum
EII6a, a także w serze kontrolnym.
Rys. 2. Rozdział elektroforetyczny białek sera zaszczepionego poszczególnymi kulturami
drożdży
Fig. 2. Protein degradation in cheese inoculated with yeast strains
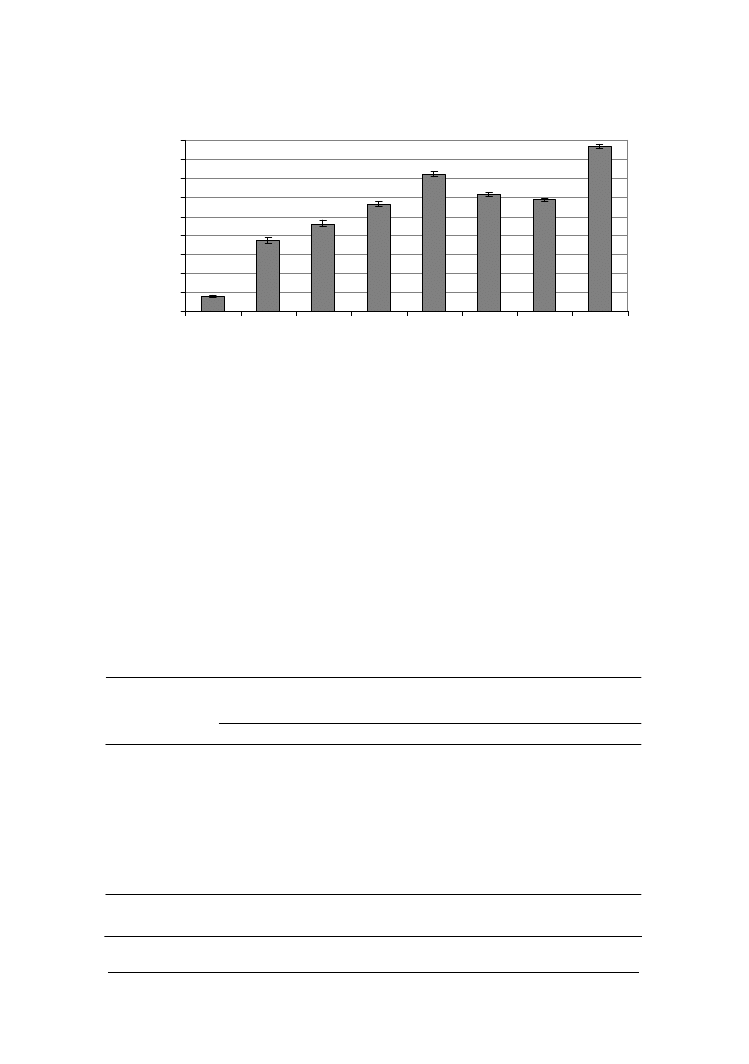
Drożdże rosnące w masie serowej powodowały również zmiany degradacyjne tłusz-
czu mlecznego (rys. 3). Największy poziom wolnych kwasów tłuszczowych (WKT)
stwierdzono w serze zaszczepionym drożdżami
Y. lipolytica
PII6a i
C. sphaerica
FII7a.
Wynosił on odpowiednio 2610 µmol i 2161 µmol WKT w 100g. W mniejszym stopniu
kwasy tłuszczowe były uwalniane przez drożdże
C. kefyr
PII1b,
G. penicillatum
EII6a i
S. kluyveri
BII3a. Po 7 dniach ich wzrostu w skrzepie parakazeinowym zawartość wol-
nych kwasów tłuszczowych była na poziomie 1689-1850 µmol/100 g sera. Najmniejszą
aktywność lipolityczną w masie serowej wykazywały szczepy
C. famata
MI1a i
C. intermedia
BI2a uwalniające po okresie jednego tygodnia odpowiednio 1121 i
1385 µmol kwasów/100
g
.
W serach kontrolnych zawartość wolnych kwasów tłusz-
czowych wynosiła 230 µmol/100 g masy serowej tak na początku, jak i po 7 dniach
inkubacji w temperaturze pokojowej.
Kontrola/Control
Sk BII3a
Ck PII1b
Yl PII6a
Ci BI2a
Gp EII6a
Cs FII7a
Cf MI1a
0
7
0
7
0
7
0 7
Czas [doba], Time [days]
A. Czajgucka i in.
Acta Sci. Pol.
100
0
300
600
900
1200
1500
1800
2100
2400
2700
Control
without
yeast
Cf
MI1a
Ci
BI2a
Ck
PII1b
Cs
FII7a
Gp
EII6a
Sk
BII3a
Yl
PII6a
Szczepy drożdży, Yeast strains
[µ
mo
l /
10
0g
]
Rys. 3. Ogólna zawartość wolnych kwasów tłuszczowych w serze po 7 dniach inkubacji
z kulturami drożdży
Fig. 3. Total free fatty acids contents in cheese inoculated with yeasts after 7 days of incubation
Udział procentowy poszczególnych kwasów tłuszczowych uwolnionych po 7
dniach
inkubacji wybranych szczepów drożdży w masie serowej przedstawiono w tabeli 2.
W obecności wszystkich szczepów drożdży stwierdzono największą zawartość kwasu
oleinowego (C
18:1
) i mirystynowego (C
14
). Największą zdolność uwalniania kwasu ole-
inowego posiadał szczep
Y. lipolytica
PII6a (31,8%), a kwasu mirystynowego szczep
G. penicillatum
EII6a (42,89%). Szczepy pozostałych gatunków drożdży uwalniały te
kwasy odpowiednio w granicach 23,14-28,02% i 15,70-29,93%.
Tabela 2. Udział procentowy WKT w serze po 7 dniach inkubacji z różnymi szczepami drożdży
Table 2. Relative contents of FFA in cheese after the 7 days growth of yeast strains
Wolne Kwasy Tłuszczowe [%]
Free Fatty Acids [%]
Szczepy drożdży
Yeast strains
C
4
C
6
C
8
C
10
C
12
C
14
C
16
C
18:0
C
18:1
C
18:2
C. famata
MI1a
2,1
1,7
2,8
3,2
5,6
24,5
22,6
7,4
27,1
3,2
C. intermedia
BI2a
2,5
2,2
2,7
1,9
14,8
15,7
29,5
5,7
23,3
1,8
C. kefyr
PII1b
3,5
1,7
4,6
2,7
8,0
22,8
28,8
2,6
23,1
2,2
C. sphaerica
FII7a
1,6
1,6
2,9
1,8
15,7
33,7
6,4
5,0
28,0
3,3
G. penicillatum
EII6a
1,0
1,1
1,5
2,5
6,4
42,9
14,5
3,6
25,0
1,7
S. kluyveri
BII3a
1,8
2,5
3,8
2,2
10,8
29,9
12,8
6,4
25,0
4,8
Y. lipolytica
PII6a
2,3
2,2
2,6
3,7
4,3
22,0
10,3
20,0
31,2
1,4
Kontrola bez drożdży
Control without
yeasts
3,1
2,8
3,1
2,5
10,6
13,0
31,8
7,3
21,2
5,0

Wzrost drożdży w modelowym serze...
Biotechnologia
5(1-2) 2006
101
Równocześnie, w porównaniu do próby kontrolnej, obserwowano w masie serowej
inkubowanej z drożdżami
Y. lipolytica
PII6a oraz
C. intermedia
BI2a i
C. sphaerica
FII7a większy udział, odpowiednio, kwasu stearynowego (C
18:0
) oraz lauryowego (C
12
)
w ogólnej puli wolnych kwasów tłuszczowych. Krótkołańcuchowe kwasy tłuszczowe,
tj. kwas masłowy (C
4
) i kaprylowy (C
6
), były uwalniane w najmniejszych ilościach
(0,96-3,50%) przez wszystkie szczepy drożdży. Zawartość wolnych kwasów tłuszczo-
wych w próbie kontrolnej była na stałym poziomie w ciągu całego okresu inkubacji.
DYSKUSJA
W wyniku przeprowadzonych badań stwierdzono, że po tygodniu inkubacji mode-
lowych serów zaszczepionych kulturami drożdży populacje tych drobnoustrojów uległy
powiększeniu i osiągnęły liczebność 10
6
- 10
8
j.t.k.
×
g
-1
. Podobnie jak w badaniach
Wyder i Puhan [1999] odnotowano najbardziej znaczący wzrost drożdży z gatunku
Y. lipolytica.
Jednocześnie określenie pH parakazeinianu inkubowanego z drożdżami
dało możliwość wyodrębnienia szczepów mających największą zdolność do odkwasza-
nia masy serowej. Wykazywały ją drożdże
C. intermedia
BI2a,
S. kluyveri
BII3a
, G.
penicillatum
EII6a,
C. famata
MI1a i
Y. lipolytica
PII6a, co wynika ze zdolności tych
gatunków do utylizacji kwasu mlekowego i cytrynowego lub wytwarzania zasadowych
metabolitów [Wyder i Puhan 1999, Juszczyk i in. 2005].
Wyniki przedstawione w niniejszej pracy wskazują na duże różnice w głębokości
zmian degradacyjnych białek i tłuszczu badanych mas serowych, wynikające z różnych
uzdolnień hydrolitycznych poszczególnych szczepów drożdży. Największa proteoliza
była obserwowana w serze zaszczepionym drożdżami
Y. lipolytica
PII6a. Przyrost
związków białkowych, rozpuszczalnych w wodzie oraz niskocząsteczkowych związków
azotowych rozpuszczalnych w kwasie fosfowolframowym, świadczy o wysokiej ak-
tywności tak endo-, jak i egzopeptydazowej tych drożdży. Podobne wyniki, wskazujące
na wysoką aktywność proteolityczną drożdży
Y. lipolytica,
wprowadzonych do "slurry"
z mleka krowiego, przedstawili Wyder i Puhan [1999], a także Freitas i in. [1999], któ-
rzy analizowali wpływ tych drożdży na degradację parakazeinianu uzyskanego z mleka
koziego i owczego. Ci ostatni autorzy dowiedli też niewielką aktywność endopeptyda-
zową drożdży z gatunku
D. hansenii
/
C. famata
wobec białka mleka zarówno krowie-
go, jak i koziego i owczego. Potwierdzają to również wyniki uzyskane w pracy własnej,
bowiem ser zaszczepiony drożdżami
C. famata
MI1a charakteryzował się najniższym
stopniem proteolizy. Zmiany lipolityczne zachodzące podczas dojrzewania serów są
wynikiem uwalniania kwasów tłuszczowych [Fox i in. 1995]. O cechach sensorycz-
nych, związanych z hydrolitycznym rozkładem tłuszczu mlecznego, decydują kwasy
tłuszczowe o długości łańcucha od 2 do 18 atomów węgla, ale największe znaczenie
mają kwasy krótko- i średniołańcuchowe [Fox i in. 1993]. Jednocześnie mogą one być
prekursorami innych ważnych związków, np. metyloketonów, alkoholi czy estrów,
biorących udział w kształtowaniu cech organoleptycznych serów [Jollivet i in. 1994,
Molimard i Spinnler 1996, Cichosz 1997, Gardini i in. 1999, Pandey i in. 1999, Mc-
Sweeney i Sousa 2000]. Charakteryzując procesy lipolizy, zachodzące w masie serowej
pod wpływem badanych szczepów drożdży, oznaczono poziom uwalnianych kwasów
tłuszczowych. Najwyższy był on w masach serowych inkubowanych z drożdżami
Y. lipolytica
PII6a i
C. sphaerica
FII7a, a najmniej zauważalny w obecności
C. famata
MI1a. Obserwacje te są zgodne z wynikami uzyskanymi przez Wyder i in. [1999].

A. Czajgucka i in.
Acta Sci. Pol.
102
Jednocześnie drożdże
Y. lipolytica,
dzięki wysokim uzdolnieniom hydrolitycznym,
odpowiedzialne były za wykształcanie pożądanych cech organoleptycznych serów.
Guerzoni i in. [1998] w swoich badaniach wykazali również korzystny wpływ drożdży
tego gatunku na cechy smakowo-zapachowe serów, co mogłoby mieć szczególnie duże
znaczenie przy wykorzystaniu ich w produkcji serów o zredukowanej zawartości tłusz-
czu charakteryzującymi się na ogół niskimi walorami smakowymi.
PIŚMIENNICTWO
Besançon X., Smet C., Chabalier C., Rivemale M., Revelbel J.P., Ratomahenina R., Galzy P.,
1992. Study of surface yeast flora of Roquefort cheese, Int. J. Food Microbiol., 17, 9-18.
Cichosz G., 1997. Czynniki determinujące cechy sensoryczne serów dojrzewających. Lipoliza,
Przegląd Mleczarski, 325-329.
Deeth H.C., Fitz-Gerald C.H., Snow A.J., 1983. A gas chromatographic method for the quantita-
tive determination of free fatty acids in milk and milk products, J. Dairy Sci. Technol., 18,
230-233.
Deeth H.C., Fitz-Gerald C.H., Wood A.F., 1975. A convenient method for determining the extent
of lipolysis in milk, Australian Journal of Dairy Technology, 30, 109-111.
Fox P. F., Law J., McSweeney P.L.H., Wallace J., 1993. Biochemistry of cheese ripening. Ed.P.F.
Fox, Elsev. Appl. Sci8., London, 389-438.
Fox P.F., Singh T.K., McSweeney P.L.H., 1995. Chemistry of Structure-Function Relationships
in cheese, Ed. E.L. Malin and M.H.Tunick, Plenium Press, New York, 1995.
Freitas A. C., Pintado A. E., Pintado M. E., Malcata F. X., 1999. Role of dominant microflora of
Picante cheese on proteolysis and lipolysis, International Dairy Journal, 9, 593-603.
Gardini F., Lanciotti R., Guerzoni M.E., Torriani S., 1999. Evaluation of aroma production and
survival of
Streptococcus thermophilus, Lactobacillus delbrueckii
subsp.
bulgaricus
and
Lac-
tobacillus acidophilus
in fermented milks,
Int. Dairy J.
, 9, 125-134.
Gdula A., Chrzanowska J., Szołtysik M., Kieżel X., Wojtatowicz M., 2002. Factors affecting
hydrolytic enzymes production by
Yarrowia lipolityca
strains, Biotechnologia 1(102), 81-88.
Guerzoni M.E., Gobbetti M., Lanciotti R., Vannini L., Chaves Lopez C., 1998.
Yarrowia
lipolytica
as potential ripening agent in milk products, In: FIL-IDF "
Yeast in the dairy indus-
try: positive and negative aspects
", Jakobsen, M., Narvhus, J., Viljoen, B.C., (Eds.) Copena-
gen, Denmark, 1996, 23-33.
Jarret W.D., Aston J.W., Dulley J.R., 1982. A simple method for estimating free amino acids in
Cheddar cheese, Aust. J. Dairy Technol., 6, 55-58.
Jollivet N., Chataud J., Vayssier Y., Bensoussan M., Belin J.-M., 1994. Production of volatile
compounds in model milk and cheese media by eight strains of
Geotrichum candidum
Link, J.
Dairy Res.,
61, 241-248.
Juszczyk P., Wojtatowicz M., śarowska B., Chrzanowska J., Malicki A., 2005. Diversity of
physiological and biochemical properties within yeast species occurring in Rokpol cheese,
Pol. J. Food Nutr. Sci., 4, 37-41.
Kuchroo C.N., Rahilly J., Fox P.F., 1983. Assessment of proteolysis in cheese by reaction with
trinitrobenzene sulphonic acid, Ir. J. Food Sci. Technol., 7, 129-133.
McSweeney P.L.H., Sousa M.J., 2000. Biochemical pathways for the production of flavour
compounds in cheeses during ripening: A review, Le Lait, 80, 293-324.
Molimard P., Spinnler H.E. 1996. Review: Compounds involved in the flavor of surface mold-
ripened cheese: origins and properties, J. Dairy Sci., 79, 169-184.

Wzrost drożdży w modelowym serze...
Biotechnologia
5(1-2) 2006
103
Pandey A., Benjamin S., Soccol C.R., Nigam P., Krieger N., Soccol V.T., 1999. The realm of
microbial lipases in biotechnology, Biotechnol. Appl. Biochem
.,
29, 119-131.
Roostita R., Fleet G.H., 1996. Growth of yeasts in milk and associated changes to milk composi-
tion
,
Int. J. Food Microbiol., 31, 205-219.
van den Tempel T., Jakobsen M., 1998. Yeast associated with Danablu, Int. Dairy J
.
, 8, 25-31.
van den Tempel T., Jakobsen M., 2000. The technological characteristics of
Debaryomyces han-
senii
and
Yarrowia lipolytica
and their potential as starter cultures for production of Danablu,
Int. Dairy J
.,
10, 263-270.
Welthagen J.J., Viljoen B.C., 1998. Yeast profile in Gouda cheese during processing and ripen-
ing, Int. J. Food Microbiol., 41, 185-194.
Wojtatowicz M., Chrzanowska J., Juszczyk P., Skiba A., Gdula A., 2001. Identification and bio-
chemical characteristics of yeast microflora of Rokpol cheese, Int. J. Food Microbiol., 69,
135-140.
Wyder M.-T., Puhan Z., 1999. Role of selected yeasts in cheese ripening: an evaluation in aseptic
cheese curd slurries, Int. Dairy J.,
9, 117-124.
Wyder M.-T., Bachmann H.-P., Puhan Z., 1999. Role of selected yeasts in cheese ripening: an
evaluation in foil wrapped Raclette cheese, Lebensm.-Wiss. Technol
.
, 32, 333-343.
Zmarlicki S., 1981. Ćwiczenia z analizy mleka i produktów mlecznych, Warszawa, 1981.
YEAST GROWTH IN MODEL CHEESE
AND THEIR EFFECT ON PROTEIN
AND FAT DEGRADATION
Abstract.
Seven yeast strains isolated from Polish blue cheese Rokpol:
Candida famata
MI1a,
C. intermedia
BI2a,
C. kefyr
PII1b,
C. sphaerica
FII7a,
Geotrichum penicillatum
EII6a,
Saccharomyces kluyveri
BII3a i
Yarrowia lipolytica
PII6a, were used to asepti-
cally inoculate model cheeses at the level 10
5
c.f.u.
×
g
-1
of cheese. During one week incu-
bation period their growth as well as protein and lipid degradation processes were ana-
lysed. The highest number of yeast in cheese was observed within strain
Y. lipolytica
,
which also appeared to cause the most advanced proteolytic and lipolytic changes.
Key words:
yeasts, model cheese, growth, proteolysis, lipolysis
Zaakceptowano do druku – Accepted for print: 20.11.2006
Wyszukiwarka
Podobne podstrony:
Doktorska praca Wpływ procesu suszenia rozpyłowego na degradację preparatu alfa amylazy z Aspergill
ZAŁĄCZNIKI Wpływ ludzi, sprzętu i techniki na degradacje środowiska naturalnego człowieka ppt
31 05 2012 Ochrona środowiska Temat 2 Wpływ ludzi, sprzętu i techniki na degradacje środowiska na
Wykład 1, WPŁYW ŻYWIENIA NA ZDROWIE W RÓŻNYCH ETAPACH ŻYCIA CZŁOWIEKA
WPŁYW STRESU NA NADCIŚNIENIE TETNICZE
Wpływ AUN na przewód pokarmowy
WPŁYW NIKOTYNY NA SKÓRĘ
Wpływ choroby na funkcjonowanie rodziny
Wpływ stresu na motorykę przewodu pokarmowego ready
Wpływ masażu na tkanki
Wpływ szkoły na niedostosowanie społeczne
5 Wplyw dodatkow na recyklingu Nieznany
M Cupryjak WPŁYW TERRORYZMU NA ŚRODOWISKO BEZPIECZESTWA
Wpływ emocji na zdrowie jamy ustnej okiem stomatologa
Wpływ Napełniaczy Na Sieciowanie I Właściwości Usieciowanych Mieszanek Kauczukowych
wpływ leków na kwasy nukleinowe
Wpływ TV na dzieci! (art z sieci)
Referat wpływ elektrotechniki na rozwój techniki
więcej podobnych podstron