
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
MINISTERSTWO EDUKACJI
NARODOWEJ
Przemysław Śmietana
Prowadzenie wychowu raków 632[01].Z3.04
Poradnik dla ucznia
Wydawca
Instytut Technologii Eksploatacji – Państwowy Instytut Badawczy
Radom 2007

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
1
Recenzenci:
dr inż. Sławomir Keszka
dr inż. Marcin Biernaczyk
Opracowanie redakcyjne:
dr inż. Przemysław Śmietana
Konsultacja:
mgr inż. Andrzej Zych
Poradnik stanowi obudowę dydaktyczną programu jednostki modułowej 632[01].Z3.04
„Prowadzenie wychowu raków”, zawartego w modułowym programie nauczania dla zawodu
rybak śródlądowy.
Wydawca
Instytut Technologii Eksploatacji – Państwowy Instytut Badawczy, Radom 2007

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
2
SPIS TREŚCI
1.
Wprowadzenie
3
2.
Wymagania wstępne
5
3.
Cele kształcenia
6
4.
Materiał nauczania
7
4.1. Podstawowe informacje o biologii raków w aspekcie ich chowu i hodowli
7
4.1.1. Materiał nauczania
7
4.1.2. Pytania sprawdzające
9
4.1.3. Ćwiczenia
10
4.1.4. Sprawdzian postępów
11
4.2. Systemy i metody chowu raków
12
4.2.1. Materiał nauczania
12
4.2.2. Pytania sprawdzające
18
4.2.3. Ćwiczenia
18
4.2.4. Sprawdzian postępów
20
4.3. Hodowla raków, wymagane zabiegi
21
4.3.1. Materiał nauczania
21
4.3.2. Pytania sprawdzające
28
4.3.3. Ćwiczenia
28
4.3.4. Sprawdzian postępów
29
4.4. Choroby, pasożyty raków, organizmy stanowiące zagrożenie
30
4.4.1. Materiał nauczania
30
4.4.2. Pytania sprawdzające
32
4.4.3. Ćwiczenia
33
4.4.4. Sprawdzian postępów
33
5.
Sprawdzian osiągnięć
34
6. Literatura
39

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
3
1.
WPROWADZENIE
Poradnik będzie Ci pomocny w przyswajaniu podstawowych wiadomości i umiejętności
o wychowie raków.
W poradniku zamieszczono:
−
wymagania wstępne, wykaz umiejętności, jakie powinieneś mieć już ukształtowane, abyś
bez problemów mógł korzystać z poradnika,
−
cele kształcenia, wykaz umiejętności, jakie ukształtujesz podczas pracy z poradnikiem,
−
materiał nauczania, „pigułkę” wiadomości teoretycznych niezbędnych do opanowania
treści jednostki modułowej,
−
zestaw pytań przydatny do sprawdzenia, czy już opanowałeś podane treści,
−
ć
wiczenia, które pomogą Ci zweryfikować wiadomości teoretyczne oraz ukształtować
umiejętności praktyczne,
−
sprawdzian osiągnięć, przykładowy zestaw zadań i pytań. Pozytywny wynik sprawdzianu
potwierdzi, że dobrze pracowałeś podczas zajęć i że nabrałeś wiedzy i umiejętności
z zakresu tej jednostki modułowej,
−
literaturę.
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
4
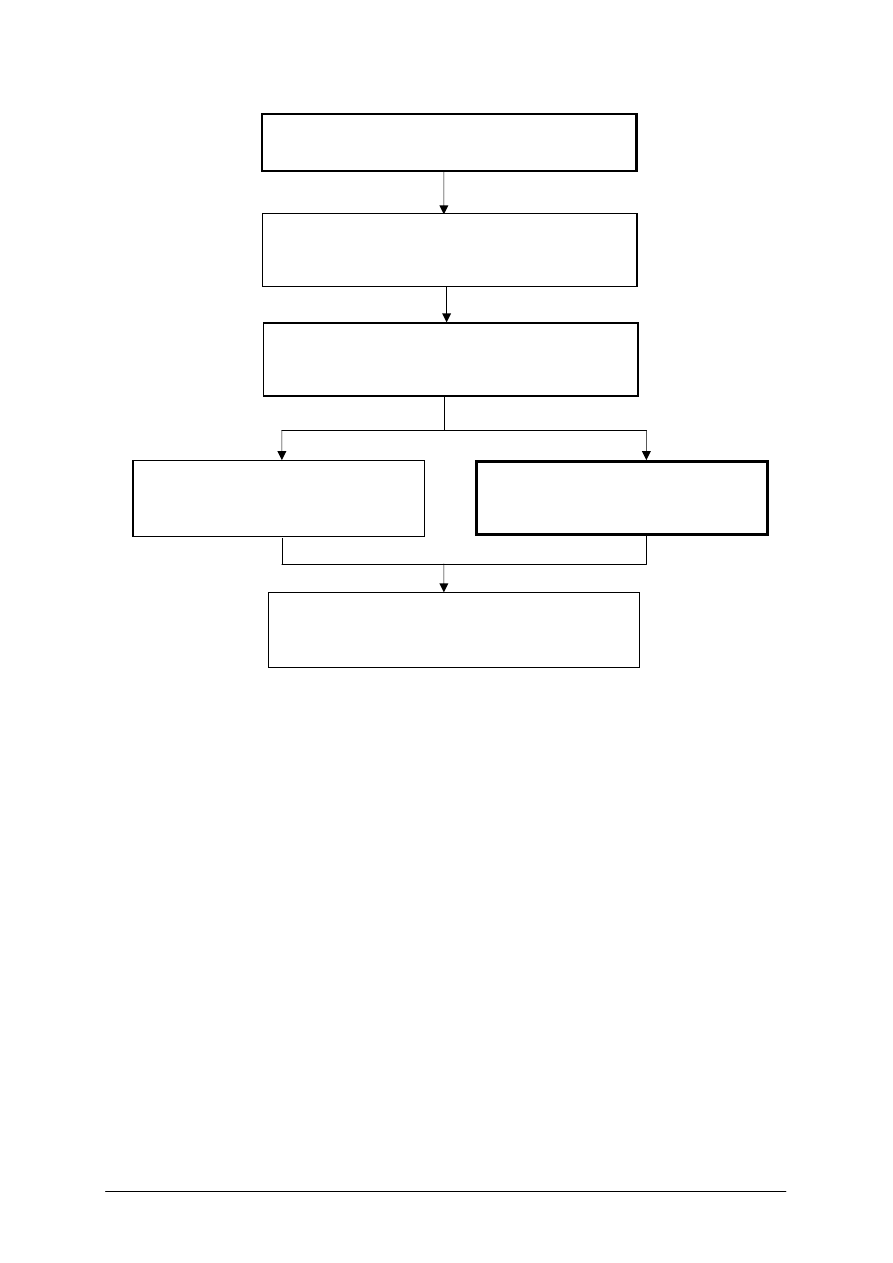
Schemat układu jednostek modułowych
Moduł 632[01].Z3
Akwakultura
632[01].Z3.01
Rozróżnianie organizmów i obiektów
akwakultury
632[01].Z3.02
Kształtowanie środowiska wodnego
632[01].Z3.03
Prowadzenie wychowu ryb
632[01].Z3.04
Prowadzenie wychowu raków
632[01].Z3.05
Prowadzenie chowu ryb w intensywnych
systemach akwakultury

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
5
2. WYMAGANIA WSTĘPNE
Przystępując do realizacji programu nauczania jednostki modułowej „Prowadzenie
wychowu raków” powinieneś umieć:
−
rozpoznawać gatunki raków,
−
korzystać z atlasów pomocniczych do określania różnych gatunków zwierząt wodnych,
−
charakteryzować rodzaje wód otwartych,
−
charakteryzować jeziora pod względem rybackim,
−
klasyfikować krainy rzeczne,
−
oceniać przydatność wód otwartych na podstawie ich parametrów,
−
korzystać z podstawowych informacji na temat budowy skorupiaków,
−
charakteryzować podstawowe parametry fizyko-chemiczne wody,
−
przestrzegać przepisów ochrony środowiska naturalnego,
−
przestrzegać zasad bezpieczeństwa i higieny pracy,
−
korzystać z różnych źródeł informacji,
−
prezentować wyniki swojej pracy,
−
korzystać z Internetu,
−
współpracować w grupie.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
6
3. CELE KSZTAŁCENIA
W wyniku realizacji programu jednostki modułowej powinieneś umieć:
–
określić wymagania środowiskowe raków,
–
rozróżnić systemy chowu raków,
–
ocenić przydatność zbiornika wodnego do chowu raków,
–
wykonać prace związane z chowem raków,
–
określić zagrożenia występujące podczas chowu raków,
–
rozróżnić płeć raków na podstawie ich cech zewnętrznych,
–
przygotować kryjówki dla różnych stadiów rozwojowych raków,
–
wpuścić raki do zbiornika wodnego,
–
przeprowadzić odłowy raków,
–
zastosować sposoby zapobiegania zagrożeniom chorobowym podczas chowu raków,
–
przeprowadzić kwarantannę raków,
–
przetrzymać i przygotować do transportu pozyskane raki,
–
zastosować sposoby dokarmiania raków podczas przetrzymywania,
–
zastosować sposoby transportu raków,
–
zastosować przepisy bezpieczeństwa i higieny pracy oraz bezpieczeństwa zdrowotnego
ż
ywności.
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
7
4. MATERIAŁY NAUCZANIA
4.1. Podstawowe informacje o biologii raków w aspekcie ich
chowu i hodowli
4.1.1 Materiał nauczania
Spośród czterech dotychczas stwierdzonych gatunkach raków występujących w wodach
Polski dwa uznano za gatunki rodzime to znaczy naturalnie występującymi w europejskich
wodach, oraz dwa gatunki introdukowane to znaczy sprowadzone do wód europejskich
z kontynentu Ameryki Północnej.
Potencjalnie wszystkie te gatunki mogą być obiektem chowu i hodowli raków, jednak
względy ekonomiczne i prawne wskazują, że promowanymi gatunkami w akwakulturze
powinny być gatunki rodzime to znaczy rak szlachetny i błotny. Podatność tych gatunków na
choroby zwłaszcza te przenoszone przez gatunki amerykańskie, stwarza duże ryzyko
związane z możliwością wystąpienia masowych śnięć i całkowitego załamania się chowu lub
hodowli. Jednak wysokie ceny jakie gatunki rodzime mogą potencjalnie osiągnąć na rynku
powodują, że wszędzie tam gdzie jest to tylko możliwe powinna być promowana hodowla
i chów właśnie tych gatunków, a zwłaszcza raka szlachetnego. Z tego powodu informacje na
temat chowu i hodowli raków zawarte w niniejszym poradniku dotyczą głównie raka
szlachetnego. Spełnienie warunków chowu dla tego gatunku jest, bowiem najtrudniejsze
i z powodzeniem zapewnia wymagania pozostałych trzech gatunków.
W tabeli prezentowanej poniżej przedstawiano w sposób syntetyczny najważniejsze
informacje ułatwiające podjęcie decyzji o zaangażowanie się w przedsięwzięcie jakim jest
chów i hodowla raków.
Tabela 1. Wymagania środowiska wód służących do chowu raków
Parametr
Rak
szlachetny
Rak
błotny
Rak
sygnałowy
Rak
pręgowaty
Natlenienie wody
wysokie, stałe
umiarkowanie
wysokie, możliwe
duże wahania
umiarkowanie
wysokie, możliwe
duże wahania
umiarkowanie
wysokie,
możliwe duże
wahania
Temperatura
niska, stała
umiarkowanie
wysoka, możliwe duże
wahania
raczej niska, możliwe
duże wahania
umiarkowana,
możliwe duże
wahania
Preferowana trofia
zbiorników
naturalnego
występowania
oligotrofia
lub mezotrofia
mezotrofia
lub
eutrofia
mezotrofia
lub
eutrofia
eutrofia
Tempo wzrostu
wolne
b. szybkie
w szczególnie
sprzyjających
warunkach
szybkie
b. szybkie
Wielkość
przeciętnego
osobnika w populacji
w
odniesieniu
do
oczekiwanej
wielkości
konsumpcyjnej raka
duża
umiarkowanie duża
(relatywnie małe
szczypce)
duża
(relatywnie duże
szczypce)
mała

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
8
Długość życia
długowieczny
długowieczny
Długowieczny
krótkowieczny
Płodność
umiarkowana
ś
rednio wysoka
Wysoka
bardzo wysoka
Podatność
na
ś
miertelne choroby
bardzo duża
duża
mała
mała
Chów
lub
próby
chowu
gatunku
w Polsce
tak
tak
tak
nie
Cena na rynku
bardzo wysoka
wysoka
wysoka
niska
Status ochronny
częściowa ochrona
częściowa ochrona
brak ochrony, gatunek
niepożądany.
Ewentualny chów
w warunkach izolacji
brak ochrony,
gatunek
niepożądany.
Ewentualny
chów
w warunkach
izolacji
Rozróżnianie płci raków
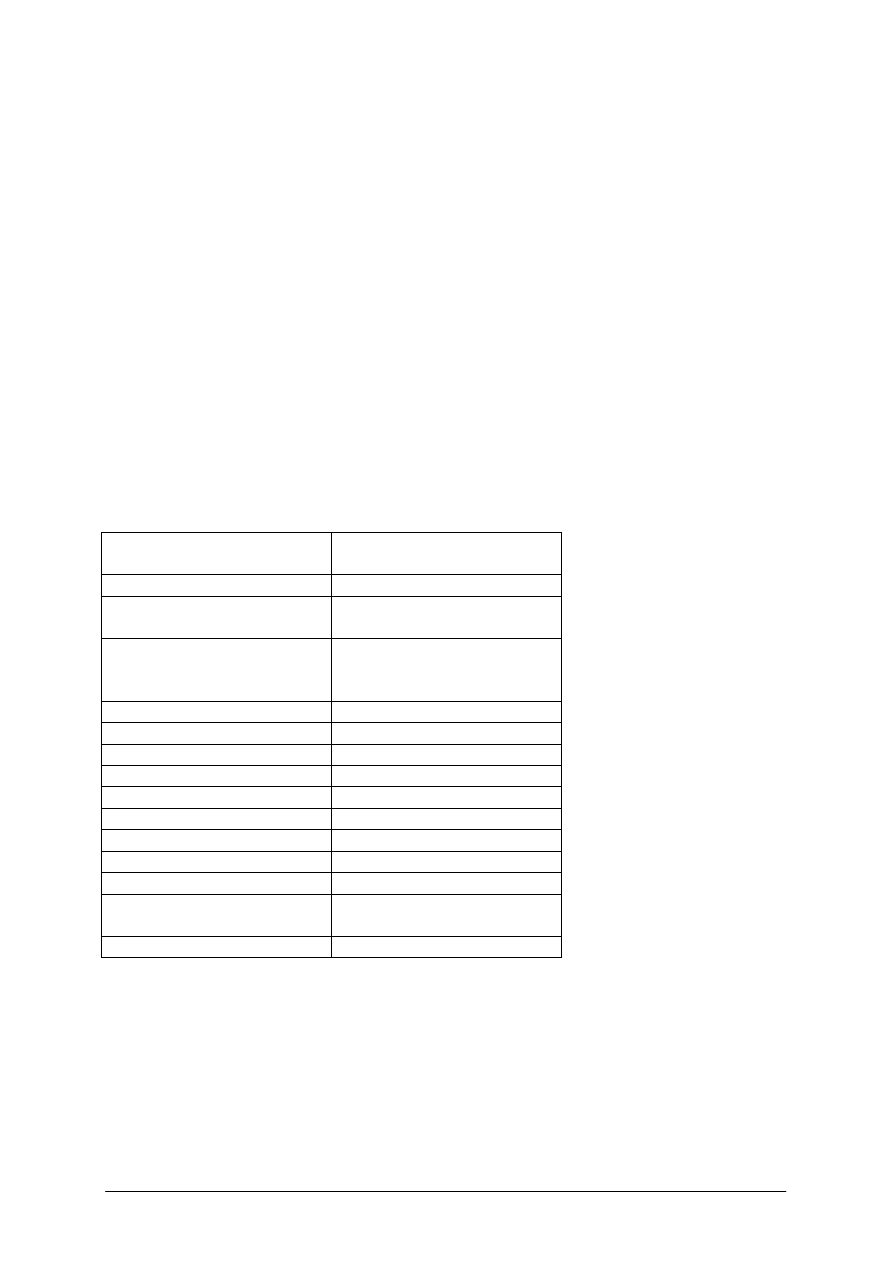
Aby rozróżnić płeć raków należy dokonać analizy budowy anatomicznej odnóży
odwłokowych przedstawionych na rysunku 1.
SAMICA
SAMIEC
odnóża kopulacyjne
większe szczypce
odwłok węższy niż
głowotułów
kolec charakterystyczny
tylko dla samców raka
pręgowatego
otwory płciowe
otwory płciowe
odwłok szerszy niż
głowotułów
mniejsze szczypce
Rys. 1. Budowa anatomiczna raka
U samców występują wyraźnie lepiej rozwinięte dwie pierwsze pary odnóży
odwłokowych. Tworzą one aparat kopulacyjny raka i mają wyraźnie masywniejszą budowę
niż pozostałe dwugałęziste odnóża odwłokowe. U samic wszystkie odnóża odwłokowe mają
ten sam plan budowy i brak jest ich pierwszej pary.
Budowa odnóży odwłokowych jest w zasadzie wystarczająco wyraźną cechą do
rozróżniania płci tych organizmów. Jako pomocnicze cechy mogą służyć:
Położenie otworów płciowych oraz proporcje budowy ciała.
Otwory płciowe są to małe owalne dziurki w wewnętrznej nasadzie pierwszego członu
odnóży krocznych.
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
9
U samców występują one na ostatniej parze tych odnóży („nóg raka”) u samic na trzeciej
parze licząc od kierunku odwłoka.
Cechami determinowanymi płcią są wyraźnie większe szczypce u samców niż u samic tej
samej wielkości. Samice mają wyraźnie szerszy odwłok niż samce. Jest on u nich tej samej
szerokości lub szerszy niż głowotułów. U samców odwłok jest węższy niż głowotułów.
Cechy te przy zdobyciu pewnego doświadczenia stają się łatwiej dostrzegalne i pomocne
są we wstępnej ocenie płci. Całkowitą pewność jednak daje jedynie analiza budowa odnóży
odwłokowych.
Ilustrację omawianych różnic na przykładzie raka pręgowatego prezentuje rysunek 1.
Oczywiście najłatwiej rozróżnić płeć raka wówczas, gdy samica posiada jaja lub larwy
przytwierdzone do odnóży odwłokowych. Liczba tych jaj uwarunkowana jest zwykle
przynależnością gatunkową i wielkością samicy oraz odzwierciedla warunki bytowania
samicy w okresie noszenia jaj lub larw. Zasadniczo im większa samica tym większa liczba jaj
przytwierdzona jest do odwłoka. U samic porównywalnej wielkości największej liczby jaj
należy spodziewać się u raka pręgowatego najmniej u szlachetnego.
Szacownie liczby jaj
Umiejętność szacowania jaj ma duże znaczenie praktyczne. Zasadniczo do tego celu
można posłużyć się danymi z tabeli poniżej. Dane prezentowane w tabeli 2 dotyczą zdrowych
samic u których nie wystąpiły ubytki jaj w trakcie ich noszenia pod odwłokiem. Zewnętrznym
objawem niskich strat jaj przez samicę jest całkowite wypełnienie jajami przestrzeni pod
odwłokiem samicy. Jeżeli patrząc od spodniej strony, segmenty odwłoka samicy całkowicie
zakryte są przez jaja przytwierdzone do odnóży odwłokowych, wówczas przybliżona liczba
jaj odpowiada wartościom prezentowanym w tabeli 2. Jeśli widoczne są widoczne segmenty
odwłoka wówczas liczba jaj jest niższa od tych wartości, co należy uwzględnić w szacowaniu
liczby jaj.
Tabela 2. Ilość jaj noszonych przez samicę
Wielkość raka
Rak szlachetny
Rak błotny
Rak sygnałowy Rak pręgowaty
od 8 do 10 cm
70
70
100
150
od 10,1 do 11,0 cm
150
150
200
250
od 11,1 do 12,0 cm
200
200
250
300
powyżej 12,1 cm
250
300
300
–
4.1.2. Pytania sprawdzające
Odpowiadając na pytania, sprawdzisz, czy jesteś przygotowany do wykonania ćwiczeń.
1.
Jak rozpoznać samicę raka?
2.
Jak rozpoznać samca raka?
3.
Jakie są orientacyjne płodności poszczególnych gatunków raków?
4.
Jak szacuje się liczbę jaj raków?

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
10
4.1.3. Ćwiczenia
Ćwiczenie 1
Przeanalizuj dokładnie zdjęcia i wysuszone wylinki raków. Zidentyfikuj odnóża
kopulacyjne, znajdź i wskaż miejsce ujść otworów płciowych. Opisz krótko różnice proporcji
budowy ciała u poszczególnych płci wypełniając tabelę:
Cecha
Samiec
Samica
Odnóża kopulacyjne
Umiejscowienie otworów
płciowych
Proporcje wielkości
szczypiec do długości ciała
Proporcja szerokości
głowotułowia do odwłoka
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie, powinieneś:
1)
wyszukać w materiałach dydaktycznych informacji o sposobie określania płci raków,
2)
obejrzeć dokładnie preparaty, wylinki lub zdjęcia,
3)
wpisać do tabeli wyniki obserwacji, sporządzić schematyczne rysunki ilustrujące daną
cechę.
Wyposażenie stanowiska pracy:
−
wylinki raków, preparaty raków, zdjęcia, rysunki z widocznymi cechami
determinowanymi płcią raka,
−
literatura zgodna z rozdziałem 6 poradnika dla ucznia.
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
11
Ćwiczenie 2
Oszacuj liczbę jaj u samic raka szlachetnego, o różnej wielkości. W tabeli
wyszczególniono ilość złowionych samic:
Wielkość
(klasa długościowa)
Liczba samic
Liczba jaj na samicę
Całkowita liczba jaj
9 cm
1
10–11 cm
21
11,1–12 cm
8
powyżej 12 cm
4
Suma:
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie, powinieneś:
1)
przypomnieć sobie informacje dotyczące ilościowego szacowania jaj,
2)
wpisać w tabelę liczbę jaj typową dla danego gatunku i danej klasy długościowej,
3)
oszacować liczbę jaj u samic z poszczególnych przedziałów długościowych mnożąc
liczbę jaj typową dla danej klasy długościowej przez liczbę samic w tej grupie, wynik
wpisać tabelę,
4)
podać sumę jaj i zapisać w tabeli.
Wyposażenie stanowiska pracy:
−
kalkulator,
−
literatura zgodna z rozdziałem 6 poradnika dla ucznia.
4.1.4. Sprawdzian postępów
Tak
Nie
Czy potrafisz:
1)
określić podstawowe cechy gatunków raków ważnych dla prowadzenia
wychowu raków?
2)
opisać charakterystyczne elementy budowy samców raków umożliwiające
rozróżnienie płci raka?
3)
opisać charakterystyczne elementy budowy samic raków umożliwiające
rozróżnienie płci raka?
4)
oszacować liczbę jaj samic raków?
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
12
4.2. Systemy i metody chowu raków
4.2.1 Materiał nauczania
Chowem raków nazywamy zespół metod i środków oraz zabiegów gospodarczych
mających na celu utrzymanie i zwiększanie biomasy raków. Przedmiotem chowu są tak
zwane raki obsadowe czyli te będące we wczesnym lub młodocianym stadium rozwoju, które
zależnie od obranej metody podchowywane są do form starszych albo raków
konsumpcyjnych.
Istnieją dwa systemy chowu raków:
−
chów ekstensywny o stosunkowo niewielkich nakładach i niskiej produkcji przypadającej
na jednostkę powierzchni zbiornika bądź objętości przepływu wody,
−
chów intensywny związany jest z relatywnie dużymi nakładami dającymi efekty
wysokiej produkcji jednostkowej raków.
Podstawowym warunkiem chowu raków jest odpowiedniej jakości woda w zbiorniku lub
cieku.
Woda taka powinna charakteryzować się następującymi wskaźnikami przedstawionymi
w tabeli 3
Tabela 3. Warunki fizyko-chemiczne wody
WSKAŹNIK
WARTOŚĆ
Widzialność
>4m
Przewodnictwo
elektryczne
<250µS/cm
Chemiczne
zapotrzebowanie tlenu
(ChZT)
<20mg/l
Twardość ogólna
<7 mval/l
Odczyn pH
6,5-8,5
Tlen rozpuszczony
>6 mg/l
Fosforany
<0,2 mg/l
Wapń
>10 mg CaCO
3
/l
Azot azotanowy
<1,5 mg/l
Azot amonowy
<1,0 mg/l
Chlorki
< 250 mg/l
ś
elazo ogólne
<1,0 mg/l
Metale ciężkie (Cu, Pb,
Hg)
brak
Pestycydy
brak
Woda spełniająca te parametry zasadniczo spełnia wymagania środowiskowe wszystkich
gatunków raków. Badania wody mogą być wykonywane tylko przez specjalistyczne
laboratorium. Dodatkowo ważne są badania zawartości tlenu w warstwach przydennych
zbiornika w okresie letnim i zimowym. Zawartość tlenu w tych porach roku również nie
powinna spadać poniżej >6 mg/l.
Chów raków prowadzony może być we wszelkiego typu zbiornikach wody stojącej
takich, jak: jeziora, stawy rybne, torfianki, glinianki i wyrobiska pożwirowiskowe.
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
13
Chów w jeziorach
Do chowu raków szlachetnych nadają się jeziora, w których oprócz wymaganej jakości
wody nie stwierdzono występowania innych gatunków raków. Ze względu na podatność na
choroby raka szlachetnego jest to wymaganie bezwzględnie konieczne. Należy pamiętać, że
również woda zasilająca to jezioro nie może pochodzić ze zbiornika lub rzeki, w której
występuje którykolwiek z gatunków amerykańskich raków.
Jezioro najlepiej spełniające warunki chowu raka szlachetnego powinno posiadać
niewielką głębokość do 5 m i posiadać urozmaiconą linię brzegową. Brzegi powinny mieć
stromy spadek z burtą brzegową oferującą dużą liczbę kryjówek. Dno powinno być twarde
najlepiej gliniasto –marglowe lub kamieniste. Dno pierwszego z wymienionych typów
umożliwia wykopywanie kryjówek przez raki, drugi typ oferuje dużą liczbę gotowych
schronień. Zdecydowanie jezioro przeznaczone do chowu raków powinno cechować się
znikomym udziałem dna mulistego. Roślinność porastająca dno strefy przybrzeżnej powinna
składać się z takich dominujących gatunków, jak moczarka kanadyjska, wywłócznik, rogatek,
rdestnica.
Jeżeli jezioro przeznaczone jest do chowu raka błotnego wówczas wymagania odnośnie
mulistego dna są znacznie łagodniejsze. Ponieważ gatunek ten sam nie kopie norek wymaga
większej liczby dodatkowych kryjówek typu: zatopione gałęzie, konary drzew.
Wszelkie odstępstwa istniejących warunków w zbiorniku od tych podanych wyżej będą
miały wpływ na obniżenie spodziewanej wydajności rybackiej jeziora, czyli mniejsze odłowy
raków. Należy tu także pamiętać, że o jakości jeziora i jego produktywności określanej
połowami raków decyduje, bowiem bardziej długość linii brzegowej niż powierzchnia lustra
wody.
Tabela 4. Cechy jeziora przeznaczonego do chowu raków
Jakość jeziora
Wielkość obsady na 1 km
długości linii brzegowej
(Liczba osobników)
Planowane połowy z 1 km
strefy przybrzeżnej
zbiornika (kg)
Bardzo wysoka – spełniają
optymalnie warunki
hydrochemiczne, siedliskowe
(kryjówki i pokarm) na całej
powierzchni dna
Ponad 1000
Ponad 100
Wysoka – spełniają
optymalnie warunki
hydrochemiczne, gorzej
siedliskowe (kryjówki
i pokarm) nie na całej
powierzchni dna
500–1000
50–100
Przeciętna – spełniają
podstawowe warunki
hydrochemiczne, optymalnie
siedliskowe (kryjówki
i pokarm) nie na całej
powierzchni dna
300–500
25–50
Wystarczająca – spełniają
podstawowe warunki
hydrochemiczne i siedliskowe
(kryjówki i pokarm) na części
dna jeziora
300–500
> 25
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
14
Uwzględniając powyższe należy właściwie dobrać wielkość obsady rakiem danego
jeziora. Wielkości obsad i spodziewane połowy na ich bazie przedstawia tabela 4, przy
założeniu, że materiał obsadowy składa się z jednorocznych raczków przy zachowaniu
proporcji płci (3 samice: 1 samiec). Przy zaraczaniu jeziora rakami dorosłymi stosuje się
normy obsad zawarte w tabeli 5.
Biorąc pod uwagę tempo wzrostu raków i wiek osiągania dojrzałości płciowej, odłowy
należy zacząć po czterech latach w przypadku wysokiej jakości jezior i pięciu gdy jakość
jeziora nie jest optymalna.
Tabela 5. Obsada raków dorosłych przy zaraczaniu jeziora
Jakość jeziora
Wielkość obsady na 1
hektar powierzchni
zbiornika
(Liczba osobników)
Planowane połowy z 1
hektara powierzchni
zbiornika (kg)
Bardzo wysoka –
spełniają optymalnie warunki
hydrochemiczne, siedliskowe
(kryjówki i pokarm) na całej
powierzchni dna
400 samic/200 samców
Ponad 100
Wysoka – spełniają
optymalnie warunki
hydrochemiczne, gorzej
siedliskowe (kryjówki
i pokarm) nie na całej
powierzchni dna
200 samic/ 100 samców
50–100
Przeciętna – spełniają
podstawowe warunki
hydrochemiczne, optymalnie
siedliskowe (kryjówki
i pokarm) nie na całej
powierzchni dna
100 samic/ 50 samców
25–50
Wystarczająca – spełniają
podstawowe warunki
hydrochemiczne i siedliskowe
(kryjówki i pokarm) na części
dna jeziora
50 samic/ 25 samców
10–25
Przeciętna masa osobnika dorosłego o długości ciała 10 cm wynosi około 30 g.
Obsada rakiem szlachetnym lub błotnym musi spełniać następujące wymogi:
–
obsadza się tylko jeziora w których nie ma raków gatunków obcych tj. sygnałowego
i pręgowatego,
–
raki użyte do obsady zwane obsadowymi muszą pochodzić ze znanego źródła i posiadać
ś
wiadectwo weterynaryjne wystawione przez Powiatowego Lekarza Weterynarii
właściwego dla miejsca pochodzenia materiału obsadowego,
–
wpuszczanie raków do nowego zbiornika musi być przeprowadzona w odpowiedni sposób
minimalizujący straty.
Najlepszym okresem do przeprowadzenia zabiegu obsady jest miesiąc wrzesień. Raki
wpuszczamy w miejscach jeziora, które w sposób najbardziej optymalny spełniają

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
15
wymagania środowiskowe raków. Takie miejsca powinny charakteryzować się odpowiednim
nachylenie dna w strefie przybrzeżnej. Dno powinno posiadać strukturę umożliwiającą
szybkie znalezienie bądź wykopanie przez raki kryjówek. Miejsca takie powinny być
położone w strefie bujnej wegetacji zapewniającej dostęp do pożywienia.
Jeśli jezioro oferuje niewielką liczbę takich miejsc można sztucznie je stworzyć na
przykład poprzez lokowanie w wodzie konstrukcji wiklinowych ustawionych pomiędzy
drewnianymi palami bądź stworzenie stref koncentracji sztucznych kryjówek poprzez
narzucenie kamieni czy pni drzew. Taki miejsca noszą nazwę mateczników.
Raki przygotowane do wpuszczenia do wody należy chronić przed bezpośrednim
nasłonecznieniem i gwałtownymi zmianami temperatury. Do wpuszczenia klasyfikujemy
raki, które w tym momencie charakteryzują się dobrą kondycją. Testem takiej kondycji jest
duża ruchliwość raków trzymanych za głowotułów (zwłaszcza ruchy szczypców). Oznaką złej
kondycji jest bezwładne zwisanie szczypców u trzymanego raka. Takie osobniki raczej nie
powinny być wykorzystywane do obsady.
Ponieważ raki obsadowe przewozi się bez wody, wpuszczając raka należy zapewnić
powolne napełnianie się wodą jamy skrzelowej. Zbyt gwałtowne zanurzenie może wiązać się
z uwięzieniem w jamie skrzelowej powietrza, co jest zjawiskiem szkodliwym i może
prowadzić do śmierci organizmu. Dlatego też przed wpuszczeniem do wody raki należy,
przez co najmniej 15 minut polewać wodą lub kilkanaście razy zanurzać i wyciągać z wody.
Dodatkowo uzyskuje się równocześnie efekt adaptacji raków do aktualnych warunków
termicznych jeziora.
Chów raków w stawach
Stawy przeznaczone do chowu raków powinny uwzględniać wymagania siedliskowe
raków. Jakość wody powinna być podobna do tej wymaganej w przypadku jezior. Optymalne
parametry stawu do chowu raków to:
−
powierzchnia od 0,5 do 10 ha,
−
głębokość średnia od 0,8 do 1,5 m (maksymalnie 4 m),
−
długa linia brzegowa (preferowany wydłużony kształt),
−
zasilanie wodą źródlaną bądź z cieku o niskiej temperaturze wody w okresie letnim
i możliwość regulacji tempa wymiany wody w stawie, tym samym regulacji jej
temperatury w upalnym okresie lata,
−
tlen przy dnie przez cały rok minimum 6 mg/l,
−
osuszalność dna,
−
strome szerokie groble z łagodnymi stokami,
−
dno gliniaste, piaszczyste z dużą ilością kamieni,
−
możliwość instalowania dodatkowych sztucznych kryjówek (stosów kamieni, rurek
drenarskich, falistych dachówek itp.),
−
rośliny zanurzone: wywłócznik, moczarka kanadyjska,
−
ryby: brak ewentualnie karaś, lin.
Stawy produkcyjne należy obsadzać według kryteriów stosowanych dla wysokiej jakości
jezior z możliwością zagęszczanie obsady w przypadku zaobserwowania takich możliwości.
Stawy przeznaczone do rozrodu raków należy obsadzać na poziomie 5–10 samic na 1
metr kwadratowy powierzchni stawu.
Stawy muszą być dobrze zabezpieczone przed presją drapieżników oraz możliwością
przeniesienia chorób. Chów z uwagi, na co najmniej czteroletni cykl wzrostu raków
w stawach jest obarczony relatywnie dużym ryzykiem. Jednak w przypadku zapewnienia
trwałych optymalnych warunków bytowania raków i ich dokarmiania zapewnia relatywnie
najwyższy poziom produkcji. Dlatego praktycznie jedynie przy chowie w stawach możliwy

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
16
jest system intensywnego chowu raków. Szczególnie wówczas, gdy konstrukcja stawów od
samego początku ukierunkowana jest na produkcję raków. Takie stawy, w których uzyskuje
się maksymalnie optymalne warunki bytowania raków nazywa się raczarniami. Kształt takich
stawów bardziej przypomina system wzajemnie połączonych rowów niż typowy staw rybny.
Dno zapewnia maksymalną liczbę kryjówek. Woda w takich rowach jest w zasadzie ciągle
wymieniana zapewniając optymalne warunki termiczno-tlenowe. Raki są racjonalnie
dokarmiane. Normy obsadowe są bardzo wysokie do 200 kg samic na 200 metrów
kwadratowych dna. Produktywność może sięgać 200 tys. młodych raczków. Tego typu
raczarnia w latach 50 produkowała rocznie około 600 tys. sztuk rocznych raczków.
Chów raków w stawach może odbywać się w systemie jednopokoleniowym lub wielo
pokoleniowym.
W tym pierwszym przypadku chów prowadzony jest przez jeden rok, czyli od momentu
uzyskania wylęgu do chwili pozyskania jednorocznych raczków. Wymogiem prowadzenia
takiego chowu jest posiadanie możliwości odłowienia raków. Efektywne odłowienie młodych
raczków w zasadzie zapewniają tylko opisane w innej części poradnika stawy specyficznej
konstrukcji umożliwiającej stopniowy odpływ wody.
Chów wielopokoleniowy prowadzony jest w cyklu wieloletnim i wówczas w zbiorniku
mamy do czynienie ze współwystępowaniem raków w różnym wieku.
Czynnikiem powodującym duże straty w chowie raków jest kanibalizm. Zjawisko to jest
szczególnie częste w przypadku dużego zagęszczenia populacji i nasila się w czasie
występowania
linienia
raków.
Niezsynchronizowane
linienie
jest
spowodowane
nierównomiernym wzrostem raków, co ma znacznie większe znaczenie w chowie w systemie
jednopokoleniowym. Jednak i w systemie wielopokoleniowym kanibalizm może być
przyczyną znacznych strat.
Czynnikami ograniczającymi wpływ kanibalizmu są odpowiednie żywienie i zapewnienie
wystarczającej liczby kryjówek dla raków przez dostarczenie sztucznych kryjówek.
Sztucznymi kryjówkami raków mogą być wszelkiego typu substytuty naturalnych norek.
Ich wielkość powinna być dostosowana do wielkości organizmu. I tak, dla małego raczka tuż
po usamodzielnieniu się, odpowiednią kryjówką może być rurka z tworzywa sztucznego
o średnicy 0,5 cm długości 3 cm. Dorosłe raki wymagają kryjówek odpowiednio większych.
Maksymalna średnica nie powinna przekraczać 5–6 cm, a długość powinna umożliwić
schronienie się w kryjówce całemu rakowi z wyciągniętymi ku przodowi szczypcami.
W praktyce oznacza to minimalną długość kryjówki równą 1⅓ długości raka.
W praktyce wychowu raków najczęściej używanymi substytutami kryjówek są
wszelkiego typu ceramiczne materiały budowlane takie jak: dachówki, cegły dziurawki, rurki
drenarskie. Mają one odpowiednią trwałość i masę zapewniającą stabilność na dnie zbiornika.
Oferują także dużą zmienność wielkości kryjówek i są „przyjazne” środowisku naturalnemu.
Liczba zastosowanych sztucznych kryjówek powinna uwzględniać wielkość obsady oraz
liczebność naturalnych kryjówek i tych wynikających z konstrukcji stawu (zwłaszcza rodzaju
dna i burty brzegowej).

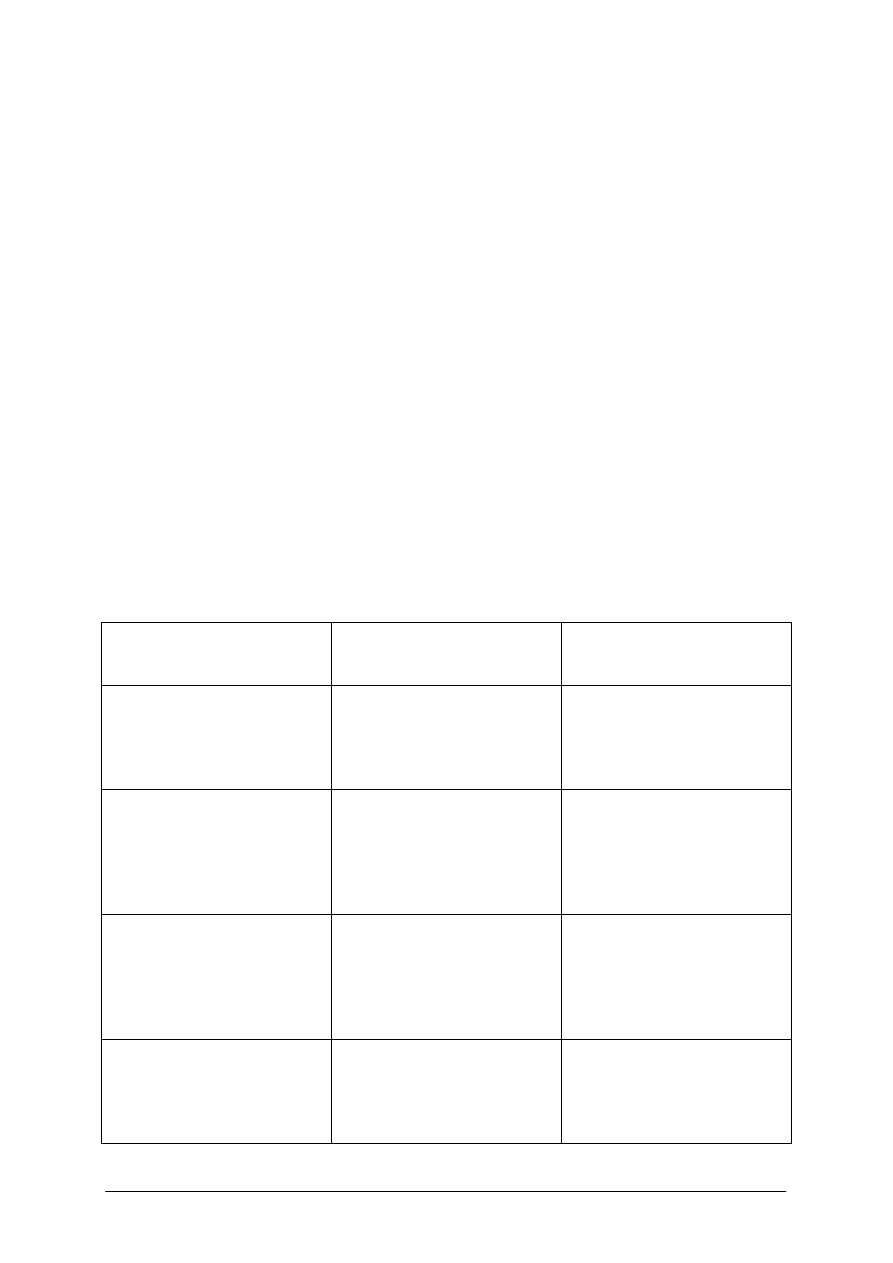
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
17
Rys. 2. Dno stawu podchowu raków z przygotowanymi kryjówkami
(tuż przed zalaniem wodą)
Chów raków w torfiankach
Torfianki powstawały lub powstają na terenach zwanych torfowiskami, czyli
w miejscach, w których w wyniku obumarcia roślinności naczyniowej, przy nadmiarze
wilgotności i małym dostępie powietrza tworzą się złoża torfu. W zależności od stosowanej
eksploatacji torfu, ich zasobności i głębokości złóż torfianki mogą być:
–
głębokie od 1,5 do 2 m, o dnie stosunkowo wyrównanym,
–
ś
redniogłębokie od 0,8 do 1,5 m, dno równe z przegłębieniami,
–
płytkie do 0,8 m.
Do
chowu
raków
mogą
być
wykorzystywane
jedynie
torfianki
głębokie
i średniogłębokie. Tylko torfianki z tych dwu grup mogą zapewnić występowanie
odpowiednich warunków termicznych i tlenowych przez cały rok. W płytkich bowiem latem
woda nagrzewa się powyżej 25 stopni w całej masie wody, zimą zaś może wystąpić zjawisko
zamarzania całej masy wody do dna zbiornika.
Najlepiej, gdy torfianka przeznaczona do chowu raków spełnia wymagania maksymalnie
zbliżone do tych, które powinien spełniać staw urządzony do chowu raków.
Oczywiście spełnienie tych wszystkich warunków nie jest możliwe, dlatego też torfianka
taka winna spełniać, co najmniej minimalne wymagania takie jak:
–
głębokość ponad 1,5 m,
–
odpowiednia jakość wody zwłaszcza zawartość wapnia i odczyn pH – co najmniej 5,5,
–
uregulowane brzegi i wyrównane dno, bez większych dołów czy brył torfu na dnie.
–
tlen obecny w warstwach przydennych przez cały rok na poziomie przynajmniej 4 mg/l,
–
brak niepożądanej roślinności takiej jak trzcina czy wierzba,
–
skład gatunkowy ryb z małym udziałem okonia, szczupaka, sumika karłowatego,
najlepiej bez tych gatunków.
J
eśli któryś z powyższych warunków nie jest spełniony możliwa jest często modyfikacja
tych parametrów.
Zaraczenie torfianki powinno wynosić około 200–500 osobników raka na hektar
w przypadku raków jednorocznych lub 100–200 na hektar w przypadku dwuletnich przy
zachowaniu stosunku 3 samice : 1 samiec.
Orientacyjna wydajność torfianek wynosić może około 60 kg raków z hektara.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
18
Chów raków w gliniankach
Glinianki są to doły powstałe przez wybranie podkładu gliny, położone zwykle
w okolicach cegielni. Są to zbiorniki o niewielkiej powierzchni (1–2 ha) i często dużej
głębokości. Wymagania względem glinianek w aspekcie chowu raków są takie same jak
w przypadku stawów czy torfianek. Zatem preferowane będą te torfianki, które ze względu na
kształt ukształtowanie rzeźby dna, oraz jakość wody odpowiadają optymalnym warunkom
bytowania raków. W przypadku stwierdzenia takowych, zaraczenie glinianek powinno
wynosić około 250–500 osobników raka na hektar w przypadku raków jednorocznych lub
100–200 na hektar w przypadku dwuletnich, przy zachowaniu stosunku 3 samice : 1 samiec.
Orientacyjna wydajność glinianek wynosić może około 50–120 kg raków z hektara.
Chów raków w wyrobiskach pożwirowych
Wyrobiska powstałe po eksploatacji złóż piasku i żwiru bardzo często samoistnie
napełniają się wodą dając początek nowym zbiornikom wodnym. Bardzo często jakość wody
w takim zbiorniku jest zbliżona do tej odpowiadającej optymalnym wymaganiom raków.
Dodatkowo koncentracja sprzętu przystosowanego do wybierania kruszywa stwarza dogodne
warunki do zakładania nowych miejsc chowu raków słodkowodnych. Uzyskać można w ten
sposób zbiornik dostosowany do warunków bytowych raków. Pewnym mankamentem
ż
wirowni jako miejsc chowu raków jest stosunkowo duża „świeżość” takich zbiorników.
Dlatego do tych celów powinno wykorzystywać się zbiorniki, które mają kilkuletnią historię
(co najmniej dwuletnią). Dopiero wówczas należy przystąpić do obsady rakiem. Zaraczenie
tak jak w przypadku glinianek powinno wynosić około 250–500 osobników raka na hektar
w przypadku raków jednorocznych lub 100–200 na hektar w przypadku dwuletnich, przy
zachowaniu stosunku 3 samice : 1 samiec.
4.2.2. Pytania sprawdzające
Odpowiadając na pytania, sprawdzisz, czy jesteś przygotowany do wykonania ćwiczeń.
1.
Co znaczy chów raków?
2.
Jakie znasz systemy chowu raków?
3.
Jakie wymagania musi spełniać jezioro charakteryzujące się wysoką jakością siedliska
raków?
4.
Jakie zbiorniki mogą spełniać wymagania stawiane przed chowem raków?
5.
Jakie są normy obsadowe stosowane w przypadku chowu raków w różnych zbiornikach?
6.
Jakie są wydajności chowu raków w poszczególnych typach zbiorników?
4.2.3. Ćwiczenia
Ćwiczenie 1
Korzystając z danych zawartych w Atlasie Jezior Polski wybierz przykład jeziora
optymalnie spełniającego wymagania chowu raka i uzasadnij swoją decyzję opisując wybrane
jezioro.
Wyjaśnij, dlaczego na podstawie tych danych nie można być całkowicie pewnym
słusznego dokonania wyboru – jakich danych brakuje?
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie, powinieneś:
1)
narysować tabelę,

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
19
2)
wpisać w rubrykę wymagania odpowiednie informacje i wartości podane w materiale
nauczania,
3)
w Atlasie Jezior Polski znaleźć jezioro najlepiej spełniające wymogi głębokości średniej
i maksymalnej jeziora, również rozwinięcie linii brzegowej (im wyższa wartość tym
lepiej),
4)
wpisać dane wybranego jeziora do kolumny „Wybrane jezioro” w swojej tabeli,
5)
porównać wskaźniki fizyko-chemiczne wybranego jeziora podane w tabeli 1 oraz tabeli 2
(niektóre jeziora) w Atlasie Jezior Polski do podanych wymagań chowu raków
w jeziorach, wpisując je do swojej tabeli,
6)
uzasadnić i ocenić wybór oraz wytłumaczyć dlaczego nie można być całkowicie pewnym
dokonania pewnego i słusznego wyboru – jakich danych brakuje?
Parametr
Wymagania
Wybrane jezioro
.................
Ś
rednia głębokość
Maksymalna głębokość
Rozwinięcie linii
brzegowej
Jak największe
Ukształtowanie dna
Przewodność
Wapń
Chlorki
Wyposażenie stanowiska pracy:
−
Atlas Jezior Polski,
−
literatura podana w punkcie 6 poradnika dla ucznia.
Ćwiczenie 2
Oblicz wymaganą obsadę raków w przypadku zaraczania wybranego jeziora oraz
spodziewane roczne odłowy. Jak przedstawia się możliwość wykorzystania tego samego
materiału w przypadku zaraczania żwirowni i jaką wydajność dałoby zaraczenie nim
torfianek?
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie, powinieneś:
1)
określić na podstawie posiadanych niepełnych danych wartość jeziora pod katem chowu
raków korzystając z odpowiedniej tabeli zamieszczonej w materiale nauczania,
2)
obliczyć na podstawie danych o długości linii brzegowej powierzchni zbiornika wielkość
materiału zaraczeniowego potrzebnego do pełnej obsady jeziora,
3)
podać wymaganą liczbę samców i samic,
4)
obliczyć spodziewaną wielkość produkcji raków w jeziorze,
5)
obliczyć ile żwirowni o powierzchni 5 ha każda, można by zaraczyć wykorzystując ten
materiał obsadowy i stosując minimalny poziom obsady w każdej z nich,
6)
podać jaka liczebność samic i samców powinna cechować zaraczeniowy materiał,
7)
obliczyć jaką wydajność można by uzyskać zaraczając tym materiałem torfianki.
Wyposażenie stanowiska pracy:
−
literatura podana w punkcie 6 poradnika dla ucznia.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
20
4.2.4. Sprawdzian postępów
Tak
Nie
Czy potrafisz:
1)
określić podstawowe systemy chowu raków?
2)
określić podstawowe wymagania wobec środowiska jeziora,
które może być obiektem chowu raków?
3)
rozróżnić zbiorniki nadające się do chowu raków?
4)
określić warunki wpuszczania raków do zbiornika w celu chowu?
5)
oszacować przybliżoną wielkość obsady i spodziewaną produkcję
różnych typach zbiorników wodnych?

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
21
4.3. Hodowla raków, wymagane zabiegi
4.3.1. Materiał nauczania
Hodowla raków to doskonalenie populacji raków w zbiornikach sztucznych (stawy,
baseny) z uwzględnieniem zasad dziedziczności. Hodowla w obrębie poszczególnych
gatunków ma na celu przystosowanie ich do określonych warunków środowiska oraz
poprawienia ich cech hodowlanych i użytkowych. W hodowli wykorzystywana jest wiedza na
temat anatomii, embriologii, fizjologii, genetyki, żywienia raków oraz chorób i pasożytów.
Część akwakultury (zespół działań i wiedza na temat hodowli organizmów wodnych)
obejmująca hodowlę raków nazywa się astasikulturą.
Podstawą hodowli organizmów wodnych jest opanowanie procesu wylęgu młodych
organizmów stanowiących główny przedmiot hodowli. W przypadku raków rozmnażanie
i inkubacja jaj stanowi pierwszy etap hodowli tych organizmów. Schemat pełnej hodowli
można przedstawić następująco:
1.
rozmnażanie i inkubacja,
2.
podchów w warunkach kontrolowanych,
3.
hodowla stawowa lub w basenach,
4.
zaraczanie (obsada) wód,
5.
chów.
Pierwszy etap hodowli zwany „rozmnażanie i inkubacja” polega na doprowadzeniu samic
raków do złożenia zapłodnionych jaj i przytwierdzenia ich do odwłoka. Celem dalszej
hodowli jest kontrolowana inkubacja jaj, czyli doprowadzenie ich do stadium wyklucia się
młodych raczków. Zasadniczo inkubację można przeprowadzać w dwojaki sposób. Jednym
z nich jest pozostawienie jaj przytwierdzonych do odwłoka samicy aż do momentu wykłucia
się raczków i uzyskania przez nie samodzielności następnie odseparowanie ich od matki.
Drugi sposób polega na usuwaniu jaj z odwłoka samicy i przeprowadzeniu inkubacji
w urządzeniach wylęgarniczych.
Samice przeznaczone do rozrodu pozyskuje się w miesiącach kwiecień – maj z miejsc ich
chowu. Najlepiej pozyskiwać je ze specjalistycznych stawów zwanych raczarniami. Termin
połowu powinien być dostosowany do stadium dojrzałości rozwijających się jaj zależnej
głownie od temperatury wody. Ocenę taką powinien przeprowadzić specjalista. Dla orientacji
można wspomnieć, że jajo posiadające wystarczającą dojrzałość jest wyraźnie dwu barwne
(ciemniejszy kolor pochodzi od zabarwienia woreczka żółtkowego, a jasna barwa wskazuje
miejsce położenia ukształtowanego ciała małego raczka). Odłów samic we wcześniejszym
okresie niepotrzebnie zwiększa straty jaj.
Inkubacja jaj pozostawionych na odwłoku samicy
Jeśli obrany jest pierwszy z wymienionych wyżej sposobów, czyli pozostawienia jaj na
odwłoku samicy, wówczas każdą samicę należy odizolować od pozostałych. Można to
uzyskać wkładając samicę do specjalnych pomieszczeń – pojemników czy klatek. Samice
muszą przebywać w optymalnych warunkach termiczno tlenowych oraz muszą mieć spokój
i czystość.
Dodatkowym wymogiem takiego pomieszczenia jest zapewnienie schronienia dla
usamodzielnionego wylęgu. Brak możliwości ucieczki wylęgu spowoduje niemal całkowitą
jego stratę wywołaną kanibalizmem samicy.
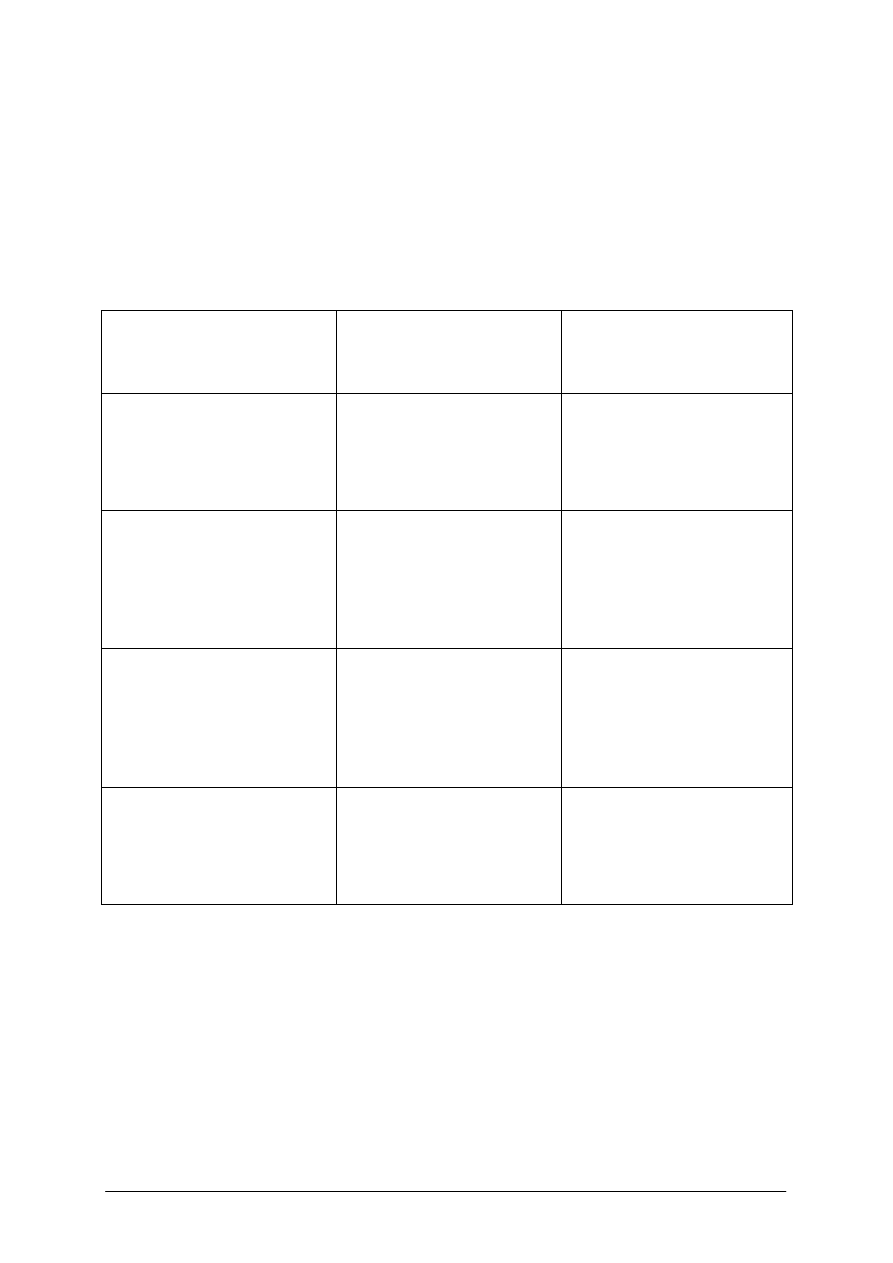
Schemat takiego pojemnika – klatki przedstawia rysunek 3.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
22
klatka rozłożona
klatka złożona
Rys. 3 Pojemnik – klatka do przetrzymywania samic w trakcie inkubacji jaj na odwłoku
Takie pomieszczenie powinno posiadać otwory lub oczka kratek o odpowiednio dobranej
wielkości. Obecność ich z jednej strony zapewnia swobodną wymianę wody z drugiej zaś
zapobiega ucieczce samicy, a umożliwia ją małym raczkom.
Małe raczki uciekające z pomieszczenia samicy powinny łatwo znaleźć kryjówki
zapewniające ochronę przed kanibalizmem ze strony rodzeństwa.
Przykładem konstrukcji zapewniającej te warunki jest aparat wylęgarniczy raków
prezentowany poniżej na rysunku 4.
napływ
wody
odpływ
wody
pojemnik-klatka z
samicą
kryjówki
dla wylęgu
Kratka umożliwiająca
przepływ
wody
Rys. 4. Urządzenie do przetrzymywania samic raków w trakcie inkubacji jaj na odwłoku
Jeżeli małe raczki mają być podchowywane w specjalnych stawach lub basenach
pojemniki z samicami umieszcza się bezpośrednio nad ich dnem najlepiej zapewniając
pływalność tuż pod powierzchnią wody. Dodatkową zaletą takich pływających pojemników
w odkrytych stawach jest przebywanie samic w strefie dobrze natlenionej wody
i o podwyższonej temperaturze, co może znacznie przyśpieszyć inkubację jaj. Rysunek 5

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
23
prezentuje taką klatkę. Na zdjęciu nie pokazano pokrywy skrzynki, która wykonana jest
zwykle ze styropianowej płyty dopasowane rozmiarami do górnej powierzchni skrzynki.
Styropian zapewnia pływalność skrzynki. Powinien być on obłożony grubą folią
zabezpieczającą przed wygryzieniem dziur przez samice i ich ucieczką.
samice z jajami
Rys. 5 Klatka pływająca z samicami raków w okresie inkubacji jaj
Inkubacja jaj zdjętych z odwłoka samicy
Jeśli obrany jest drugi z wymienionych wyżej sposobów czyli usunięcia jaj z odwłoka
samicy, wówczas każdą samicę należy delikatnie pozbawić jaj przytwierdzonych do
odwłokowych odnóży pływnych. Czynność usuwania jaj wykonana fachowo jest całkowicie
nieszkodliwa dla samicy.
Samice należy odwrócić stroną brzuszną ku górze i położyć na płaskiej powierzchni. Do
tej powierzchni należy delikatnie docisnąć raka, tak aby nie wykonywał gwałtownych ruchów
odwłokiem i nie chwytał palców szczypcami. Jaja usuwamy pęsetą starając się chwytać za
nitkowate styliki, którymi jaja przytwierdzone są do odwłoka. Oderwane jaja delikatnie
przenosimy do naczynia z natlenioną wodą. Pojemnik ten należy często opróżniać, aby nie
narażać jaj na stres wywołany deficytami tlenowymi.
Tak szybko jak to możliwe jaja umieszczamy w urządzeniu wylęgarniczym
Inkubację prowadzimy w urządzeniu wylęgarniczym zapewniając optymalne warunki
termiczno-tlenowe oraz sanitarne. Temperatura (17–21
o
C) i natlenienie (8–11 mg/l) muszą
być zgodne z optymalnymi wymaganiami gatunku raka. Odpowiednie warunki sanitarne
zapewniamy przez zastosowanie stałego przepływu czystej wody oraz przeprowadzając
regularną (codzienną) selekcję jaj. Selekcja ta polega na usuwaniu martwych jaj. Wszystkie
jaja o barwie różniącej się od pozostałych, wyraźnie zmatowiałe lub pokryte pleśnią powinny
być natychmiast usunięte. W przypadku stwierdzenia rosnących ilości pleśniejących jaj
należy zastosować antygrzybiczą kąpiel leczniczą metodami standardowo stosowanymi
w wylęgarnictwie.
Wylęg powinien pozostać w urządzeniu wylęgarniczym około 9–12 dni. W tym okresie
raczki przechodzą dwukrotnie linienie, zużywają zapasy zgromadzone w woreczku
ż
ółtkowym i usamodzielniają się. W urządzeniu wylęgarniczym raczki zbijają się wówczas
w charakterystyczne grona.
Gdy raczki samodzielnie potrafią przemieszczać się powinny zostać jak najszybciej
przeniesione do zbiornika, w którym będzie prowadzony podchów.
Klasycznym urządzeniem wylęgarniczym jest naczynie szklane Zugera zwane także
słojem Zugera. Przypomina ono dużą butelkę z odciętym dnem. Ustawiając je szyjką ku
dołowi podłączamy wężyk lub rurkę przez którą woda pompowana jest do naczynia. Na

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
24
wlocie wody w szyjce butelki powinien znajdować się tarcza tłumiąca ciśnienie wody.
Ciśnienie wody regulowane za pomocą zacisku na wężyku wlotowym powinno być tak
dobrane, aby zapewnić efektywną wymianę wody w naczyniu lecz jednocześnie powinno być
na tyle niskie aby siły grawitacyjne zapobiegały wypływaniu jaja wierzchem naczynia. Jaja
nie powinny wirować a jedynie unosić się w wodzie.. Przy standardowej obsadzie 8–10 tys.
jaj w jednym litrze wody przepływ powinien wynosić 0,8–1,0 litra wody na sekundę.
Podchów w warunkach kontrolowanych
Młode usamodzielnione raczki mogą być obiektem kontrolowanego podchowu. W tym
celu należy je umieścić w zbiornikach umożliwiających ten etap hodowli. Zbiorniki do
podchowu raków są rożnego typu. Mogą być to rowy z przepływową wodą, stawy
o stożkowatym układzie dna czy też baseny usytuowane w pomieszczeniach.
Zbiorniki te powinny cechować się przepływowością i możliwością stopniowego
spuszczania wody z równoczesnym obniżaniem jej poziomu. Parametry wody powinny
spełniać wymagania raków na poziomie optymalnym. Powinny posiadać twarde dno z dużą
liczbą kryjówek rożnej wielkości. W zależności od planowanej intensywności dokarmiania
raków przyrost roślin wodnych powinien być odpowiednio mniej lub bardziej bogaty.
W zbiornikach takich nie powinno być naturalnych wrogów raków.
Raki w takich zbiornikach przetrzymuje się zwykle przez jeden sezon. Pod jego koniec tj.
we wrześniu, październiku młode raczki o długości 3–4 cm odławia się. Odłowienie tak
małych i delikatnych organizmów wymaga dużej uwagi i ostrożności. Dokonuje się tego
poprzez powolnie obniżanie wody w zbiorniku, a następnie ręcznym wybieraniu raczków
skoncentrowanych w najniżej położonych miejscach zbiornika. Małe raczki mogą być
traktowane jako efekt jednosezonowej hodowli raków i wykorzystane do zaraczania lub
w przypadku systemu wielosezonowego skierowane do dalszego chowu.
Podchów raków w pomieszczeniach
Podchów kontrolowany raków możliwy jest także w basenach znajdujących się
w pomieszczeniach. Lepsza kontrola warunków termicznych takiego sposobu podchowu
może mieć wpływ na szybszy wzrost raków. Dotychczasowe doświadczenia szwedzkie
i fińskie wskazują że do tego typu podchowu należy mieć do dyspozycji co najmniej kila
zbiorników – basenów. Tak, jak w wyżej opisanych wariantach podchowu muszą być
spełnione wszystkie warunki hydrochemiczne i siedliskowe raków (kryjówki). Gdy
konstrukcja posiadanych basenów na to pozwala, zaleca się okresowe sortowanie
podchowywanych raczków. Utrzymywanie w jednym zbiorniku podobnych wielkościowo
osobników znacznie zmniejsza intensywność kanibalizmu i straty z tym związane. Hodowla
raków w pomieszczeniach wymaga bardzo uważnego i odpowiednio zbilansowanego
ż
ywienia. Duże znaczenie ma tu zarówno jakość jak i ilość podawanego pokarmu. Niezwykle
ważnym ze względów sanitarno-zdrowotnych jest natychmiastowe usuwanie nadwyżek
niezjedzonego przez raki pokarmu i tym samym bieżące korygowanie wielkości dawek
pokarmu.
śywienie raków
Rak jest organizmem oportunistycznym ze względu na stosowaną strategię pokarmową.
Oznacza to że jest przystosowany do wykorzystania różnorodnego pokarmu o z reguły
niewielkiej wartości odżywczej. W przypadku pokarmu zwierzęcego, ze względu na budowę
anatomiczną raki bazują głównie na organizmach, które są nieruchome lub relatywnie wolno
się poruszają. Dlatego podstawą diety raków w warunkach naturalnych jest roślinność wodna,
wśród zjadanych zwierząt dominują ślimaki, małże, mało ruchliwe larwy owadów jak na
przykład larwy muchówek. Rak chętnie zjada również martwe organizmy pełniąc ważną rolę

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
25
sanitarną w zbiornikach. Zjedzony pokarm jest bardzo dokładnie rozdrabniany przez raka co
pozwala mu na stosunkowo efektywne wchłanianie go na bardzo krótkim odcinku przewodu
pokarmowego.
Wszystkożerność raków stwarza wrażenie, że karmienie ich w warunkach hodowlanych
czy dokarmianie w warunkach chowu nie powinno nastręczać wiele problemów. Praktyka
hodowlana wskazuje, że w tym względzie koniecznym jest przestrzeganie pewnych zasad.
Dokładne informacje na temat karmienia tak jak i skład pasz przeznaczonych do hodowli
raków jest często tajemnicą producenta. Badania na dietą raka Procambarus clarkii wskazują
ż
e optimum jego zapotrzebowania białkowego wynosi 30% składu paszy przy wartości
energetycznej na poziomie 120 mg/kcal. W przypadku raka szlachetnego przekłada się to na
zalecaną zawartość białka w paszy na poziomie 30–35%, węglowodanów na poziomie 20–
25% i tłuszczu nie więcej niż 10%. Wartość energetyczna na poziomie 114 mg/kcal. Co
znaczy, że 114 mg paszy jest nośnikiem energii równej 1000 kalorii.
W praktyce oprócz specjalnych pasz dostosowanych do wymagań, raki karmi się
pokarmem roślinnym takim jak: odpowiednio rozdrobnionymi ziemniakami, marchwią
poddanym procesowi wstępnego gotowania, zielonym groszkiem. Możliwym jest
dokarmianie raków pokarmem zwierzęcym takimi, jak: ryby, rzeźne odpadki drobiowe.
Przy karmieniu raków niezwykle ważne jest odpowiednie dobranie dawek i bezwzględnie
konieczne usuwanie nie wykorzystanego i łatwo psującego się pożywienia. Ponieważ ten
drugi wymóg jest w praktyce trudny do spełnienia, aby unikać konieczności czyszczenia
zbiorników z resztek pokarmu trzeba odpowiednio dobierać ich dawki. Ich odpowiednia
wielkość uzależniana jest od warunków środowiskowych (temperatura, natlenienie) stanu
fizjologicznego raków. Odpowiednie ich dobieranie jest sztuką, którą opiera się na wynikach
bezpośrednich obserwacji. Normą początkową jest dawka wynosząca 1% masy obsady raków
dziennie.
Problem związany z trudnościami oczyszczania zbiorników z rakami z reszek pożywienia
można złagodzić poprzez stosowanie karmników. Karmnik powinien być tak skonstruowany
aby pokarm w nim utrzymywał się przez cały czas karmienia i nie był roznoszony przez raki
po całym zbiorniku. Najłatwiej to osiągnąć w przypadku karmienia raków paszami które
wymagają wstępnego przygotowania. Przygotowanie to polega na sporządzeniu z sypkiej
paszy pasty o odpowiedniej konsystencji. Pastę taka uzyskuje się poprzez dodanie wody
i zagniecenie masy. Pastę taką można wówczas przyklejać do płaskich powierzchni np.
dachówek które stają się wówczas karmnikami.
Zalecana gęstość rozmieszczania karmników to:
1.
w przypadku chowu intensywnego typowych w stawach,
2.
karmniki na 1 m
2
powierzchni przy chowie intensywnym i zbiorniku w kształcie rowu do
5 karmników na 1 m
2
.
Im intensywniejszy chów tym zagęszczenie karmników może być mniejsze. Duża ich
gęstość zapewnia nie tylko regularny dostęp do pokarmu większej liczby raków, ale także nie
wymusza zbyt długich wędrówek raków w poszukiwaniu pokarmu, utratę kryjówki a nawet
na kanibalizm. Walka o nową kryjówkę bądź jej poszukiwanie jest dla raków kosztowne
energetycznie i może wiązać się z utratą kończyn podczas walk. Z reguły raki tracą szczypce
przez co ich wartość znacznie spada, dodatkowo ranny osobnik może stać się ofiarą
kanibalizmu ze strony w pełni sprawnych osobników.
Kanibalizm jest niezwykle niedogodnym w hodowli raków zjawiskiem, a jego
minimalizacja jest często decydująca o powodzeniu przedsięwzięcia. Dlatego zjawisko to,
które nasila się razem ze wzrostem tempa wzrostu raków, powinno być łagodzone przez
odpowiednie dawkowanie i odpowiedni skład pokarmu oraz zapewnienie dużego nadmiaru
kryjówek. W przypadku gatunków tolerujących dużą zawartość zawiesiny w wodzie można
stosować sztuczne zmętnienie wody, które utrudnia wzajemne odnalezienie się osobników.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
26
Niestety w przypadku gatunków europejskich zwłaszcza raka szlachetnego nie jest to sposób
zalecany.
Metody odłowu raków
Najbardziej ekonomiczną metodą połowu dorosłych raków zwłaszcza, gdy istnieje
potrzeba odłowu ich znaczących liczebności jest połów przy pomocy pułapkowych narzędzi
połowu z zastosowaniem przynęty pochodzenia zwierzęcego. W przypadku raka
szlachetnego, błotnego oraz sygnałowego reakcja na tego typu przynętę jest stosunkowo silna
i powoduje koncentrację raków w miejscu jej występowania. Przy dużej sile wabiącej
przynęty zadaniem narzędzi połowu jest: uniemożliwienie ucieczki raków z miejsca takiej
koncentracji, uniemożliwienie przemieszczenia przynęty przez raki, oraz umożliwienie
wyciągniecie z wody złowionych organizmów.
Do tego celu najlepiej nadają się różnego typu raczniki charakteryzujące się ustalonym
planem budowy. Jest to przestrzeń w formie walca lub prostopadłościanu wykrojona przez
jadro z sieci lub kratki z tworzywa sztucznego. Wielkość oczek sieci czy kratek powinna być
tak dobrana, aby umożliwić ucieczkę osobnikom niewymiarowym.
Typowy racznik (rys. 6) posiada zwykle na przeciwległych płaszczyznach dwa wloty do
wnętrza, w postaci dwóch skierowanych (mniejszymi otworami) ku sobie lejków.
W centralnym punkcie racznika powinna znajdować się przynęta. Przynęta powinna być
zamocowana tak, aby dostęp do niej był możliwy jedynie w wypadku wejścia raka do jego
wnętrza racznika, oraz w sposób uniemożliwiający jej przemieszczenie przez raki.
Pułapki do połowu raków
Wloty pułapek
miejsce mocowania przynęty
miejsce mocowania przynęty
Rys. 6. Pułapki do połowu raków
Przynętę zwykle mocuje się na specjalnej agrafce lub umieszcza się wewnątrz ażurowego
pojemnika z tworzywa sztucznego
Należy mieć świadomość, że przynęta zwierzęca niewiadomego pochodzenia (chodzi tu
szczególnie o ryby) może być zarażona chorobami niebezpiecznymi dla raków np.: „dżumą
raczą”. Dlatego jako przynętę należy stosować odpady lub podroby drobiowe (np. wątrobę),
a w przypadku konieczności użycia ryb z niewiadomego pochodzenia stosować ryby morskie
(np. śledź). Najskuteczniejsza jest przynęta świeża. W raz ze wzrostem stopnia rozkładu
maleje siła wabiąca przynęty.
Odłowy powinno przeprowadzać się okresach największej aktywności pokarmowej
raków. Najbardziej efektywny okres odłowów przypada od połowy sierpnia do połowy
października. Połowy należy prowadzić po zachodzie słońca.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
27
Pułapki rozstawiać przy użyciu sprzętu pływającego rozmieszczając je wzdłuż brzegu na
głębokości 1–2 m w odstępach od około 10 metrów do 30. Wielkość odstępów pomiędzy
pułapkami uzależniona jest od zagęszczenia raków w zbiorniku.
Pułapki kontrolować najlepiej dwu – trzykrotnie przez całą noc. Zostawienie pułapek na
kilka dni powoduje znaczne obniżenie wydajności spowodowane ucieczką części raków
z racznika i zaniku wabiącej roli przynęty wraz z jej zjedzeniem lub zepsuciem.
Złowione raki należy przechowywać w ażurowych pojemnikach zapewniających stałe
odciekanie wody w sposób zapobiegający gromadzeniu się jej przy dnie pojemnika.
Gdy ten wymóg nie jest zapewniony, raki które znajdują się w tak zgromadzonej wodzie
(zwłaszcza te na dnie), szybko giną wskutek uduszenia.
Pojemniki z ze złowionymi rakami powinny być składowane w miejscach o możliwie
niskiej temperaturze (optymalnie ok. 10
º
C) i zabezpieczone przed bezpośrednim
promieniowaniem słonecznym.
Przetrzymywanie i kwarantanna raków
Jeśli wymaga tego określona sytuacja, raki można przetrzymywać w środowisku wodnym
przez czas dłuższy niż kilka dni. W szczególnych przypadkach, gdy takie przetrzymywanie
spowodowane jest koniecznością sprawdzenia stanu zdrowotnego raków obsadowych,
nazywamy je kwarantanną. W tym przypadku powinno ono trwać ok. 14 dni.
Przetrzymywanie raków związane jest z dużą koncentracją osobników na małej
przestrzeni co wiąże się ze szczególnym ryzykiem strat wywołanych przegęszczeniem
populacji.
Zdecydowanie do celów przetrzymywania raków najlepiej należy wykorzystywać
zbiorniki z wodą przepływową. Muszą być one w ten sposób izolowane, aby uniemożliwić
ucieczkę z nich raków. Wymóg ten jest szczególnie ważny w przypadku raka sygnałowego i
w tym przypadku niezwykle trudny do spełnienia. Z tego powodu najbezpieczniej raki
przetrzymywać w odpowiednich klatkach umożliwiających swobodny przepływ wody.
Liczba raków przypadających na jednostkę powierzchni dna zbiornika czy objętości klatki
zależna jest od czasu przetrzymywania raków oraz od warunków ich przetrzymywania.
Warunki te zależne są od jakości wody, której parametry powinny odpowiadać
wymaganiom gatunkowym. Zatem im większa koncentracja raków tym intensywniejsza
wymiana wody w ich otoczeniu. Ważnym parametrem jest względnie niska (optymalnie ok.
10ºC) temperatura wody.
Jeśli wymiana wody jest intensywna i posiada ona względnie stałą zbliżoną do optymalnej
temperaturę raki można przechowywać w klatkach w bardzo dużych zagęszczeniach i bez
potrzeby dokarmiania przez cały okres kwarantanny. Ze względu na możliwość wystąpienia
trudnych do przewidzenia czynników szkodliwych w wodzie, raki przechowywane powinny
być doglądane najmniej 2 razy dziennie.
Transport raków
Najefektywniejszym sposobem transportowania raków jest transport tzw. na sucho. Duża
sztywność skrzeli i ich ukrycie w jamie skrzelowej umożliwia rakom oddychanie tlenem
atmosferycznym przez dłuższy czas (nawet dwa tygodnie). Warunkiem transportu na sucho
bez strat jest zapewnienie odpowiednich warunków.
Raki należy przewozić w suchych pojemnikach i na sucho, czyli umieszczać
w pojemnikach osobniki, z których odciekła woda.
Pojemniki powinny mieć ażurową konstrukcję tak, aby możliwy był dostęp powietrza, ale
jednocześnie otwory nie powinny być na tyle duże, aby możliwe było wystawianie przez nich
kończyn raków, które mogłyby ulec uszkodzeniu podczas transportu.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
28
Pojemniki powinny być dobrze zamknięte i mieć wielkość uniemożliwiającą zgniecenie
raków z najniższej warstwy przez te powyżej.
Pojemniki z rakami powinny znajdować się w stałej temperaturze optymalnie poniżej
10
º
C, a powyżej 5
º
C. Zdecydowanie unikać transportu raków w temperaturach powyżej 25
º
C.
Pojemniki nie powinny być nadmiernie przewietrzane, aby zbytnio nie wysuszyć raków
podczas transportu. Dlatego zaleca się, aby na transportowane raki położyć cienką wilgotną
tkaninę, zapewniającą względnie trwałe warunki wilgotnościowe. W czasach historycznych tę
rolę spełniały pęczki pokrzyw umieszczane w pojemnikach z rakami.
Optymalnymi pojemnikami do transportu raków są pojemniki styropianowe lub plecione
z łyka (podobne do łubianek na truskawki) o objętości umożliwiającej umieszczenie 4–
5 kilogramów dorosłych raków. Wysokość takiego pojemnika powinna wynosić do 30 cm.
Wymieniany często jako możliwy do stosowania transport raków w workach z tlenem
w warunkach transportu dużych ilości raków jest bardzo niepraktyczny.
Przewożone w workach raki są, bowiem bardziej niż ryby narażone na urazy
mechaniczne, zatem należałoby je dodatkowo umieszczać w specjalnych pojemnikach.
Dodatkowo ostre końcówki szczypiec raków mogą łatwo przebić worek, dlatego worki takie
powinny mieć dużo większą grubość niż worki stosowane do transportu ryb.
I wreszcie efektywność takiego transportu nie jest wcale wyższa niż dobrze
zorganizowana transportu „na sucho”, a znacznie kosztowniejsza i pracochłonna.
4.3.2. Pytania sprawdzające
Odpowiadając na pytania, sprawdzisz, czy jesteś przygotowany do wykonania ćwiczeń.
1.
Co znaczy hodowla raków i czym się rożni od chóu raków?
2.
Jakie znasz etapy hodowli raków?
3.
Jakie znasz sposoby inkubacji jaj raków?
4.
Na czym polega podchów raków?
5.
Jak żywić raki w hodowli?
6.
Jak poławiać raki?
7.
Jak transportować raki?
4.3.3. Ćwiczenia
Ćwiczenie 1
Podaj warunki chowu i hodowli raków.
W podaną niżej tabelę wpisz wymagania jaki należy spełnić aby prowadzić chów
i hodowlę raków.
Rodzaj warunku
Chów
Hodowla
Etapy produkcji
Wyszczególnić w punktach
podstawowe etapy chowu
i dowolnie wybranego modelu
hodowli
Parametry wody
Określ podstawowe
wymagania chowu i dowolnie
wybranego modelu hodowli

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
29
Zbiorniki wodne
Scharakteryzuj podstawowe
wymagania dotyczące zbiorników
wodnych użytecznych do chowu
i dowolnie wybranego modelu
hodowli
Materiał wyjściowy (raki)
Określ wymagania dotyczące
materiału, od którego powinno
zacząć się chów i hodowlę raków
ś
ywienie
Opisz sposób żywienia raków
w chowie oraz poszczególnych
etapach hodowli
Zagrożenia
Określ zagrożenia dla sukcesu
produkcyjnego chowu i hodowli
w kolejności zgodnej z malejącym
zagrożeniem
Spodziewane efekty
( Jak wykorzystać raki będące
rezultatem przeprowadzenia
procesów związanych z chowem
i hodowlą raków)
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie, powinieneś:
1)
wyszukać w materiałach dydaktycznych informację dotyczącą wymagań chowu
i hodowli raków,
2)
uzupełnić tabelę.
Wyposażenie stanowiska pracy:
−−−−
literatura zgodna z punktem 6 poradnika dla ucznia.
4.3.4. Sprawdzian postępów
Czy potrafisz:
Tak
Nie
1)
rozróżnić podstawowe systemy chowu raków?
2)
określić podstawowe wymagania wobec środowiska jeziora,
które może być obiektem chowu raków?
3)
rozróżnić zbiorniki nadające się do chowu raków?
4)
określić warunki wpuszczania raków do zbiornika w celu chowu?
5)
oszacować przybliżoną wielkość obsady i spodziewaną produkcję
różnych typach zbiorników wodnych?

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
30
4.4. Choroby, pasożyty raków, organizmy stanowiące zagrożenie
4.4.1. Materiał nauczania
Czynniki biologiczne stanowiące zagrożenie dla powodzenia chowu czy hodowli raków
można podzielić na:
–
choroby grzybicze,
–
choroby bakteryjne,
–
choroby wywołane przez pasożyty,
–
oddziaływanie innych organizmów szkodliwych.
Choroby grzybicze
Do tej grupy chorób należy najgroźniejsza dla rodzimych gatunków choroba wywołana
przez grzyb Aphanomyces astaci. Ze względu na ostrą formę jej przebiegu i 100 procentową
ś
miertelność zarażonych nią raków zyskała miano „dżumy raczej”. Choroba ta została
najprawdopodobniej zawleczona do Europy z kontynentu Ameryki Północnej w połowie XIX
wieku. Od tego czasu, odpowiedzialna jest za wyniszczenie zdecydowanej większości
populacji raków szlachetnych w Europie. Z tej przyczyny sprowadzono do Europy gatunki
amerykańskie, które są praktycznie odporne na tę chorobę. Niestety jak się okazało również ją
przenoszą.
Zarażenie następuje poprzez spory – mikroskopijne twory zaopatrzone w dwie wici
umożliwiające im aktywne poruszanie się. Na skutek kontaktu z wodą, pożywieniem lub
innym organizmem, który przenosi spory może nastąpić zarażenie chorobą. Wskutek
zarażenia z otorbionej spory zagnieżdżonej w pancerzu raka zaczynają wyrastać strzępki
pleśni, które przenikają do tkanki mięśniowej organizmu. Dodatkowo strzępki pleśni
produkują neurotoksyny – trucizny niszczące układ nerwowy raka. Śmierć organizmu
następuje w kilka dni po zarażeniu. Populacja raka szlachetnego w dużym jeziorze może
zniknąć w ciągu dwóch tygodni. Chore raki zwykle zostają częściowo sparaliżowane
(usztywnione kończyny), tracą wrażliwość na światło i masowo zaczynają wychodzić na
brzeg zbiornika. U martwych osobników na słupkach ocznych i stawach kończyn można
zauważyć kępki pleśni.
Zarażenie chowanych lub hodowlanych raków „dżumą raczą” wiąże się z całkowitą ich
zagładą, katastrofą hodowlaną nie rzadko finansową. Dlatego niezwykle ważnym jest
zabezpieczenie hodowli przed potencjalnym zawleczeniem „dżumy raczej”.
Należy, zatem całkowicie wyeliminować możliwość przeniesienia tej choroby wraz
z wodą z zarażonych zbiorników, sprzętem połowowym, pływającym, odzieży używanej
w kontakcie z taką wodą, zwierzętami i roślinami oraz przedmiotami pochodzącymi z takich
wód.
Za potencjalne źródło pochodzenia „dżumy raczej” powinny być uznane wszystkie wody,
w których stwierdzono występowanie gatunków amerykańskich, czyli raka sygnałowego oraz
pręgowatego.
Sprzęt, przedmioty, które przeznacza się do użytku w wodach hodowli i chowu raków,
a które miały kontakt z wodą potencjalnie zarażoną należy bezwzględnie dezynfekować
ś
rodkami antygrzybiczymi.
Drugą chorobą pochodzenia grzybiczego mającą również czasami podłoże bakteryjne jest
plamica raków zwana też „chorobą plam gangrenowych”. Jest ona wywołana przez różne
gatunki grzybów i bakterii. Objawia się ciemnymi często czarnymi plamami na pancerzu
raka. Pancerz w tym miejscu jest wyraźnie miękki, czasami do tego stopnia, że dochodzi do
jego perforacji. Gdy nastąpi perforacja pancerza może ona spowodować śmierć raka. Choroba

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
31
ta atakuje w szczególności miejsca mechanicznych uszkodzeń pancerza i sprzyja jej obniżony
poziom czystości wody i osadów w zbiorniku.
Walka z tą chorobą polega na eliminacji osobników chorych i dbałości o stan sanitarny
chowu czy hodowli.
Choroby bakteryjne
Zapalenie wątrobotrzustki raka jest bakteryjną chorobą, jedną z najniebezpieczniejszych
opisanych jako odrębna jednostka chorobowa. Wywołuje ją bakteria Citrobacter freundii.
Objawem są brunatne plamy na wątrobotrzustce zielonkawożółtym organie w dużym stopniu
wypełniającym głowotułów.
Pojawienie się tej choroby jest zwykle wskaźnikiem stresowych warunków bytowania
raków. Śmiertelność w najcięższych przypadkach może sięgać 100% pogłowia, zwykle jest
jednak niewielka.
Choroby wywołane przez pasożyty
Choroba porcelanowa – nazwa tej choroby pochodzi od wyglądu mięśni u raków
zarażonych tą chorobą. U takich osobników w skutek zarażenia w mięśniach występuje
masowo pierwotniak z rzędu Microsporidia. Choć ma on niezwykle małe rozmiary to
masowość jego występowania powoduje zniszczenie struktury mięśni. Zniszczone mięsnie
zamiast półprzezroczystych stają się całkowicie nieprzeźroczyste i mlecznie białe.
U zarażonych raków objaw ten jest wyraźnie widoczny na spodniej części odwłoka.
Widoczne od spodu mięśnie są właśnie mleczno białe i wyglądem przypominają porcelanę.
Ś
miertelność jest uwarunkowana stopniem zarażenia mięśni. W przypadku raków
posiadających wyraźnie mleczne zabarwienie mięśni, śmierć następuje podczas linienia. Jeśli
taki rak zostanie zjedzony przez innego, następuje zarażenie. Inne sposoby zarażenia nie są
udowodnione, choć zapewne istnieją.
Stopień zarażenia tą chorobą w naturalnych populacjach sięga 10% i zwykle rośnie, gdy
pogarszają się warunki bytowe. Nie ma żadnych danych wskazujących by choroba ta była
zagrożeniem dla chowu czy hodowli raków. Walka z nią polega na eliminacji osobników,
u których stwierdza się zarażenie.
Branchiobdelloza – opanowanie raków przez podobne do pijawek pierścienice zwane
branchiobdellami lub pijawkami raczymi może być przyczyną osłabienia organizmu.
W zdecydowanej większości należą do tej grupy gatunki, które są komensalami raków.
Znaczy to, że żyją one wykorzystując raka, lecz nie powodują u niego żadnych
niekorzystnych następstw. Tylko (Branchiobdella hexadonta) jeden z kilku gatunków okazał
się pasożytem żywiącym się tkankami raka. Wydaje się jednak, że w przypadku licznego
skolonizowania raków przez branchiobdelle, mogą one niekorzystnie oddziaływać.
Podejrzewa się na przykład, że obecność pakietów jaj złożonych na jaja racze może obniżać
wytrzymałość osłonek i powodować przedwczesne ich pękanie w końcowej fazie inkubacji.
Psorospermioza – choroba o tak łagodnym przebiegu, że nie jest oczywistym fakt czy
może być tak klasyfikowana. U gatunków raków rodzimych w mięśniach spotyka się
mikroorganizmy o niewyjaśnionej przynależności systematycznej zwane Psorospermium
haeckli, do tej pory nie udowodniono szkodliwego oddziaływania na raki, lecz przy wysokim
poziomie zarażenia, najprawdopodobniej wpływa on ujemnie na kondycję raka.
Organizmy stanowiące zagrożenie dla chowu i hodowli raków
Rak pręgowaty i rak sygnałowy stanowić mogą krytyczne zagrożenie dla każdej hodowli
i chowu raka szlachetnego czy błotnego. Powodem tego jest zjawisko przenoszenia „dżumy
raczej” oraz konkurencyjne wypieranie gatunków rodzimych przez amerykańskie.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
32
Raki słodkowodne narażone są na drapieżnictwo ze strony różnych gatunków zwierząt
wodnych i lądowych. Szczególnie krytycznym okresem w życiu raka jest pierwszy rok życia.
Wówczas mały raczek może być zjedzony przez szerokie spektrum drapieżników od larwy
ważki czy chrząszcza wodnego przez pawie wszystkie gatunki ryb i ptaków brodzących na
ssakach takich jak rzesorek kończąc. Wśród kręgowców można wymienić następujące
zwierzęta.
Ryby
Dla młodych raczków czyli tych do 1,5 cm długości każdy gatunek ryb odżywiający się
organizmami żyjącymi na dnie stanowi śmiertelne zagrożenie. Dlatego dla raków w tym
wieku zagrożeniem są praktycznie duże osobniki większości gatunków ryb karpiowatych,
okoniowatych, sumowatych.
Dla osobników dorosłych naturalnym wrogiem wśród ryb są następujące gatunki
w następującej kolejności określającej stopień zagrożenia: szczupak, pstrąg, miętus, sumik
karłowaty, okoń, sum, węgorz.
Ptaki
Wśród ptaków stanowiących zagrożenie dla raków wymienia się: czaplę siwą, wronę
i łyskę. Z pewnością rakiem będącym tuż po wylince, a więc łatwym do schwytania nie
pogardzą różne gatunki kaczek.
Ssaki
Jako naturalnego wroga raków wśród ssaków pierwszej kolejności wymienia się wydrę.
Raki stanowią naturalny składnik pokarmu dla tego organizmu. Ze względu na doskonałe
zdolności łowieckie wydry jej szkodliwość w miejscach intensywnej hodowli czy chowu
raków może być znaczna. W przypadku stwierdzenia obecności wydry w takich miejscach
należy dołożyć wszelkich starań by uniemożliwić jej dostęp do hodowlanego obiektu.
Podobne właściwości i szkodliwość może cechować inny gatunek, jakim jest norka
amerykańska. Jest ona znacznie mniejsza od wydry, lecz porównywalna, jeśli chodzi o jej
szkodliwość w chowie lub hodowli raków. Ze względu na to, że nie jest to gatunek chroniony
a nawet niepożądany w naturalnych ekosystemach Polski zakres metod walki z tym
szkodnikiem można rozszerzyć o te powodujące eksterminację norki
Innymi ssakami okazjonalnie żywiącymi się rakami są lisy, które czasami są w stanie
złowić osobniki przebywające na płyciznach.
4.4.2. Pytania sprawdzające
Odpowiadając na pytania, sprawdzisz, czy jesteś przygotowany do wykonania ćwiczeń.
1.
Jak są biologiczne czynniki wywołujące choroby raków?
2.
Jakie są przyczyny i objawy „dżumy raczej”?
3.
Jakie są objawy bakteryjnych chorób raków?
4.
Jakie są pasożytnicze choroby raków?
5.
Jak rozpoznać pasożytnicze choroby raków?
6.
Jakie organizmy stanowią zagrożenie dla chowu i hodowli raków?

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
33
4.4.3. Ćwiczenia
Ćwiczenie 1
Określ choroby raków.
Wstaw do tabeli typowe objawy poszczególnych chorób raków i określ zagrożenie dla
wychowu raków w skali duże lub małe.
Choroba
Objawy
Zagrożenie
Dżuma racza
Choroba plam gangrenowych
Choroba porcelanowa
Zapalenie wątrobotrzustki
Choroba porcelanowa
Branchiobdelloza
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie, powinieneś:
1)
wyszukać w materiałach dydaktycznych informacje dotyczące chorób raków,
2)
uzupełnić tabelę.
Wyposażenie stanowiska pracy:
−−−−
literatura zgodna z punktem 6 poradnika dla ucznia.
4.4.4. Sprawdzian postępów
Czy potrafisz:
Tak
Nie
1)
wymienić czynniki biologiczne zagrażające rakom?
2)
podać nazwę najgroźniejszej grzybiczej choroby raków i wskazać
jej przyczynę?
3)
omówić, jak objawia się „plama gangrenowa”?
4)
omówić, jak objawia się choroba porcelanowa?
5)
omówić, jak objawia się branchiobdelloza?
6)
wymienić gatunki zwierząt niebezpiecznych dla raka?

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
34
5. SPRAWDZIAN OSIĄGNIĘĆ
INSTRUKCJA DLA UCZNIA
1.
Przeczytaj uważnie instrukcję.
2.
Podpisz imieniem i nazwiskiem kartę odpowiedzi.
3.
Zapoznaj się z zestawem zadań testowych.
4.
Test zawiera 20 zadań. Do każdego zadania dołączone są 4 możliwości odpowiedzi, tylko
jedna jest prawidłowa.
5.
Udzielaj odpowiedzi tylko na załączonej karcie odpowiedzi stawiając w odpowiedniej
rubryce znak X. W przypadku pomyłki należy błędną odpowiedź zaznaczyć kółkiem,
a następnie ponownie zakreślić odpowiedź prawidłową.
6.
Pracuj samodzielnie, bo tylko wtedy będziesz miał satysfakcję z wykonanego zadania.
7.
Kiedy udzielenie odpowiedzi będzie Ci sprawiało trudność, wtedy odłóż jego rozwiązanie
na później i wróć do niego, gdy zostanie Ci wolny czas.
8.
Na rozwiązanie testu masz 45 min.
ZESTAW ZADAŃ TESTOWYCH
1.
Samica raka charakteryzuje się zwykle
a)
szerokością odwłoka większą niż głowotułowia.
b)
szerokością odwłoka mniejszą niż głowotułowia.
c)
brakiem głowotułowia.
d)
szerokością odwłoka równą szerokości szczypca.
2.
Samca raka najłatwiej odróżnić od samicy po
a)
proporcjach budowy ciała.
b)
liczbie odnóży krocznych.
c)
budowie odnóży odwłokowych.
d)
kształcie szczypców.
3.
Gatunki raków które są rodzime dla wód Polski to
a)
pręgowaty i sygnałowy.
b)
szlachetny i sygnałowy.
c)
szlachetny i błotny.
d)
błotny i pręgowaty.
4.
Gatunek raka, który powinien być priorytetowo brany pod uwagę jako gatunek hodowlany
to
a)
rak sygnałowy bo to gatunek rodzimy, osiąga wysokie ceny zbytu na rynku.
b)
rak szlachetny bo to gatunek rodzimy, osiąga wysokie ceny zbytu na rynku.
c)
rak błotny bo to gatunek rodzimy, odporny na choroby.
d)
rak pręgowaty bo łatwo pozyskać materiał obsadowy.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
35
5.
Najbardziej rygorystyczne wymagania odnośnie jakości środowiska wodnego (np.
natlenienia i temperatury) ma rak
a)
sygnałowy.
b)
szlachetny.
c)
błotny.
d)
pręgowaty.
6.
Rak sygnałowy jest gatunkiem
a)
szybko rosnącym, rodzimym, odpornym na choroby.
b)
szybko rosnącym, introdukowanym, odpornym na choroby.
c)
wolno rosnącym, rodzimym, nie odpornym na choroby.
d)
wolno rosnącym, obcym, nie odpornym na choroby.
7.
Chów o stosunkowo niewielkich nakładach i niskiej produkcji przypadającej na jednostkę
powierzchni zbiornika bądź objętości przepływu wody to
a)
chów zrównoważony.
b)
chów intensywny.
c)
chów ekstensywny.
d)
chów semintensywny.
8.
Jezioro spełniające warunki chowu raków, najlepiej powinno posiadać takie cechy jak
a)
duża głębokość średnia powyżej 15 m, duża produktywność glonów – niewielka
przeźroczystość, brak zanieczyszczeń chemicznych.
b)
niewielka głębokość średnia do 2 m, szybkie nagrzewanie się wód, muliste dno, brak
zanieczyszczeń chemicznych.
c)
głębokość średnia ok. 4 m, długa linia brzegowa, twarde dno, brak zanieczyszczeń
chemicznych.
d)
głębokość maksymalna do 5 m, duża produktywność glonów – niewielka
przeźroczystość, brak zanieczyszczeń chemicznych.
9.
Cechy jeziora mają pierwszorzędne znaczenie dla jego przydatności do chowu raków. Są
to
a)
wysoka jakość wody, mulisty charakter dna i brzegu, mała długość linii brzegowej,
dobra jakość i duża ilość dostępnego pokarmu.
b)
wysoka jakość wody, duża maksymalna głębokość, niskie położenie względem
poziomu morza, duża wielkość powierzchni lustra wody.
c)
łatwy dojazd do zbiornika, położenie przy szlaku komunikacyjnym, wysoka wartość
rekreacyjna.
d)
brak raków amerykańskich, wysoka jakość wody, kamienisty charakter dna i brzegu,
duża długość linii brzegowej, dobra jakość i umiarkowana ilość dostępnego pokarmu.
10.
Wydajności z hektara powierzchni jeziora, jakiej należy się spodziewać, jeśli
charakteryzuje się ono optymalnymi warunkami dla chowu raków to
a)
nie wyższych niż 5 kg.
b)
ponad 10 kg.
c)
nie wyższych niż 100 kg.
d)
ponad 100 kg.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
36
11.
Minimalna liczba jednorocznych raków do zaraczenia 3 ha wyrobiska pożwirowego to
a)
3*100 = 300 osobników (75 samców /225 samic).
b)
3*500 = 1500 osobników (500 samców/1000 samic).
c)
3*100 = 300 osobników (200 samców/ 100 samic).
d)
3*500 = 1500 osobników (375 samców/1125 samic).
12.
Inkubację jaj raków można prowadzić
a)
w inkubatorach i na odwłoku samicy.
b)
w urządzeniach wylęgarniczych i w inkubatorach.
c)
w urządzeniach wylęgarniczych i na odwłoku samicy.
d)
wyłącznie w urządzeniach wylęgarniczych.
13.
Podchów raków polega na
a)
dokarmianiu raków.
b)
ochronie raków przed drapieżnikami.
c)
działaniu mającym na celu otrzymanie raków towarowych.
d)
działaniu mającym na celu otrzymanie materiału do dalszego chowu raków lub
zaraczania.
14.
Raki są organizmami
a)
wszystkożernymi.
b)
zdecydowanie mięsożernymi.
c)
zdecydowanie roślinożernymi.
d)
samożywnymi.
15.
Zbyt duża dawka zadanej i nieusuniętej karmy może spowodować śmierć raków
wywołaną
a)
kanibalizmem.
b)
zanieczyszczeniem wody.
c)
infekcją bakteryjną.
d)
konkurencją między osobnikami.
16.
Kanibalizm wśród hodowanych raków jest duży, gdy
a)
temperatura wody jest zbyt wysoka.
b)
brak jest wystarczającej liczby kryjówek i pokarmu.
c)
jest zbyt niska obsada hodowlana i nadmiar pokarmu.
d)
do hodowli mają dostęp organizmy żywiące się rakami.
17.
Najefektywniejszy sposób transportu raków towarowych to
a)
„na sucho”. w skrzynkach.
b)
w wodzie. w specjalnych pojemnikach.
c)
„na sucho”. w skrzynkach z lodem.
d)
w wodzie. w workach z tlenem.
18.
Najniebezpieczniejsza choroba dla raków rodzimych to
a)
choroba porcelanowa.
b)
choroba gangrenowa.
c)
grzybicza choroba zwana „dżumą raczą”.
d)
branchiobdelloza.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
37
19.
Chorobę porcelanową najłatwiej poznać po
a)
charakterystycznych spękaniach pancerza raka.
b)
dużej kruchości pancerza raka.
c)
mlecznym zabarwieniu mięsni odwłoka u raka.
d)
częściowym paraliżu ciała raka.
20.
Odłów raków towarowych najefektywniej przeprowadzić przy zastosowaniu
a)
sieci ciągnionych po i nad dnem zbiornika.
b)
pułapek z przynętą roślinną.
c)
pułapek z przynętą zwierzęcą.
d)
sieci stawnych – wontonów.
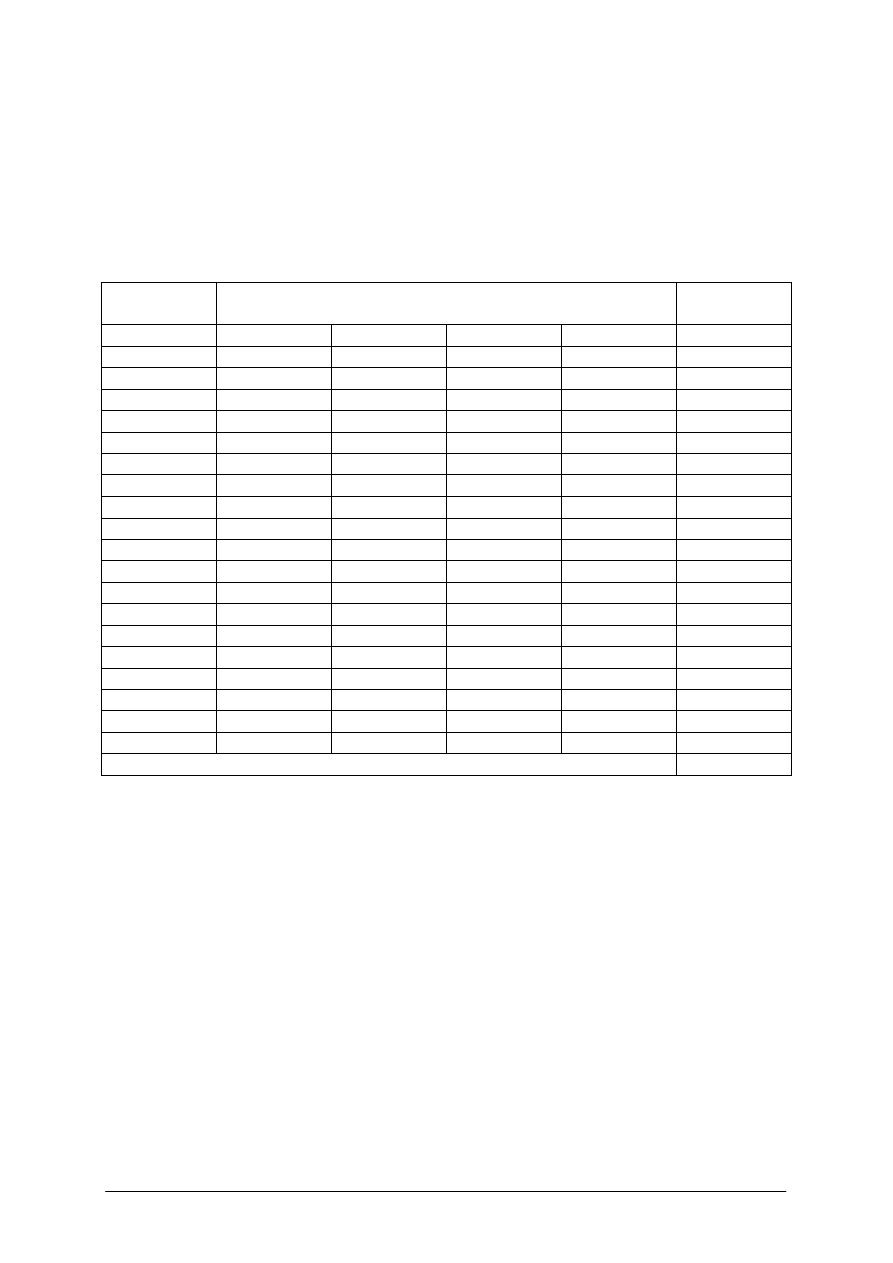
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
38
KARTA ODPOWIEDZI
Imię i nazwisko ...........................................................................................................................
Prowadzenie wychowu raków
Zakreśl poprawną odpowiedź
Nr
zadania
Odpowiedź
Punkty
1
a
b
c
d
2
a
b
c
d
3
a
b
c
d
4
a
b
c
d
5
a
b
c
d
6
a
b
c
d
7
a
b
c
d
8
a
b
c
d
9
a
b
c
d
10
a
b
c
d
11
a
b
c
d
12
a
b
c
d
13
a
b
c
d
14
a
b
c
d
15
a
b
c
d
16
a
b
c
d
17
a
b
c
d
18
a
b
c
d
19
a
b
c
d
20
a
b
c
d
Razem:

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
39
6.
LITERATURA
1.
Gondko K.: Raki. Praca zbiorowa. PWN, Warszawa. 1992
2.
Gajewski Z., Terlecki W.: Raki. PWRiL, Warszawa 1956
3.
Jańczak J. (red.): Atlas jezior Polski. Tom I, II, III. IMiGW, Bogucki Wydawnictwo
Naukowe 1997
4.
Kossakowski J.: Raki. PWRiL, Warszawa 1966
5.
Krzywosz T.: Astakofauna Polski: historia, stan obecny, perspektywy. Funkcjonowanie
i ochrona ekosystemów wodnych na obszarach chronionych. Wydawnictwo Instytutu
Rybactwa Śródlądowego, Olsztyn 2000
6.
Krzywosz T.: Chów raka sygnałowego. Wydawnictwo Instytutu Rybactwa
Ś
ródlądowego, Olsztyn 1995
7.
Mastyński J., Andrzejewski W.: Cechy morfometryczne i rozpoznawanie
raków
występujących w Polsce. Wydawnictwo Akademii Rolniczej w Poznaniu, Poznań 2001
8.
Mastyński J., Andrzejewski W.: Chów i hodowla raków. Wydawnictwo Akademii
Rolniczej w Poznaniu, Poznań 2005
9.
Holdich D.M.(red): Biology of Freshwater Crayfish, Blackwell Science Home Page 2002
10.
Pöckl M., Holdich D.M., Pennerstorfer J., Identiyfing native and alien crayfish species in
Europe. Product of European Project Craynet. 2006
11.
Pierożyński J.: Rak. PWRiL, 1951
12.
Strużyński W., Śmietana P.: Ochrona rodzimych raków wobec zagrożeń związanych
z rozprzestrzenianiem się obcych gatunków. Przegląd Rybacki 6, 1998
13.
Ś
mietana P.: Nasze raki. Przegląd Rybacki 2, 1999
14.
Strużynski W., Śmietana P.: On the distribution of Crayfish in Poland. Freshwater
Crayfish, 12, 1999
Wyszukiwarka
Podobne podstrony:
rybak srodladowy 632[01] z4 01 u
rybak srodladowy 632[01] z2 02 u
kelner 512[01] z3 04 n
kaletnik 744[01] z3 04 u
kelner 512[01] z3 04 u
fototechnik 313[01] z3 04 n
kaletnik 744[01] z3 04 n
fototechnik 313[01] z3 04 u
kelner 512[01] z3 04 n
Rejestracja Wykonywanie fotografii technicznych 313[01] z3 04 u
kelner 512[01] z3 04 u
kelner 512[01] z3 04 u
opiekunka dziecieca 513[01] z3 02 u
fototechnik 313[01] z2 04 n
operator maszyn i urzadzen do obrobki plastycznej 812[01] o1 04 u
monter elektronik 725[01] z3 03 n
operator urzadzen przemyslu chemicznego 815[01] z1 04 n
więcej podobnych podstron