
Analityka ogólna, dwiczenia dla studentów III OAM
2010/2011
Wydział Farmaceutyczny UJCM, Zakład Diagnostyki Medycznej
1
E
NZYMY
Enzymy komórkowe:
o Miejscem ich działania są komórki, są związane z różnymi organellami komórkowymi:
o Pojawiają się w dużych ilościach po uszkodzeniu narządów.
o Należą do nich min. ALT, AST
Enzymy sekrecyjne:
o Po uszkodzeniach komórek (np. hepatocytów) zachodzi spadek ich aktywności, ponieważ ich
ilośd zależy od syntezy na rybosomach.
o Należą do nich min. czynniki krzepnięcia krwi oraz fibrynolizy, esterazy cholinowe i lipaza
lipoproteinowa.
Enzymy ekskrecyjne
o przeszkoda w odpływie wydzielin ustrojowych, takich jak: żółd, sok trzustkowy, ciecz
sterczowa czy ślina, powoduje zastój wydzieliny i przedostanie się enzymów do krwiobiegu.
o Do tej grupy należą enzymy soku trzustkowego, żółci oraz fosfataza sterczowa
_________________________________________________
Izoenzymy
o Homologiczne enzymy w obrębie danego organizmu, które katalizują tę samą reakcję,
ale różnią się nieznacznie strukturą, wartościami K
m
i V
max
oraz właściwościami
regulacyjnymi.
o Izoenzymy ulegają ekspresji w różnych tkankach lub organellach w różnych stadiach
rozwojowych.
o Są kodowane przez geny zajmujące różne loci
o Izoenzymy można często odróżnid od siebie na podstawie właściwości biochemicznych, np.:
ruchliwośd elektroforetyczna – izoenzymy dehydrogenazy mleczanowej
Inhibicja przez L-winian: L-winian hamuje kwaśną fosfatazę sterczową, nie działając
na inne izoenzymy fosfatazy kwaśnej

Analityka ogólna, dwiczenia dla studentów III OAM
2010/2011
Wydział Farmaceutyczny UJCM, Zakład Diagnostyki Medycznej
2
O
ZNACZANIE AKTYWNOŚCI ENZYMÓW
Typowe przyczyny zmian aktywności enzymów we krwi:
o Zmiana przepuszczalności błony komórkowej
o Rozpad komórek w wyniku patologicznych procesów
o Zmiany w eliminacji/katabolizmie enzymu
o Zwiększona proliferacja komórek/ indukcja enzymów
o Utrudniony odpływ wydzieliny gruczołu zawierającej enzymy ekskrecyjne
o Upośledzenie syntezy enzymu
Zasada pomiaru aktywności enzymów
A) Kofaktory oznaczanych enzymów:
Pomiar spadku/ wzrostu absorbancji pochodzący od powstającego/ zużywanego w reakcji
enzymatycznej NADH lub NADPH :
o NADH/NAD i NADPH/NADP są kofaktorami używanymi przez wiele enzymów
o Redukcja NAD do NADH i NADP do NADPH jest monitorowana przy
=340 nm, ponieważ
forma utleniona nie absorbuje światła przy tej długości fali.
o Jeśli oznaczany enzym nie wymaga do swej aktywności kofaktorów w postaci NADH/NAD
i NADPH/NADP, istnieje koniecznośd sprzężenia reakcji dla oznaczanego enzymu z reakcją
pomocniczą oraz/lub wskaźnikową podczas której wykorzystywany jest enzym wymagający
do prawidłowego funkcjonowania ww. kofaktorów, np.:
ALT
L-alanina + a-ketoglutaran <---------> L-glutaminian + pirogronian
reakcja wskaźnikowa:
LDH
pirogronian + NADH + H
+
<--------> mleczan + NAD
+
B) Analogi naturalnych substratów:
Pomiar wzrostu absorbancji pochodzący od powstającego p- nitrofenolu:
o p-nitrofenol może zostad sprzęgnięty z wieloma związkami chemicznymi, tworząc sztuczny
substrat dla oznaczanego enzymu
o Enzym katalizuje reakcję odszczepienia p-nitrofenolu, który tworzy żółto zabarwiony anion p-
nitrofenolanowy
p-nitrofenylofosforan (pNPP) – fosfatazy
p-nitrofenylo-D-maltoheptozyd (pNP-G7) - amylaza
C) Substancje, z których pod wpływem reakcji enzymatycznej powstają barwne produkty:
3,3’,5,5’-tetrametylobenzydyna (TMB)

Analityka ogólna, dwiczenia dla studentów III OAM
2010/2011
Wydział Farmaceutyczny UJCM, Zakład Diagnostyki Medycznej
3
Pomiar szybkości reakcji odbywa się w ustalonych i ściśle kontrolowanych warunkach
(pH, temperatura, stężenie substratów, aktywnośd innych enzymów biorących udział w reakcji),
w określonym przedziale czasu.
Aktywnośd enzymatyczna wyrażamy w dwóch standardowych jednostkach.
o jednostka enzymatyczna (IU – international unit) jest to taka ilośd enzymu, która katalizuje
przekształcenie 1 μmola substratu w ciągu 1 minuty, w warunkach optymalnych dla danego
enzymu.
o Katal (kat) jest jednostka aktywności enzymatycznej obowiązująca w układzie SI, to taka ilośd
enzymu, która w standardowych warunkach przekształca 1 mol substratu w ciągu 1 sekundy.
1 kat – 6x10
7
IU
1 IU = 1 μmol/min
1 kat = 1 mol/s
→ 60 mol/min → 6x10
7
IU
1 μkat = 60 IU
1 IU = 16,7 μkat
o Dopuszcza się stosowanie jednostki zwyczajowej (U - unit) pod warunkiem wskazania
przelicznika obu jednostek.
Jednostki U definiuje się w sposób zaproponowany przez producenta danego testu
enzymatycznego np. oznaczanie mieloperoksydazy (enzymu katalizującego reakcję utleniania w
obecności H
2
O
2
):
sztuczny substrat – gwajakol (forma utleniona jest barwna)
przyrost absorbancji związany jest z przyrostem barwnego produktu
ściśle zdefiniowane warunki reakcji: 1% gwajakol, 6mmol H
2
O
2
, pH 7.4, temperatura 37
st. C
pomiar absorbancji dla długości fali
= 450 nm
1U = taka aktywnośd enzymu, która spowoduje przyrost absorpcji równy 1 w czasie 1 min.

Analityka ogólna, dwiczenia dla studentów III OAM
2010/2011
Wydział Farmaceutyczny UJCM, Zakład Diagnostyki Medycznej
4
S
TANDARYZACJA OZNACZEO ENZYMATYCZNYCH
:
Cel: otrzymanie porównywalnych wyników aktywności enzymów w materiale biologicznym,
niezależnie od:
rodzaju użytych odczynników (firmy produkującej zestawy odczynników),
analizatora biochemicznego, na którym dane oznaczenie było przeprowadzone,
laboratorium w którym oznaczenie było przeprowadzone
Próba standaryzacji metod enzymatycznych przez IFCC (International Federation of Clinical Chemistry
and Laboratory Medicine – Międzynarodowa Organizacja Chemii Klinicznej) zaproponowała system
referencyjny, który obejmuje:
dobrze zdefiniowane metody referencyjne oznaczania aktywności enzymów, które
cechują się linową zależnością wyników pomiaru od stopnia rozcieoczenia materiału,
stworzenie certyfikowanych materiałów referencyjnych,
utworzenie sieci laboratoriów referencyjnych
Analityka ogólna, dwiczenia dla studentów III OAM
2010/2011
Wydział Farmaceutyczny UJCM, Zakład Diagnostyki Medycznej
5
E
NZYMY
-
WYBRANE ZAGADNIENIA
1. Aminotransferazy a alkoholowe uszkodzenie wątroby
o W większości typów schorzeo wątroby aktywnośd AlAT jest wyższa niż AspAT; wyjątek
stanowi alkoholowe zapalenie wątroby, w którym może byd wiele przyczyn podwyższenia
aktywności AspAT.
o Alkohol indukuje uwalnianie mitochondrialnej AspAT z komórek bez ich widocznego
uszkodzenia.
o Niedobór pirydoksyny, częsty u alkoholików, zmniejsza aktywnośd wątrobowej AlAT
2. Wskaźnik de Ritisa
Określa stosunek poziomu (aktywności) aminotransferazy asparaginianowej do poziomu
aminotransferazy alaninowej (AST/ALT).
W warunkach prawidłowych parametr ten jest nieco wyższy od 1
Wskaźnik <1 (AspAT < AlAT) sugeruje takie choroby miąższu wątroby, jak:
przewlekłe wirusowe zapalenia wątroby,
hemochromatoza,
uszkodzenia polekowe i toksyczne,
autoimmunologiczne zapalenie wątroby
Wskaźnik >1 (AspAT > AlAT) może świadczyd o:
toksycznym uszkodzeniu wątroby (często w praktyce wskazywad to może na alkoholową
chorobę wątroby AspAT/AlAT>2)
marskości wątroby
pozawątrobowej przyczynie - zap. trzustki, zawał serca, uszkodzenie mięśni szkieletowych
3. Wielokrotnośd górnej granicy normy – znaczenie diagnostyczne
o 100x – ciężkie uszkodzenie wątroby spowodowane działaniem toksyn
o W przebiegu ostrego WZW wzrost aktywności AlAT i AspAT jest co najmniej 10-krotny
powyżej górnej granicy normy, a często 20-30-krotny i wyższy
o W przebiegu przewlekłego WZW wzrost aktywności AlAT i AspAT jest niższy niż 10-krotny
powyżej górnej granicy normy
o W autoimmunologicznym zapaleniu wątroby aktywnośd AlAT i AspAT zwykle fluktuują
w granicach 100-1000 U/l
o W marskości aktywnośd AlAT i AspAT najczęściej jest nieznacznie podwyższona (np. 1,5-5 razy
powyżej g.g.n.), ale aminotransferazy w normie nie wykluczają marskości wątroby
o Przewlekłe, niewielkie podwyższenie aktywności AlAT i AspAT u pacjentów bezobjawowych
może byd spowodowane najczęściej: nadużywaniem alkoholu, stosowanymi lekami,
stłuszczeniem wątroby (niealkoholowym)
Analityka ogólna, dwiczenia dla studentów III OAM
2010/2011
Wydział Farmaceutyczny UJCM, Zakład Diagnostyki Medycznej
6
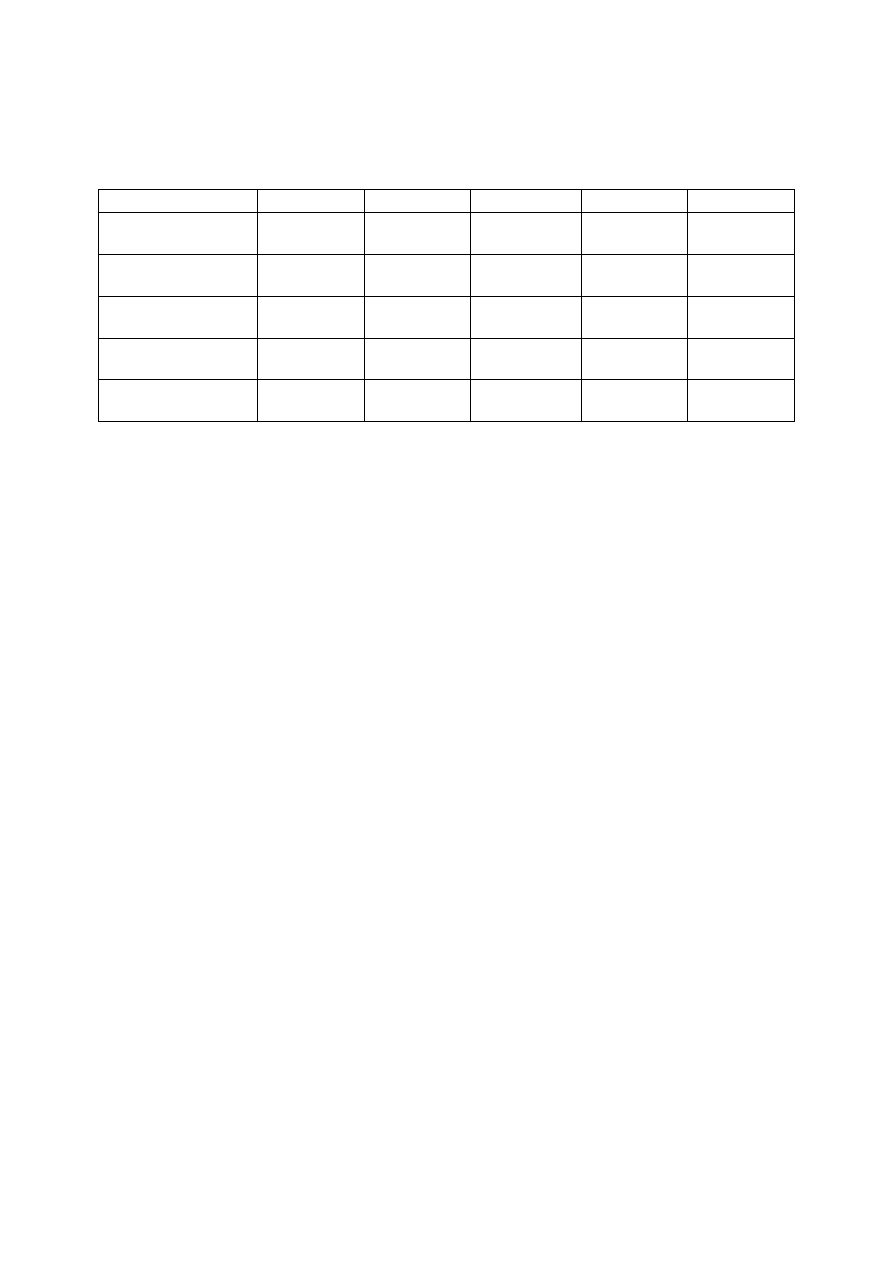
4. Diagnostyka enzymatyczna chorób wątroby – porównanie:
5. Przykładowe enzymy oznaczane w moczu:
Amylaza
NGAL - lipokaina związana z żelatynazą neutrofili
Nowy wczesny marker ostrej niewydolności nerek, może byd oznaczany we krwi i w
moczu, przy czym w moczu notuje się wyższy wzrost stężenia (>100-krotny) niż w osoczu
(ok. 10-krotny).
Ekspresja NGAL w komórkach cewek nerkowych znacznie wzrasta w związku z ich
niedokrwieniem lub uszkodzeniem przez nefrotoksyny.
ABBOTT Architect – oznaczenie immunochemiluminescencyjne (CMIA)
N-acetylo-β-D – heksozoaminidaza
W moczu oznaczana jest przede wszystkim izoforma a składająca się z podjednostek
NAG jest wczesnym markerem uszkodzenia nerek oraz markerem nasilającej się
niewydolności nerek
C
HOROBY WĄTROBY
AST
ALT
AST/ALT
ALP
GGT
Ostre zapalenie
wątroby
10-20 x
10-30 x
<1
N
3 x
N
3 x
Przewlekłe zapalenie
wątroby
N
10 x
N
8 x
>1
N
3 x
N
3 x
Choroba alkoholowa
N
7 x
v N
2 x
>5
N
2 x
1-10 x
Cholestaza
wewnątrzwątrobowa
N
5 x
N
3 x
>1,5
N
7 x
N
7 x
Cholestaza
zewnątrzwątrobowa
N
3 x
N
5 x
<1,5
2-10 x
2-10 x
Wyszukiwarka
Podobne podstrony:
OAMIII cw bialka
cw enzymy
A cw 5 preparaty handlowe enzymy
protokół enzymy metab ksenobiotyki ćw 10 OAM
ćw 4 Profil podłużny cieku
biofiza cw 31
enzymy
Kinezyterapia ćw synergistyczne
Cw 1 ! komorki
Pedagogika ćw Dydaktyka
Cw 3 patologie wybrane aspekty
Cw 7 IMMUNOLOGIA TRANSPLANTACYJNA
Cw Ancyl strong
Cw 1 Zdrowie i choroba 2009
Rehabilitacja medyczna prezentacja ćw I
ćw 2b
więcej podobnych podstron