
P
o
dsta
wy
Chemii
K
w
an
to
w
ej
Molekuªy
π
-elektrono
w
e
i
mo
del
Hü
kla
orbita
l
i
molekular n
y
h
(mo
del
HMO)
Sform
uªo
w
anie
mo
delu
HMO:
Eri
h
Hü
k
el
(1932)
Rozwini
i
e
mo
delu
HMO:
C.
A.
Coulson
i
H.
C.
Longuet-Higgi
ns
(1947).
Przybli
»
eni
e
LCA
O
MO
(MO)
ψ
k
=
M
X
r
=1
χ
r
c
r,k
(LCA
O)
.
(1)
Charakteryst
yk
a
molekuªy
π
-elektrono
w
ej:
•
Molekuªa
zbudo
w
ana
jest
z
M
atomó
w
I
I
okresu
(B,C,N,O,F),
oraz
p
ewnej
lizb
y
atomó
w
H
(w
mo
delu
HMO
atom
y
H
s¡
p
omija
ne).
•
W
szystk
ie
atom
y
le»¡
w
jednej
pªaszzy¹
n
ie
(np.
XY
).
Pªaszzyz
n
a
ta
jest
zarazem
pªaszzyzn¡
symetrii
rozw
a»anej
molekuªy
.
•
Ze
wzgldu
na
ob
eno±¢
pªaszzyz
n
y
symetrii
rozró»niam
y
dw
a
t
yp
y
symetrii
or-
bitali
atomo
wy
h
(A
O)
i
molekular
n
y
h
(MO):
σ
A
O
i
σ
MO:
symetryzne
ze
wzgldu
na
o
dbiie
w
pªaszz.
XY
,
π
A
O
i
π
MO:
an
t
ysymetryzne
ze
wzgldu
na
o
dbiie
w
pªaszz.
XY
.
•
W
rama
h
k
onstruk
ji
LCA
O
MO
orbital
e
σ
MO
t
w
orzym
y
wyª¡znie
jak
o
k
om
binaje
lini
o
w
e
orbital
i
σ
A
O,
a
orbital
e
π
MO
wyª¡znie
jak
o
k
om
binaje
lini
o
w
e
orbital
i
π
A
O.
Uw
aga:
orbital
e
σ
A
O
i
π
A
O
s¡
funk
jami
rzezyw
ist
ymi,
ale
utrzymane
z
ni
h
orbital
e
molekular
ne
mog¡
b
y¢
funk
jmi
zesp
olon
ymi
(gdy»
wsp
óªzyn
n
iki
lini
o
w
e
c
r,k
mog¡
w
ogólno±i
b
y¢
lizbami
zesp
olon
ymi).
•
W
molekule
zbudo
w
anej
z
M
atomó
w
I
I
okresu
orbital
e
π
A
O
to
orbital
e
atomo
w
e
2
p
z
t
y
h
atomó
w.
Ka»dy
atom
dostarza
jednego
orbital
u
2
p
z
,
w
sumie
jest
wi
do
dysp
ozy
ji
M
t
y
h
orbital
i
.
Z
orbital
i
t
y
h
ut
w
orzy¢
wi
mo»na
dokªadnie
M
orbital
i
π
MO.
•
P
ary
atomó
w
p
oª¡zone
s¡
p
o
jedynzy
mi
wi¡zaniam
i
hemizn
ymi
t
ypu
σ
,
ut
w
orzo-
n
ymi
przez
orbital
e
zh
ybrydy
z
o
w
ane
sp
2
pary
s¡siaduj¡y
h
atomó
w.
Je±li
w
t
ym
szkieleie
wi¡za«
σ
nie
ma
napr»e«,
to
k
¡t
y
midzy
wi¡zaniam
i
s¡
bardzo
bliskie
120
o
.
Przybli
»
eni
e
π
-elektrono
w
e
W
rama
h
tego
przybli»enia
rozw
a»a
si
t
ylk
o
te
elektron
y
w
molekule,
które
s¡
opisane
orbital
a
m
i
t
ypu
π
.
P
osªugujem
y
si
zsto
skrótem
m
y±lo
wym,
nazyw
a
j¡
te
elektron
y
elektronami
π
.
Zakªada
si,
»e
elektron
y
π
p
orusza
j¡
si
w
p
ewn
ym
efekt
ywn
y
m
p
olu
wyt
w
orzon
ym
przez
j¡dra
atomo
w
e
oraz
elektron
y
opisane
orbital
a
m
i
σ
.
W
mo
delu
HMO
zakªada
si
do
datk
o
w
o,
»e
elektron
y
π
nie
o
dziaªuj¡
ze
sob¡,
zyli
za
ho
wuj¡
si
jak
z¡stki
niezale»ne.
1

Orbitale
atomo
w
e
ortogonalizo
w
ane
Orbital
e
atomo
w
e
nale»¡e
do
atomó
w
umieszzon
y
h
w
ró»n
y
h
punkta
h
przestrzen i
nie
s¡
ortogonalne.
Inazej:
maierz
aªek
nakryw
ania
w
bazie
A
O,
o
elemen
ta
h
hχ
r
|χ
s
i = s
r,s
,
(2)
jest
ró»na
o
d
maierzy
jednostk
o
w
ej.
Np.
w
molekule
b
enzen
u
orbital
e
t
ypu
2
p
z
s¡siedni
h
atomó
w
w
gla
(orbital
e
π
A
O)
ma
j¡
aªki
nakryw
ania
s
r,s
≈ 0.3
.
Zbiór
nieortogonal
n
y
h
orbital
i
atomo
wy
h
mo»na
jednak
p
o
dda¢
p
ewnej
transformaji,
zw
anej
symetryzn¡
ortogonalizaj¡
(Lö
wdin,
1950).
Przy
p
omo
y
tej
transformaji
M
nieortogonal
n
y
h
π
A
O
t
ypu
2
p
z
przeksz
taªa
si
w
M
tzw.
ortogonali
zow
an
y
h
orbital
i
atomo
wy
h
(
π
O
A
O):
{χ
1
, χ
2
, . . . , χ
M
} ,
(3)
które
sp
eªnia
j¡
w
arunki
ortonormal
no
±i
:
hχ
r
|χ
s
i = δ
r,s
.
(4)
Symetryzna
ortogonali
zaja
zap
ewnia,
»e
otrzymane
π
O
A
O
s¡
w
na
jwy»szy
m
mo»li
wym
stopniu
p
o
dobne
do
wyj±io
wy
h
π
A
O.
Uw
aga:
zaró
wno
π
A
O,
jak
i
π
O
A
O
s¡
funk
jami
rzezyw
ist
ymi:
χ
∗
r
= χ
r
.
Maierz
top
ologi
z
na
molekuªy
π
-elektrono
w
ej
Maierz
top
ologi
zna
t
(wymiaru
M
× M
):
t
r,s
= t
s,r
:=
0 ,
dla
r
= s ,
1 ,
dla
r
i
s
p
oª¡zon
y
h
wi¡z.
σ ,
0 ,
w
inn
y
h
wypadk
a
h
.
(5)
Jest
to
maierz
symetryzna:
t
= t
T
.
W
arunek
na
liz
b
na
jbli»szy
h
s¡siadó
w
danego
atom
u
r
:
1 ¬
M
X
s
t
r,s
¬ 3 .
(6)
Efekt
ywn
y
hamilt
oni
an
jedno
elektrono
wy
w
mo
delu
HMO
Efekt
ywn
y
hamil
t
o
ni
a
n
ˆh
eff
opisuj¡y
ukªad
elektronó
w
π
w
molekule
okre±lon
y
jest
w
mo
delu
HMO
w
sp
osób
nieja
wn
y
,
p
oprzez
k
onstruk
j
maierzy
op
eratora
ˆh
eff
w
bazie
orbital
i
π
O
A
O:
h
r,s
= h
s,r
:= hχ
r
|ˆh
eff
χ
s
i =
(
α
r
,
dla
r
= s ,
β
rs
,
dla
r
6= s .
(7)
Maierz
h
jest
maierz¡
symetryzn¡:
h
= h
T
.
Mo
del
HMO
jak
o
protot
yp
meto
d
p
óªemiryz
n
y
h
hemii
kw
an
to
w
ej
W
mo
delu
HMO
wpro
w
adza
si
parametry
empiryzne
:
aªki
kulom
b
o
wskie:
α
r
= α
[r]
,
(8)
aªki
rezonanso
w
e:
β
rs
= β
sr
= t
r,s
β
[rs]
.
(9)
gdzie:
[r]
oznaza
t
yp
atom
u
r
(np.
C,
N,
O),
[rs]
oznaza
t
yp
wi¡zania
rs
(np.
CC,
CN,
CO).
2

K
onstruk
ja
LCA
O
orbitali
molekularn
y
h
π
MO:
ψ
k
=
M
X
r
=1
χ
r
c
r,k
,
(10)
hψ
k
|ψ
l
i = δ
k,l
,
(11)
gdzie
k
= 1, 2, . . . , M
.
Energie
orbitalne
elektronó
w
π
deniujem
y
jak
o:
e
k
:= hψ
k
|ˆh
eff
ψ
k
i .
(12)
Numeraja
energii
orbital
n
y
h
(a
st¡d
π
MO)
zazwyz
a
j
stosujem
y
up
orz¡dk
o
w
anie
nie-
malej¡e:
e
1
¬ e
2
¬ . . . ¬ e
M
.
(13)
Lizb
y
obsadze«
π
MO:
n
π
k
= 2, 1, 0 .
(14)
W
arto±i
te
o
dp
o
wiada
j¡
sp
eªnieniu
zak
azu
P
auliego
.
Ró»ne
zbiory
w
arto±i
{n
π
k
}
ha-
rakteryzuj¡
ró»ne
stan
y
π
-elektrono
w
e
molekuªy
.
UW
A
GA:
w
mo
delu
HMO
zakªada
si,
»e
wszys
tk
ie
π
MO
dla
który
h
n
π
k
= 1
o
dp
o
wiada
j¡
obsadzon
ym
spinorbital
o
m
o
taki
h
sam
y
h
funk
ja
h
spino
wy
h
(np.
α
).
Oznaza
to,
»e
rozw
a»am
y
t
ylk
o
takie
(ot
w
artop
o
wªok
o
w
e)
stan
y
molekuªy
,
w
który
h
niesparo
w
ane
elek-
tron
y
ma
j¡
spin
y
ró
wnolegªe.
Caªk
o
wita
liz
ba
elektronó
w
π
w
dan
ym
stanie
molekuªy:
M
X
k
=1
n
π
k
= N
π
.
(15)
Caªk
o
wita
energia
elektronó
w
π
w
dan
ym
stanie
molekuªy:
E
π
:=
M
X
k
=1
n
π
k
e
k
.
(16)
W
a»n
y
przypadek
szzególn
y:
Stan
p
o
dsta
w
o
wy
molekuªy
zamknitop
o
wªok
o
w
ej,
gdzie
N
π
= 2m
i
mam
y
n
π
k
= 2
dla
k
= 1, 2. . . . , m ;
n
π
k
= 0
dla
k
= m + 1, . . . , M .
(17)
Wtedy
ró
wn.
(16)
zapisa¢
mo»na
w
p
ostai
E
π
= 2
m
X
k
=1
e
k
.
(18)
3

W
yznazanie
opt
ymaln
y
h
orbitali
molekularn
y
h:
meto
da
w
ariayjna
Ritza.
Rozw
a»am
y
k
onstruk
j
LCA
O
MO,
patrz
ró
wn.
(10),
i
zakªadam
y
sp
eªnienie
w
arun-
k
ó
w
ortonormal
no±i
(11).
Opt
ymali
zaja
orbital
i
molekularn
y
h
oparta
jest
na
w
arianie
meto
dy
wariayjnej
zw
anej
meto
d¡
Ritza.
Odp
o
wiednie
w
arunki
matemat
yzne:
dla
k
a»dego
k
= 1, 2, . . . , M
wyra»enie
hψ
k
|ˆh
eff
ψ
k
i − (hψ
k
|ψ
k
i − 1) e
k
,
(19)
osi¡
ga
warto±¢
ekstr
emaln¡
ze
wzgldu
na
dowolne
zmiany
wsp
ólzynnik
ó
w
LCA
O
c
r,k
i
parametru
e
k
.
Sens
opt
ymaliz
aji
orbitali
molekularn
y
h
w
meto
dzie
Ritza:
dla
na
jni»szego
p
oziom
u
energet
yz
n
e
go
sp
eªnion
y
jest
w
arunek
w
ariayjn
y
e
1
= minimum .
(20)
Wªasno±¢
ta
przenosi
si
tak»e
na
wy»sz
e
p
oziom
y
energet
yz n
e
:
e
2
osi¡
ga
w
arto±¢
mini
-
maln¡
dla
wszys
tk
i
h
stanó
w
p
ostai
(10),
ortogonaln
y
h
do
orbital
u
ψ
1
,
itd.
Naªo»enie
w
arunk
ó
w
(19)
pro
w
adzi
do
r
ówna«
maierzowyh
meto
dy
R
itza ,
zapisan
y
h
p
oni»ej
w
p
ostai
ogólnej:
hc
= sce ,
(21)
c
†
sc
= I ,
(22)
gdzie
wystpu j¡
maierze
kw
adrato
w
e
M
× M
:
h
= h
†
=
h
1,1
h
1,2
· · · h
1,M
h
2,1
h
2,2
· · · h
2,M
.
.
.
.
.
.
.
.
.
.
.
.
h
M,
1
h
M,
2
· · · h
M,M
,
s
= s
†
=
s
1,1
s
1,2
· · · s
1,M
s
2,1
s
2,2
· · · s
2,M
.
.
.
.
.
.
.
.
.
.
.
.
s
M,
1
s
M,
2
· · · s
M,M
,
(23)
c
=
c
1,1
c
1,2
· · · c
1,M
c
2,1
c
2,2
· · · c
2,M
.
.
.
.
.
.
.
.
.
.
.
.
c
M,
1
c
M,
2
· · · c
M,M
,
c
†
=
c
∗
1,1
c
∗
2,1
· · · c
∗
M,
1
c
∗
1,2
c
∗
2,2
· · · c
∗
M,
2
.
.
.
.
.
.
.
.
.
.
.
.
c
∗
1,M
c
∗
2,M
· · · c
∗
M,M
,
(24)
e
=
e
1
0
· · ·
0
0
e
2
· · ·
0
.
.
.
.
.
.
.
.
.
.
.
.
0
0
· · · e
M
,
I
=
1 0 · · · 0
0 1 · · · 0
.
.
.
.
.
.
.
.
.
.
.
.
0 0 · · · 1
.
(25)
Uw
aga:
W
mo
delu
HMO
p
o
ja
wia
j¡
sie
p
ewne
uproszzen
ia:
•
Maierz
hamil
t
o
ni
a
n
u
efekt
ywn e
go
h
jest
maierz¡
hermito
wsk
¡
i
rzezyw
ist¡,
patrz
ró
wn.
(7),
a
wi
jest
maierz¡
symetryzn¡:
h
= h
†
= h
T
.
•
K
orzystam
y
z
bazy
ortogonali
zo
w
an
y
h
orbital
i
atomo
wy
h,
π
O
A
O,
patrz
ró
wn.
(4),
a
wi
maierz
aªek
nakryw
ania
ró
wna
jest
maierzy
jednostk
o
w
ej:
s
= I
.
4

•
Maierz
wsp
óªzyn n
ik
ó
w
LCA
O
jest
wtedy
maierz¡
unitarn¡:
c
†
= c
−1
.
•
Co
wieej,
w
zastoso
w
aniu
do
sk
o«zon
y
h
molekuª
mo»na
zaªo»y¢,
»e
wsp
óªzyn
n
iki
LCA
O
s¡
lizbami
rzezyw
ist
ymi
(patrz
ni»ej);
wtedy
maierz
wsp
óªzyn n
ik
ó
w
LCA
O
jest
maierz¡
ortogonaln¡:
c
T
= c
−1
.
Ró
wnania
maierzo
w
e
meto
dy
Ritza
w
mo
delu
HMO
mo»na
wi
zapisa¢
w
p
ostai:
hc
= ce ,
(26)
c
T
c
= I .
(27)
Energie
orbitali
molekularn
y
h
(energie
orbitalne
HMO),
zdenio
w
ane
w
ró
wn.
(12)
i
up
orz¡dk
o
w
ane
w
edªug
s
hematu
(13),
wyznazy
¢
mo»na
jak
o
pierwiastki
tzw.
wielom
i
a-
n
u
harakteryst
yznego
(stopnia
M
)
zmiennej
rze
zywistej
e
:
W
(M )
(e) = det(h − eI) ,
(28)
gdy»
rozwi¡zania
ró
wn.
(26)
i
(27)
sp
eªnia¢
m
usz¡
w
arunek
W
(M )
(e
k
) = 0 .
(29)
Zna
j¡
w
arto±¢
energii
orbital
nej
e
k
,
z
ªat
w
o±i¡
zna
jdujem
y
wsp
óªzyn n
iki
LCA
O
c
r,k
o
dp
o
wiedniego
orbital
u
molekularnego
[t
w
orz¡
one
w
ektor
k
olumno
wy
c
k
b
d¡y
k
-t¡
k
o-
lumn¡
maierzy
maierzy
c
,
patrz
ró
wn.
(24)℄.
Rozwi¡zujem
y
w
t
ym
elu
ukªad
r
ówna«
liniowyh
je
dnor
o
dnyh
(h − e
k
I
)c
k
= 0 ,
(30)
gdzie
0
jest
w
ektorem
k
olumno
wym
zero
wym,
a
niewiadome
c
r,k
t
w
orz¡e
w
ektor
c
k
sp
eª-
nia¢
m
usz¡
w
arunek
unormo
w
ania
M
X
r
=1
c
2
k
= 1 ,
(31)
wynik
a
j¡y
z
ró
wnania
maierzo
w
ego
(27).
W
mo
delu
HMO
maierz
h
jest
rzezyw
ista,
patrz
deniaja
(7),
st¡d
rozwi¡zania
ró
wna«
lini
o
wy
h
(30)
tak»e
s¡
lizbami
rzezyw
i-
st
ymi
(a
wi
maierz
c
jest
maierz¡
rzezyw
ist¡).
Ukªad
ró
wna«
maierzo
wy
h
(26)
i
(27)
zapisa¢
mo»na
tak»e
w
ró
wno
w
a»nej
p
ostai:
c
T
hc
= e ,
(32)
c
T
c
= I .
(33)
Ozanaza
to,
»e
(diagonal
n¡
)
maierz
energi
orbital
n
y
h
e
otrzyma¢
mo»na
przepro
w
a-
dza
j¡
diagonalizaj
maierzy
hamil
t
o
ni
a
n
u
efekt
ywn e
go
h
przy
p
omo
y
maierzy
or-
togonalnej
c
.
T
o
sform
uªo
w
anie
jest
p
o
dsta
w
¡
algorytmó
w
k
omputero
wy
h
sªu»¡y
h
do
zna
jdo
w
ania
maierzy
e
i
c
.
P
o
dsumo
wuj¡:
w
wyniku
rozwi¡zania
ró
wna«
maierzo
wy
h
(26)
i
(27),
zy
ró
w-
no
w
a»n
y
h
im
ró
wna«
(32)
i
(33),
otrzym
ujem
y
wsp
óªzyn n
iki
lini
o
w
e
c
r,k
opt
ymaln
y
h
orbital
i
molekularn
y
h
przedsta
wion
y
h
w
p
ostai
(10).
Z
ró
wna«
maierzo
wy
h
(32)
wy-
nik
a,
»e
opt
ymalne
orbital
e
molekularne
sp
eªnia
j¡
w
arunki
hψ
k
|ˆh
eff
ψ
l
i =
(
0 ,
dla
k
6= l ,
e
k
,
dla
k
= l .
(34)
Natomia
st
ró
wnania
maierzo
w
e
(33)
o
dp
o
wiada
j¡
sp
eªnieniu
w
arunku
normali
zaji
(11)
orbital
i
molekularn
y
h:
hψ
k
|ψ
l
i = δ
k,l
.
dla
wszys
tk
i
h
par
wsk
a¹nik
ó
w
k, l
.
5
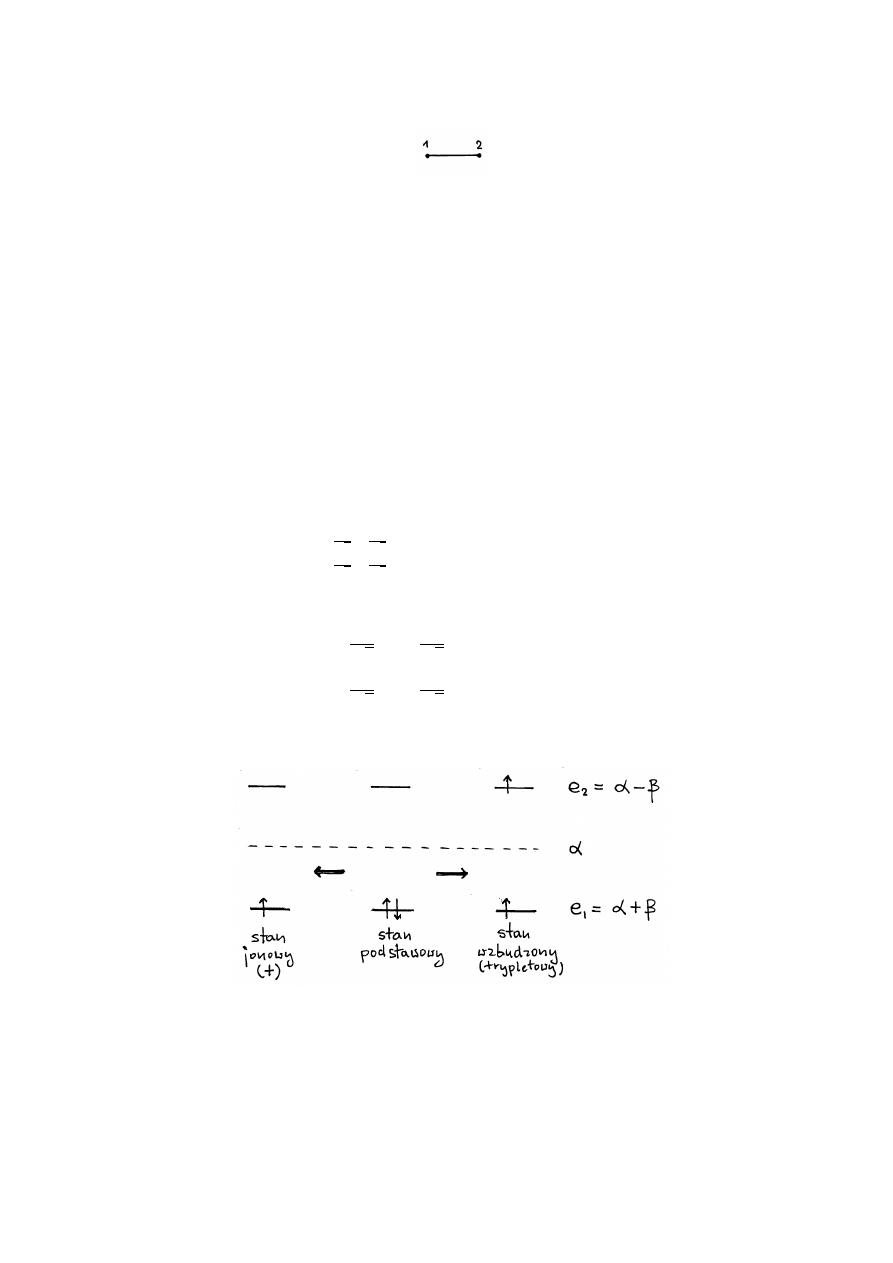
Przykªad:
molekuªa
et
ylen
u
,
C
2
H
4
.
Rysunek
1:
Et
ylen
szkielet
w
glo
wy
.
M
= 2
,
w
ob
o
jtnej
elektr.
molekule
N
π
= 2
.
Maierz
top
ologi
zna
i
maierz
hamil
t
o
ni
a
n
u
efekt
ywn e
go:
t
= t
T
=
0 1
1 0
!
,
h
= h
T
=
α β
β α
!
.
(35)
Wielom
i
a
n
harakteryst
y
z
n
y
W
(2)
(e) = det(h − eI) =
α
− e
β
β
α
− e
= (e − α)
2
− β
2
,
(36)
ma
pierwiastki
e
1
= α + β
i
e
2
= α − β
(za
ho
dzi
e
1
< e
2
).
Rozwi¡zanie
ró
wna«
maierzo
wy
h
(26),
przy
narzueniu
w
arunk
ó
w
ortonormal
no±i
(27),
da
je:
c
=
1
√
2
1
√
2
1
√
2
−1
√
2
!
,
e
=
α
+ β
0
0
α
− β
!
.
(37)
A
wi
opt
ymalne
π
MO
et
ylen
u
i
o
dp
o
wiada
j¡e
im
energie
orbital
ne
ma
j¡
p
osta¢:
ψ
1
=
1
√
2
χ
1
+
1
√
2
χ
2
,
e
1
= α + β ,
(38)
ψ
2
=
1
√
2
χ
1
−
1
√
2
χ
2
,
e
2
= α − β .
(39)
Ró»nia
energii
orbital
n
y
h:
e
2
− e
1
= −2β
Rysunek
2:
Et
ylen
stan
y
elektrono
w
e
w
mo
delu
HMO
6
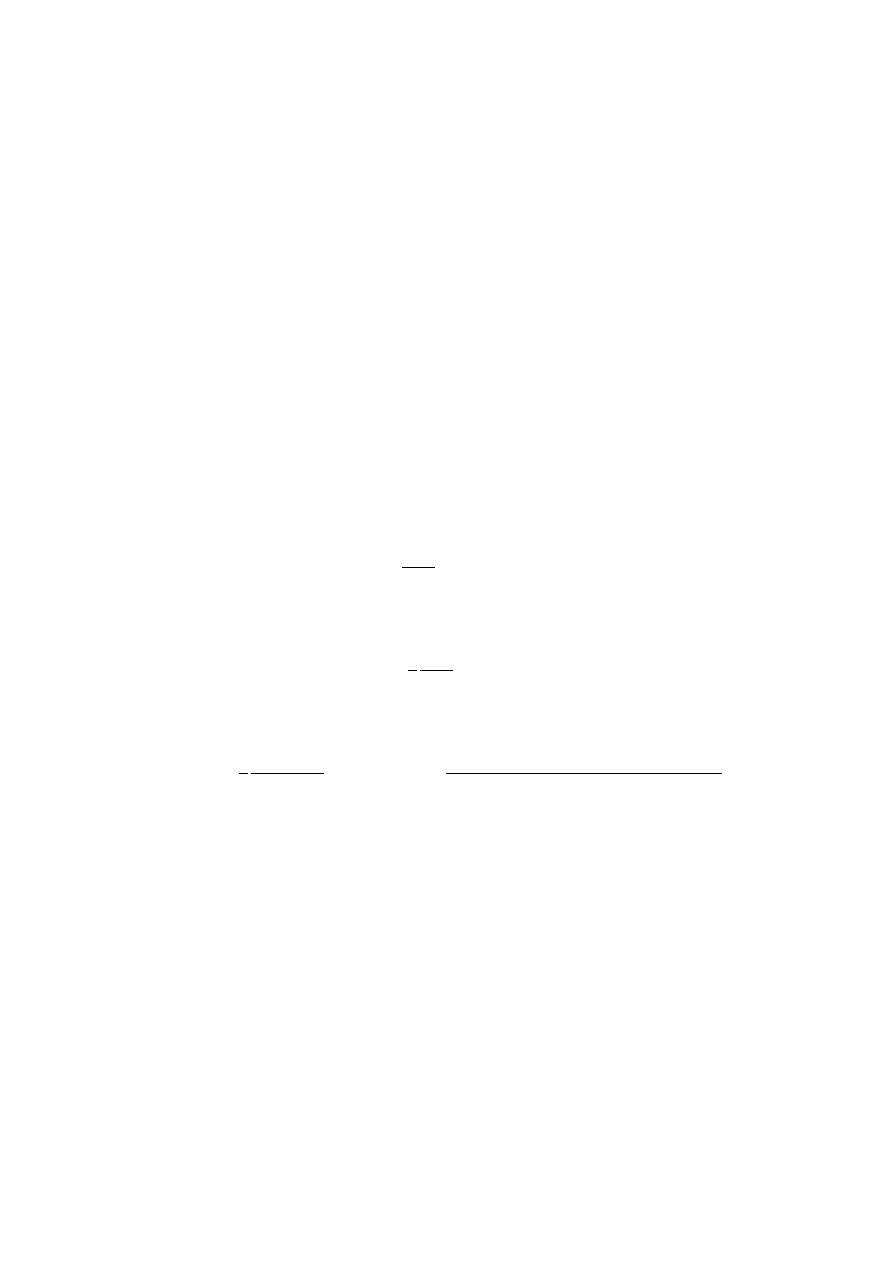
Dane
eksp
erymen
talne
dla
et
ylen
u:
Energia
jonizaji
I
= 10.5
e
V
(
≈ −e
1
).
Energia
wzbudze
n
ia
do
stan
u
trypleto
w
ego
∆E = 4.8
e
V
(
≈ e
2
− e
1
).
St¡d:
Prop
ono
w
ana
parametryzaja
mo
delu
HMO
dla
w
glo
w
o
doró
w
π
-elektrono
wy
h:
α
≡ α
C
= −8.00
e
V
,
(40)
β
≡ β
CC
= −2.50
e
V
.
(41)
Dla
et
ylen
u
otrzym
ujem
y:
Energia
jonizaji
−e
1
= 10.5
e
V
≈ I
.
Energia
wzbudze
n
ia
do
stan
u
trypleto
w
ego
e
2
− e
1
= 5.0
e
V
(
≈ ∆E
).
Energia
π
-elektrono
w
a
molekuªy
i
jej
p
o
ho
dne
Energia
π
-elektrono
w
a
molekuªy
w
mo
delu
HMO
zdenio
w
ana
jest
w
ró
wn.
(16).
P
o
ho
dne
energii
π
-elektrono
w
ej
p
o
parametra
h
mo
delu
HMO
p
ozw
ala
j¡
zdenio
w
a¢:
π
-elektrono
w
e
ªadunki
atomo
w
e:
q
r
=
∂E
π
∂α
r
=
M
X
k
=1
n
π
k
c
2
r,k
,
(42)
π
-elektrono
w
e
rzdy
wiaza«:
p
rs
= p
sr
=
1
2
∂E
π
∂β
rs
=
M
X
k
=1
n
π
k
c
r,k
c
s,k
,
(43)
π
-elektrono
w
e
p
olaryzo
w
alno±i
wi¡zanie-wi¡zani
e:
π
rs,vw
=
1
2
∂
2
E
π
∂β
rs
∂β
vw
=
M
X
k<l
(n
π
l
− n
π
k
)
(c
r,k
c
s,l
+ c
s,k
c
r,l
)(c
v,l
c
w,k
+ c
w,l
c
v,k
)
e
l
− e
k
.
(44)
Mo»na
wyk
aza¢,
»e
energia
π
-elektrono
w
a
molekuªy
w
mo
delu
HMO
mo»e
b
y¢
wyra»ona
przez
q
r
i
p
rs
:
E
π
=
M
X
r
=1
q
r
α
r
+ 2
M
X
r<s
p
rs
β
rs
.
(45)
Zmienno±
ró
wno
w
ago
wy
h
dªugo±i
wi¡za«
w
molekuªa
h
π
-elektrono
wy
h
W
zór
Coulsona-Goªbi
ewskiego:
R
e
rs
= R
o
[rs]
− x
[rs]
p
rs
,
(46)
gdzie:
R
o
[rs]
jest
dªugo±i¡
wi¡zania
p
o
jedynzego
(
p
rs
= 0
),
R
o
[rs]
− x
[rs]
jest
dªugo±i¡
wi¡zania
p
o
dw
ó
jnego
(
p
rs
= 1
)
w
ukªadzie
π
-elektrono
wym.
7

P
arametryzaja
dla
w
glo
w
o
doró
w
π
-elektrono
wy
h:
R
o
≡ R
o
[CC]
= 1.523
Å
,
(47)
x
≡ x
[CC]
= 0.189
Å
.
(48)
Wglo
w
o
dory
π
-elektrono
w
e
Wglo
w
o
dory
π
-elektrono
w
e
to
obszerna
i
zró»nio
w
ana
p
o
d
wzgldem
wªasno±i
grupa
zwi¡zk
ó
w:
o
d
et
ylen
u,
butadien
u,
itp.,
przez
b
enzen
i
p
oliykli
zne
w
glo
w
o
dory
aroma-
t
yzne
(p
oliyli
aromati
h
ydro
arb
ons
P
AH's),
p
o
fulleren
y
,
nanorurki
w
glo
w
e,
oraz
ukªady
rozi¡
gªe:
p
olia
et
ylen
(i
inne
p
olim
ery
π
-elektrono
w
e)
i
grafen
(zyli
pªaszzyz
n
grato
w
¡).
W
mo
delu
HMO
hamil
t
o
ni
a
n
efekt
ywn
y
w
glo
w
o
doru
π
-elektrono
w
ego
mo»na
zapisa
w
p
ostai
h
= αI + βt = αI − |β|t ,
(49)
gdzie
parametry
α
i
β
o
dp
o
wiada
j¡
ró
wn.
(40),
a
t
jest
maierz¡
top
ologi
zn¡
w
glo
w
o-
dru,
patrz
ró
wn.
(5).
Do
datnia
wielk
o±¢
|β|
mo»e
sªu»y¢
jak
o
je
dnostka
ener
gii
w
mo
delu
HMO
(gdy
nie
hem
y
deklaro
w
a¢
k
onkretnej
w
arto±i
tego
parametru).
W
ygo
dnie
jest
wpro
w
adzi¢
b
ezwymiar
owy
parametr
energii:
ε
:=
e
− α
|β|
,
(50)
p
ozw
ala
j¡y
wyrazi¢
do
w
oln¡
energi
orbital
n¡
e
w
p
ostai
e
= α + ε|β| .
(51)
Wielom
i
a
n
harakteryst
y
z
n
y
(28)
w
glo
w
o
doru
π
-elektrono
w
ego
mo»na
teraz
zapisa
w
p
ostai
W
(M )
(e) = det(h − eI) = det [(α − e)I − |β|t] = (−|β|)
M
det (εI + t) .
(52)
Otrzym
ujem
y
przeksztaª
ony
wielomian
har
akterystyzny
zmiennej
ε
,
w
(M )
(ε) := det (εI + t) ,
(53)
w
p
ostai
wyznaz n
ik
a
maierzy
o
bardzo
prostej
strukturze
(k
a»da
lizba
0
na
diagonal
i
maierzy
top
ologi
znej
zastapiona
zostaªa
przez
zmienn¡
ε
).
Energie
orbital
ne
HMO
w
-
glo
w
o
doru
π
-elektrono
w
ego
mo»na
teraz
oblizy¢
zna
jduj¡
pierwiastki
przeksz
taªone
go
wielomi
a
n
u
harakteryst
y
z
n
e
go:
w
(M )
(ε
k
) = 0 ,
(54)
k
= 1, 2, . . . , M
;
ze
wzoru
(51)
otrzym
ujem
y:
e
k
= α + ε
k
|β| .
(55)
Zna
j¡
w
arto±¢
energii
orbital
nej
e
k
,
z
ªat
w
o±i¡
zna
jdujem
y
wsp
óªzyn n
iki
LCA
O
c
r,k
o
dp
o
wiedniego
orbital
u
molekularnego,
patrz
ró
wn.
(30)
i
(31),
przy
zym
ukªad
ró
wna«
lini
o
wy
h
jednoro
dn
y
h
(30
mo»em
y
teraz,
k
orzysta
j¡
z
ró
wn.
(49)
i
(55),
przeksz
taªi¢
do
p
ostai
(t + ε
k
I
)c
k
= 0 .
(56)
8
Ró
wn.
(53-56)
ilustruj¡
in
teresuj¡¡
wªasno±¢
mo
delu
HMO
w
zastoso
w
aniu
do
w
glo
w
o-
doró
w
π
-elektrono
wy
h:
ukªad
energii
orbital
n
y
h
i
maierz
wsp
óªzyn
n
ik
ó
w
LCA
O
zale»¡
wyª¡znie
o
d
maierzy
top
ologi
znej
danego
w
glo
w
o
doru.
Mo
del
HMO
jest
wi
top
olo-
gizn
ym
mo
delem
orbitali
molekularn
y
h
w
glo
w
o
doró
w
π
-elektrono
wy
h .
Wglo
w
o
dory
π
-elektrono
w
e
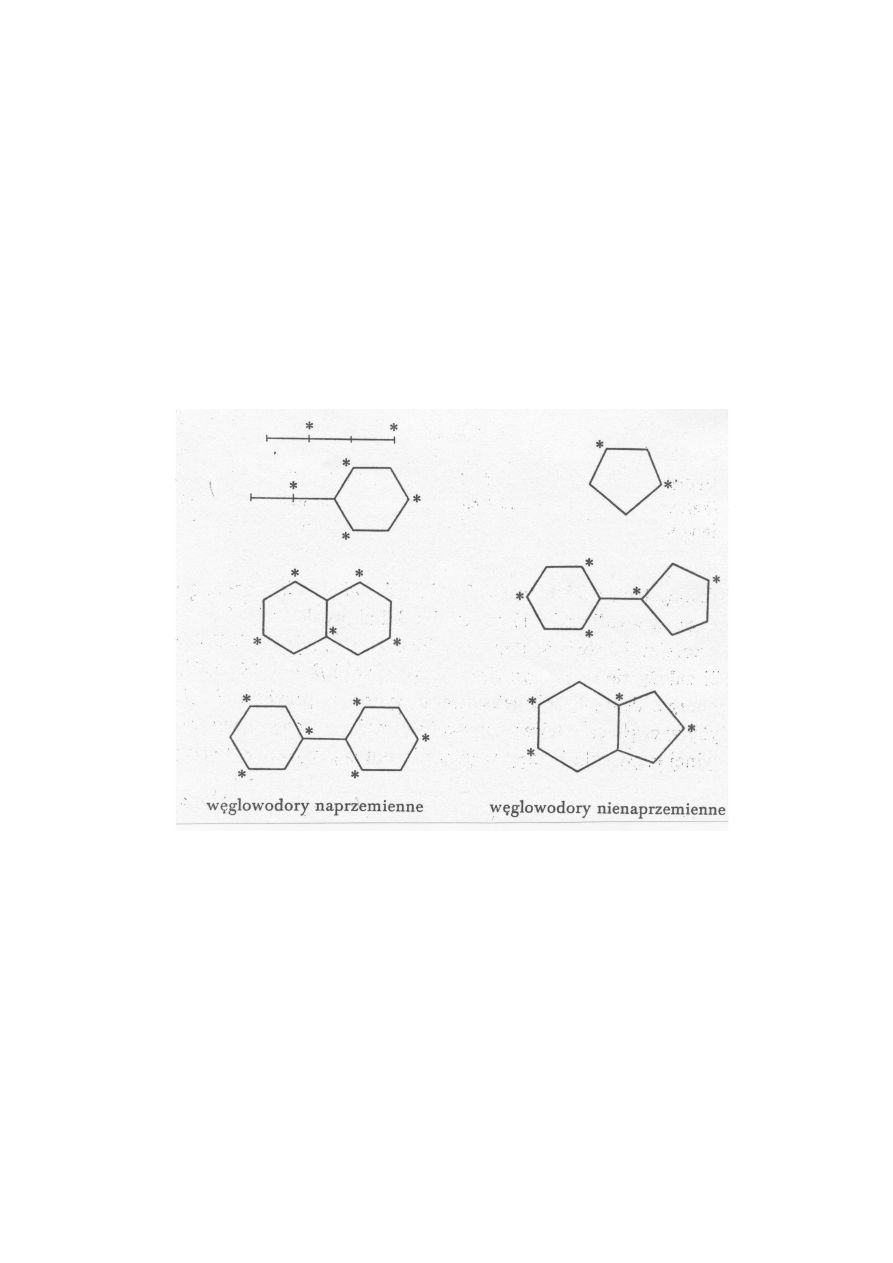
naprzemienne
i
nienaprzemienne
W
w
glo
w
o
dorze
π
-elektrono
wym
atom
y
w
gla
próbujem
y
p
o
dzieli¢
na
dw
a
p
o
dzbio-
ry:
atom
y
gwiazdk
o
w
ane
i
atom
y
niegwiazdk
o
w
ane.
T
e
dw
a
p
o
dzbiory
ma
j¡
mie¢
na-
stpuj¡¡
wªasno±:
»aden
atom
danego
p
o
dzbioru
nie
jest
na
jbli»szym
s¡siadem
atom
u
z
tego
samego
p
o
dzbioru
(zyli
atom
y
gwiazdk
o
w
ane
mog¡
s¡siado
w
a¢
t
ylk
o
z
atoma-
mi
niegwiazdk
o
w
an
ymi
)
.
Je±li
tak
a
op
eraja
gwiazdk
o
w
ania
atomó
w
si
p
o
wiedzie,
to
rozw
a»an
y
w
glo
w
o
dór
π
-elektrono
wy
nazyw
am
y
w
glo
w
o
dorem
naprzemienn
ym;
w
przeiwn
ym
razie
mam
y
do
zynienia
z
w
glo
w
o
dorem
nienaprzemienn
ym.
Przykªady
obu
t
yp
ó
w
w
glo
w
o
doró
w
p
ok
azane
s¡
na
p
oni»szym
rysunku:
Rysunek
3:
Wglo
w
o
dory
π
-elektrono
w
e
naprzemienne
i
nienaprzemienne
Ok
azuje
si,
»e
w
arunkiem
wystarza
j¡ym,
b
y
dan
y
w
glo
w
o
dór
b
yª
naprzemienn
y
,
jest
brak
pier±ieni
o
nieparzystej
lizbie
atomó
w
w
gla
(w
glo
w
o
dory
b
ez
pier±ieni
s¡
wi
za
wsze
naprzemienne!).
Naprzemienno±¢
jest
wªasno±i¡
top
ologi
zn¡
wynik
a
z
wªasno±i
maierzy
top
ologi
znej
t
rozw
a»anego
w
glo
w
o
doru
(i
jest
niezale»na
o
d
symetrii
molekuªy
lub
jej
braku).
Lizb
y
atomó
w
gwiazdk
o
w
an
y
h
M
∗
i
niegwiazdk
o
w
an
y
h
M
o
sp
eªnia
j¡
zale»no±i
M
∗
+ M
o
= M ,
(57)
M
o
− M
∗
= ∆M
∗
0 .
(58)
(przyjm
uje
si
tak
¡
zasad
gwiazdk
o
w
ania,
b
y
atomó
w
gwiazdk
o
w
an
y
h
b
yªo
nie
wieej
ni»
niegwiazdk
o
w
an
y
h).
9

Ok
azuje
si,
»e
w
glo
w
o
dory
naprzemienne
ma
j¡
p
ewne
harakteryst
y
z
n
e
wªasno±i:
•
Pierwiastki
wielomi
a
n
u
harakteryst
y
z
n
e
go
(53)
wystpuj¡
w
para
h:
ε
k
= −ε
M
−k
,
(59)
gdzie
zakªadam
y
up
orzadk
o
w
anie
takie
jak
w
s
hemaie
(13);
pierwiastki
zero
w
e
ε
k
=
0
mog¡
wystp
o
w
a¢
p
o
jedynzo.
Energie
orbital
ne
(55)
s¡
wi
uªo»one
symetryznie
wzgldem
energii
α
.
•
Je±li
lizb
y
atomó
w
gwiazdk
o
w
an
y
h
i
niegwiazdk
o
w
an
y
h
s¡
ró»ne,
zyli
w
ró
wn.
(58)
mam
y
∆N
∗
>
0
,
to
jest
nie
mniej
ni»
∆N
∗
zero
wy
h
w
arto±i
wielomi
a
n
u
harakte-
ryst
yzn
e
go
(53):
ε
k
= 0
dla
k
= M
∗
+ 1 , . . . , M
∗
+ ∆M
∗
,
(60)
którym
o
dp
o
wiada
j¡
w
arto±i
energii
orbital
n
y
h
e
k
= α
.
W
molekuªa
h
o
nieparzy-
stej
lizbie
atomó
w
w
gla
∆N
∗
1
,
a
wi
wystpuje
o
na
jmniej
jeden
pierwiastek
zero
wy
.
•
W
stanie
p
o
dsta
w
o
wym
ob
o
jtnej
elektryznie
molekuªy
(
N
π
= M
)
atomo
w
e
ªadunki
π
-elektrono
w
e
na
wszys
tk
i
h
atoma
h
w
gla
s¡
iden
t
yzne
i
ró
wne
q
k
= 1 .
(61)
Nale»y
wi
o
zekiw
a¢,
ze
takie
molekuªy
,
na
w
et
gdy
symetria
na
to
p
ozw
ala,
b
d¡
prakt
yznie
p
ozba
wione
momen
tu
dip
olo
w
ego
(o
p
ot
wierdza
eksp
ery
men
t
i
oblize-
nia
zaa
w
anso
w
an
ymi
meto
dami
hemii
kw
an
to
w
ej).
10
Wyszukiwarka
Podobne podstrony:
MatPom 12
wykład 12 pamięć
Figures for chapter 12
Mechanika techniczna(12)
Socjologia wyklad 12 Organizacja i zarzadzanie
CALC1 L 11 12 Differenial Equations
zaaw wyk ad5a 11 12
budzet ue 11 12
zapotrzebowanie ustroju na skladniki odzywcze 12 01 2009 kurs dla pielegniarek (2)
Stomatologia czesc wykl 12
Etyka 12
RI 12 2010 wspolczesne koncepcje
podst gospod grunt s 6 w 12
Wykład 12(3)
więcej podobnych podstron