
1
Podstawy toksykologii klinicznej
1.Epidemiologia ostrych zatruć
• w Polsce ostre zatrucia wymagające
leczenia szpitalnego - 40 tys./rok
• 5% ofiar zatruć wymaga hospitalizacji
• Śmiertelność wśród hospitalizowanych
1-2% + kilka tysięcy zgonów na
miejscu wypadku
• Śmiertelne zatrucia – najczęściej
dorośli, częściej samobójcze niż
przypadkowe
• dzieci < 6 r.ż. → > 50% zatruć, ale
tylko 3% zgonów
Najczęstsze drogi narażenia:
• skórna – 87%
• doustna – 74%
• narażenie narządu wzroku – 6%
• wziewna – 5%
• ukąszenia i użądlenia – 3%
• iniekcje pozajelitowe – 0,3%
Najczęściej zatrucia lekami p-bólowymi,
środkami czyszczącymi, kosmetykami
Najczęściej zgony w wyniku zatruć:
NLPZ, leki uspokajające, p-psychotyczne,
p-depresyjne, pobudzające i narkotyki,
metanol, CO
Środki farmaceutyczne są powodem 41%
zatruć ogółem i 75% ciężkich i
śmiertelnych zatruć
Najczęstsze przyczyny zatruć przypadkowych:
niewłaściwe stosowanie chemikaliów
w pracy lub w czasie zabawy
niewłaściwe oznaczenia produktów
nieczytelne etykiety
nieprawidłowa identyfikacja substancji
nieoznaczonych
samoleczenie się
błędy w dawkowaniu (lekarze,
farmaceuci, pielegniarki, rodzice
dzieci, osoby w wieku podeszłym)
nadużywanie leków lub niewłaściwe
zażywanie leków
Najczęstsze przyczyny zatruć zamierzonych:
samobójstwa
spożycie alkoholu etylowego
2. Podstawowe pojęcia w toksykologii
klinicznej
Trucizna – każda substancja, która
wprowadzona do ustroju na jakiejkolwiek
drodze, w stosunkowo małej ilości, wskutek
swych właściwości chemicznych lub
fizykochemicznych
może wywołać zmiany morfologiczne lub
czynnościowe organizmu, których wynikiem
jest choroba lub śmierć.
Urzędowy wykaz substancji niebezpiecznych
Dz.U. 05.201.1674
Substancja toksyczna: trucizna (substancja
chemiczna niebędąca produktem przemian
metabolicznych) + toksyna (substancja trująca
powstająca w procesach metabolicznych
organizmów żywych - jad węży, pająków,
toksyny roślin, grzybów, bakterii)
Ksenobiotyk – substancja chemiczna
niebędąca naturalnym składnikiem żywego
organizmu
Zatrucie – wystąpienie niekorzystnych
objawów w następstwie narażenia na
działanie
związków chemicznych.
Efekt jest to każda biologiczna zmiana w
organizmie, narządzie lub tkance
spowodowana lub związana z narażeniem na
substancję chemiczną.
Efekt szkodliwy jest to nieodwracalna zmiana
biologiczna pojawiająca się podczas lub po
zakończeniu narażenia. Jest to zaburzenie
czynnościowe lub uszkodzenie morfologiczne,
które może wpływać na wydolność całego
organizmu lub może zmniejszyć jego
sprawność w warunkach dodatkowego
obciążenia, a także może zwiększyć jego
wrażliwość na działanie innych czynników.
Stężenie krytyczne w komórce jest to stężenie,
przy którym zachodzą zmiany czynnościowe
komórki odwracalne lub nieodwracalne,
niepożądane lub szkodliwe.

2
Narządem krytycznym nazywamy narząd,
który jako pierwszy osiąga stężenie krytyczne
substancji toksycznej.
Dawka jest to ilość substancji chemicznej
podana, pobrana lub wchłonięta do organizmu
w określony sposób, warunkując brak lub
wystąpienie efektów biologicznych
wyrażonych odsetkiem organizmów
odpowiadających na te dawkę. Podawana jest
w jednostkach wagowych na masę lub
powierzchnię ciała, niekiedy dodatkowo na
dobę.
W zależności od efektów wywoływanych przez
ksenobiotyki rozróżnia się następujące rodzaje
dawek:
Dawka graniczna lub dawka progowa - ilość
substancji, która wywołuje pierwsze
spostrzegalne skutki biologiczne.
Dawka lecznicza - wykazuje działanie
farmakoterapeutyczne i nie wywołuje
istotnych zakłóceń procesów fizjologicznych.
Dawka toksyczna - ilość substancji, która po
wchłonięciu do organizmu wywołuje efekt
toksyczny.
Dawka śmiertelna - ilość substancji
powodująca śmierć organizmu po
jednorazowym podaniu.
Dawka śmiertelna medialna LD
50
-
statystycznie obliczona na podstawie wyników
badań doświadczalnych ilość substancji
chemicznej, która powoduje śmierć 50%
organizmów badanych po jej podaniu w
określony sposób.
Medialne stężenie śmiertelne LC
50
- we
wdychanym powietrzu powodujące śmierć
50% organizmów badanych podczas narażenia
drogą oddechową
Rodzaje zatruć w zależności od ich dynamiki
klinicznej
• Ostre – szybki rozwój objawów po
przyjęciu dużej, jednorazowej dawki
trucizny
• Podostre – wyraźne objawy, mniej
gwałtowne niż wskutek zatrucia
ostrego, po przyjęciu jednorazowym
lub kilkakrotnym niewielkiej dawki
trucizny
• Przewlekłe – początkowo bez objawów
klinicznych, objawy w okresie
późniejszym mają charakter efektów
przewlekłych, długotrwałe narażenie
na małe dawki, zazwyczaj ulegające
kumulacji
Rodzaje toksyczności
• Toksyczność układowa – działanie
substancji toksycznej na narządy lub
układy oddalone od miejsca
wchłaniania. Zwykle kilka narządów
docelowych.
• Toksyczność miejscowa – działanie
substancji toksycznej w miejscu
bezpośredniego kontaktu- spożycie
substancji żrących
• Toksyczność opóźniona – efekty
działania substancji toksycznej
występują po okresie utajenia - anemia
aplastyczna po chloramfenikolu po
kilku tygodniach
Klasyfikacja substancji na podstawie
klasycznych badań toksyczności ostrej
Zakres LD
50
(mg/kg masy ciała)
Droga doustna
Klasa toksyczności
LD
50
≤ 25
Bardzo toksyczna
T+
I
25 < LD
50
≤ 200
Toksyczna
T
II
200 < LD
50
≤ 2000
Szkodliwa
Xn
III
2000 < LD
50
Mało szkodliwa IV
Zatrucia – podział z uwagi na etiopatogenezę:
Zatrucia rozmyślne: samobójcze , dobrowolne
bez intencji samobójczych (demonstracyjne,
impulsywne), zbrodnicze, egzekucje
Zatrucia przypadkowe: omyłkowe, powikłania
leczenia, zatrucia związane ze skażeniem

3
środowiska bytowania (kosmetyki, środki
gospodarstwa domowego), zatrucia związane
ze skażeniem środowiska pracy – zatrucia
zawodowe.
Zatrucia w przebiegu uzależnienia od
substancji psychoaktywnych – rozmyślne?
Przypadkowe?
Odtrutka wg definicji Międzynarodowego
Programu Bezpieczeństwa Chemicznego
(IPCS):
to substancja terapeutyczna używana do
przeciwdziałania toksycznemu działaniu
określonego ksenobiotyku
Odtrutka – substancja znosząca lub
zmniejszająca toksyczność substancji
toksycznej
• specyficzna – skierowana przeciw
konkretnej substancji toksycznej (morfina –
nalokson)
• niespecyficzna – stosowana do neutralizacji
kilku substancji toksycznych (węgiel
aktywowany)
3.System nadzoru toksykologicznego w
Polsce - ośrodki toksykologiczne:
laboratorium analiz toksykologicznych +
oddział leczenia zatruć + ośrodek informacji
toksykologicznej
Ośrodek Informacji Toksykologicznej
Odddział Toksykologii i Chorób
Wewnętrznych im. Dr Wandy Błeńskiej
Szpital im. F. Raszei
ul. Mickiewicza 2, Poznań
tel. „na ratunek” 61 8476946
właściwy do kontroli zatruć na terenie
województw: wielkopolskiego,
dolnośląskiego, lubuskiego i opolskiego
4.Systemowe mechanizmy działania
toksycznego
Postacie chemiczne substancji powodujące
toksyczność
• Substancja macierzysta jest toksyczna -
morfina – depresja ośrodka oddechowego
• Metabolity są toksyczne – metabolit
acetaminofenu – NAPQI wiąże glutation, a
następnie komórkowe makrocząsteczki
hepatocytów
• Metabolity są przyczyną reakcji
fotoksycznych – metabolity tetracyklin,
fluorochinolonów, sulfonamidów,
chlorpromazyny
• Metabolity są przyczyną reakcji
fotoalergicznych – metabolity
sulfonamidów
• Reaktywne formy tlenu – powstające
podczas redukcji substancji macierzystej -
parakwat
Rodzaje reakcji toksycznych
• farmakologiczne
nadmierne zahamowanie OUN przez
barbiturany
• patologiczne
uszkodzenie wątroby przez acetaminofen
• genotoksyczne
nowotwór wywołany przez cyklofosfamid
Związki karcynogenne
• Genotoksyczne → substancja
macierzysta lub metabolit oddziałują
na DNA (mechanizmy naprawcze !)→
mutacje
• Niegenotoksyczne → promotory →
nasilają działanie karcynogenów
genotoksycznych
Reakcje alergiczne wywołane przez
ksenobiotyki
• Reakcja alergiczna nie zależy od dawki
• Pierwsza ekspozycja na ogół nie
wywołuje objawów
• Ponowny kontakt z alergenem po 1-2
tygodniach (czas syntezy p-ciał)
powoduje wystąpienie objawów
Wyróżnia się 4 typy reakcji alergicznych
(odpowiedzi immunologicznych) wg Gella
Coombsa
Mechanizm odpowiedzi immunologicznej
typu I (reakcja natychmiastowa, reakcja
anafilaktyczna) – IgE-zależna, uwalnianie
przez komórki tuczne i bazofile mediatorów

4
reakcji zapalnej na skutek połączenia się z
błoną komórkową tych komórek kompleksu
ksenobiotyk-przeciwciało. Efekty kliniczne:
astma, ostra pokrzywka, obrzęk
naczynioruchowy.
Mechanizm odpowiedzi immunologicznej
typu II (reakcja cytotoksyczna) – ksenobiotyk
jako hapten, po związaniu z białkiem błony
komórkowej erytrocytu, trombocytu aktywuje
dopełniacz. Efekty kliniczne: hemoliza,
trombocytopenia.
Mechanizm odpowiedzi immunologicznej
typu III (reakcja Arthusa , reakcja
kompleksów immunologicznych) –
ksenobiotyk indukuje wytwarzanie
przeciwciał przeciw niemu skierowanych,
ulega związaniu z nimi, a powstałe kompleksy
immunologiczne przechodząc przez
śródbłonki naczyń aktywują dopełniacz,
Efekty kliniczne: choroba posurowicza, zespół
Stevens-Johnson, zespół Lyella, pokrzywka.
Mechanizm odpowiedzi immunologicznej
typu IV (reakcja opóźnionej nadwrażliwości)
– ksenobiotyk po związaniu z białkiem jest
prezentowany przez komórki dendrytyczne
limfocytom, następuje aktywacja limfocytów,
ich migracja i wytwarzanie cytokin. Efekty
kliniczne: wysypki, wyprysk kontaktowy.
Reakcje idiosynkratyczne wywołane przez
ksenobiotyki
• Idiosynkrazja – nieprawidłowa reakcja
na związek chemiczny szczególna dla
danego osobnika
• Idiosynkrazja – genetycznie
uwarunkowana, zwykle niezależna od
dawki
• Klinicznie – nadmierna wrażliwość na
niskie dawki lub niewrażliwość na
wysokie dawki
Przykłady:
Polimorfizm genetyczny acetylacji –
izoniazdyd – podatność na
polineuropatię
Niedobór dehydrogenazy glukozo-6-
fosforanowej w erytrocytach –
hemoliza po sulfonamidach,
chinolonach, nitrofurantoinie
Reduktaza epoksydu wit.K – oporność
na acenokumarol
Interakcje toksykologiczne
• Nasilenie lub zmniejszenie działania
toksycznego ksenobiotyków
jednocześnie oddziałujących na ustrój
żywy
• Przyczyny – zmiana właściwości
farmakokinetycznych lub właściwości
farmakodynamicznych
Typy interakcji toksykologicznych:
• Efekt addycyjny – połączony efekt
dwóch związków = suma efektów
każdego z tych związków podanych
osobno – najczęstszy
• Efekt synergistyczny - połączony efekt
dwóch związków > suma efektów
każdego z tych związków podanych
osobno (CCl
4
+ etanol = działanie
hepatotoksyczne ↑)
• Potencjalizacja – nasilenie działania
związku toksycznego przy
równoczesnym podaniu ze związkiem
nietoksycznym (izoprenalina –
niehepatotoksyczna nasila
hepatotoksyczne działanie CCl
4
)
• Antagonizm – zakłócenie działania
jednego związku chemicznego przez
drugi – antidota to antagoniści
substancji toksycznych
• Antagonizm czynnościowy
(fizjologiczny) – dwa związki mają
przeciwstawny wpływ na ten sam
proces fizjologiczny (dopamina → ↑
perfuzji narządowej + barbiturany →
hipotensja)
• Antagonizm chemiczny (inaktywacja)
– interakcja polegająca na
zneutralizowaniu działania jednego
związku przez drugi (Hg +
dimerkaprol)
• Antagonizm dyspozycyjny –
zaburzenie rozmieszczenia substancji
powodujące, że mniej związku dociera
do narządu docelowego lub skraca czas
jego utrzymywania

5
• Antagonizm receptorowy –
zablokowanie działania agonisty
receptora przez antagonistę (morfina +
nalokson)
5.Współzależność działania biologicznego i
dawki, czynniki wpływające na szybkość
działania trucizny
Farmakokinetyka – opis losów leku w ustroju
z uwzględnieniem zmian stężenia leku we
krwi, w płynach ustrojowych i tkankach
organizmu, zależnych od procesów
wchłaniania, dystrybucji, biotransformacji i
wydalania z organizmu
Toksykokinetyka – farmakokinetyka
substancji toksycznych w warunkach zatrucia
Farmakodynamika – bada biochemiczne i
fizjologiczne skutki działania leków
oraz mechanizmy ich działania, a także
zależności między stężeniem leku a jego
działaniem
Toksykodynamika – farmakodynamika
substancji toksycznych w warunkach zatrucia
Toksykokinetyka
Wchłanianie
1.Zmiany czasu pasażu jelitowego
Działanie substancji toksycznej →
wymioty, biegunka →↓ wchłaniania
Działanie substancji toksycznej →
skurcz odźwiernika, zwolnienie
perystaltyki, niedrożność
→↑wchłaniania (cholinolityki,
karbamazepina, opioidy, blokery Ca)
Podanie atropiny jako odtrutki
→↑wchłaniania
Działanie substancji toksycznej →
hipotensja, hipotermia → ↓ perfuzji
p.pokarmowego →↓ wchłaniania
(barbiturany)
Działanie substancji toksycznej →
inotropowe dodatnie, obkurczające
naczynia → ↑ perfuzji p.pokarmowego
→ ↑wchłaniania (glikozydy
nasercowe, katecholaminy)
2.Wpływ postaci substancji toksycznej
Substancja płynna → wchłanianie ↑
Tabletki wolno uwalniające lek tworzą
farmakobezoary → wchłanianie
najpierw ↑ potem ↓ (teofilina,
diltiazem, karbamazepina)
Produkty roślinne → substancje
toksyczne uwalniane z celulozowej
osłonki → wchłanianie zwolnione
(nasiona bielunia dziędzierzawy)
TLPD, fenytoina, kwas walproinowy,
moklobemid, żelazo → wchłanianie
zwolnione (zła rozpuszczalność i/lub
wysycenie mechanizmów
transportowych)
3.Wysycenie mechanizmów transportowych
Dotyczy substancji wchłanianych
czynnie przy udziale specyficznych
nośników (żelazo, karotenoidy, kwas
askorbinowy, metotreksat)
Zatrucie → wysycenie nośników →
zwolnienie wchłaniania
4. Procedury lecznicze zwalniające i/lub
zmniejszające wchłanianie substancji
toksycznych
• Węgiel leczniczy – silny adsorbent
• Związki chelatujące – kompleksowanie
• Rozcieńczenie substancji w żołądku –
zwolnienie wchłaniania
Dystrybucja
Kompartment to tkanki funkcjonalnie (nie
anatomicznie) oddzielone od siebie.
Rozmieszczenie substancji w
kompartmencie jest równomierne i stężenie
równe.
Kompartment centralny – krew,
kompartmenty obwodowe – tkanka
tłuszczowa, mięśnie szkieletowe, płyn
pozakomórkowy itp.
Małe rozpuszczalne w lipidach cząsteczki
dyfundują szybko przez błony komórkowe
Większe i/lub polarne cząsteczki wymagają
nośników

6
1. Białka transportujące
Polipeptydy transportujące aniony organiczne
OATP: zlokalizowane od strony światła jelita
na rąbku szczoteczkowym enterocytów.
Transportują leki przez światło jelita
do komórek , a tym samym pobudzają
wchłanianie.
Inhibicja transportu może skutkować w
zmniejszeniu wchłaniania i
biodostępności.
P-glikoproteina
Wyrzucanie leków z jelit z powrotem
do światła jelita ogranicza wchłanianie
leków.
Indukcja transporterów może wpływać
na zmniejszenie wchłaniania.
Inhibicja transporterów może wpływać
na zwiększenie wchłaniania.
W jelitach OATP wykazuje działanie
przeciwne do P-glikoproteiny (np.
inhibicja P-glikoproteiny zwiększa
wchłanianie leków, podczas gdy
inhibicja OATP zmniejsza wchłanianie
leków, których składniki są
substratami obydwu białek).
• Białka transportujące – polimorfizm
genetyczny, saturacja
2. pH krwi
•
Słabe kwasy (aspiryna, herbicydy
chlorofenoksyoctowe) w środowisku
kwaśnym → niezjonizowane → łatwo
przechodzą przez błony komórkowe → lepsza
dystrybucja → ↑ toksyczności → wskazana
alkalizacja
Dla aspiryny kompartment efektu
toksycznego to kompartment peryferyjny
(OUN i mitochondria komórkowe).
• Słabe zasady (TLPD) w środowisku
alkalicznym → niezjonizowane →
łatwo przechodzą przez błony
komórkowe → lepsza dystrybucja → ↓
toksyczności .
Dla TLPD kompartment efektu
toksycznego to kompartment centralny (TPLD
transportowane zkrwią wiążą się z kanałami
jonowymi kardiomiocytów), dlatego
alkalizacja jest korzystna powodując
przesunięcie leku z krwi do tkanek
obwodowych
Metabolizm
Metabolizm – biotransformacja – detoksykacja
- szereg reakcji chemicznych, których celem
jest modyfikacja struktury związku
macierzystego, tak aby był on rozpuszczalny
w wodzie i mógł być wydalany drogą
nerkową.
Reakcje I fazy: reakcje degradacji
zwiększające rozpuszczalność w wodzie
Reakcje II fazy: reakcje sprzęgania
zwiększające polarność i/lub masę
cząsteczkową zmniejszenie objętości
dystrybucji, przyspieszenie eliminacji
• Reakcje I fazy zazwyczaj są reakcjami
detoksykacyjnymi
• Wyjątki – metabolity bardziej toksyczne, niż
związek macierzysty : paracetamol, kodeina,
tiopochodne związki fosforoorganiczne,
dapson
• Wyjątki - metabolity równie toksyczne, jak
związek macierzysty : aspiryna, tiorydazyna,
glikol etylenowy, metanol, petydyna
• Najważniejsze dla reakcji I fazy izoenzymy
cytochromu P-450 - CYP-450
• Enzymatyczny metabolizm trucizn może
ulec wysyceniu (saturacji) → wydłuża czas
trwania efektu toksycznego (fenytoina,
teofilina, aspiryna)
• Ksenobiotyki mogą być zarówno
induktorami, jak i inhibitorami CYP-450
• Nadużywanie alkoholu: jednorazowe ↓ CYP,
przewlekłe ↑ CYP
• Rola przepływu krwi przez wątrobę w
metabolizmie leków
• Perfuzja wątroby zależy od rzutu serca i
ciśnienia krwi → hipotensja i hipotermia →↑
czasu trwania efektu toksycznego
(propranolol, diltiazem, barbiturany)
• Znaczenie efektu pierwszego przejścia efekt
1-szego przejścia zmniejsza biodostępność
związków chemicznych podanych doustnie.
W przypadku bardzo dużych dawek
7
następuje saturacja układów
enzymatycznych i biodostępność wzrasta →
toksyczność wzrasta
• Schorzenia wątroby prowadzące do
ograniczenia jej wydolności (marskość,
przewlekłe zapalenie) → ↓ reakcji I fazy →
↑ toksyczności (propranolol, blokery Ca,
TLPD, propoksyfen)
• Nie stosuje się indukcji enzymów CYP-450
dla zmniejszenia ostrej toksyczności - czas
niezbędny dla indukcji to 24-48h
• Drogi wydalania substancji toksycznych:
nerki, drogi żółciowe, układ oddechowy,
czasem skóra.
• Krążenie wątrobowo-jelitowe wydłuża
eliminację
• Schorzenia dróg żółciowych upośledzają
wydalanie
Wydalanie
• Wydalanie drogą nerkową – bierna
filtracja w kłębuszkach i/lub aktywna
sekrecja w kanalikach.
• Substancje o dużej objętości
dystrybucji (leki przeciwdepresyjne,
benzodiazepiny, fenotiazyny,
propranolol, werapamil) nie mogą być
skutecznie usuwane za pomocą dializy
• Wchłanianie zwrotne wydłuża
eliminację.
• Hipotensja i hipotermia → ↓ przepływ
nerkowy → wydłuża eliminację.
• ↑ przepływu nerkowego przyspiesza
wydalanie. Wydalanie toksyn przez
nerki przyspiesza diureza wymuszona
• Jeśli substancja wydalana jest poprzez
aktywna sekrecją kanalikową →↑
frakcji wolnej leku zwiększy jej
eliminację. Zwiększenie frakcji wolnej
→ saturacja wiązania z białkami
osocza lub zmiany pH krwi
• Saturacja Gp-P i OATP w kanalikach
nerkowych zmniejsza wydalanie
nerkowe
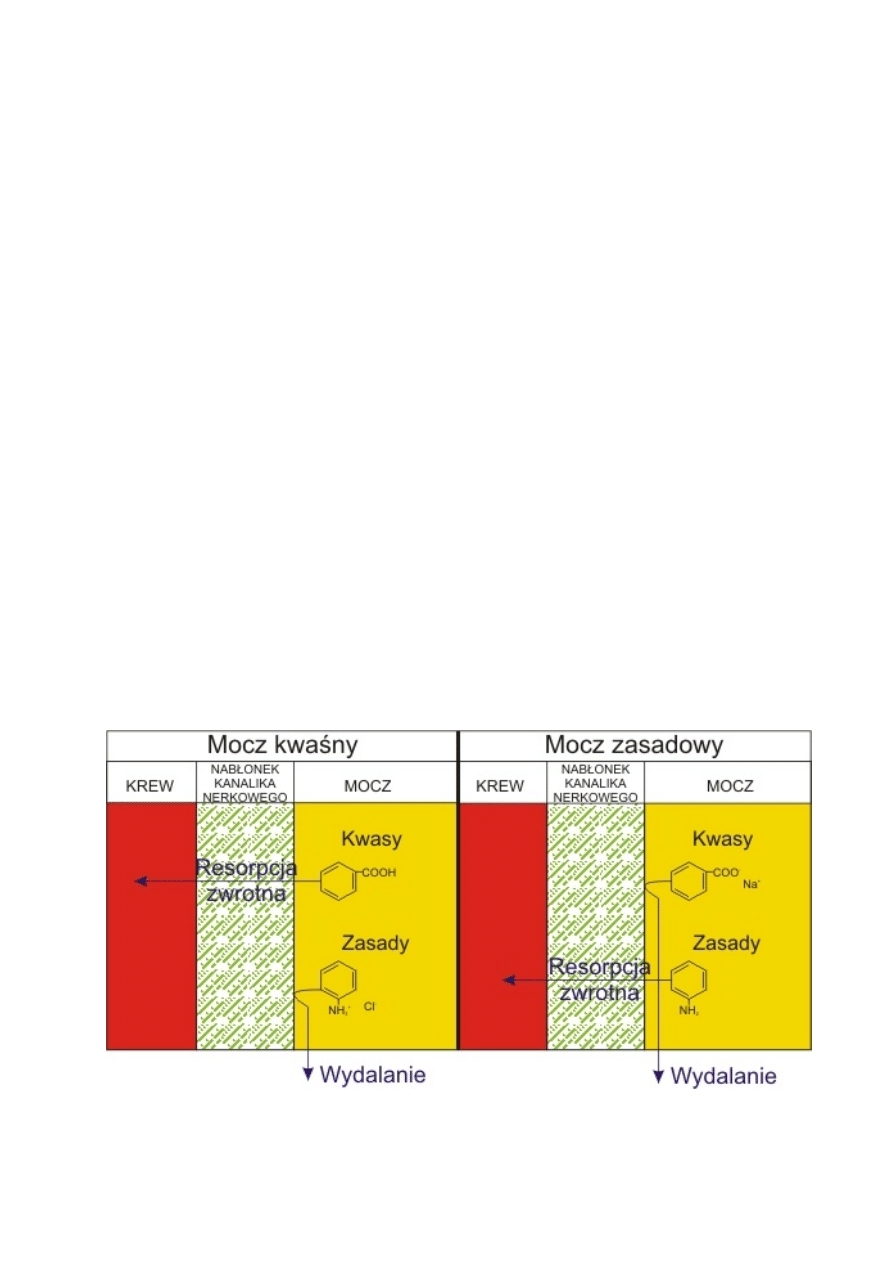
• Wydalanie drogą nerkową można
nasilić poprzez zmiany pH moczu.
Alkalizacja moczu →↑ wydalanie
słabych kwasów. Zakwaszanie moczu
tylko teoretycznie korzystne → ale
odczyn moczu jest pierwotnie kwaśny
→dalsze zakwaszanie nie daje
wyraźnego efektu
Wyszukiwarka
Podobne podstrony:
toksykologia W1 omega
Toksykologia W1, studia pielęgniarstwo
toksykologia W1 omega
toksykologia W1 cz2
toksykologia W1 cz3
sciaga cz1, W1
Toksykologia cz1
2 fale w1 ruch falowy zaoczne cz1
Farmakologia pokazy, Podstawy Farmakologii Ogólnej (W1)
W1 wprow
Przygotowanie PRODUKCJI 2009 w1
w1 czym jest psychologia
PD W1 Wprowadzenie do PD(2010 10 02) 1 1
RI cz1
toksykologia 4
więcej podobnych podstron