POTENCJOMETRIA – elektroda jonoselektywna
2010/2011
ANALIZA INSTRUMENTALNA
Strona 1
Oznaczanie stężenia jonów chlorkowych za pomocą elektrody
jonoselektywnej
Metoda:
Potencjometria.
Cel ćwiczenia:
Celem ćwiczenia jest wyznaczenie krzywej kalibracji i zakresu pracy elektrody selektywnej na
jony Cl
-
oraz oznaczenie za jej pomocą jednego z tych jonów w badanej próbce metodą
potencjometrii bezpośredniej.
Odczynniki:
•
chlorek sodu (NaCl), roztwór mianowany o stężeniu c=0.1M,
•
Siarczan (VI) sodu (Na
2
SO
4
), roztwór o stężeniu c=0.1M - elektrolit podstawowy,
•
Roztwory badane wydaje prowadzący.
Aparatura i sprzęt laboratoryjny:
•
Kolba miarowa o pojemności 50 ml – 8 szt.
•
Pipeta wielomiarowa pojemności 10 ml – 4 szt.
•
Pipeta wielomiarowa pojemności 5 ml – 2 szt.
•
Titrator CerkoLab
•
Elektroda jonoselektywna na jony chlorkowe
•
Elektroda odniesienia
Sposób wykonania:
1.
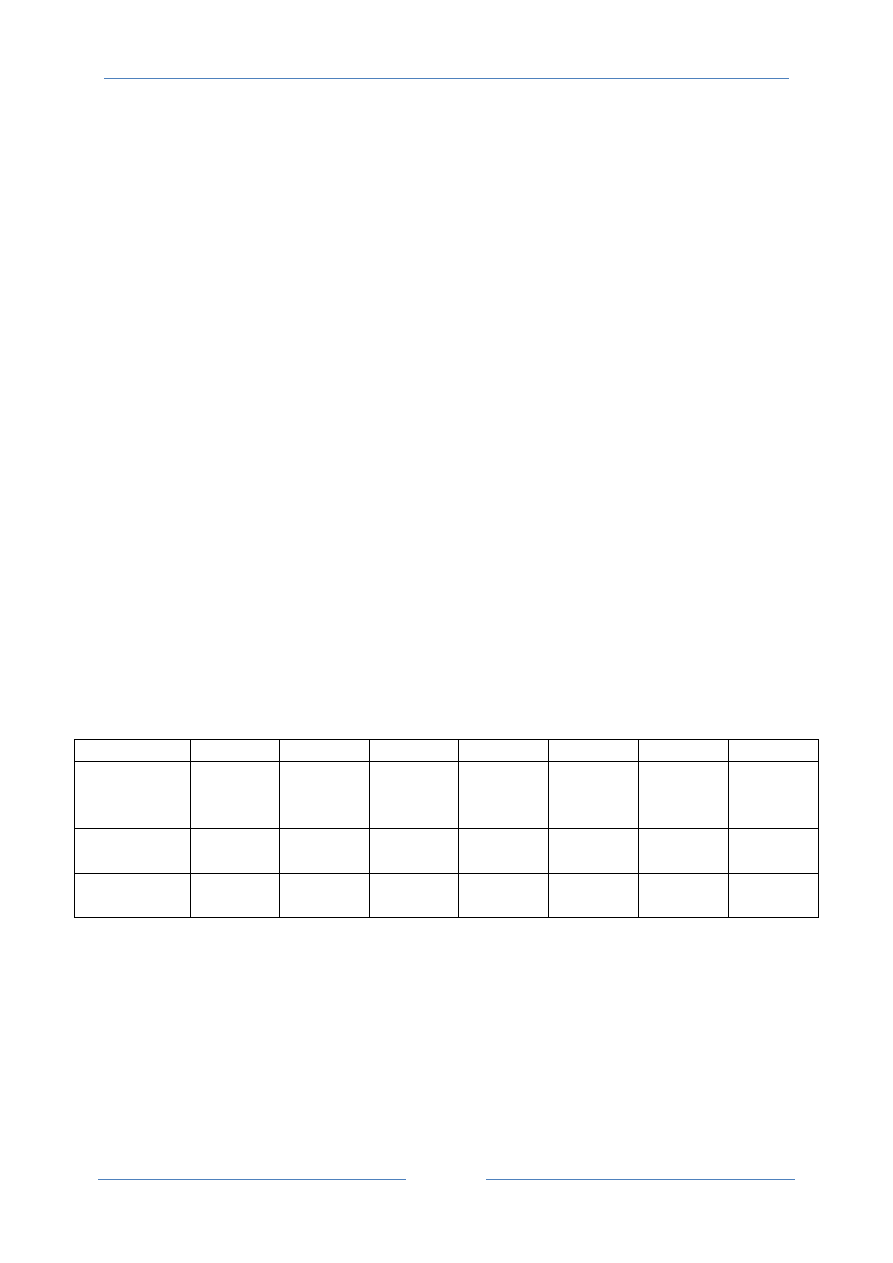
Należy sporządzić serie roztworów wzorcowych w kolbach miarowych o pojemności
50 ml zgodnie z tabela podaną poniżej:
roztwór 1 roztwór 2 roztwór 3 roztwór 4 roztwór 5 roztwór 6 roztwór 7
elektrolit
podstawowy
Na
2
SO
4
[ml]
0
5 ml
5 ml
5 ml
5 ml
5 ml
5 ml
V roztworu
NaCl [ml]
50
5ml
roztworu 1
5ml
roztworu 2
5ml
roztworu 3
5ml
roztworu 4
5ml
roztworu 5
5ml
roztworu 6
C roztworu
NaCl [mol/l]
0.1
0.01
0.001
1∙10
-4
1∙10
-5
1∙10
-6
1∙10
-7
2.
Do naczynka pomiarowego pobrać dokładnie 10 ml oznaczanego roztworu. W
naczynku umieścić elektrody.
3.
Uruchomić titrator (patrz instrukcja obsługi titratora CerkoLab).
4.
Pomiary wykonywać od najmniejszego stężenia do największego dwu-krotnie dla
każdego roztworu.
5.
Do badanej próbki (próbek) wydaną przez prowadzącego należy dodać 5 ml elektrolitu
podstawowego i uzupełnić wodą destylowaną do kreski. Następnie umieścić 10 ml
analizowanego roztworu w naczynku i umieścić elektrody, wykonać pomiar dwukrotnie.

POTENCJOMETRIA – elektroda jonoselektywna
2010/2011
ANALIZA INSTRUMENTALNA
Strona 2
Opracowanie wyników:
1.
Sporządzić wykres krzywej kalibracji elektrody jonoselektywnej w układzie współrzędnych
SEM = f(logC).
2.
W celu oceny jakości stosowanej elektrody jonoselektywnej, wyznaczyć nachylenie krzywej
kalibracji, wyrażone w mV/logC (
obliczając współczynnik kierunkowy linii regresji
otrzymanej metodą najmniejszych kwadratów).
3.
Wyznaczyć zakres pracy elektrody oraz stężenie oznaczanego jonu chlorkowego w próbkach
w
mol∙l
-1
i w mg∙l
-1
.
Literatura:
1.
Praca zbiorowa po red. I. Głuch i M. Balcerzak „Chemia analityczna” WPW 2007; str.
250-251.
2.
W. Szczepaniak „Metody instrumentalne w analizie chemicznej” PWN 1985-2005.
3.
A. Cygański „Metody elektroanalityczne” WNT 1991.
4.
K. Cammann „Zastosowanie elektrod jonoselektywnych” WNT 1997.
5.
J. Minczewski, Z. Marczenko „Chemia Analityczna T3 Analiza Instrumentalna” PWN
1998.
6.
D. A. Skoog, D. M. West, F. J. Holler, S. R. Crouch “Podstawy chemii analitycznej”
PWN 2007.
Wyszukiwarka
Podobne podstrony:
Dodatek A Uwaga o równaniu Nernst'a opisującym potencjał elektrody
Elektrody jonoselektywne Wyznaczanie stężenia jonów metodami dodatku wzorca
gr5, Szereg elektrochemiczny (napięciowy) metali Uszeregowanie metali wg rosnących wartości potencja
gr5, Szereg elektrochemiczny (napięciowy) metali Uszeregowanie metali wg rosnących wartości potencja
25 Potencja elektryczny (2)
Elektrody jonoselektywne id 157 Nieznany
potencjometr elektroniczny
Normalne potencjały elektrochemiczne metali
potencjał elektryczny
chemia, ogniwa, Potencjał elektrochemiczny - różnica potencjału na granicy faz metal/roztwór
Ściąga - Fale4, POTENCJA˙ ELEKTRYCZNY:
ćw9 - Elektrody jonoselektywne, studia, chemia fizyczna
19 elektr jonoselektywne
potencjal elektryczny komorki materialy
Potencjometia elektrody
Elektrochemia potencjał elektrochemiczny
Elektrody jonoselektywne, Studia, Chemia fizyczna
Pomiar stężenia fizjologiczne aktywnych jonów za pomocą elektrod jonoselektywnych
więcej podobnych podstron