Pobrano ze strony www.sqlmedia.pl
Pobrano ze strony www.sqlmedia.pl
Miejsce
na naklejk
Ċ
z kodem
dysleksja
PRÓBNY
EGZAMIN MATURALNY
Z CHEMII
Arkusz II
czas pracy 120 minut
Instrukcja dla zdaj
ącego
1. ProszĊ sprawdziü czy arkusz egzaminacyjny zawiera 12 stron.
Ewentualny brak nale
Īy zgáosiü przewodniczącemu zespoáu
nadzoruj
ącego egzamin.
2. ProszĊ uwaĪnie czytaü wszystkie polecenia i informacje do
zada
Ĕ.
3. Rozwiązania i odpowiedzi naleĪy zapisaü czytelnie w miejscu
na to przeznaczonym przy ka
Īdym zadaniu.
4. W rozwiązaniach zadaĔ rachunkowych trzeba przedstawiü tok
rozumowania prowadz
ący do ostatecznego wyniku oraz
pami
Ċtaü o jednostkach.
5. W trakcie obliczeĔ moĪna korzystaü z kalkulatora.
6. ProszĊ pisaü tylko w kolorze czarnym; nie pisaü oáówkiem.
7. Nie wolno uĪywaü korektora.
8. BáĊdne zapisy trzeba wyraĨnie przekreĞliü.
9. Brudnopis nie bĊdzie oceniany.
10. Obok kaĪdego zadania podana jest maksymalna liczba
punktów, któr
ą moĪna uzyskaü za jego poprawne rozwiązanie.
11. Do ostatniej kartki arkusza doáączona jest karta odpowiedzi,
któr
ą wypeánia nauczyciel.
ĩyczymy powodzenia!
ARKUSZ II
STYCZE
ē
ROK 2005
Za rozwi
ązanie
wszystkich zada
Ĕ
mo
Īna otrzymaü
áącznie 60 punktów
(Wpisuje zdaj
ący przed rozpoczĊciem pracy)
PESEL ZDAJ
ĄCEGO
Pobrano ze strony www.sqlmedia.pl

2
Zadanie 32. (2 pkt)
Pierwiastek X znajduje si
Ċ w trzecim okresie ukáadu okresowego. Atom tego pierwiastka ma
nast
Ċpująca konfiguracjĊ elektronową: 1s
2
2s
2
2p
6
3s
1
.
Okre
Ğl, do jakiego bloku energetycznego naleĪy pierwiastek X. Za pomocą czterech liczb
kwantowych (n, l, m, m
S
) opisz stan elektronu walencyjnego pierwiastka X.
Blok energetyczny: .......................
Liczba kwantowa n: ......................
Liczba kwantowa l: .......................
Liczba kwantowa m: .....................
Liczba kwantowa m
S
: ....................
Zadanie 33. (2 pkt)
W wyniku rozpadu promieniotwórczego j
ądro izotopu radu
228
88
Ra przekszta
áciáo siĊ w jądro
izotopu rt
Ċci
212
82
Hg.
Okre
Ğl, ile cząstek
D i ile cząstek
E zostaáo wypromieniowanych podczas tego rozpadu.
Liczba cz
ąstek
D : ..........
Liczba cz
ąstek
E : ..........
Zadanie 34. (2 pkt)
W
áaĞciwoĞci fizyczne i chemiczne substancji wynikają z budowy i ksztaátu ich cząsteczek.
Podaj po jednej przyczynie wyja
Ğniającej nastĊpujące fakty:
a) tlenek azotu(II) bardzo áatwo ulega reakcjom z innymi substancjami,
b) moc beztlenowych kwasów fluorowców roĞnie wraz ze wzrostem liczby
atomowej fluorowca (moc HI > moc HBr > moc HCl > moc HF).
a) ...........................................................................................................................................
...........................................................................................................................................
b) ...........................................................................................................................................
...........................................................................................................................................
Pobrano ze strony www.sqlmedia.pl

3
Zadanie 35. (2 pkt)
Reakcja ca
ákowitego spalania butanu zachodzi zgodnie z równaniem:
2C
4
H
10 (g)
+ 13O
2 (g)
ĺ 8CO
2 (g)
+ 10H
2
O
(g)
Wyznacz stosunek masowy oraz stosunek obj
ĊtoĞciowy substratów i produktów tej
reakcji. Obj
ĊtoĞci wszystkich gazów odmierzono w tych samych warunkach ciĞnienia
i temperatury.
m
10
4
H
C
: m
2
O
: m
2
CO
: m
O
H
2
= .........................................................................................................
.......................................................................................................................................................
V
10
4
H
C
: V
2
O
: V
2
CO
: V
O
H
2
= ..........................................................................................................
.......................................................................................................................................................
Zadanie 36. (4 pkt)
Maj
ąc do dyspozycji rozcieĔczone wodne roztwory siarczanu(VI) miedzi(II)
i wodorotlenku sodu, zaprojektuj do
Ğwiadczenie, w wyniku którego otrzymasz tlenek
miedzi(II). Przedstaw s
áowny opis doĞwiadczenia, zapisz przewidywane obserwacje oraz
odpowiednie równania reakcji chemicznych w formie cz
ąsteczkowej.
S
áowny opis doĞwiadczenia: ......................................................................................................
.......................................................................................................................................................
.......................................................................................................................................................
.......................................................................................................................................................
Przewidywane obserwacje: .........................................................................................................
.......................................................................................................................................................
Równania reakcji:
.......................................................................................................................................................
.......................................................................................................................................................
Pobrano ze strony www.sqlmedia.pl
4
Zadanie 37. (2 pkt)
Poni
Īej przedstawiono dwa równania reakcji.
I.
HSO
4
+ H
2
O
қ H
3
O
+
+ SO
2
4
II.
NH
3
+ H
2
O
қ NH
4
+ OH
-
Wpisz w odpowiednie miejsca do tabeli wzory dwóch sprz
ĊĪonych par kwas – zasada
(wed
áug protonowej teorii Brönsteda) dla kaĪdego równania reakcji przebiegającej
wed
áug ogólnego schematu:
kwas
1
+ zasada
2
қ kwas
2
+ zasada
1
kwas
1
– zasada
1
Równanie reakcji I
kwas
2
– zasada
2
kwas
1
– zasada
1
Równanie reakcji II
kwas
2
– zasada
2
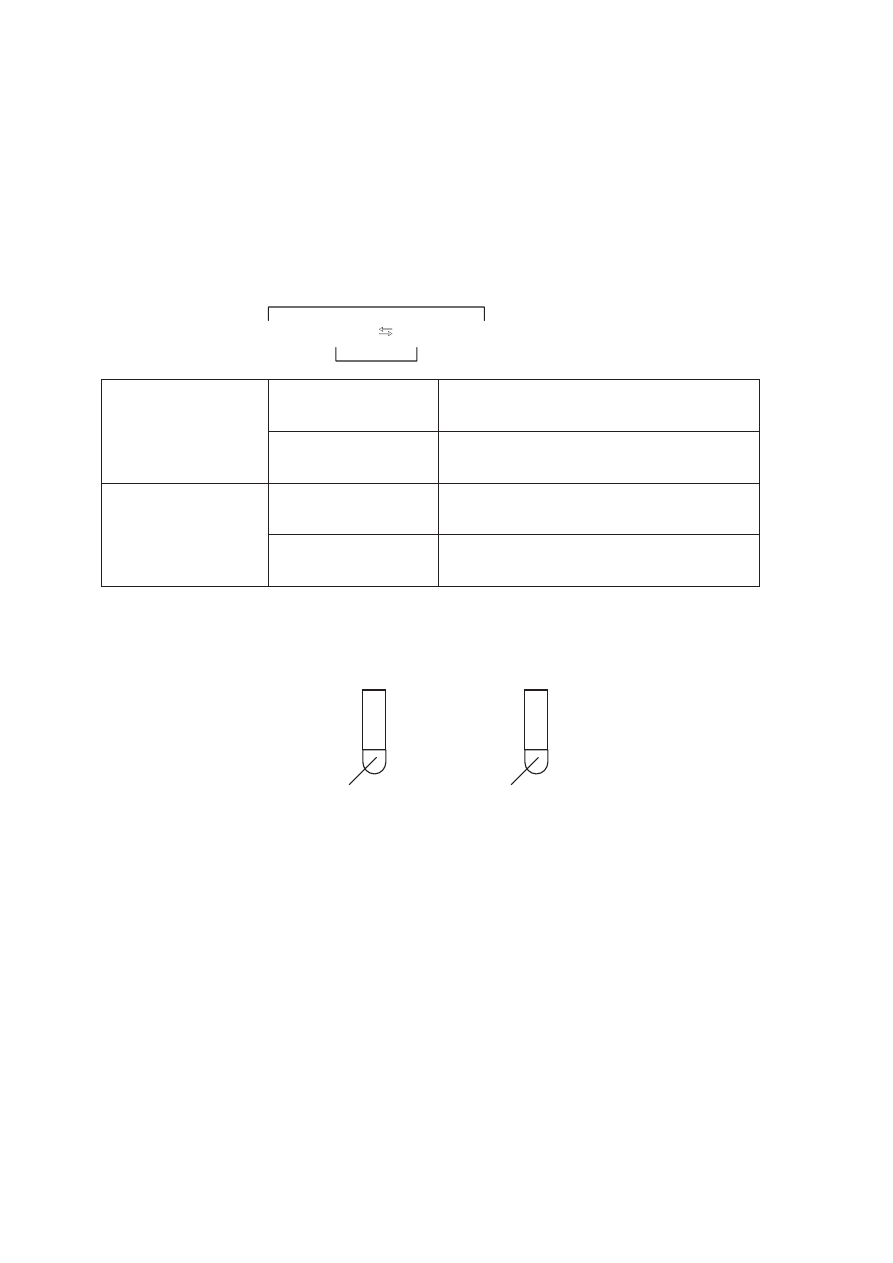
Zadanie 38. (4 pkt)
Do dwóch probówek przedstawionych na poni
Īszym rysunku dodano niewielką iloĞü
zawiesiny wodorotlenku cynku.
I II
H
2
SO
4(aq)
NaOH
(aq)
Zapisz obserwacje, których dokonano podczas tego do
Ğwiadczenia. Napisz w formie
jonowej skróconej równania zachodz
ących reakcji chemicznych i sformuáuj wniosek
dotycz
ący chemicznego charakteru wodorotlenku cynku.
Obserwacje: ..................................................................................................................................
.......................................................................................................................................................
Równania reakcji:
Probówka I: .................................................................................................................................
Probówka II: ...............................................................................................................................
Pobrano ze strony www.sqlmedia.pl
5
Wniosek: .....................................................................................................................................
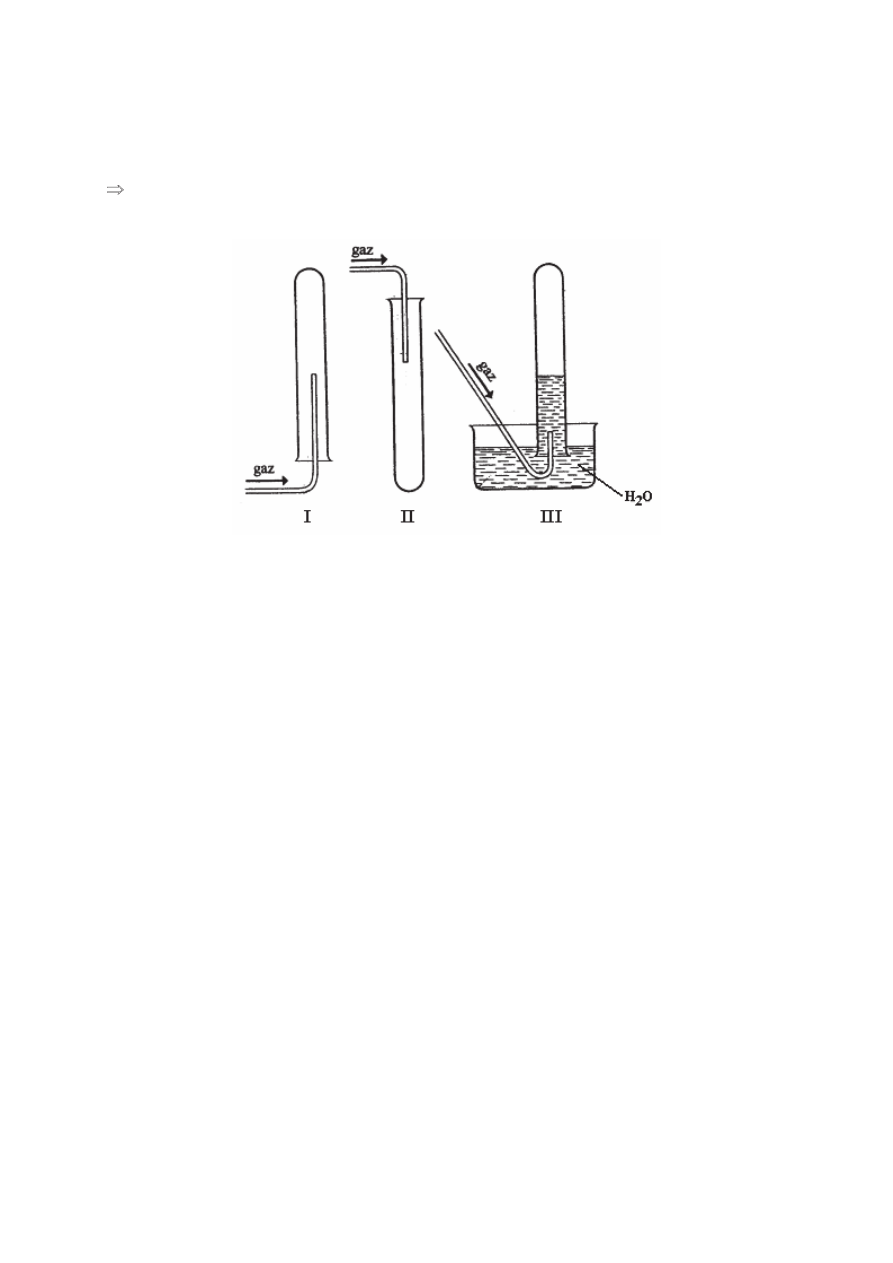
Informacja do zadaĔ 39. i 40.
Poni
Īsze rysunki przestawiają odmienne sposoby zbierania róĪnych gazów do probówek (I, II
i III).
Zadanie 39. (3 pkt)
Wymie
Ĕ po jednej wáaĞciwoĞci kaĪdego gazu, która umoĪliwia zbieranie go w sposób
pokazany na rysunkach.
Probówka I: .................................................................................................................................
Probówka II: ................................................................................................................................
Probówka III: ..............................................................................................................................
Zadanie 40. (3 pkt)
Podaj po jednym przyk
áadzie gazu (nazwa gazu), który mógáby byü zbierany
w probówce I, w probówce II i w probówce III.
Probówka I: .....................................................................
Probówka II: ....................................................................
Probówka III: ...................................................................
Pobrano ze strony www.sqlmedia.pl

6
Zadanie 41. (2 pkt)
Uzupe
ánij poniĪszy tekst, wpisując brakujące informacje w wykropkowane miejsca.
„Zmiany st
ĊĪeĔ mogą powodowaü przesuniĊcia równowagi reakcji odwracalnych
równie
Ī w organizmach Īywych, np.: reakcje dysocjacji i asocjacji tlenu do hemoglobiny.
Tlen jest transportowany do komórek w postaci oksyhemoglobiny, która powstaje zgodnie
z reakcj
ą:
HHb + O
2
қ
HbO
2
+ H
+
oksyhemoglobina
Reakcja wysycenia hemoglobiny tlenem jest reakcj
ą odwracalną, stąd obok innych czynników,
równie
Ī zmiany ciĞnienia parcjalnego tlenu mają wpáyw na przesuniĊcie tej równowagi.
Zwi
Ċkszenie stĊĪenia (ciĞnienia parcjalnego) tlenu, czyli substratu powyĪszej reakcji
spowoduje,
Īe zgodnie z reguáą przekory pewna iloĞü substratów zamieni siĊ
w .......................................... Z kolei zwi
Ċkszenie stĊĪenia jonów wodorowych przesuwa
równowag
Ċ w .................................................”
Teresa K
Ċdryna Chemia ogólna z elementami biochemii.
Wydawnictwo „Zamiast korepetycji” s.c. Kraków 1994
Zadanie 42. (3 pkt)
Podczas syntezy amoniaku w T=670 K równowaga reakcji:
N
2(g)
+ 3H
2(g)
ҙ 2NH
3(g)
ustali
áa siĊ przy stĊĪeniach: [N
2
] = 4 mol
ǜdm
-3
, [H
2
] = 0,2 mol
ǜdm
-3
, [NH
3
] = 0,08 mol
ǜdm
-3
.
Zapisz wyra
Īenie na staáą równowagi tej reakcji, a nastĊpnie oblicz staáą równowagi
oraz st
ĊĪenie początkowe azotu.
Wyra
Īenie na staáą równowagi reakcji: ......................................................................................
Obliczenia:
Pobrano ze strony www.sqlmedia.pl
7
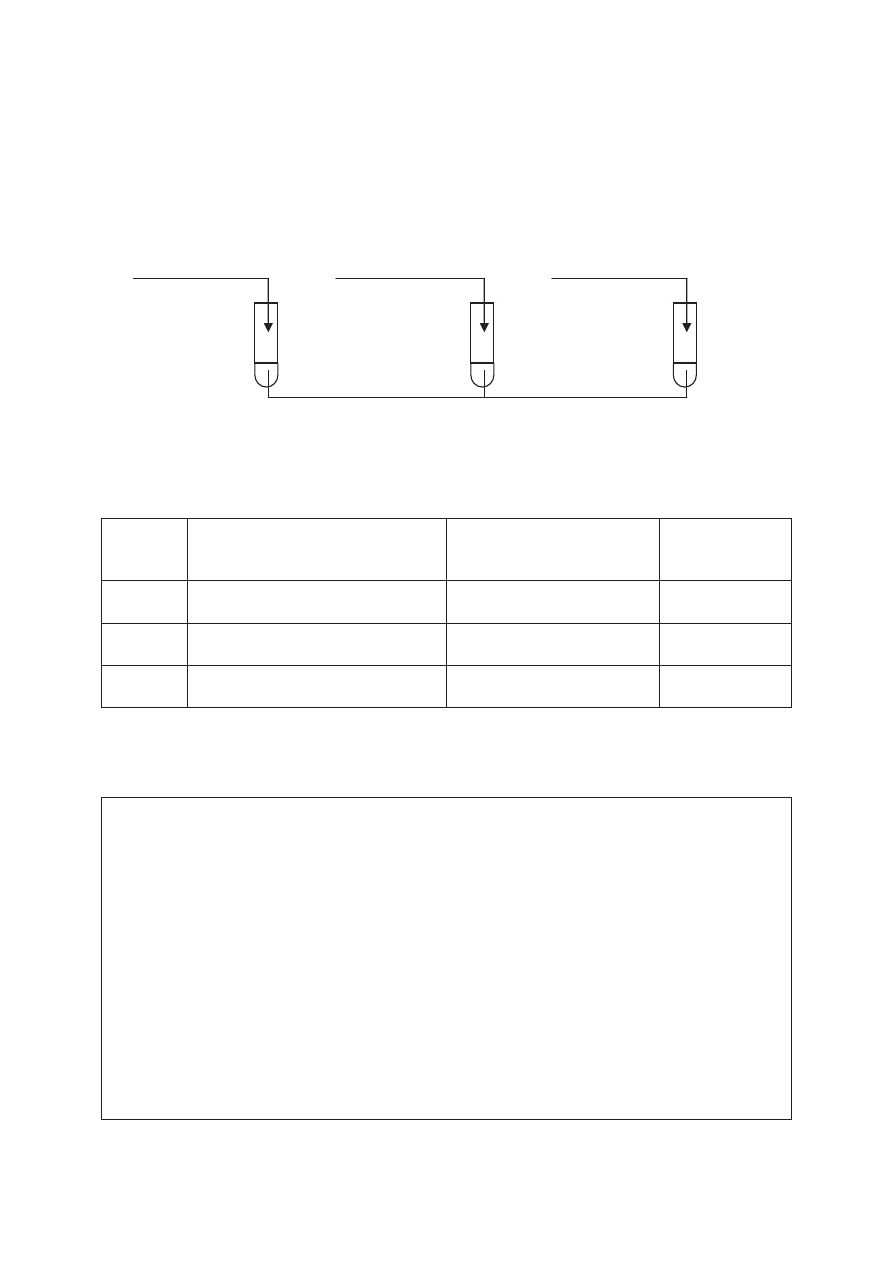
Zadanie 43. (3 pkt)
Na VII stopniu utlenienia mangan tworzy manganiany(VII), które maj
ą silne wáaĞciwoĞci
utleniaj
ące. Manganiany(VII), w zaleĪnoĞci od Ğrodowiska, redukują siĊ do związków
manganu(II), manganu(IV) lub manganu(VI). Przeprowadzono do
Ğwiadczenie przedstawione
na poni
Īszym schemacie.
H
2
SO
4(aq)
+ Na
2
SO
3(aq)
NaOH
(aq)
+ Na
2
SO
3(aq)
H
2
O + Na
2
SO
3(aq)
I II III
KMnO
4(aq)
Uzupe
ánij poniĪszą tabelĊ, wpisując w puste miejsca obserwacje dokonane podczas tego
do
Ğwiadczenia, wzór produktu powstaáego w wyniku redukcji manganianu(VII) potasu
lub
Ğrodowisko reakcji.
Numer
probówki
Obserwacje
Wzór produktu powsta
áego
w wyniku redukcji
manganianu(VII) potasu
ĝrodowisko
reakcji
I
MnSO
4
kwasowe
II
roztwór przyjmuje zielon
ą barwĊ
zasadowe
III
wytr
ąca siĊ brunatny osad
MnO
2
Zadanie 44. (3 pkt)
Oblicz, ile cm
3
wody nale
Īy dolaü do 20 cm
3
0,5-molowego roztworu KOH, aby otrzyma
ü
roztwór 0,2-molowy.
Obliczenia:
Pobrano ze strony www.sqlmedia.pl
8
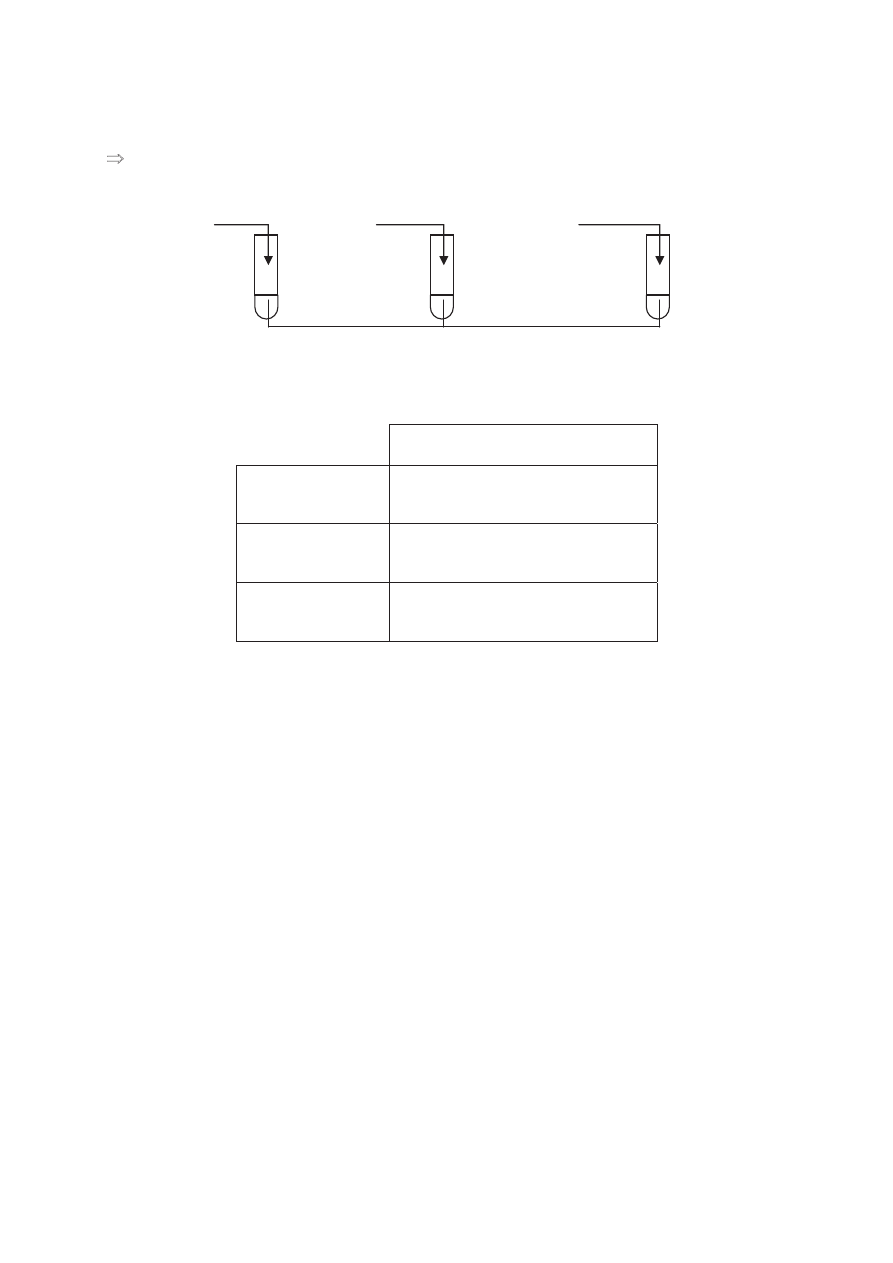
Informacja do zadaĔ 45., 46. i 47.
Wykonano do
Ğwiadczenia przedstawione na poniĪszym rysunku:
Zadanie 45. (2 pkt)
Okre
Ğl, jaki odczyn posiadają roztwory otrzymane w wyniku tych doĞwiadczeĔ.
Odczyn roztworu
Roztwór Na
2
S
Roztwór K
2
SO
4
Roztwór NH
4
NO
3
Zadanie 46. (2 pkt)
Napisz w formie jonowej skróconej równania reakcji zachodz
ących w probówkach
I i III.
Probówka I: .................................................................................................................................
Probówka III: ..............................................................................................................................
Zadanie 47. (2 pkt)
Nazwij reakcje chemiczne zachodz
ące w probówkach I i II.
Probówka I: .................................................................................................................................
Probówka II: ...............................................................................................................................
NH
4
NO
3
II
I
Na
2
S
III
K
2
SO
4
H
2
O
Pobrano ze strony www.sqlmedia.pl
9
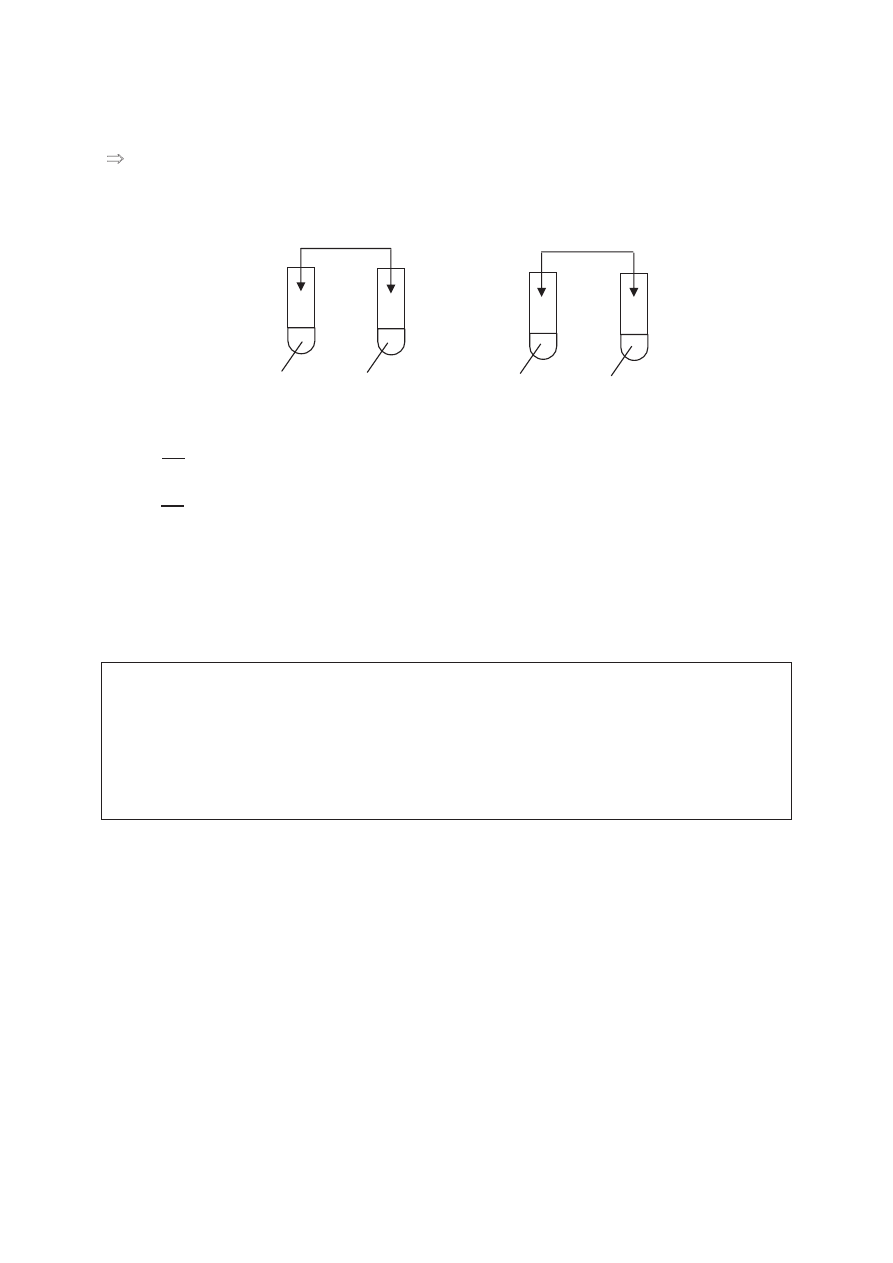
Informacja do zadaĔ 48. i 49.
W celu zbadania zachowania miedzi i cynku wobec wodnych roztworów soli wybranych
metali przeprowadzono do
Ğwiadczenia przedstawione na poniĪszym rysunku.
Zadanie 48. (2 pkt)
Wykorzystuj
ąc szereg elektrochemiczny metali, wskaĪ, w których probówkach badane
metale nie reagowa
áy z roztworami soli i wyjaĞnij dlaczego.
Metale nie reagowa
áy w probówkach: ........................................................................................
Wyja
Ğnienie: ................................................................................................................................
.......................................................................................................................................................
Zadanie 49. (2 pkt)
Napisz w formie jonowej skróconej równania zachodz
ących reakcji chemicznych.
Zadanie 50. (4 pkt)
SEM pewnego ogniwa w warunkach standardowych wynosi 2,46V. Elektrod
Ċ dodatnią w tym
ogniwie stanowi srebro.
Okre
Ğl, z jakiego metalu zostaáa wykonana elektroda ujemna. Przedstaw schemat tego
ogniwa oraz napisz równania reakcji przebiegaj
ących na jego elektrodach.
Metal stanowi
ący elektrodĊ ujemną: ...........................................................................................
Schemat ogniwa: .........................................................................................................................
Równania reakcji:
Elektroda ujemna: .......................................................................................................................
Pb(NO
3
)
2
(aq)
Zn
III
AlCl
3
(aq)
IV
I
Cu
II
AgNO
3
(aq)
Pb(NO
3
)
2
(aq)
Pobrano ze strony www.sqlmedia.pl
10
Elektroda dodatnia: ....................................................................................................................
Informacja do zadaĔ 51. i 52.
Poni
Īej przedstawiono wzory dwóch wĊglowodorów.
CH
3
– CH
2
H CH
3
– CH
2
CH
3
C = C C = C
H
3
C CH
3
H
3
C H
I II
Zadanie 51. (2 pkt)
Podaj nazwy systematyczne zwi
ązków I i II.
Nazwa systematyczna zwi
ązku I:
................................................................................................
Nazwa systematyczna zwi
ązku II: ..............................................................................................
Zadanie 52. (1 pkt)
Oce
Ĕ, czy związki I i II są wzglĊdem siebie izomerami czy homologami.
.......................................................................................................................................................
Informacja do zadaĔ 53. i 54.
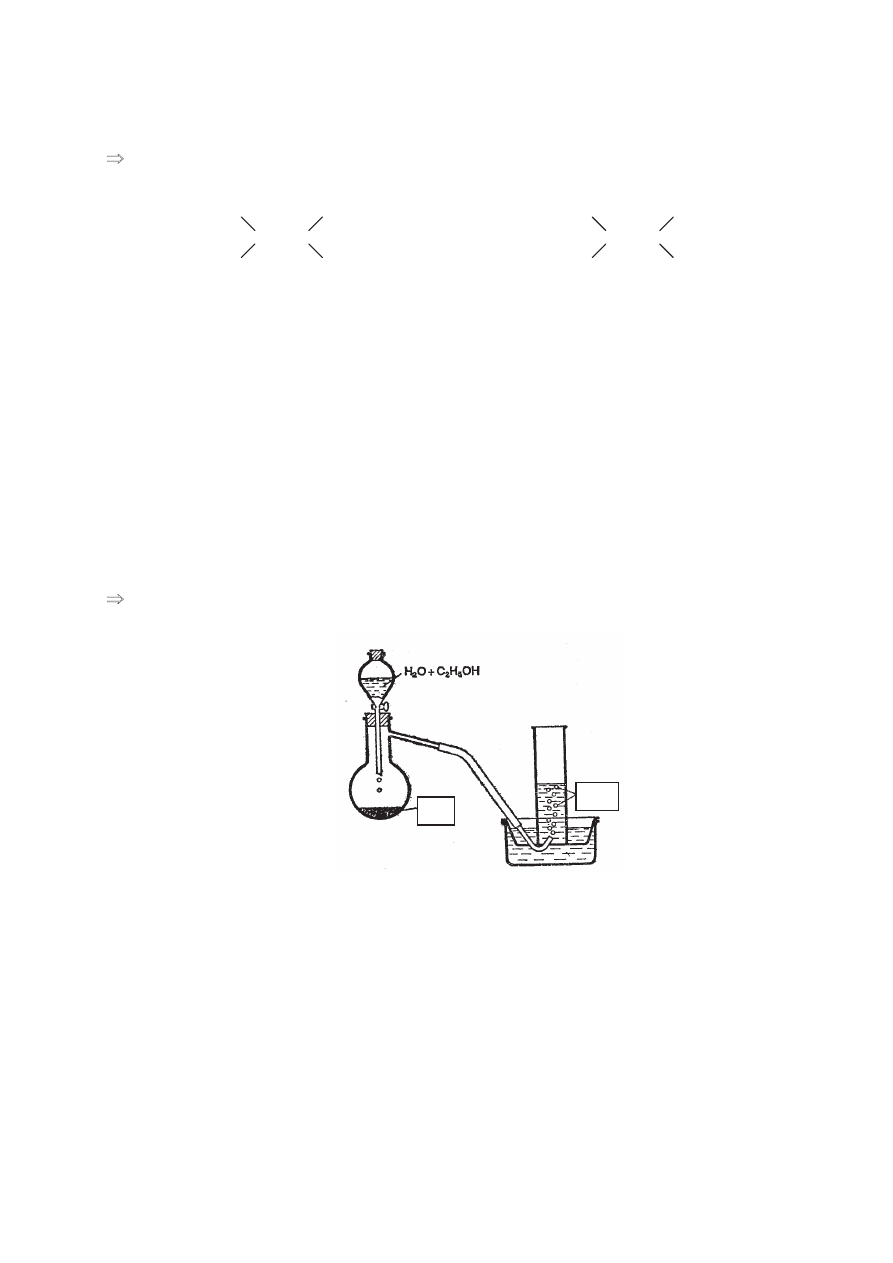
Poni
Īszy rysunek przedstawia schemat aparatury do otrzymywania etynu (acetylenu).
Zadanie 53. (2 pkt)
W miejsca liter A i B wpisz wzory odpowiednich reagentów.
A: ......................................................................................
B: ......................................................................................
Zadanie 54. (1 pkt)
Wyja
Ğnij, dlaczego we wkraplaczu aparatury znajduje siĊ mieszanina wody i etanolu,
a nie sama woda.
.......................................................................................................................................................
A
B
Pobrano ze strony www.sqlmedia.pl

11
.......................................................................................................................................................
Zadanie 55. (2 pkt)
Zaproponuj metod
Ċ doĞwiadczalnego odróĪnienia etanolu od etano-1,2-diolu: podaj
wzór potrzebnego odczynnika i zapisz przewidywane obserwacje.
Przewidywane obserwacje: ..........................................................................................................
Wzór odczynnika: .......................................................................................................................
.......................................................................................................................................................
.......................................................................................................................................................
Zadanie 56. (3 pkt)
Metanoamina (metyloamina) rozpuszcza si
Ċ w wodzie, a takĪe reaguje z nią.
Napisz,
pos
áugując siĊ wzorami grupowymi (póástrukturalnymi) związków
organicznych, równanie reakcji metanoaminy z wod
ą.
Okre
Ğl, jak zabarwi siĊ papierek uniwersalny zanurzony w wodnym roztworze tej
aminy. Podaj, jaki charakter chemiczny posiada metanoamina.
Równanie reakcji: .......................................................................................................................
Barwa papierka uniwersalnego w roztworze: .............................................................................
Charakter chemiczny metanoaminy: ...........................................................................................
Pobrano ze strony www.sqlmedia.pl

12
BRUDNOPIS (nie podlega ocenie)
Pobrano ze strony www.sqlmedia.pl
Wyszukiwarka
Podobne podstrony:
ark1 ch styczen pp2005
ark2 ch styczen ODP2005
ark1 ch styczen ODP2005
9 Ch organiczna WĘGLOWODANY
ch wrzodowa prof T Starzyńska
ch zwyrodnieniowa st
Ch 28 Pelites
11 Ch organiczna AMINOKWASY I BIAŁKAid 12388 ppt
3 ch org zwiazki funkcyjne
WYKúAD 4 MASA» J CH cd
Reh amb w ch Parkinsona
Wykład Ch F konduktometria
Wykład Ch F wielkości kol
Ch Pageta
więcej podobnych podstron