Podstawy teoretyczne
Wielkością o dość dużym znaczeniu identyfikacji związków chemicznych jest współczynnik załamania światła zwany niekiedy współczynnikiem refrakcji. Współczynnik załamania światła jest zdefiniowany jako stosunek sinusa kąta padania, do sinusa kąta załamania i jest dla danych ośrodków wielkością stałą zależną od długości fali użytego światła i od temperatury.
sinα = n = const.
sin β
Można również wprowadzić zależność:
c1
n =
c2
gdzie c1 i c2 są prędkościami światła w ośrodku I i II, przy czym promień przechodzi z ośrodka I do II. Dla gazów współczynnik załamania światła podaje się w odniesieniu do próżni, dla ciał stałych i cieczy współczynnik refrakcji mierzy się w stosunku do powietrza.
Pomiarów współczynnika załamania światła nie wykonuje się w oparciu o jego definicję (a więc o pomiar kąta padania i załamania), gdyż znacznie wygodniejszą od pomiaru wielkością jest tzw. kąt graniczny βgran, który związany jest ze współczynnikiem załamania światła następującą zależnością:
n = sin β
gran
Jeśli światło przechodzi z powietrza do badanej substancji, to wystarczy zmierzyć kąt graniczny tej substancji. Jeśli natomiast światło przechodzi np. z pryzmatu szklanego do badanej substancji to w oparciu o powyższy wzór otrzymalibyśmy współczynnik załamania badanej substancji względem szkła danego pryzmatu.
Chcąc otrzymać współczynnik załamania światła badanej substancji względem powietrza (n1) należy w tej sytuacji skorzystać z zależności:
n = n ⋅ sin β
1
2
2 gran
gdzie:
n2 - współczynnik refrakcji drugiego ośrodka
βgran - wartość graniczna kąta w drugim ośrodku Badania współczynnika refrakcji znajdują zastosowanie zarówno w analizie ilościowej (zależność n = f(C) rzadko jest linią prostą), jak również
do
identyfikacji
związków
chemicznych.
Z
zestawień
tabelarycznych
współczynników refrakcji dla różnych związków widać jednak, że zmieniają się one niewiele w zależności od substancji i dlatego ich przydatność do identyfikacji jest niewielka (raczej stosuje się jako sprawdzian czystości). Natomiast funkcje współczynnika załamania światła, takie
jak
dyspersja
D
=
(n2
–
n1)
i refrakcji molowa lub właściwa różnią się znacznie bardziej między sobą przy przejściu np.
od substancji do substancji w szeregu homologicznym. Drogą rozważań teoretycznych H.A.
Lorenz stwierdził, że wartość:
n2 −1 M
R =
⋅
n2 + 2 d
gdzie:
M- ciężar cząsteczkowy substancji
d - gęstość substancji
R - zwana refrakcją molową jest dla określonego połączenia chemicznego stała i niezależna od temp (wyrażona w cm3).
1
Na podstawie rozważań sił działających na cząsteczkę w jakimś ośrodku można otrzymać tzw. równanie Clausiusa-Masittiego:
E −1 = 4 ⋅Π ⋅ N ⋅α
E +
3
2
gdzie:
E- stała dielektyczna ośrodka
α - polaryzowalność cząsteczki
N - liczba Avogadro
4/3⋅Π⋅N = P - polaryzacja molowa
Całkowita polaryzacja składa się z polaryzacji elektronowej, atomowej i polaryzacji ustawienia. Jeśli cząsteczki znajdują się w polu elektromagnetycznym o odpowiednio dużej częstości zmian np. w przedziale światła widzialnego, zanika polaryzacja ustawienia i atomowa i pozostaje tylko polaryzacja elektronowa jedynie powłoki elektronowe zdążą się przesuwać w takt zmian tego pola. Można również wykazać, że polaryzowalność elektronowa cząsteczki równa się w przybliżeniu sześcianowi jej promienia: αe = r3, a więc polaryzacja elektronowa PE wyraża się wzorem:
E −1 M
P =
⋅
= 4 ⋅Π ⋅ r3 ⋅ N
E
E + 2 d
3
gdzie:
4/3⋅Π⋅r3⋅N - jest sumaryczną objętością własną cząsteczek w 1 molu.
Wziąwszy pod uwagę fakt, iż:
2
E = n
CZ
tj. stała dielektryczna ośrodka niedipolowego równa się kwadratowi ekstrapolowanej na fale nieskończenie długie wartości współczynnika załamania światła, otrzymuje ostatecznie RCZ, czyli refrakcję molową ekstrapolowaną na fali nieskończenie długiej: n2 −1 M
E −1 M
R
=
⋅
=
⋅
CZ
n2 + 2 d
E + 2 d
Dla substancji niedipolowych jest to po prostu całkowita polaryzacja molowa, dla substancji zaś dipolwych jest to wartość molowej polaryzacji elektronowej PE, czyli w przybliżeniu objętość własna cząsteczek w 1 molu.
Wartość refrakcji molowej bardzo wyraźnie zależy od budowy cząsteczki związku organicznego, a więc od składu empirycznego badanego połączenia, a także od sposobu powiązania atomów w cząsteczce. W szczególności obecność w cząsteczce wiązań podwójnych, potrójnych lub układu sprzężonych wiązań podwójnych powoduje znaczne i swoiste dla każdego wymienionych typów wiązań odchylenia od wartości obliczonej na podstawie wzoru sumarycznego. Odchylenie to nosi nazwę „inkrementu” (dla wiązania podwójnego lub potrójnego) względnie „egzaltacji” (nadwyżka ponad sumę inkrementów w przypadku wiązania, sprzężonego).
Znając, zatem wzór sumaryczny połączenia, a nie znając jego wzoru strukturalnego, można za pomocą pomiaru refrakcji molowej uzyskać informację o obecności wiązań wielokrotnych w cząsteczce. Innym zastosowaniem pomiarów refrakcji jest określenie składu mieszaniny.
Dla roztworów refrakcja molowa może być obliczona jako suma udziałów refrakcji molowych poszczególnych składników, jeżeli oddziaływań i między nimi są nieznaczne. Dla roztworu dwuskładnikowego słuszne są następujące równania: 2
n
n
1
x =
2
x =
1
n + n
2
n + n
1
2
1
2
R
= x ⋅ R + x ⋅ R
,
1 2
1
1
2
2
{ x + x =1
1
2
2
2
2
n
−1
⋅
+ ⋅
−
−
,
1 2
x M
x
M
n
1 M
n
1 M
1
1
2
2
1
1
2
2
⋅
= x ⋅
⋅
+ x ⋅
⋅
2
1
2
2
2
n
+ 2
d
n + 2 d
n + 2 d
,
1 2
,
1 2
1
1
2
2
gdzie x1 i x2 są ułamkami molowymi składników roztworu.
Wartości refrakcji atomowej grup są dołączone na końcu instrukcji.
Opis aparatury i metoda pomiaru
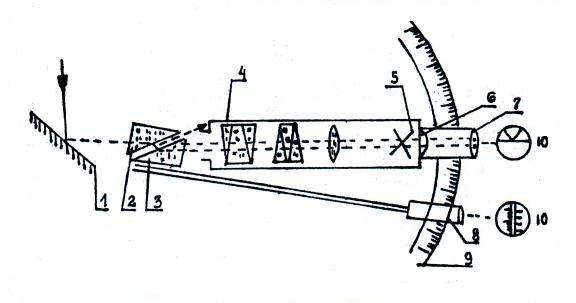
Pomiary współczynnika załamania światła wykonuje się na refraktometrze Abbego, schemat jego działania podany jest na rys.1.
Rys.1 Schemat refraktometru Abbego.
Promień świetlny pada po odbiciu od lustra 1 na pryzmat 2, załamuje się w warstwie cieczy badanej i następnie przechodzi przez drugi pryzmat 3, system optyczny 4, skrzyżowane nitki 5, wpada do okularu 6 i 7, w którym widzimy skrzyżowane nitki. Przez obrót pryzmatów zmieniamy kąt padania od momentu, kiedy na skrzyżowaniu nitek, obserwowanych w okularze, pojawi się granica cienia. Zachodzi to dla kąta padania równego kątowi granicznemu. Wtedy przez lupę 8, sprzęgniętą na stałe z lunetą główną, odczytujemy na skali 9 wartość współczynnika n. W refraktorze Abbego obudowa pryzmatów jest wykonana tak, że zapewnia utrzymanie w czasie pomiaru temperatury równej 200C, co uzyskuje się przez odpowiednie połączenie obudowy z termostatem, z którego doprowadza się ciecz opływającą pryzmaty.
Wykonanie ćwiczenia
Asystent podaje ciężar cząsteczkowy składników I i II, oraz ich wzory sumaryczne. Składniki te oraz ich mieszanina znajduje się w trzech butelkach. Należy wykonać pomiary współczynników załamania światła składników I i II oraz ich mieszaniny. Następnie wykonujemy pomiary ich gęstości. W tym celu wykonujemy następujące czynności: 3
a) ważymy na wadze analitycznej pusty, czysty, suchy piknometr b) piknometr napełniamy wodą i ważymy
c) pilknometr napełniamy składnikiem I i ważymy
d) piknometr napełniamy składnikiem II i ważymy
e) piknometr napełniamy mieszaniną składników I i II i ważymy Należy po każdym pomiarze (z wyjątkiem pomiaru a) piknometr wyruszyć za pomocą dmuchania fenem, nie ogrzewać). Po ważeniu wody piknometr przepłukać alkoholem metylowym, ale po ważeniu substancji organicznych jest to zbyteczne, gdyż z reguły są one łatwo lotne. Następnie wykonać następujące obliczenia:
a) gęstość składnika l i II oraz ich mieszaniny
b) refrakcje molowe składników I i II na podstawie zmierzonych n i d, oraz narysować wszystkie możliwe wzory tych składników i obliczyć refrakcje molowe jako sumy refrakcji atomowych odczytanych z tabeli 1.
Ustalić wzory strukturalne składników I i II.
c) obliczyć ułamki molowe składników I i II w mieszaninie.
UWAGA: Roztwory z butelek pobieramy za pomocą czystej i suchej pipetki. Roztwory po zważeniu w piknometrze zlewamy z powrotem do odpowiednich butelek.
Wzór sprawozdania
Numer mieszaniny:
Masa piknometru w [g]
Gęstość d w [g/cm3]
pustego
z H2O
z I
z II
z I + II
H2O
I
II
I + II
Współczynnik załamania światła n
I
II
I + II
Refrakcja molowa dla składnika I wynosi ....................................
Refrakcja molowa dla składnika II wynosi ...................................
Podać wszystkie możliwe wzory strukturalne dla składnika I i II, wyliczyć dla nich refrakcje molowe z atomowych i porównać z refrakcjami molowymi. Na tej podstawie określić rodzaj składnika I i II. Podać nazwy tych związków.
Mieszanina zawierała: I ................ o ułamku masowym: ................ oraz II ................
o ułamku masowym .................
4
Tabela 1. Refrakcje atomowe Ra atomów (grup) 1 wiązań dla linii D (5893A) widma sodowego.
Rodzaje atomu (grupy)
Ugrupowania, w których atom
Lp.
Symbol
R
i wiązania
występuje
a
C C H H
1. Węgiel
-C-
C-C-C, C-C-H, C-C-H, C-C-H
2,418
C C C H
2. Wodór
-H
C-H, O-H, H-H, S-H
1,100
3. Chlor
-Cl
C-Cl, O-Cl, S-Cl
5,967
4. Brom
-Br
C-Br, O-Br, S-B
8,865
5. Jod
-I
C-I, O-I, S-I
13,90
6. Tlen karbonylowy
=O
>C=O
2,211
7. Tlen alkoholowy
-O-
C-O-H
1,525
8. Tlen eterowy
-O-
C-O-C
1,643
9. Siarka tiolowa
-S-
C-S-H
7,690
10. Siarka tioeterowa
-S-
C-S-C
7,970
H
11. Azot amin I-rzędowych
>N-
C-N
2,322
H
C
12. Azot amin II-rzędowych
-N=
H-N
2,502
C
C
13. Azot amin III-rzędowych
N≡
N -C
2,840
C
O
14. Azot nitro
-N<
C-N
........
O
15. Azot nitrozo
-N
C-N=O
........
16. Grupa nitrylowa
-CN
-C≡N
5,415
17. Grupa izonitrylowa
-NC
-N=C
6,136
18. Pierścień trójczłonowy
0,710
19. Pierścień czteroczłonowy
0,480
20. Pierścień benzoesowy
5,200
21. Wiązanie podwójne
C=C
>C=C<
1,733
22. Wiązanie potrójne
C≡C
-C≡C-
2,336
5
Wyszukiwarka
Podobne podstrony:
Cwiczenie 7 refraktometria
cwiczenie 4 refraktometria
Cwiczenie 7 refraktometria
Sprawozdania z fizycznej 1, Refraktometria - nasze, Sprawozdanie z ćwiczenia nr
FIZYKA-sprawozdania, s2, Celem ćwiczenia jest wyznaczenie współczynnika załamania kilku badanych cie
Ćwiczenie 1 Piknometria i refraktometria
3 ćwiczenia BADANIE asfaltów
Ćwiczenie7
Cwiczenia 2
Ćwiczenia V
metody redukcji odpadów miejskich ćwiczenia
Ćwiczenia1 Elektroforeza
cwiczenia 9 kryzys
Ćwiczenia 1, cz 1
Ćwiczenie 8
więcej podobnych podstron