
W związku z tym, że przy ostatnich wyborach do
Samorządu Studentów Uniwersytetu Wrocławskiego
frekwencja wyniosła 2%, w tym roku powstała silna
grupa studentów, którzy chcą to zmienić.
Jeżeli jest to możliwe, prosimy o pomoc
polegającą na poinformowaniu studentów
Wydziału Fizyki, że
w najbliższy poniedziałek i wtorek, (2XI - 3XI)
na ich Wydziale przy pl. M. Borna 9 wystawione zostaną urny
wyborcze w związku z tegorocznymi wyborami do organów
regulaminowych Samorządu Studentów Uniwersytetu
Wrocławskiego, w skład których wchodzą:
-Parlament studentów,
-Wydziałowa rada samorządu studentów,
-Starosta wydziału

Samorząd to niesamowite miejsce do rozmów, od
niego zależy większość spraw dotyczących studentów.
W tych wyborach, realnie może się poprawić sposób
funkcjonowania organów administracji w społeczności
Studentów Uniwersytetu Wrocławskiego. Następne
wybory odbędą się dopiero za trzy lata.
Z poważaniem,
Anna Koropczuk, Wydział Prawa Administracji i
Ekonomii, UWr Krzysztof Parjaszewski, Wydział
Matematyki i Informatyki UWr
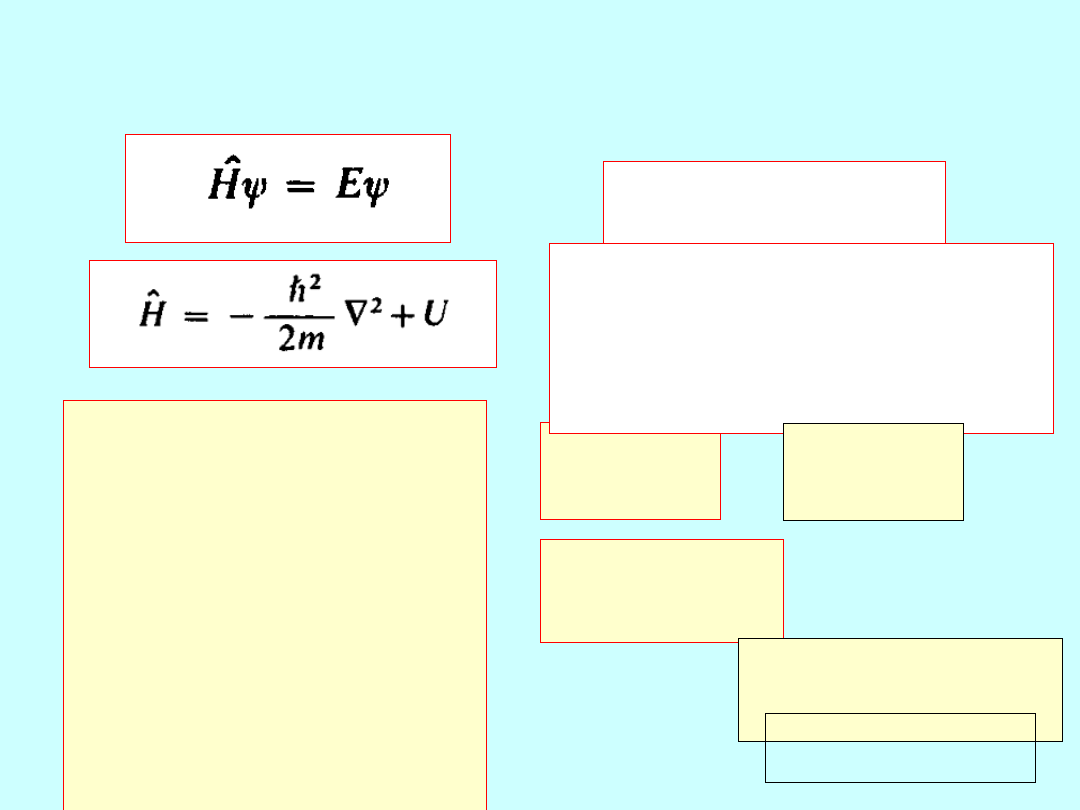
Atomy w mechanice kwantowej
1. Atom wodoru i
wodoropodobny
2. Atom
wieloelektronowy
- metale alkaliczne
Li, Na, K, Rb, Cs, Fr
- inne pierwiastki
E =
E(
n
)
ψ =
ψ(
n,l,m
l
,m
s
)
n = 1, 2, 3, ...; l = 0, 1,
.., n-1;
m
l
= -l, -l+1,..., l; m
s
=
-1/2, 1/2
E =
E(
n,l,m
s
)
E
R/n
2
E R/
(n+
α
(l,m
s
))
2
Rydberg,
α - defekt kwantowy
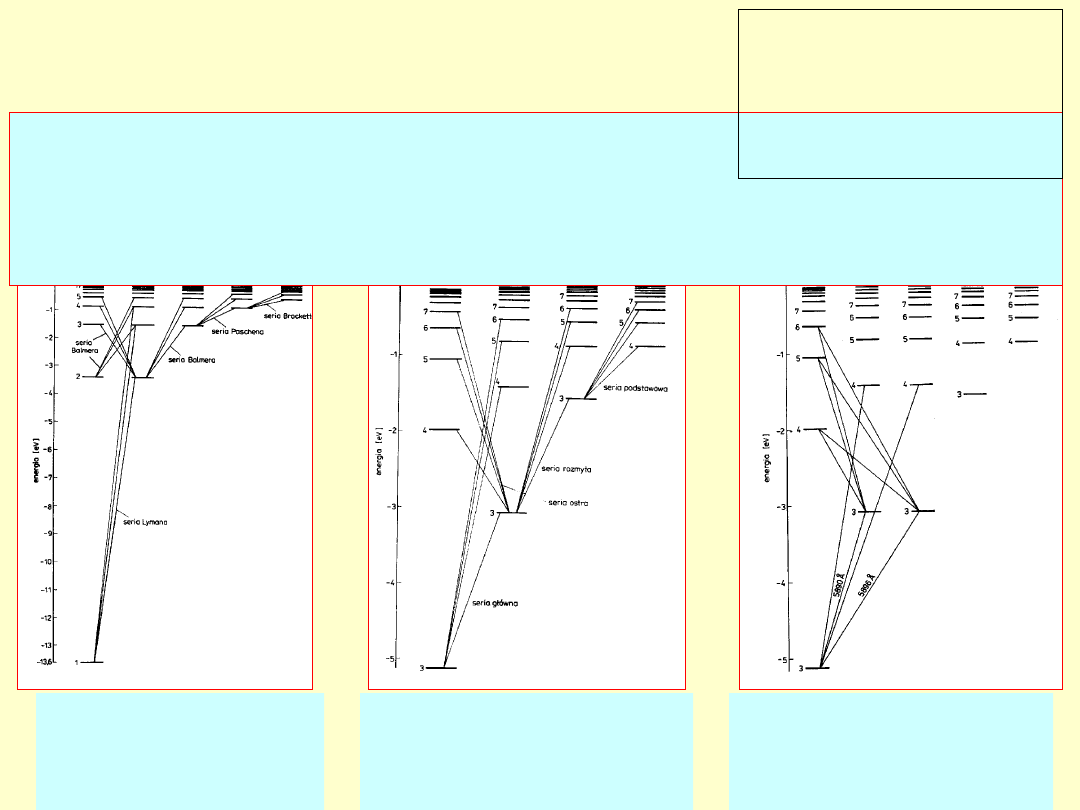
Poziomy struktury
energetycznej H
(krotność degen. =
2n
2)
Poziomy struktury
energetycznej Na
(krotność degen. =
2(2l+1))
Poziomy subtelnej
struktury
energetycznej Na
(krotność degen. =
2l+1)
Serie widmowe – reguły
wyboru
Wynik przejść między stanami o
różnych energiach
a także liczbach orbitalnego momentach pędu (l lub L) różniących się o 1
(
ΔL=±1
)
oraz równych liczbach całkowitego momentu pędu (j lub J) lub różniących
się o1 (
ΔJ=0,±1
).
Spin fotonu
Spin fotonu
=
1
(liczba spinowa
fotonu)
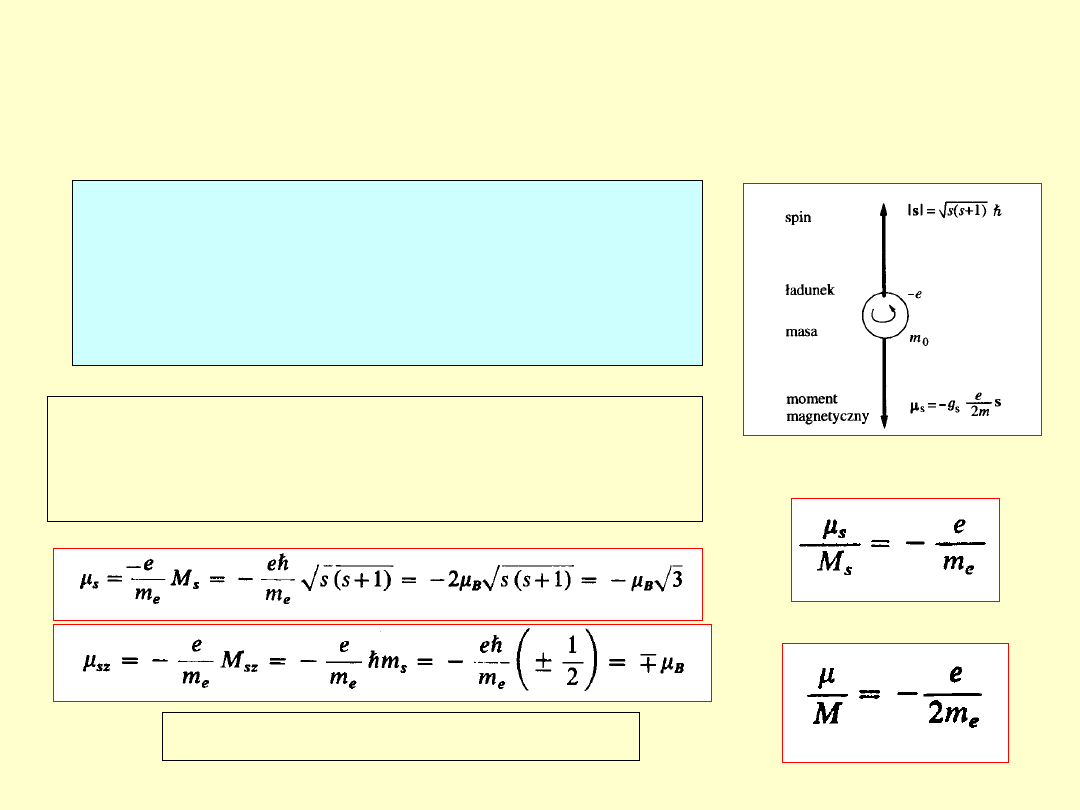
Spin elektronu
Spin elektronu
= ½
- liczba kwantowa s spinu elektronu czyli jego własnego
momentu pędu s (M
s
).
μ
B
– magneton Bohra = ½ eh/m
e
g
s
= 2 s =
1/2
Spinowy moment magnetyczny elektronu
μ
s
jest wprost proporcjonalny do jego spinu M
s
(s)
elektron
wirująca kula
Spin elektronu a właściwie
spinowy moment magnetyczny
spinowy moment magnetyczny
elektronu
elektronu
μ
μ
s
s
jest odpowiedzialny za
subtelną strukturę widm atomowych
subtelną strukturę widm atomowych
.
–
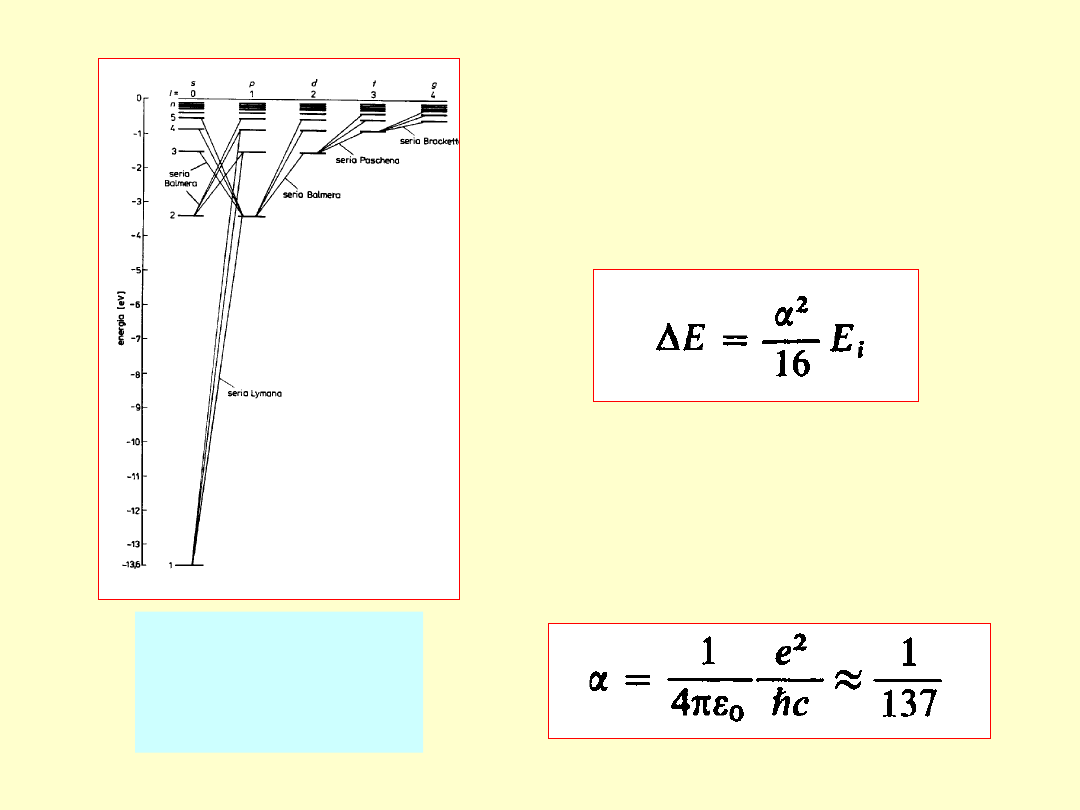
Odległość między
poziomami struktury
subtelnej atomu wodoru,
uwarunkowana spinem
elektronu (efekt
relatywistyczny):
E
i
– energia jonizacji (dla M
j
= )
Bezwymiarowa stała α -
stała struktury
subtelnej:
Poziomy struktury
energetycznej H
(krotność degen. =
2n
2)

Atomy
wieloelektronowe
1. Moment pędu.
2. Moment magnetyczny.

Moment pędu atomu
wieloelektronowego
(
suma momentów orbitalnych i spinowych wszystkich
elektronów)
- uwarunkowany oddziaływaniem momentów
magnetycznych
1. Sprzężenie Russela-Saundersa lub
sprzężenie L-S (
występuje najczęściej
).
J = Σl
i
+ Σs
i
, L = Σl
i
, S = Σs
i
,
(J = L+S)
2. Sprzężenie j-j (
ciężkie
atomy
).
J = Σ(l
i
+ s
i
),
j
i
=
l
i
+ s
i
Wektory momentu pędu:
orbitalnego – L (M
L
), własnego – S (M
S
),
całkowitego – J (M
J
).
M
J
= ΣM
l
+ ΣM
s
, M
L
= ΣM
l
, M
S
= ΣM
s
,
(M
J
= M
L
+M
S
)
M
J
= Σ(M
l
+ M
s
), M
j
= M
l
+ M
s
i i i i
i i i i
i
Sprzężenie Russela-
Saundersa
J = L+S, L+S–1, ... , |L–S|
2S+1 (S<L) lub 2L+1 (L<S) wartości całkowitych lub
połówkowych (decyduje wartość S, L zawsze całkowite)
Symbol
charakteryzujący stan
elektronów atomu –
term stanu tych
elektronów.
Liczby kwantowe:
S - spinowa
L – orbitalna,
J - całkowitego momentu
pędu
L = S (
L=0
), P (
L=1
), D (
L=2
), F
(
L=3
), itd.
Przykład.
S = 1
(2S+1=3)
L = 1,
J = 0, 1, 2
2S+1
L
J
3
P
0
,
3
P
1
,
3
P
2

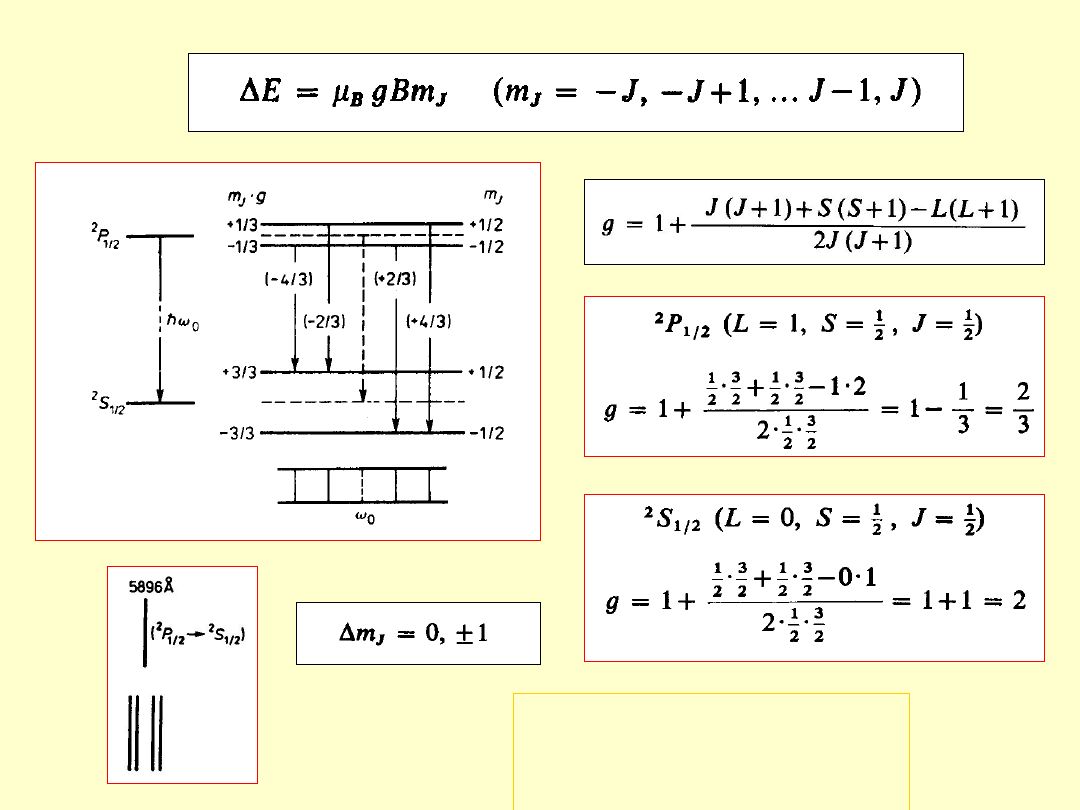
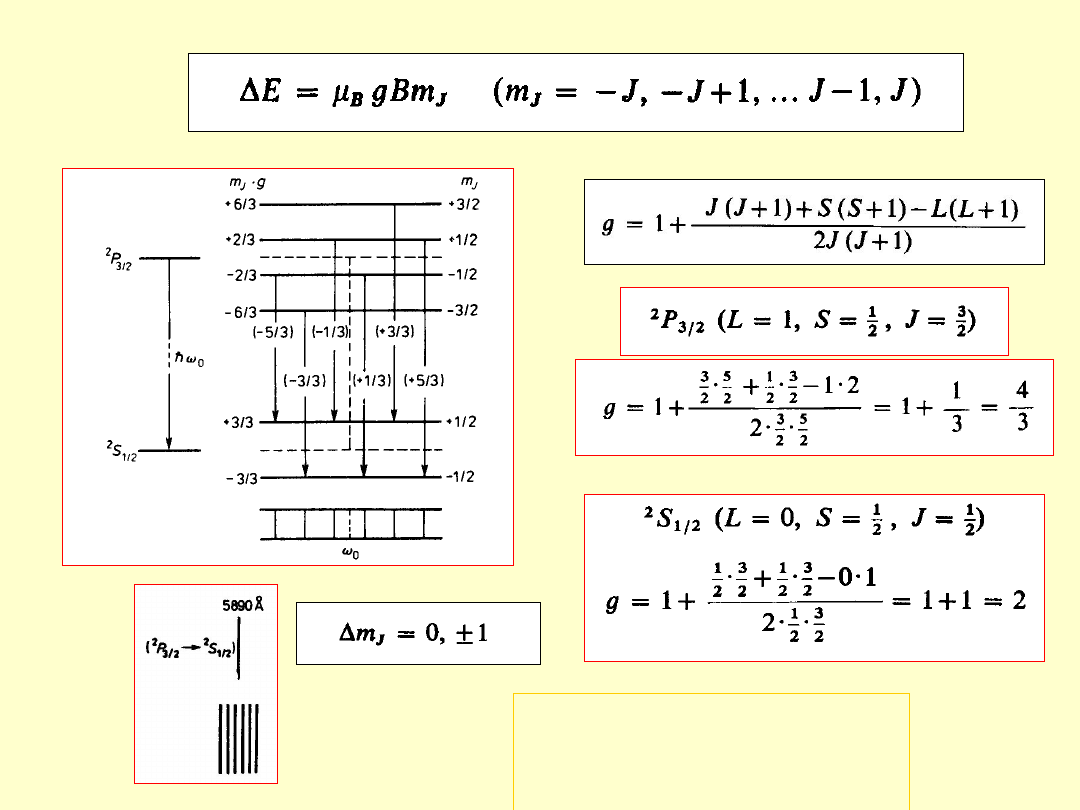
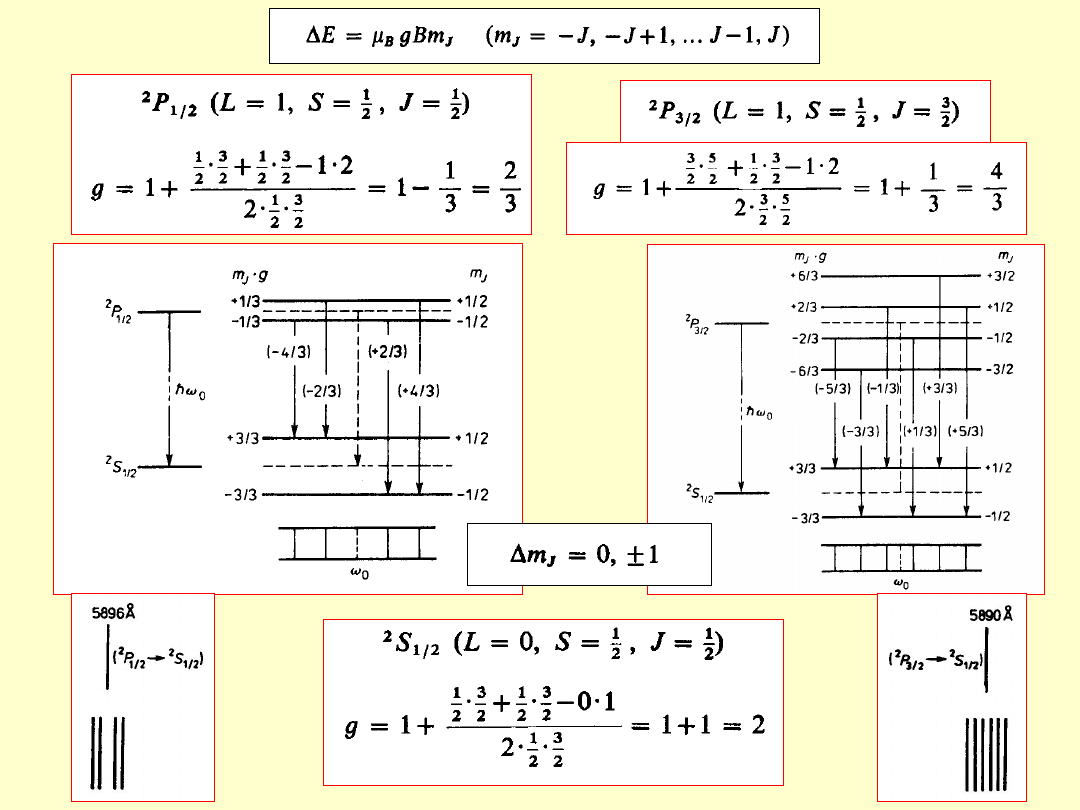
Moment magnetyczny atomu
orbitaln
y
spinow
y
całkowi
ty
Magnet
on
Bohra
Czynnik
Landégo
Spinowy i orbitalny czynnik
Landégo elektronu nie są
jednakowe.
g
s
= 2g
l
(g
s
=2, g
l
=1)
W konsekwencji
μ
μ
j
j
i
i
J
J
nie są współliniowe.
nie są współliniowe.
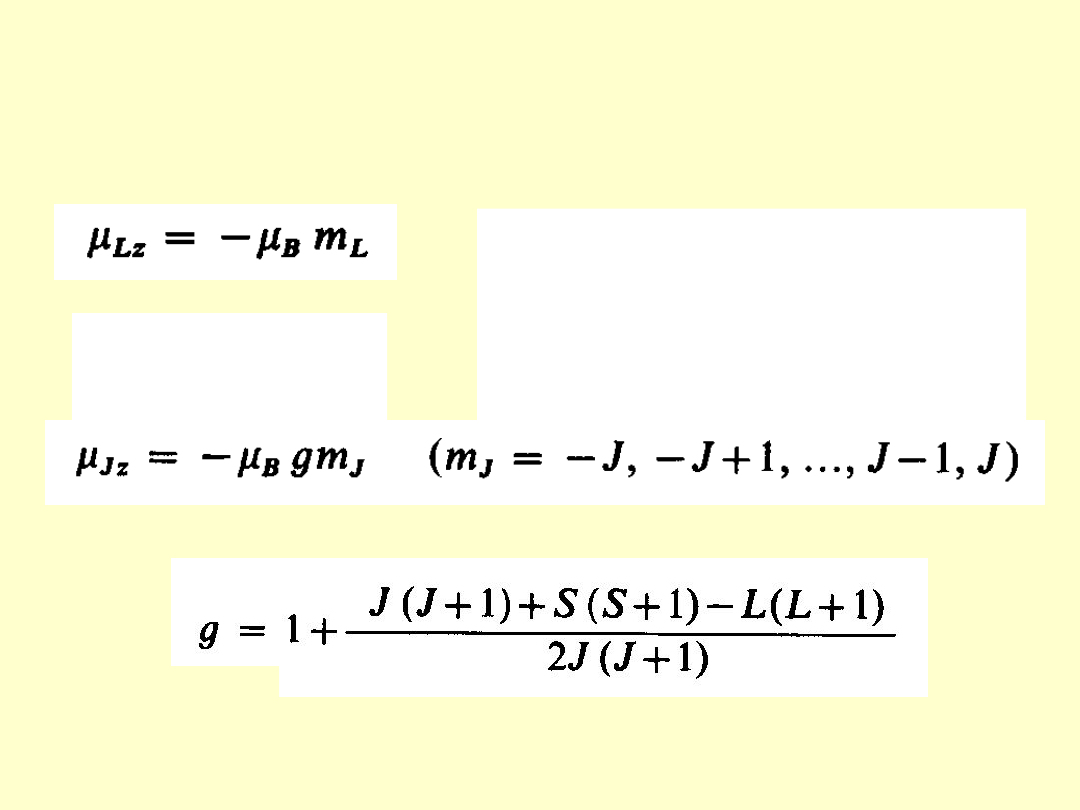
μ
Sz
= – 2 μ
B
m
S
Rzuty μ na wyróżnioną oś
(
z
)
(m
L
= – L, – L+1, ..., L
– 1, L)
(m
S
= – S, – S+1, ..., S
– 1, S)
Czynnik
Landégo
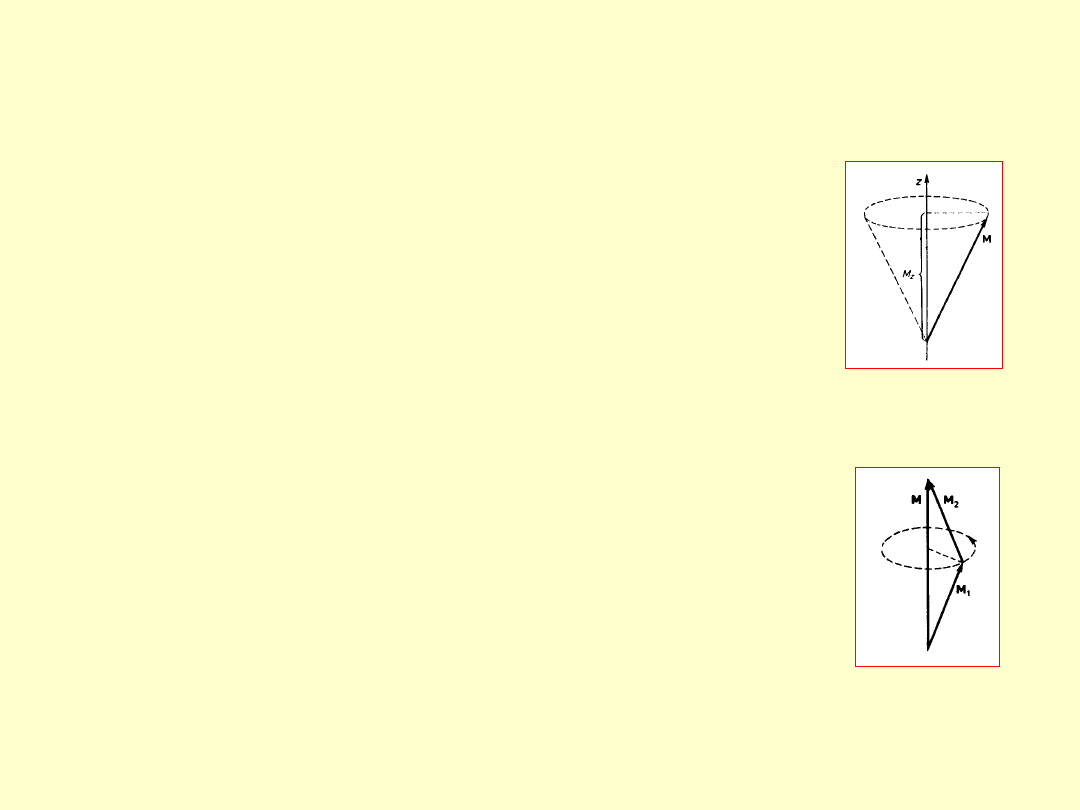
Wektorowy model
atomu
1. Jeżeli znany jest moment pędu M i jedna
z jego składowych M
z
(wzdłuż osi z) to
wektor M wykonuje ruch precesyjny wokół
osi z (dwie pozostałe jego składowe M
x
i M
y
są w tym przypadku nieokreślone).
2. Jeżeli moment pędu M jest
wypadkowym wektorem dwóch momentów
pędu M
1
i M
2
, oddziaływujących ze sobą za
pośrednictwem momentów magnetycznych
μ
1
i μ
2
, to M
1
i M
2
wykonują ruch
precesyjny wokół kierunku wektora M z
częstością proporcjonalną do energii
oddziaływania między μ
1
i μ
2
.
Jeżeli jednocześnie znany jest moment
pędu M i jedna z jego składowych M
z
to
wektor M wykonuje z kolei ruch
precesyjny wokół osi z (patrz pkt.1).

Atom w polu
magnetycznym.
1. Zjawisko Zeemana (1896) – normalne i
anomalne.
2. Zjawisko Paschena – Backa (1912).
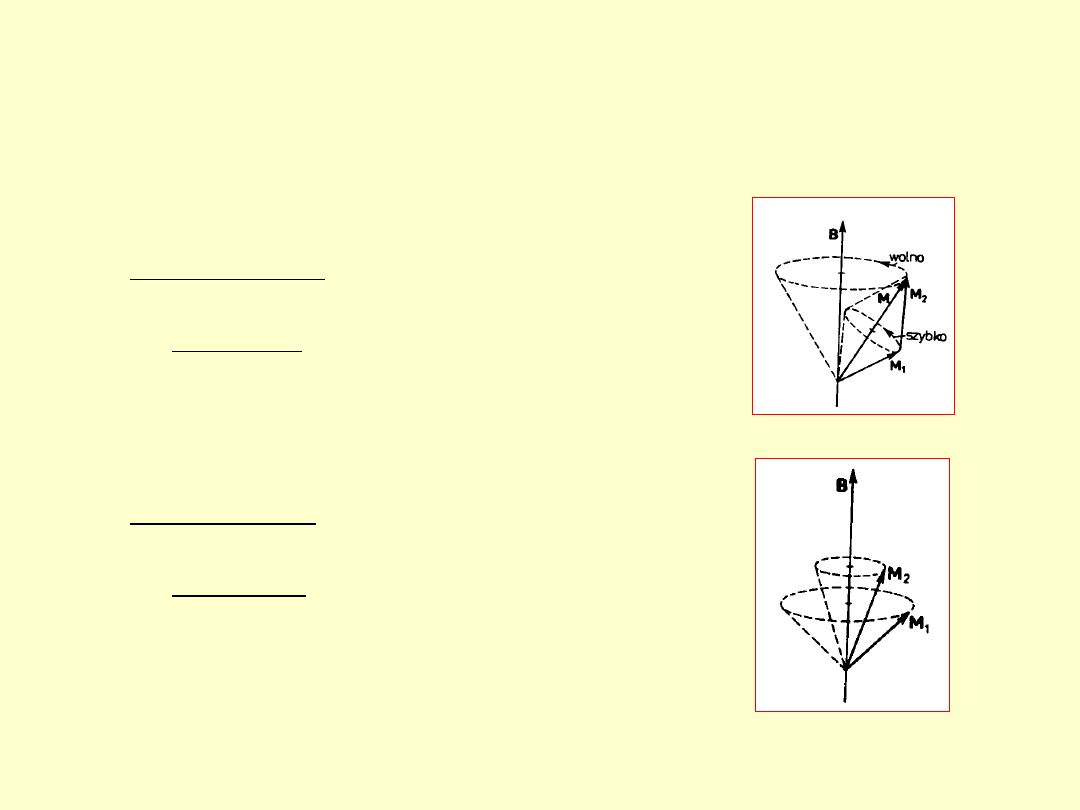
Pole magnetyczne B
wzdłuż osi z
1. Słabe pole B – oddziaływanie
momentów magnetycznych ze
sobą większe od oddziaływania
każdego z nich z polem
magnetycznym.
2. Silne pole B – oddziaływanie
momentów magnetycznych ze
sobą mniejsze od oddziaływania
każdego z nich z polem
magnetycznym.
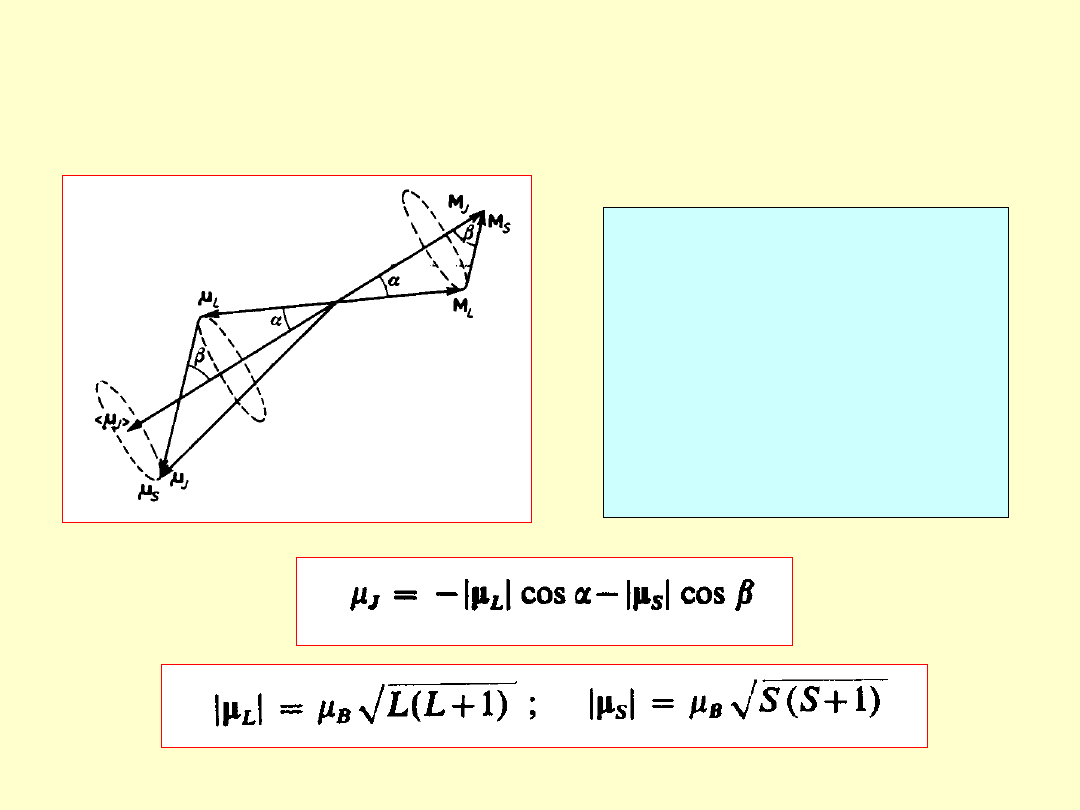
Czynnik
Landégo
Spinowy i orbitalny czynnik
Landégo elektronu nie są
jednakowe.
g
s
= 2g
l
(g
s
=2, g
l
=1)
W konsekwencji
μ
j
i M
j
nie są współliniowe.
2
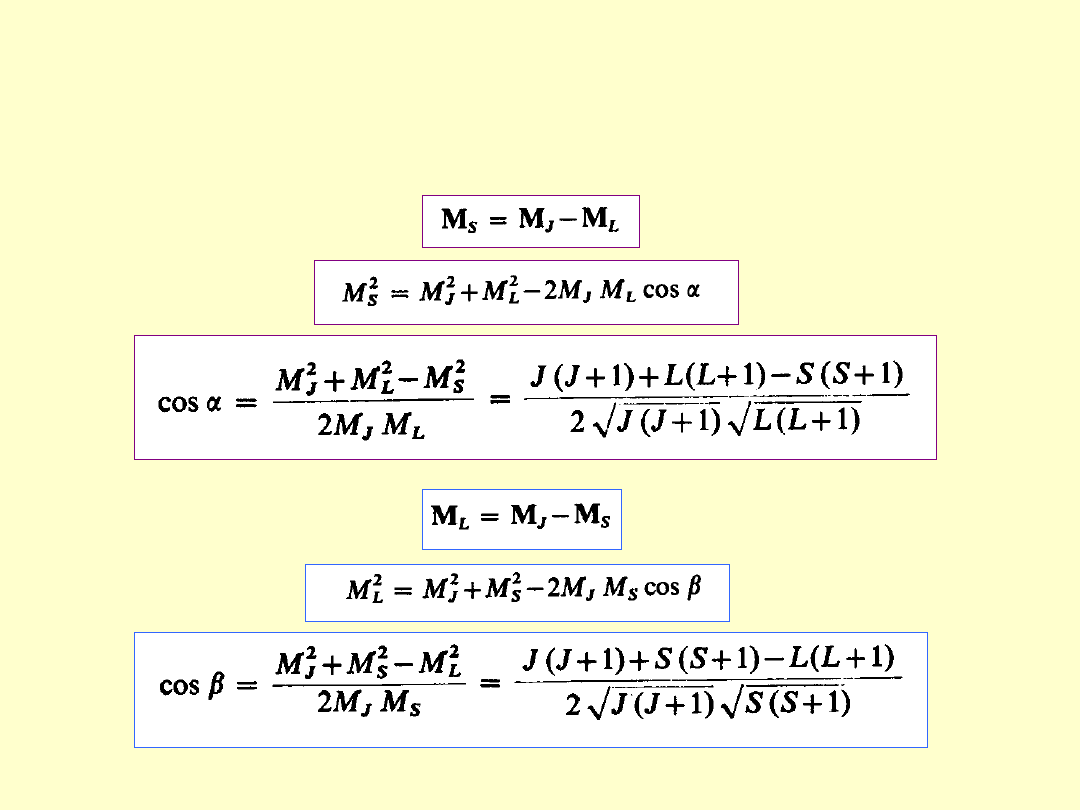
Czynnik Landégo c.d.
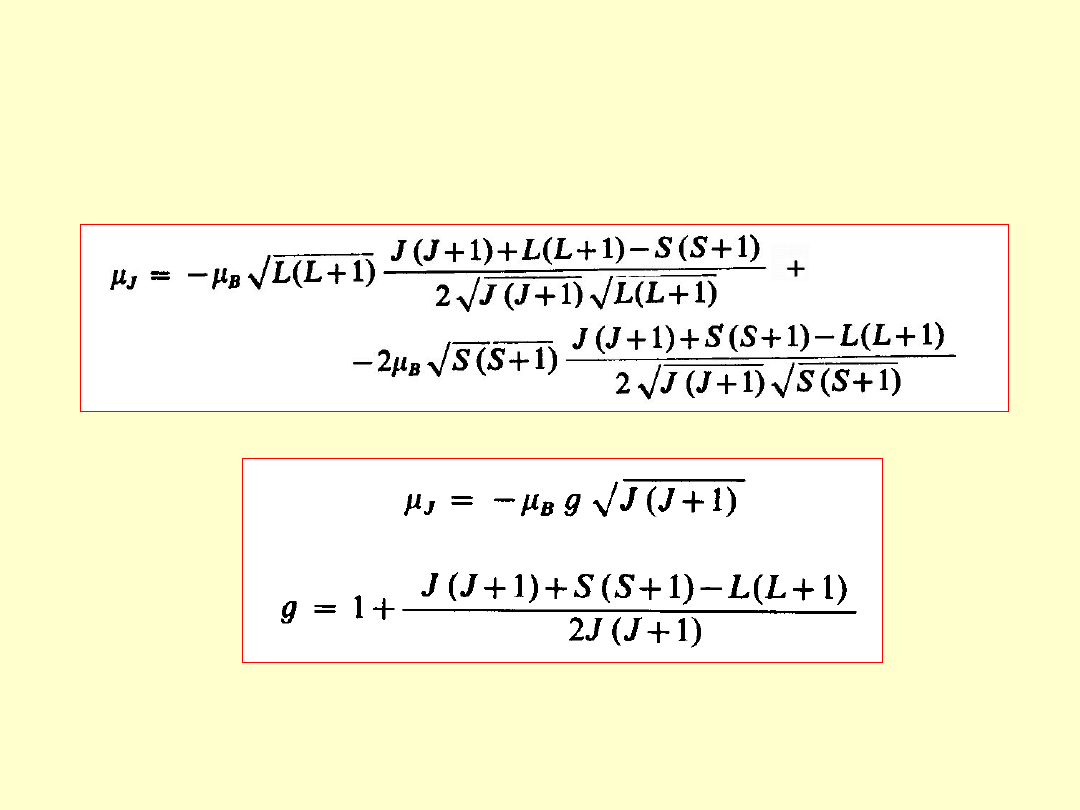
Czynnik Landégo
c.d.

Zjawisko Zeemana
Zeemana
- 1896
rozszczepienie poziomów energetycznych atomu
(i w konsekwencji linii widmowych)
pod wpływem zewnętrznego, słabego
słabego
pola
magnetycznego
(rozszczepienie magnetyczne mniejsze od
multipletowego – uwarunkowane subtelnym
oddziaływaniem spin-orbita)
ΔE = -μ
J
•B = -μ
J
B
cos(μ
J
,B)
Pole magnetyczne zdejmuje degeneracje stanów o różnej liczbie
kwantowej m
J
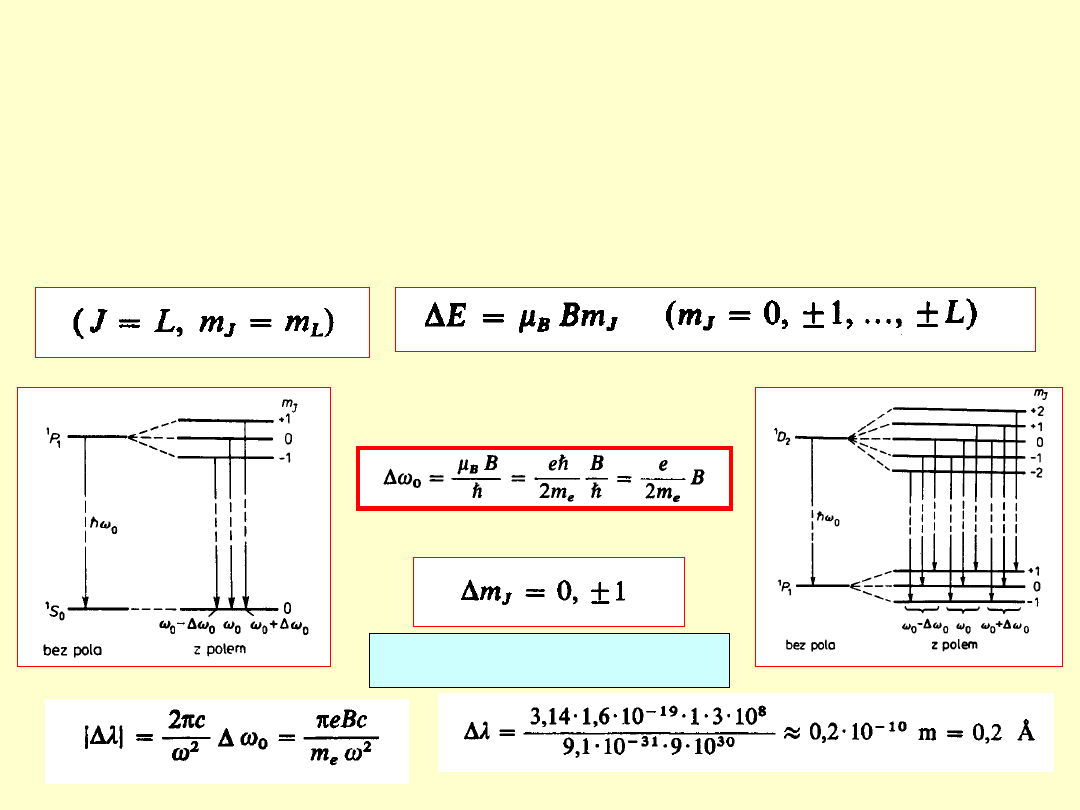
Normalne
Normalne
zjawisko Zeemana
– rozszczepienie magnetyczne
singletów
(linie widmowe nie mające struktury subtelnej –
wynik przejść między poziomami z S=0 czyli g=1)
Jednakowa odległość między kolejnymi
podpoziomami
Rozszczepienie zawsze tylko na 3
linie
Przesunięcie normalne
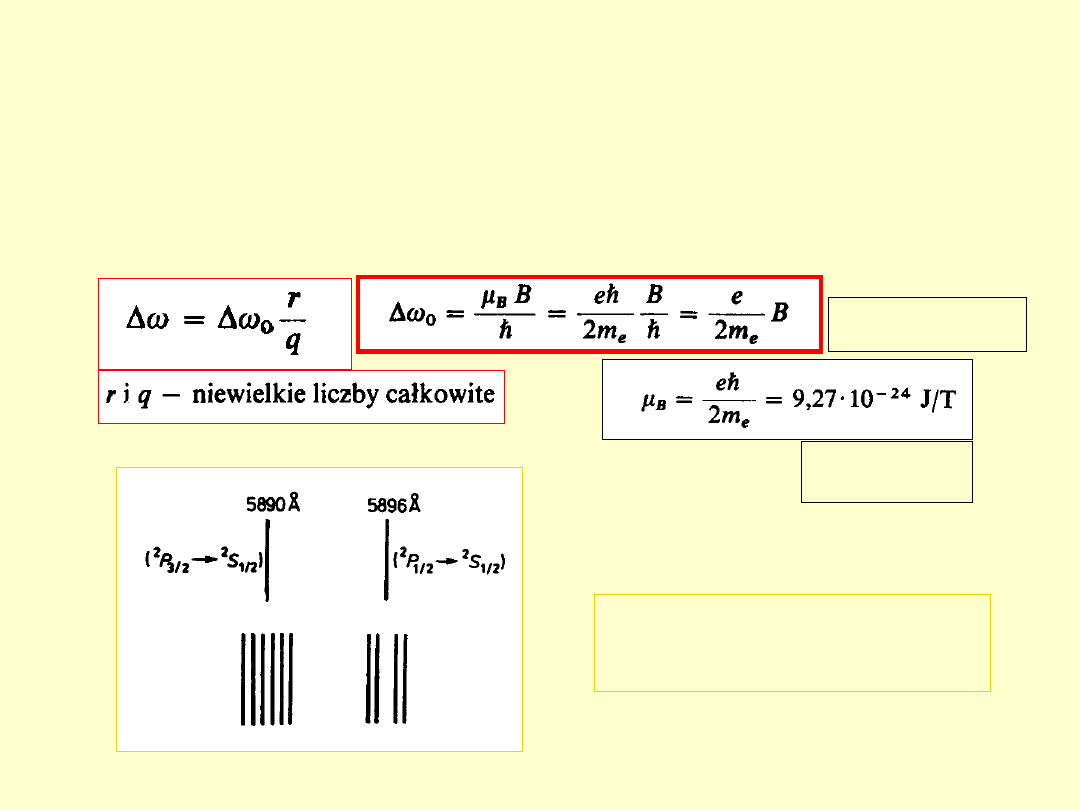
Anomalne
Anomalne
zjawisko Zeemana
– rozszczepienie magnetyczne
multipletów
(linie widmowe mające strukturę subtelną)
Przesunięcie
normalne
Rozszczepienie żółtego
dubletu sodu w słabym polu
magnetycznym
Magneton
Bohra
Rozszczepienie żółtego
dubletu sodu w słabym polu
magnetycznym – linia o
mniejszej energii
Rozszczepienie żółtego
dubletu sodu w słabym polu
magnetycznym – linia o
większej energii
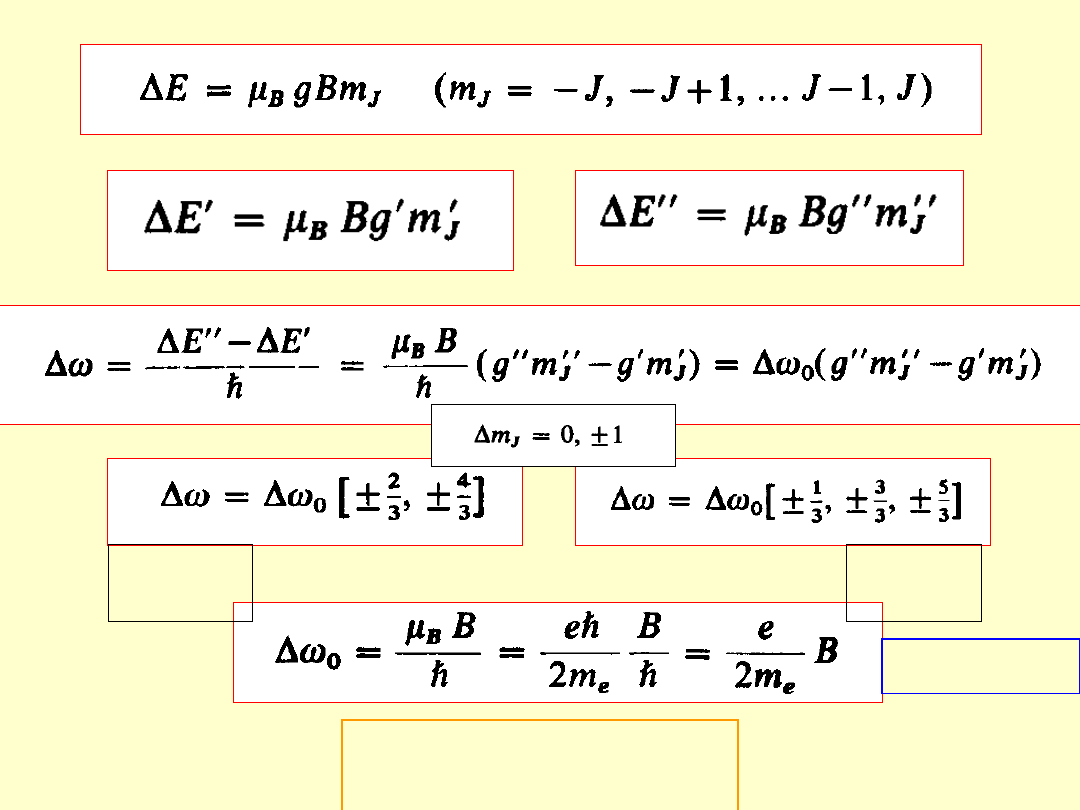
2
P
1/2
–
2
S
1/2
2
P
3/2
–
2
S
1/2
Rozszczepienie żółtego
dubletu sodu w słabym polu
magnetycznym
Przesunięcie
normalne
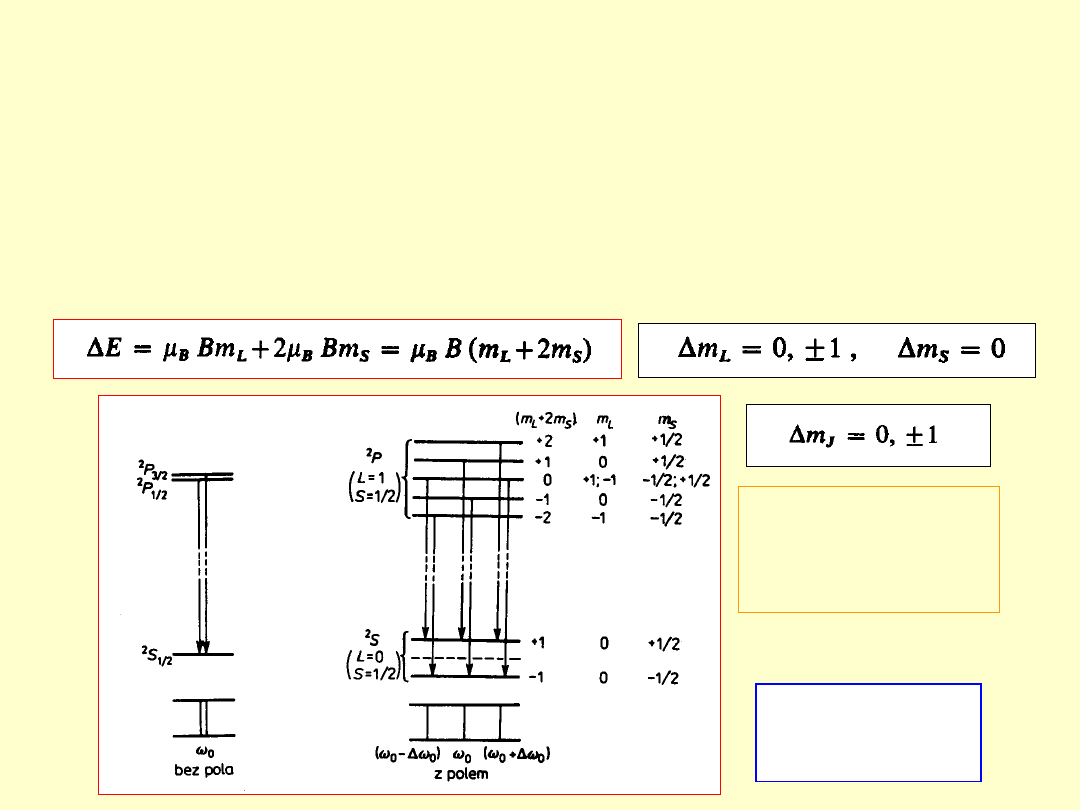
Zjawisko Paschena-Backa
Paschena-Backa
-
-
1912
1912
rozszczepienie poziomów energetycznych atomu
(i w konsekwencji linii widmowych)
pod wpływem zewnętrznego, silnego
silnego
pola
magnetycznego
(rozszczepienie magnetyczne większe od
multipletowego)
Rozszczepienie
żółtego dubletu
sodu w silnym polu
magnetycznym
Normalny
tryplet
zeemanowski
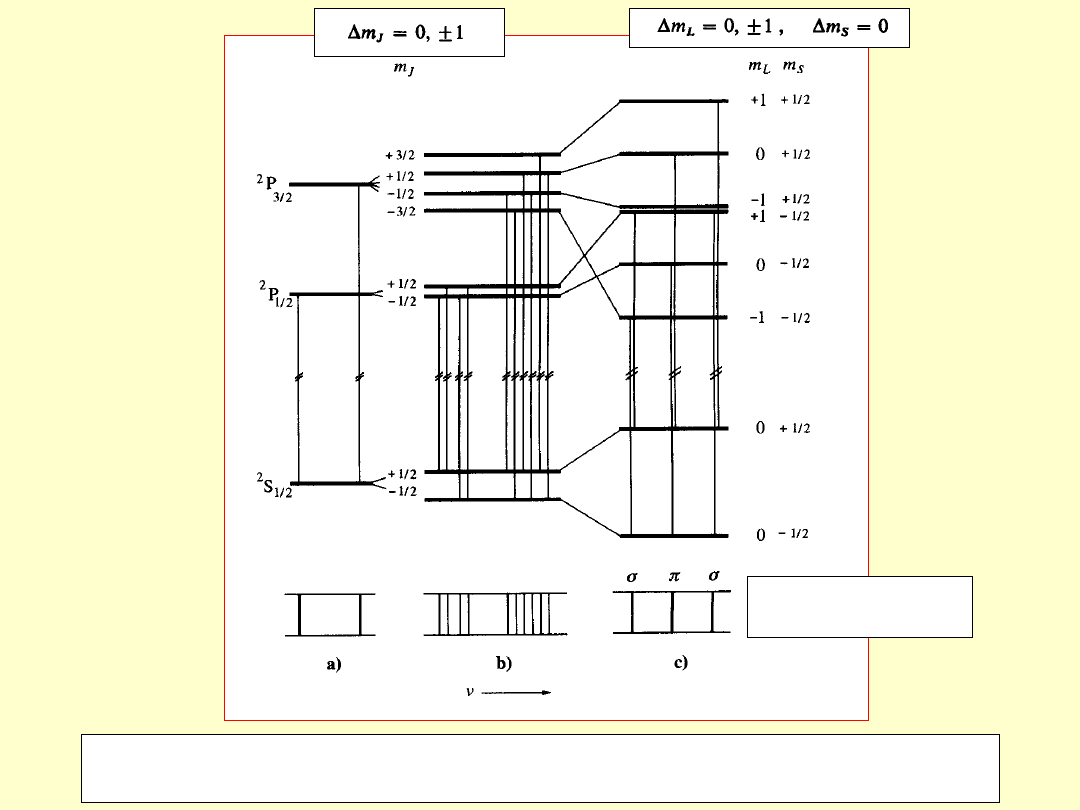
Rozszczepienie żółtego dubletu sodu (a) w słabym (b) i silnym (c) polu
magnetycznym
Normalny tryplet
zeemanowski

Konfiguracja elektronowa
atomu
1. Charakterystyki stanu elektronu.
2. Zakaz Pauliego.
3. Reguły Hunda
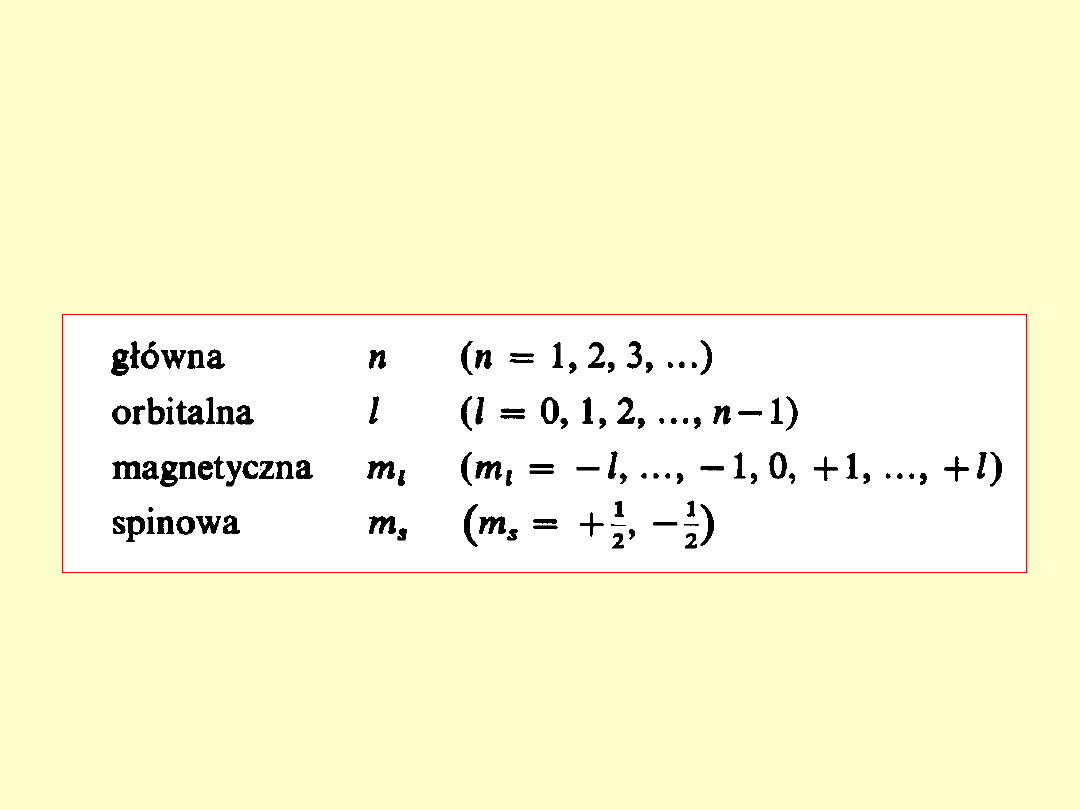
Stan każdego elektronu w atomie
charakteryzują cztery liczby
kwantowe:

Zakaz Pauliego:
W tym samym atomie nie może być dwóch
elektronów opisanych przez taki sam zbiór
czterech liczb kwantowych: n, l, m
l
i m
s
.
W stanach o danej wartości n
może być w atomie nie więcej
niż 2n
2
elektronów:
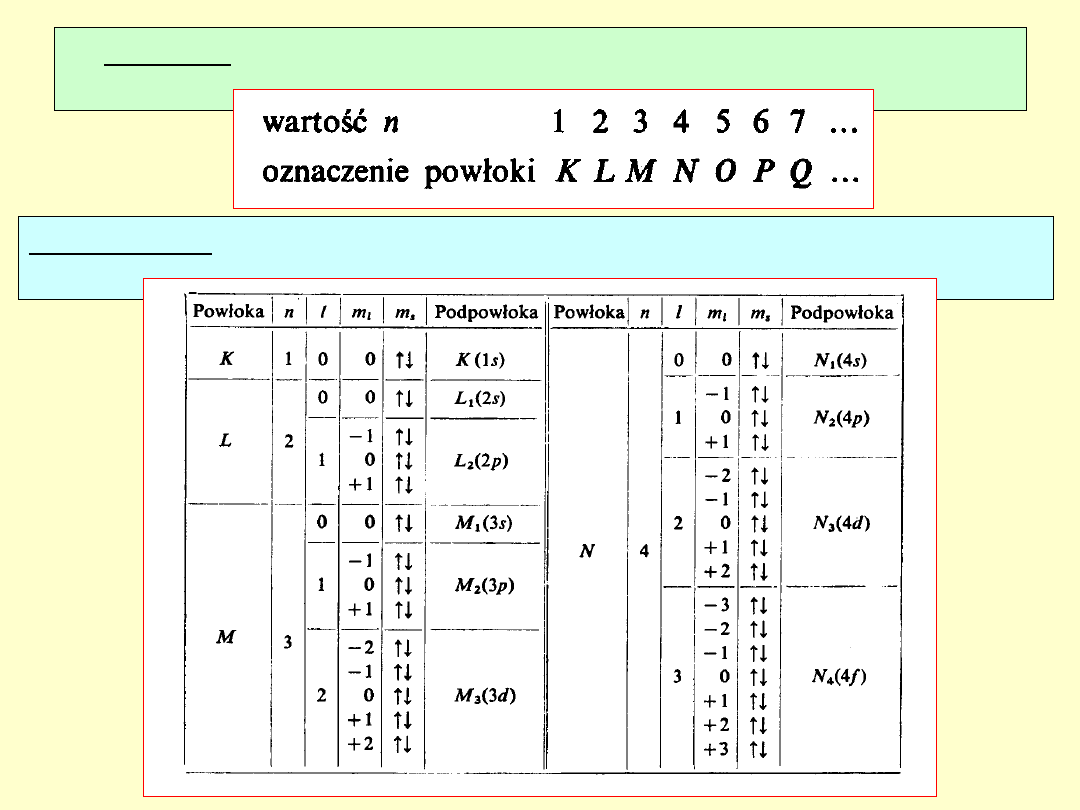
Powłoka: zbiór elektronów atomu o takiej samej wartości
liczby kwantowej n.
Podpowłoka: zbiór elektronów powłoki o takiej samej wartości
liczby kwantowej l.

Dla całkowicie zapełnionej
podpowłoki
jej sumaryczny spinowy moment
pędu S
i sumaryczny orbitalny moment
pędu L
są równe zeru tj.
S = 0
i
L = 0
stąd
J =
0.
Przy wyznaczaniu L i S
atomu można nie brać pod
uwagę zapełnionych
podpowłok.
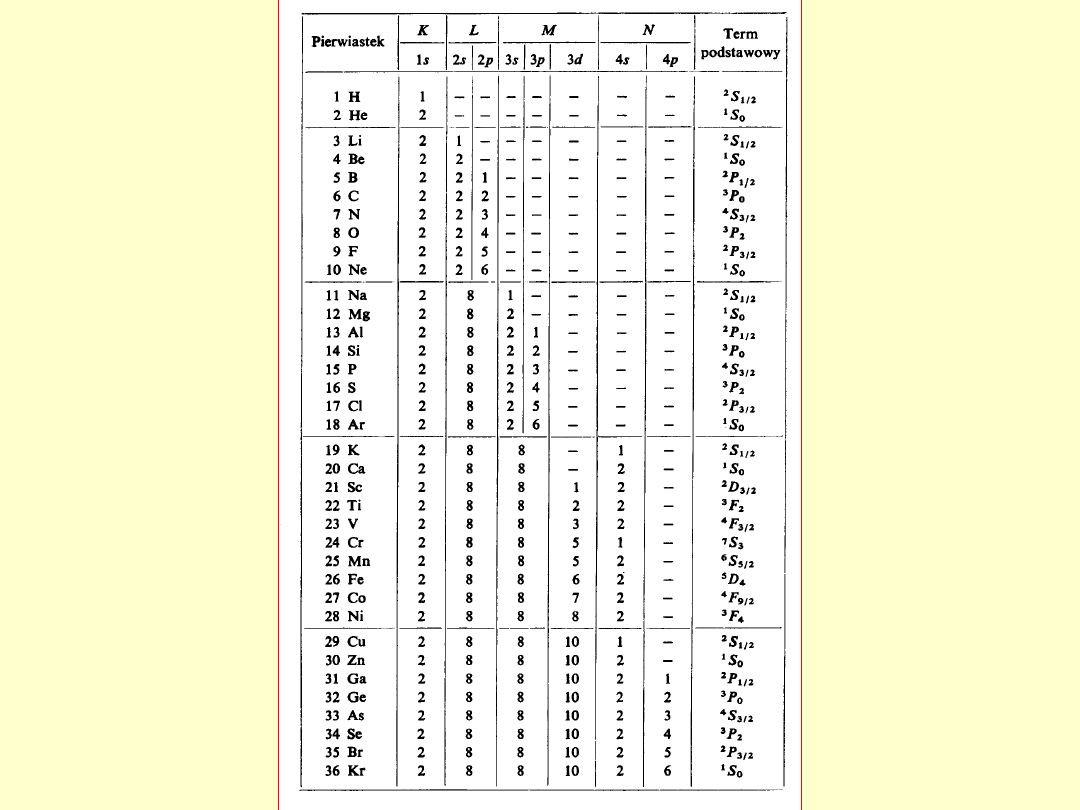
Konfiguracja elektronowa atomu zapisywana jest
przez podanie symboli wszystkich stanów
elektronowych nl obsadzonych przez elektrony
począwszy od podstawowego 1s, wraz z liczbą
elektronów k w poszczególnych stanach – ciąg
symboli nl
k
;
np. konfigurację elektronową atomu litu zapisujemy
w postaci: 1s
2
2s
1
.
Informacja o wartościach S, L i J dla danego
stanu elektronów atomu zawarta jest w symbolu
termu tego stanu:
2S+1
L
J
;
np. term podstawowego stanu atomu litu ma
postać:
2
S
1/2
.

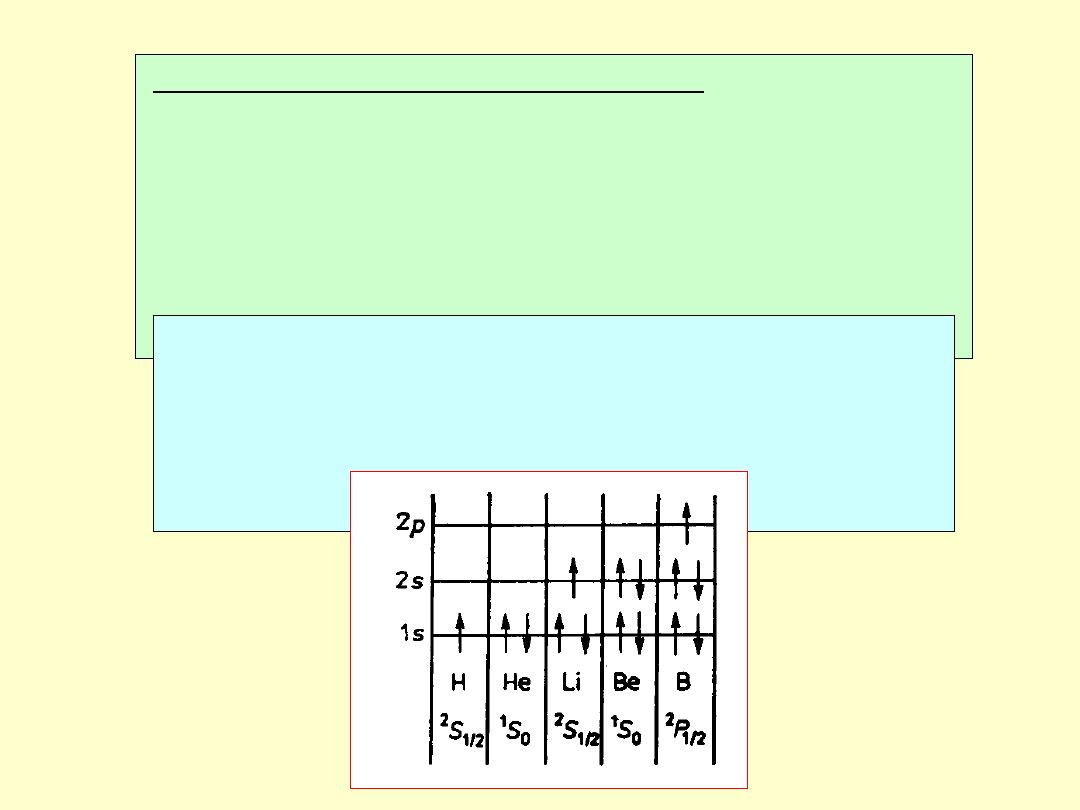
Reguły Hunda
1. Spośród termów odpowiadających danej
konfiguracji elektronowej najmniejszą energię ma
term o największej możliwej wartości S oraz o
największej wartości L możliwej przy takim S.
2. Multiplety utworzone przez elektrony równoważne
(takie samo nl) są regularne (ze wzrostem J rośnie
energia stanu), jeżeli zapełniona jest nie więcej niż
połowa podpowłoki, natomiast jeżeli zapełnienie
przekracza połowę podpowłoki to multiplety są
odwrócone (ze wzrostem J energia stanu maleje).
Wynika stąd, że dla multipletów regularnych J = |L-S| a
dla odwróconych J = L+S.
Liczba niesparowanych elektronów na podpowłokach
(nl) powinna być jak największa.

Promieniowanie
rentgenowskie
1. Generowanie.
2. Charakterystyczne promieniowanie
rentgenowskie.
3. Prawo H. Moseleya – 1913
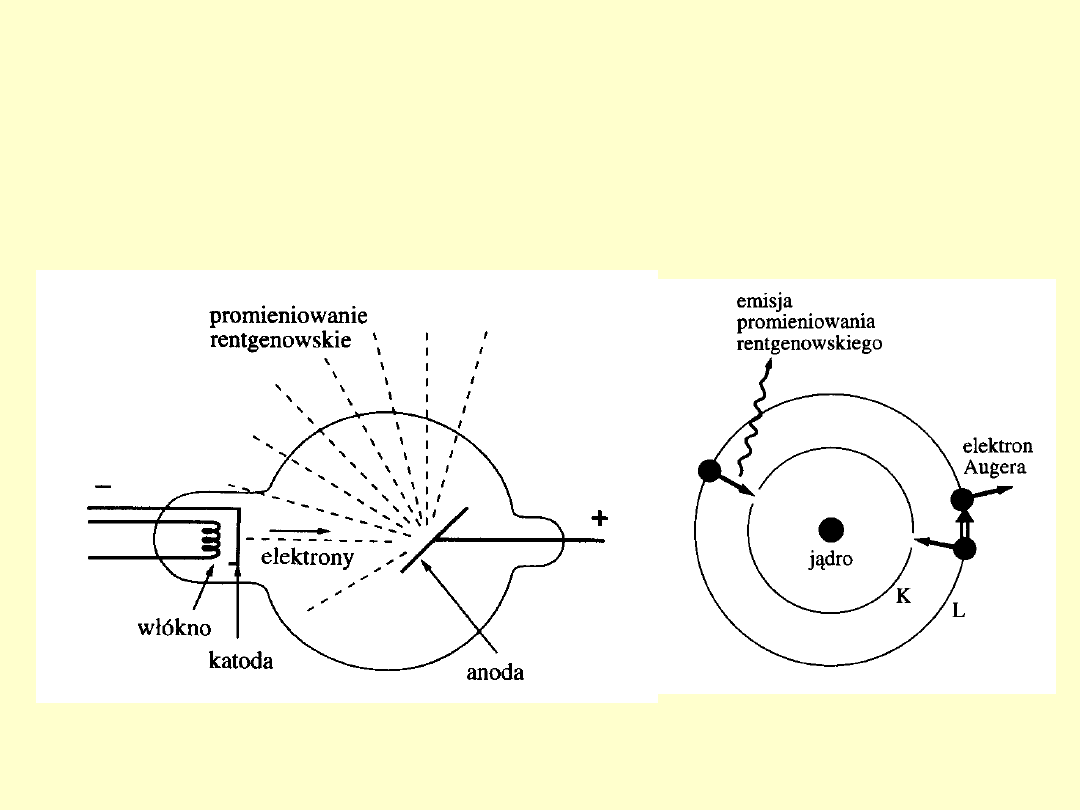
Charakterystyczne promieniowanie
rentgenowskie
- powstaje wówczas gdy wyrwany zostaje jakiś
elektron
z wewnętrznej powłoki atomu.
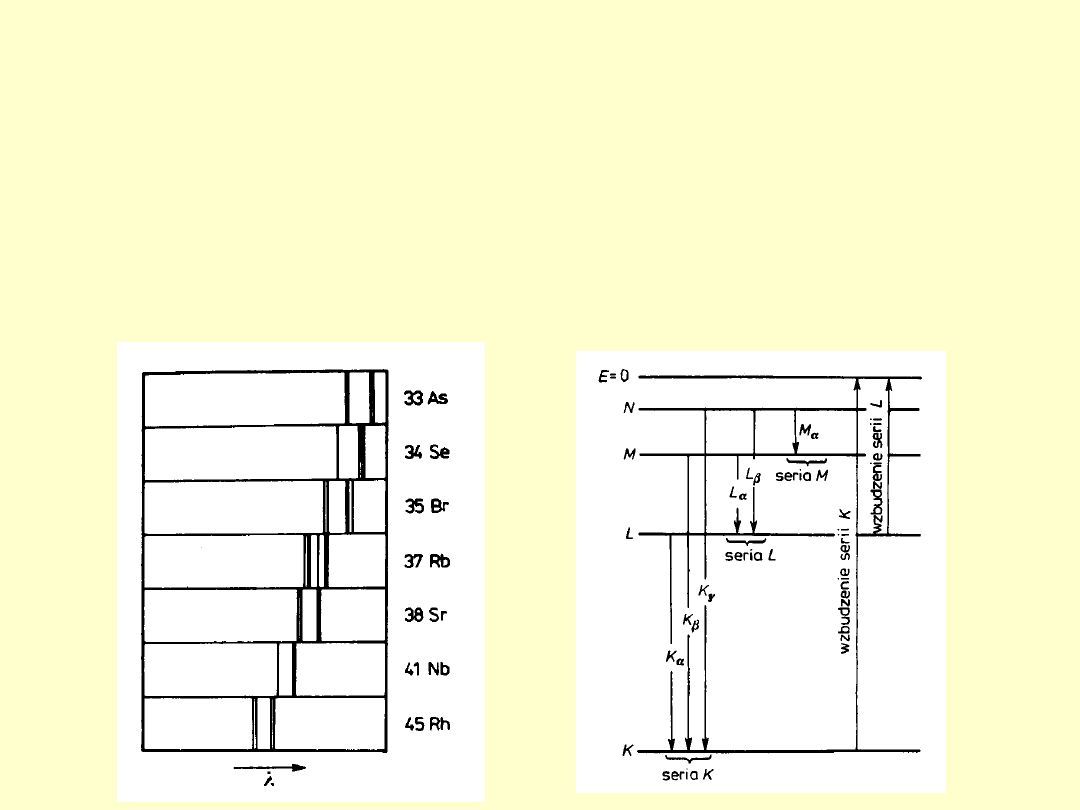
1. Charakterystyczne widma rentgenowskie składają się z
kilku serii oznaczonych literami K, L, M, N i O.
2. Liczba linii w każdej serii jest niewielka; oznaczone są one
w kolejności wzrostu częstości za pomocą greckich liter α, β,
γ, ... , np..: K
α
, K
β
, K
γ
, ... .
3. Widma różnych pierwiastków mają podobny charakter.
4. Ze wzrostem liczby atomowej Z pierwiastka jego widmo
rentgenowskie przesuwa się w stronę fal krótszych (wyższych
częstości).
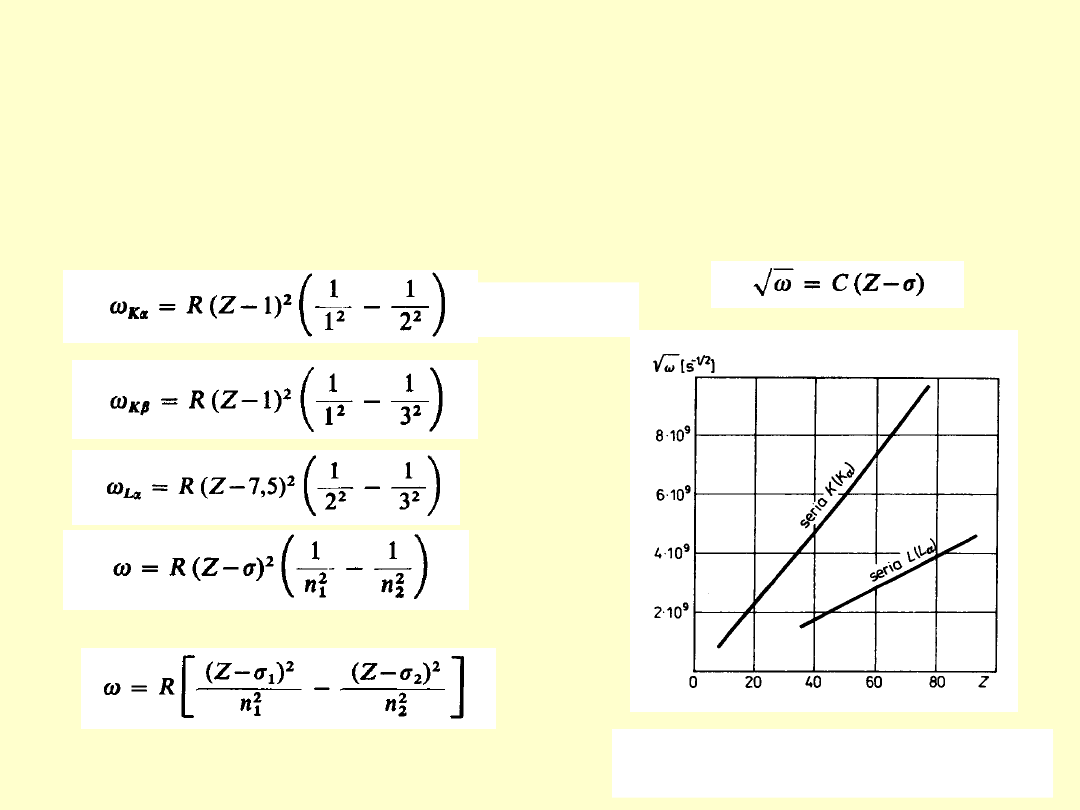
Prawo H. Moseleya – 1913
Wiąże liczbę atomową Z pierwiastka z częstością linii
emitowanego przezeń rentgenowskiego promieniowania
charakterystycznego.
R – stała
Rytberga
σ – stała ekranowania jądra przez
elektrony

Dziękuję za uwagę

Wymuszona emisja fotonów
Einstein – 1918
Zarówno przejścia absorpcyjne jak i emisyjne
atomu mogą być wywoływane przez
promieniowanie elektromagnetyczne.
Tego typu przejścia nazywamy wymuszonymi.
Promieniowanie emitowane w wyniku takich
przejść to promieniowanie wymuszone.
Promieniowania (fotony) wymuszające i
wymuszone mają taki sam kierunek rozchodzenia
się, częstość, fazę i polaryzację a zatem są
spójne.
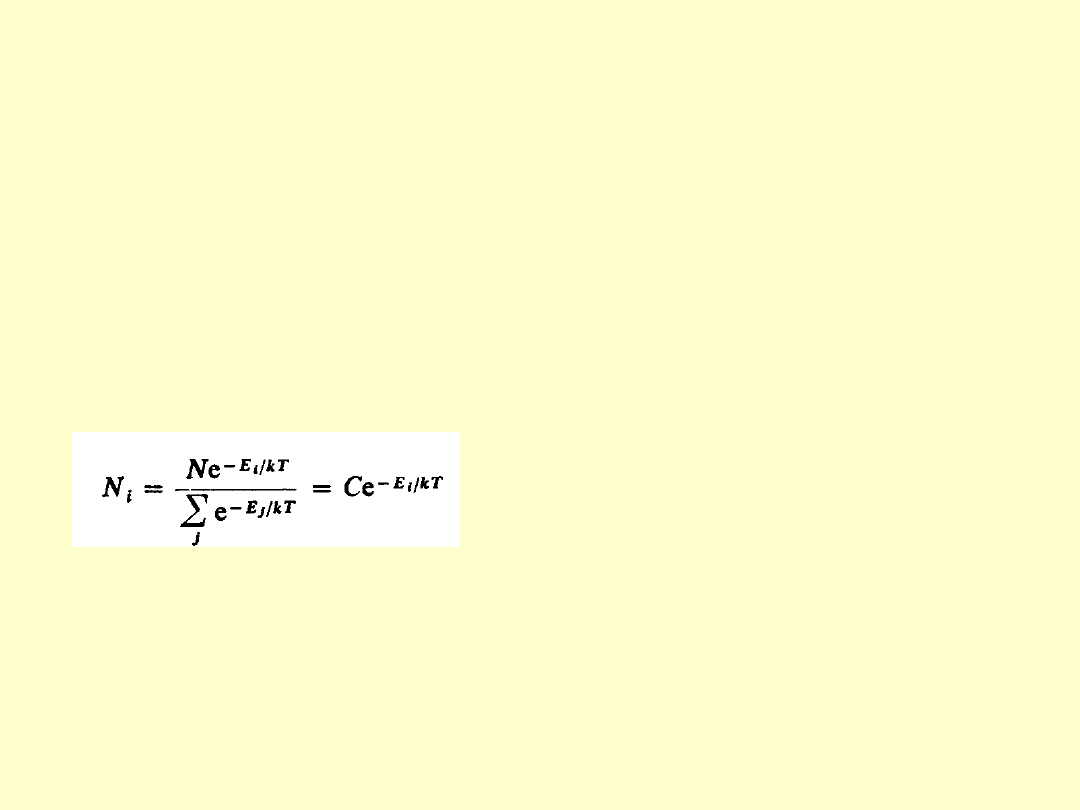
Lasery
(wzmacniacze światła za pomocą emisji wymuszonej)
1953 – MASER
(Microwave Amplification by Stimulated Emission
of Radiation)
1960 – LASER
(Light Amplification by Stimulated Emission
of Radiation)
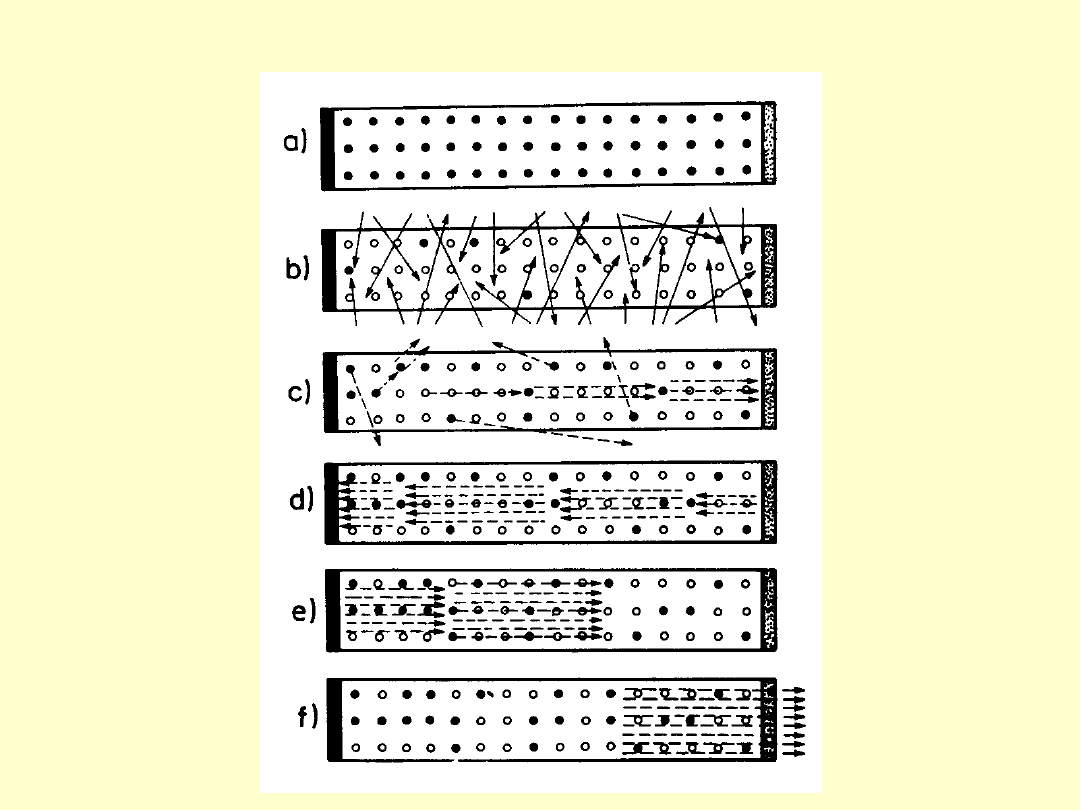
W przypadku równowagi termodynamicznej liczbę atomów
N
i
, które w temperaturze T znajdują się w stanie o energii
E
i
opisuje prawo Boltzmana:
gdzie N jest całkowita liczbą
atomów.
Liczba przejść między dwoma poziomami jest
proporcjonalna do obsadzenia poziomu wyjściowego więc
dla atomów w równowadze termodynamicznej
pochłanianie padających fotonów przeważa nad emisją
wymuszoną i spada natężenie wiązki fotonów podczas ich
przechodzenia przez materię (w równowadze
termodynamicznej).
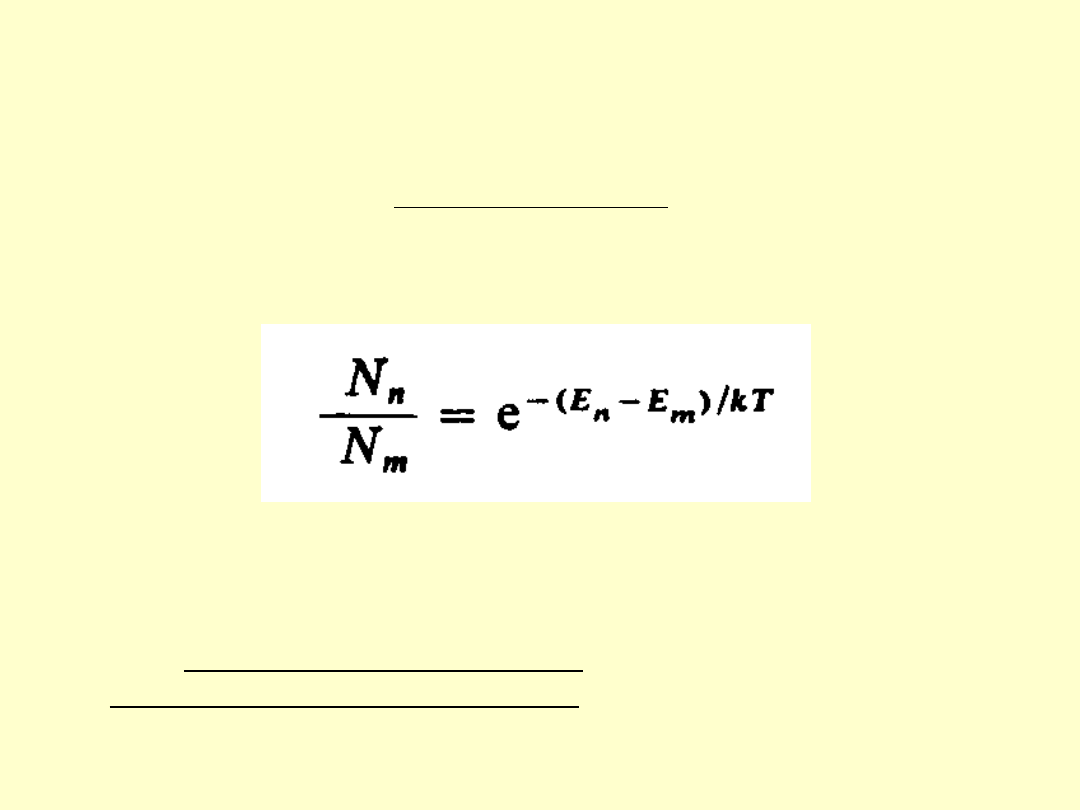
Wzmocnienie promieniowania padającego za pomocą
emisji wymuszonej w danym zespole atomów wymaga
wystąpienia w nim inwersji obsadzeń – sytuacji, w której
w stanie o większej energii E
n
jest więcej atomów niż w
stanie o mniejszej energii E
m
.
Opis takiej sytuacji (N
n
>N
m
gdy E
n
>E
m
) za pomocą
rozkładu Boltzmana wymaga by T miało wartość ujemną
stąd stany z inwersją obsadzeń nazywane są niekiedy
stanami z ujemną temperaturą.
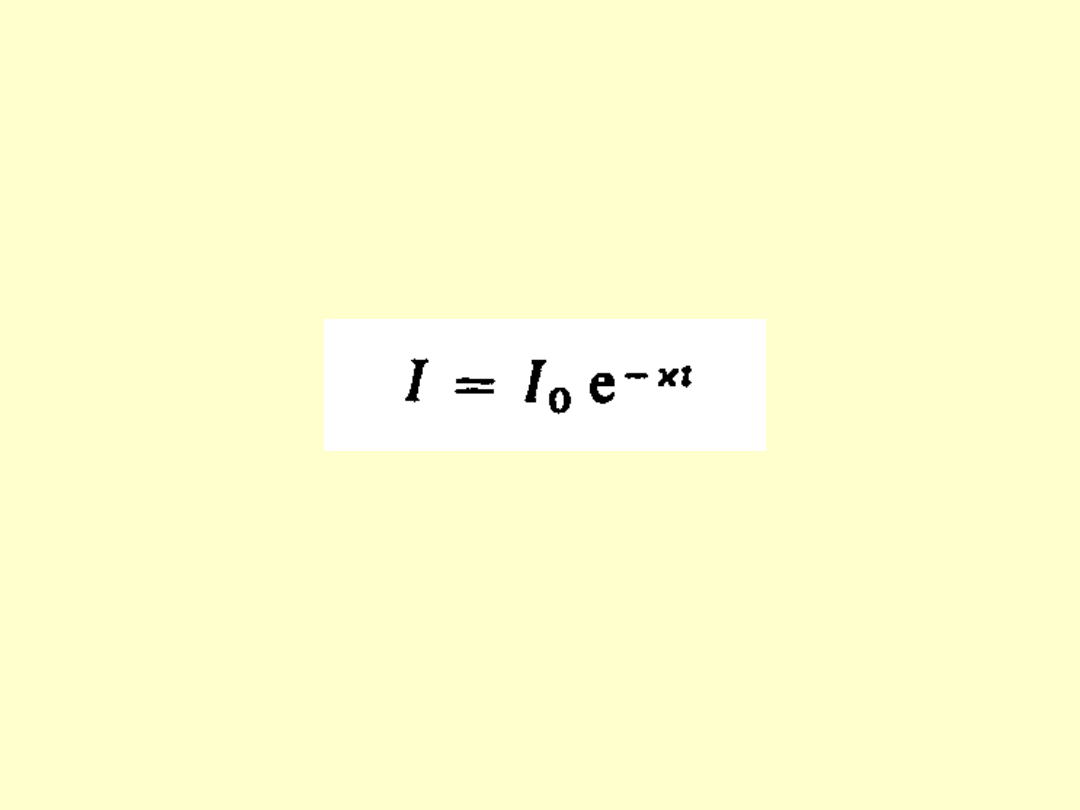
W substancji z inwersją obsadzeń, emisja
wymuszona może przewyższać pochłanianie światła
przez atomy na skutek czego padająca wiązka może
być wzmacniana przez tą substancję.
Opis takiej sytuacji za pomocą związku dla
ośrodka pochłaniającego światło wymaga
przyjęcia, że współczynnik pochłaniania ma
wartość ujemną.
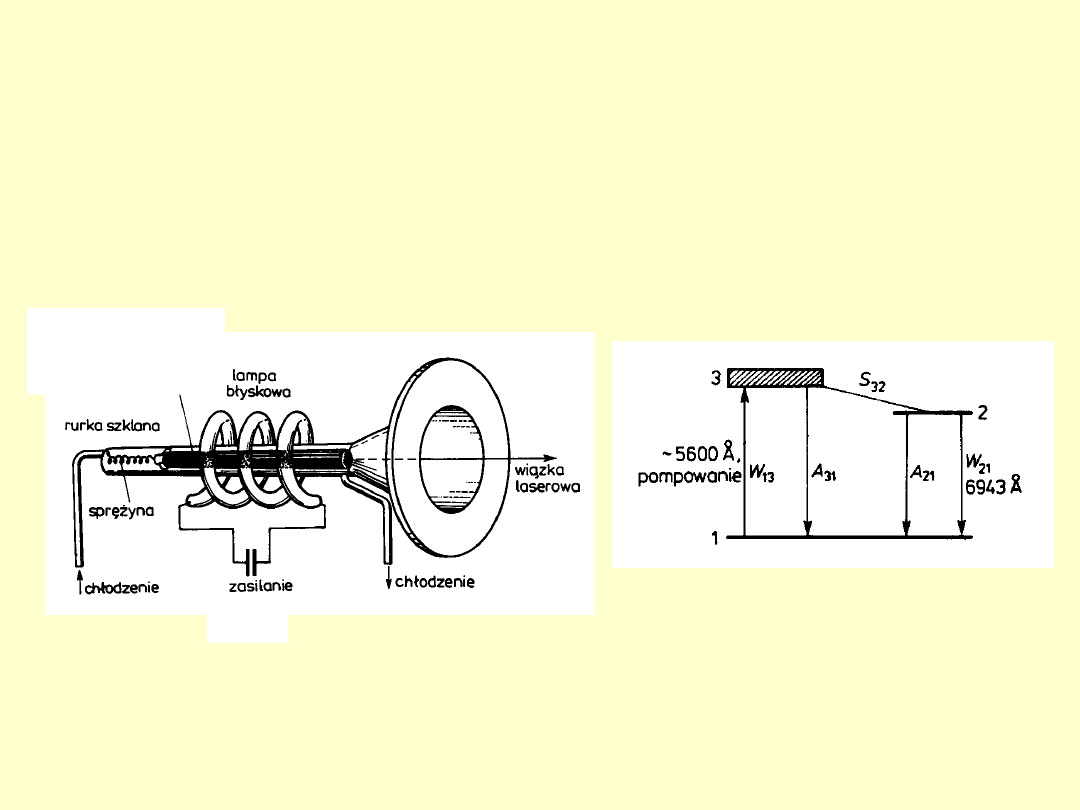
Laser rubinowy
(Al
2
O
3
, niektóre atomy Al zastąpione przez Cr
+++)
Cr
+++)
τ
2
=
~10
-3
s
1960 – T.H. Maiman
(USA)
walec,
Φ = 1 cm, l = 5
cm
1KV
ksenono
wa
τ
3
=
~10
-8
s
1961 – laser gazowy
He i N
2
1963 – lasery
półprzewodnikowe
Ag
100
%
8%

Dziękuję za uwagę
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
- Slide 41
- Slide 42
- Slide 43
- Slide 44
- Slide 45
- Slide 46
Wyszukiwarka
Podobne podstrony:
atomy w zewnętrznym polu magnetycznym i elektrycznym
34 atomy wieloelektronowe
C 4, MIBM WIP PW, fizyka 2, laborki fiza(2), 31-Ruch elektronu w polu magnetycznym i elektrycznym. W
12 Ruch cząstki naladowanej w polu elektrycznym 13 Ruch naładowanej cząstki w polu magnetycznym
36 Atomy wieloelektronowe, układ okresowy pierwiastków
Pomiar stosunku em metodą odchyleń w polu magnetycznym2
siŁa-elektrodynamiczna, SIŁA ELEKTRODYNAMICZNA-sila dzialajaca na przewodnik z pradem umieszczony w
C -4 -, MIBM WIP PW, fizyka 2, laborki fiza(2), 31-Ruch elektronu w polu magnetycznym i elektrycznym
A-2p, MIBM WIP PW, fizyka 2, laborki fiza(2), 31-Ruch elektronu w polu magnetycznym i elektrycznym.
C 4 , MIBM WIP PW, fizyka 2, laborki fiza(2), 31-Ruch elektronu w polu magnetycznym i elektrycznym.
Pomiar stosunku e-m metodą odchyleń w polu magnetycznym, FZZ206, 206
Pomiar stosunku e-m metodą odchyleń w polu magnetycznym, FZZ206, 206
33Obwod z pradem w polu magnety Nieznany (2)
4 Ruch naładowanych cząstek w polu magnetycznym
Pomiar stosunku em metodą odchyleń w polu magnetycznym
Cwiczenie 31, MIBM WIP PW, fizyka 2, laborki fiza(2), 31-Ruch elektronu w polu magnetycznym i elektr
więcej podobnych podstron