STRUKTURA ELEKTRONOWA ATOMU
Struktura elektronowa atomu określa jak rozmieszczone są elektrony w atomie. To określa właściwości chemiczne danego atomu.
Koniec XVII wieku - Christian Huyghens - teoria falowa światła.
Początek XVIII wieku - Isaac Newton - teoria korpuskularna światła.
Pierwsza połowa XIX wieku - Thomas Young i Augustin Fresnel, dyfrakcja i interferencja światła. Potem zjawiska załamania i polaryzacji światła spowodowały odrzucenie teorii korpuskularnej.
Dalsze potwierdzenie teorii falowej światła przyniosły prace Maxwella i Hertza. Określono c = 3·108 m·s-1. c = λν, ν = c/λ
1900 Max Planck, światło jest pochłaniane i emitowane przez ciało doskonale czarne tylko w porcjach o energii E zależnej od ν.
Emitowanie w postaci oddzielnych porcji to znaczy kwantowanie.
E = hν h = 6,626·10-34 J·s
Energia fotonu światła zielonego 500 nm = 500·10-9m=5·10-7m
ν = c / λ =
= 6·1014s-1
E (dla 1 fotonu) = 6,626·10-34J·s·6·1014s-1 = 4·10-19J [=2,5eV]
Energia 1 mola fotonów 4·10-19J·6,022·1023 = 240000 J = 240 kJ
Jest to energia wystarczająca do rozerwania wiązania chemicznego.
Zjawisko fotoelektryczne - poprawna interpretacja opiera się o postulat Planck'a
Szybkość elektronów zależy od długości fali (częstotliwości) padającego światła i od rodzaju materiału. Ilość elektronów zależy od natężenia padającego światła.
Wzbudzony wodór (wyładowania elektryczne) emituje promieniowanie elektromagnetyczne w postaci dyskretnych linii. Nie jest to widmo ciągłe. Jest to widmo emisyjne wodoru
H2 H + H* wzbudzenie
H* H emisja
n1 = 1 seria Lymana (UV)
n1 = 2 seria Balmera (Vis)
RH = stała Rydberga 3,29·1015Hz n1 = 3 seria Paschena (IR)
hυ = E2 - E1
Wniosek. Tylko niektóre stany energetyczne elektronów w atomie wodoru są dozwolone.
Model atomu w. g. Bohra (planetarny) tylko historyczne znaczenie.
Dualizm falowo - korpuskularny.
Praca doktorska de Broglie. Założył on, że jeżeli promieniowanie wykazuje właściwości korpuskularne to cząstki materii wykazują właściwości falowe.
Dla przedmiotów makroskopowych efekty falowe są bez znaczenia.
Atom wodoru 110 pm = 110·10-12 m = 1,1·10-10 m
mΔvx - nieoznaczoność pędu wzdłuż osi x
Δx - nieoznaczoność położenia na osi x
Metody fizyki klasycznej źle opisują materię w skali atomowej.
Erwin Schrödinger - mechanika falowa (mechanika kwantowa).
Ruch elektronu w atomie można opisać ogólnym równaniem dla ruchu falowego, przyjmując dla niego falę o długości wynikającej z zależności de Broglie. Prowadzi to do równania Schrödingera.
H Ψ = E Ψ H - operator Hamiltona
Rozwiązaniami równań Schrödingera są funkcje zwane funkcjami falowymi (orbitalami) Ψ (psi). Kwadrat wartości funkcji falowej w jakimś miejscu przestrzeni Ψ2 określa prawdopodobieństwo znalezienia się elektronu w danym obszarze przestrzeni
Ψ2 - gęstość prawdopodobieństwa.
W mechanice kwantowej posługujemy się tylko prawdopodobieństwem znalezienia się elektronu w danym punkcie przestrzeni.
Dla atomu mamy szereg funkcji falowych (orbitali) i odpowiadające im energie. Tylko niektóre funkcje falowe mają sens fizyczny.
Tym funkcjom falowym odpowiadają parametry zwane liczbami kwantowymi.
Trzy liczby kwantowe n, l i m opisują dany orbital
n główna liczba kwantowa: 1, 2, 3 ... powłoki K, L, M ....
Im n większe tym energia elektronu większa; n → ∞, E → 0
Elektrony o tej samej wartości n zajmują tę samą powłokę elektronową.
E = -
h = stała Planck'a. RH = stała Rydberg'a.
l - poboczna liczba kwantowa: 0,1,2....(n-1) (s,p,d,f..)
Określa kształt orbitalu, określa podpowłokę.
Dla atomów (jonów) zawierających więcej niż jeden elektron także ma wpływ na energię elektronu.
m magnetyczna liczba kwantowa: -l...0...+l
określa przestrzenne położenie orbitali (funkcji falowych) danej podpowłoki elektronowej. W polu magnetycznym także wpływa na energię elektronu.
Sumarycznie dla danego n liczba orbitali = n2.
Elektron posiada wewnętrzną cechę zwaną spinem. Jest kwantowana i opisana przez spinową liczbę kwantową przyjmującą wartość s = ½ i s = - ½. Zatem każdy elektron w atomie opisany jest przez 4 liczby kwantowe: n, l, m i s.
Sumarycznie dla danego n liczba stanów elektronowych = 2n2.
Schemat ten pokazuje zasadę rozbudowy powłok ale nie pokazuje energii elektronów obsadzających poszczególne orbitale.
Kształt orbitali
Orbitale s, powierzchnia graniczna
Orbitale p.
m = -1, 0, 1 przyjęto dowolnie jako px, py i pz.
Orbitale d
Dostępne orbitale muszą być zdegenerowane to znaczy muszą mieć taką samą energię. Zasada maksymalnej multipletowości spinowej.
Zasada rozbudowy powłok elektronowych
Elektrony obsadzają poziomy energetyczne w miarę wzrastającej energii. Jeżeli obsadzone są tylko poziomy o najniższej energii mówimy o stanie podstawowym. Przy doprowadzeniu energii możemy obsadzić poziomy o wyższej energii, jest to stan wzbudzony. He 1s2 doprowadzenie energii He* 1s1 2s1
Elektrony obsadzają poszczególne poziomy energetyczne poczynając od najniższych
Reguły Slatera:
Ładunek działający na elektron zależy od typu orbitalu obsadzonego przez ten elektron oraz od pozostałych elektronów w atomie. Dla danej liczby n najbardziej trwały (najniższa energia) jest orbital s, dalej p, d i na końcu f.
Elektrony na poziomie wyższym od badanego elektronu nie ekranują.
Udział elektronów o tej samej liczbie kwantowej wnosi do liczby σ 0.35 ilości elektronów, udział elektronów z powłoki n-1 wynosi 0,85 ilości elektronów.
Elektrony na głębszych powłokach oraz elektrony d i f wnoszą udział równy ilości elektronów.
Przesuwając się w okresie w prawo efektywny ładunek działający ma ostatni elektron jest coraz większy.
Li (Z = 3) σ = 2·0,85 = 1,7 Z* = 1,3
Be (Z = 4) σ = 2·0,85 + 0,35 = 2,05 Z* = 1,95
B (Z = 5) σ = 2·0,85 + 2·0,35 = 2,4 Z* = 2,60
C (Z = 6) σ = 2·0,85 + 3·0,35 = 2,75 Z* = 3,25
N (Z = 7) σ = 2·0,85 + 4·0,35 = 3,1 Z* = 3,9
O (Z = 8) σ = 2·0,85 + 5·0,35 = 3,45 Z* = 4,55
F (Z = 9) σ = 2·0,85 + 6·0,35 = 3,8 Z* = 5,20
Ne (Z = 10) σ = 2·0,85 + 7·0,35 = 4,15 Z* = 5,85
Schemat rozbudowy powłok dla atomów nie wodoropodobnych
Tworzenie kationów.
Tworzenie się anionów.
3d nie są elektronami walencyjnymi
Typowe jednoatomowe aniony: X- n. p. F-, X2- n. p. S2-,
X3- n. p. P3-, X4- n.p. C4-
Na+ F- CaCl2 Ca2+ 2Cl-
Mg2+S2- Al2O3 2Al3+ 3O2-
Li3N 3Li+ N3- Sr3P2 3Sr2+ 2P3-
Li4C 4Li+ C4-
Omówić stopnie utlenienia, jony, wodorki i tlenki pierwiastków grup głównych, właściwości kwasowo zasadowe.
Właściwości pierwiastków zależą w istotny sposób od:
rozmiarów atomów,
energii jonizacji tych atomów,
powinowactwa elektronowego tych atomów
Stąd określamy promienie kowalencyjne dla metalu
Promień van der Waalsa obliczone z najmniejszej odległości między stykającymi się atomami, niezwiązanymi wiązaniem kowalencyjnym.
Promień kowalencyjny odległość w A2 między środkami
A — A = 2 rA (kowalencyjne) Długość wiązania A — B = rA + rB
Promień kowalencyjny określamy dla wiązania pojedynczego n. p. H2O2 , H4N2
POTENCJAŁ JONIZACJI: określa łatwość oderwania elektronu od atomu, czy też jonu. Określa się go jako energię potrzebną do usunięcia elektronów z 1 mola atomów czy też jonów będących w stanie podstawowym w fazie gazowej.
Wzrost ładunku jądra przesuwając się w prawo w okresie powoduje zmniejszenie promienia kowalencyjnego. Elektrony
są silniej wiązane i energie jonizacji dla fluorowców i gazów szlachetnych są bardzo duże.
POWINOWACTWO ELEKTRONOWE
Powinowactwo elektronowe E(g) + e- → E-(g) [kJ · mol-1]
Entalpia przyłączenia elektronu E(g) + e- → E-(g) + ΔHo (EA= - ΔHo)
Ilość energii wydzielana na skutek przyłączenia 1 mola elektronów w fazie gazowej do 1 mola obojętnych atomów (powinowactwo
elektronowe z reguły dodatnie, ΔHo ujemne).
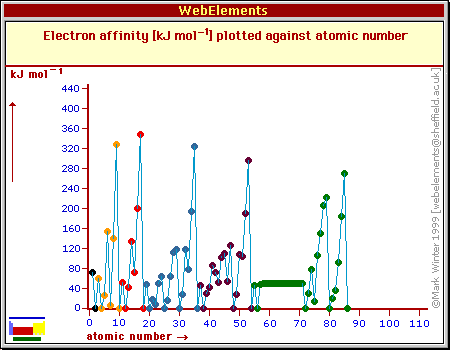
F Cl Br
I
At
S Se Te Po
C O
Duże powinowactwo elektronowe F, Cl, Br, I i At - tendencja do tworzenia anionów E- (np. F-)
Dość duże powinowactwo elektronowe O, S, Se, Te i Po - dodatnia wartość powinowactwa elektronowego i łatwe tworzenie anionów E- (np. O-).
Ze względu na tendencję do zapełniania powłok elektronowych tworzą się także jony E2- mimo że E-(g) + e- → E2-(g)
zdecydowanie ujemne.
Energia sieci krystalicznej umożliwia istnienie jonów np. O2- i S2-.
O(g) + e = O-(g) ΔHo = -142 kJ·mol-1, O-(g) + e = O2-(g) ΔHo = 844 kJ · mol-1,
Sumarycznie O(g) + 2e = O2-(g) ΔHo = 702 kJ·mol-1,
Dodatnia wartość ΔHo.
Dla hipotetycznej reakcji
2Na + O → 2 Na+ + O2- ΔHo = 702 kJ·mol-1 + 2· 496 kJ·mol-1
Energia sieci krystalicznej umożliwia istnienie jonów np. O2- i S2-.
ELEKTROUJEMNOŚĆ - tendencja atomu w cząsteczce do przyciągania ku sobie elektronów. Gdy dwa atomy mają dużą różnicę elektroujemności wiązanie ma charakter jonowy. Pojęcie bardzo przydatne dla dyskusji charakteru wiązań niemetali, mało przydatne dla metali bloku d. Jest to pojęcie półilościowe.
Wg Paulinga: χA - χB = 0,102
χH = 2,2 ( z definicji)
D = DA-B -
, DA-B, DA-A i DB-B są energiami wiązań w cząsteczkach A-B, A-A i B-B.
χb > χa
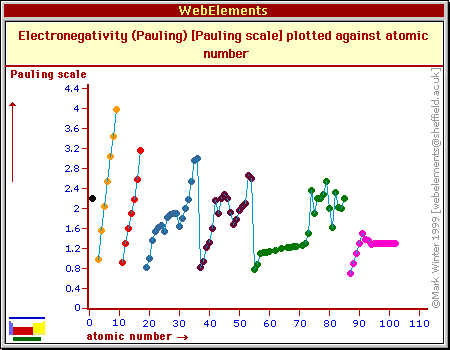
F
O
Cl Br
N
I
Li Na K Rb Cs Fr
Duża jest elektroujemność dla F (4.0), O, Cl, N, Br - pierwiastki elektroujemne. Mała jest dla Li, Na, K, Rb i Cs (0,79) - pierwiastki o niskiej elektroujemności.
Δ χA - χB
1,5 (raczej kowalencyjny charakter wiązania A-B) - HCl(g)
Δ χA- χB
2,0 ( jonowy charakter wiązania A-B) - LiF
Elektroujemność wzrasta przesuwając się w prawo w okresie.
Elektroujemność maleje przesuwając się w dół grupy.
Metale : dobre przewodnictwo elektryczne, dobre przewodnictwo cieplne, kowalne, ciągliwe, połysk metaliczny, mają zasadowe tlenki, tworzą kationy, tworzą jonowe halogenki. Są to pierwiastki bloku s, bloku d, bloku f i niektóre pierwiastki bloku p. Są to ciała stałe z wyjątkiem Hg, (Cs i Ga t. t. około 30 ºC)
Metaloidy: mają wygląd metalu, a właściwości chemiczne niemetalu. Si - Ge, As - Sb, Te - Po (ciała stałe)
Niemetale: złe przewodniki elektryczności, złe przewodniki ciepła (oprócz diamentu), kruche, brak połysku metalicznego. Tworzą kwasowe tlenki, tworzą kowalencyjne halogenki. Są to gazy, ciecz (Br2) oraz ciała stałe.
EFEKT BIERNEJ PARY ELEKTRONOWEJ
Dla pierwiastków bloku p, szczególnie dla ich cięższych przedstawicieli obserwowany jest tak zwany efekt biernej (nieczynnej) pary elektronowej.
W dalszych okresach bloku p elektrony ns2 mają zdecydowanie niższą energię niż npx, gdyż są słabo ekranowane od jądra. Dlatego łatwo uzyskać jest jon Tl+, natomiast trudno jest otrzymać Al+. Jest to tendencja pierwiastków bloku p do tworzenia kationów o ładunku o dwie jednostki mniejszym niż by to wynikało z numeru grupy.
7
Wyszukiwarka
Podobne podstrony:
wyklad3 tech bad
wyklady tech roślinna (ziemniak)
wyklad9i10 tech bad
wyklad7i8 tech bad
1-Wyklad TECH, Technologia chemiczna PG, Chemia, I ROK, WYKŁADY, WYKŁADY
wyklad4 tech bad
wyklad13i14 tech bad
wyklad 1 i 2 tech bad
wyklad5i6 tech bad
wyklad3 tech bad
WYKŁAD I TECH STAL
wyklad 29 i 30 tech bad
Wybrane Technologie Przetwazania Zywnosci WYKLADY. , WNOŻCiK wieczorowe, semestr V, wybrane tech prz
3 01 13 wykład org i tech
wyklad 25 i 26 tech bad
tech.chem. PGd chemia fizyczna wyklady, Technologia chemiczna, Chemia fizyczna, Wykłady, wykłady na
wyklad 21 i 22 tech bad
więcej podobnych podstron