1.Co to jest parametr stanu i jakie parametry znasz
parametr - mierzalna wielkość fizyczna, której zmiany nie zależą od drogi przemiany. Zmiana parametru jest równa różnicy jego wartości na końcu i początku.
p.Ekstensywne - zależą od ilości substancji [masy, objętości, liczby moli] np.: energia objętość układu, entropia, entalpia
p.Intensywne - nie zależą od ilości substancji np.: temp. Ciśnienie
p.Własciwy - jest to parametr ekstensywny podzielony przez masę, objętość lub liczbę moli np.: gęstość, objętość właściwa, entropia właściwa, en. wewn. Właściwa
2.jakie znasz formy wymiany energii z otoczeniem? Czym się od siebie różnią/
a) układ zamknięty [praca, ciepło]
Praca - forma wymiany energii, która związana jest z przemieszczeniem. W termodynamice mamy doczynienia z pojęciem pracy zewnętrznej (pracy oddawanej lub pobierane przez układ) związanej ze zmianą objętości układ
oraz pracy użytkowej
tzn pracy zewnętrznej pomniejszonej o pracę czynnika w układzie.
Ciepło - forma wymiany energii, która wymaga różnicy temperatury między układem a otoczeniem
, gdzie c-ciepło właściwe
Obie te formy energii związane są też z procesem dysypacji energii gdzie następuje zmiana pracy tarcia w ciepło tarcia np. mieszadło w lepkim płynie.
b) układ otwarty [Praca, ciepło, transport masy]
transport masy - masa substancji zawiera w sobie energię (kinetyczną, potencjalną i wewnętrzną) którą wnosi lub wynosi z układu. Aby dostarczyć lub odprowadzić masę z układu musimy dodatkowo wykonać pracę wtłoczenia, wprowadzone jest zatem pojęcie entalpii
,
3.Co to jest energia wewnętrzna i od czego zależy?
Jest to forma energii gromadzona w materii i związana ze zmianą temperatury, ciśnienia i składu . Obejmuje ona energię ruchów translacyjnych i obrotowych cząstek i atomów, energię wiązań. Wprowadzenie tego pojęcia pozwala na uwzględnienie w bilansie energii procesów jej rozproszenia np.: tarcie
Dla gazów doskonałych energia wewnętrzna jest funkcją temperatury dla rzeczywistych zależy też od ciśnienia. Zmiany energii obserwujemy poprzez zmianę temp. Ciśnienia i składu chemicznego.
4.Co to jest entalpia , jakie jest jej znaczenie fizyczne?
Jest to suma energii wewnętrznej i pracy wtłoczenia masy do układu wykonanej przeciwko ciśnieniu w układzie I=U+pV. Zatem jest to wielkość, która mówi jaka ilość energii jest doprowadzana lub odprowadzana z układu z masą. Praca pV wykonana na masie to zwiększa energię tej masy, jej dodanie do całkowitej energii masy nie daje jej entalpii.
5. 1ZT jej sens fizyczny i techniczny,
jest to zasada zachowania energii całkowitej, która mówi ile energii nie ulega zmianie w układzie ODOSOBNIONYM - tzn. układzie izolowanym i nie wymieniającym masy. Za taki układ można wziąć układ + otocznie.
, gdzie
w układzie zamkniętym powyższą zasadę można zapisać
. Praktyczne znaczenie tego zapisu jest takie, że praca może być wykonywana jedynie kosztem doprowadzenia ciepła i/lub spadku energii wewnętrznej ciała. Doprowadzenie ciepła i/lub pracy z drugiej strony zwiększa energię wewnętrzną ciała. W układzie otwartym musimy uwzględnić jeszcze wymianę na skutek wymiany masy
lub
6.2ZT jej sens fizyczny i techniczny
Mówi ona o tym, że w układzie adiabatycznym entropia rośnie w przemianach nieodwracalnych a pozostaje stała w przemianach odwracalnych
. 2ZT TO ZASADA WZROSTU ENTROPII [ZWE] gdy układ wymienia ciepło z otoczeniem entropia może wzrosnąć lub zmaleć [doprowadzony/odprowadzony]. Możemy pokazać że z ZWE wynika że ciepło może przepływać tylko od temp. Wyższej do niższej => wynika z tego kierunek nieodwracalnej przemiany. Nie można także całości ciepła zamienić na pracę. Nie można też poprowadzić ciepła od ciała o niższej temp do wyższej bez włożenia pracy - NIE MOŻNA ZBUDOWAĆ POMPY CIEPŁA O NIESKOŃCZENIE WILEKIM WSPÓŁCZYNNIKU WYDAJNOŚĆI [SENS TECHNICZNY]
, oraz
7.Co to jest entropia?
![]()
Jest to parametr stanu, który definiujemy jako
-funkcja stanu która w stanie równowagi osiąga maksimum. + ZWE. Jeśli układ wymienia ciepło z otoczeniem wówczas mamy:
,gdzie
-zmiana entalpii w skutek wymiany ciepła z otoczeniem
dla Q>0 lub
dla Q<0 ;
,
[odwracalna]
[nieodwracalna]
8.Omów znane ci procesy nieodwracalne [Jakie są układy w których zachodzi dysypacja energii?]
A)kaloryczne mieszanie - wymiana ciepła przy skończonej różnicy temperatur między dwoma ciałami o różnych temperaturach
![]()
B)Przepływ lepkiego płynu przez rury, przewężenia - dławienie - jest to spadek ciśnienia bez wykonania pracy dla dławienia adiabatycznego
, dla gazu doskonałego
DŁAWIENIE = PRZEMIANA IZENTALPOWA
C)Mieszanie czynników - mieszanie gorącej i zimnej wody lub gazów o różnych ciśnieniach i temperaturach
D)Efekt ciepła Joula w przewodniku elektrycznym - ciepło Joula powstaje w skutek tarcia na diodę elektronów
,
E)Procesy nagrzewania para- i ferro- magnetyków
9.Co to jest obieg carnota jakie znaczenie odgrywa w termodynamice?
![]()
![]()
Obieg carnota składa się z 2 izoterm i 2 adiabat odwracalnych. Jeśli jest to obieg silnikowy to ciepło Q, doprowadzone przy stałej temp Tg i odprowadza przy stałej temp Td. Wszystkie przemiany tego obiegu są odwracalne. Sprawność SOC jest maksymalną możliwą teoretycznie spr. Silnika
. Służy jako model porównawczy.
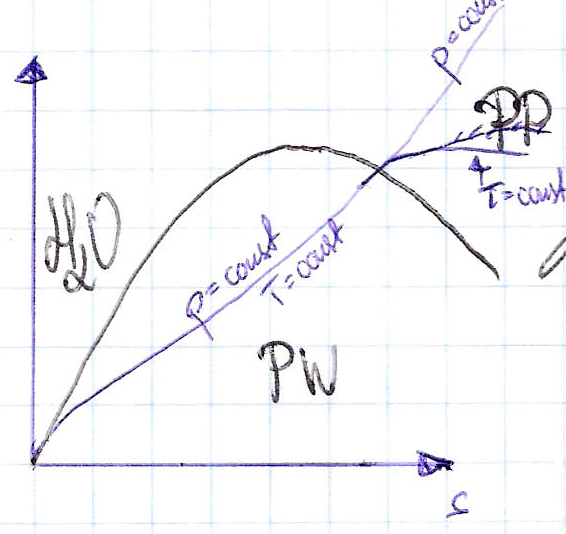
10.Prawo Daltona, ciśnienie cząstkowe składnika w mieszaninie
Prawo to dotyczy mieszanin gazów doskonałych. Każdy składnik mieszaniny zachowuje się tak jakby wypełniał całą objętość mieszaniny, ma przy tym ciśnienie zmniejszone od ciśnienia mieszaniny. Suma ciśnień cząstkowych = ciśnieniu mieszaniny.
lub
11.Jakie parametry jednoznacznie odkreślają stan mieszaniny gazów doskonałych?
Jest to ciśnienie, temperatura, objętość [tak jak w pojedynczych może 2 z 3] oraz od składu - jakie przy, w jakich ilościach. Czyli 2 parametry takie jak (p,T) lub (p,V) lub (V,T) ORAZ udziały składników mieszaniny. Jeśli mieszanina ma „n” składników wystarczy znać n-1 udziałów. Możemy tu użyć udziałów molowych
,
lub molowych (obj.)
,
,
,
12.Gaz doskonały, pół-doskonały, rzeczywisty i ich różnice
A)GD i GPD
-Spełnia równanie stanu gazu doskonałego pV=mRT
-Spełnia prawo Avogadro
-W modelu tego gazu pomija się: objętość cząstek gazu w stosunku do zbiornika oraz siły oddziaływania cząstek gazu na siebie.
-Energia wewnętrzna zależy tylko od temperatury
-ciepła właściwe GD są stałe natomiast GPD są funkcjami temperatury
,
GD
, GPD
-dławienie adiabatyczne GD jest izotermą (temp=const)
B)Gaz rzeczywisty
-Nie spełnia równania Clapeyrona, bo nie można pominąć objętości cząstek gazu oraz oddziaływań między nimi. Van der Weals uwzględnił to w swoim r-niu
-energia wewnętrzna gazu jest funkcją temperatury i ciśnienia
-ciepła właściwe są funkcjami ciśnienia i temperatury
-podczas dławienia gazu temperatura się zmienia
13.Przemiana politropowa
Jest to przemiana przy stałym cieple właściwym
, związek między parametrami GD można zapisać jako
, n-wykładnik politropy
, ciepło właściwe przemiany
, gdzie
,
,
,
dla n=1 izoterma, n=0 izobara, n=
izochora
14.Czym się różni ciepło właściwe przemiany politropowej od ciepła właściwego gazu?
A)Ciepło właściwe gazu - jest to fizyczna własność materii, jest zawsze dodatnia, dla gazów rozróżniamy następujące ciepła właściwe
i
dla GD
,
dla GPD
,
dla GR zależą od p i T
B)Ciepło właściwe przemiany - to wielkość mówiąca o tym ile ciepła zostało wymienione w przemianie na kg czynnika i na 1 stopień zmiany temp.C=dQ/dT. Ciepło to może być dodatnie, ujemne , zerowe lub nieskończone, tylko w szczególnych przypadkach przemiany politropowej przyjmuje ono wartość fizycznych ciepeł
![]()
15.Podaj różnice między pompą ciepła i chłodziarką
Są to różne urządzenia pracujące w analogicznym obiegu odwrotnym realizującym inne cele. Pracują one między górnym i dolnym źródłem przenosząc ciepło od układu (dodatkowego źródła) o temp Td (niższej) do temp górnego źródła Tg 9drugiego układu) kosztem doprowadzonej pracy.
Rolą chłodziarki jest odebranie odpowiedniej ilości ciepła od cieła o temp. niższej. Górny układ odgrywa 2-rzędną role, jako odbiornika ciepła
nie interesuje nas ile ciepła odprowadzono do otoczenia.
W przypadku PC interesuje nas ile ciepła wprowadziliśmy do układu, który jest odbiornikiem ciepla.
![]()
16.Przemiana odwracalna i nieodwracalna
Przemiana odwracalna to taka że możemy ją zrealizować wracając do stanu 2 od 1 przy tych samych stanach otoczenia jakie mieliśmy idąc od 1 do 2. to wyidealizowany model bowiem wszystkie przemiany rzeczywiste są nieodwracalne. Ta nieodwracalność wynika z jednokierunkowych procesów dysypacji energii (np. tarcie). Choć możemy wrócić do stanu 1 to przy innych danych otoczenia
. Wzory na pracę zewnętrzną lub techniczną są prawdziwe tylko dla przemian odwracalnych.
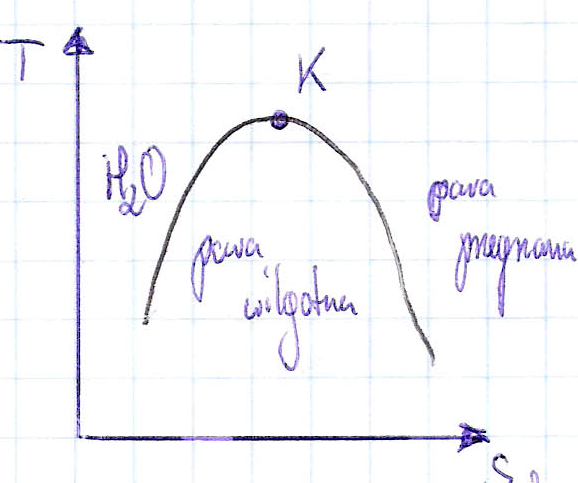
17.omów wszystkie stany pary wodnej i parametry je określające [PARAMETRY KRYTYCZNE]
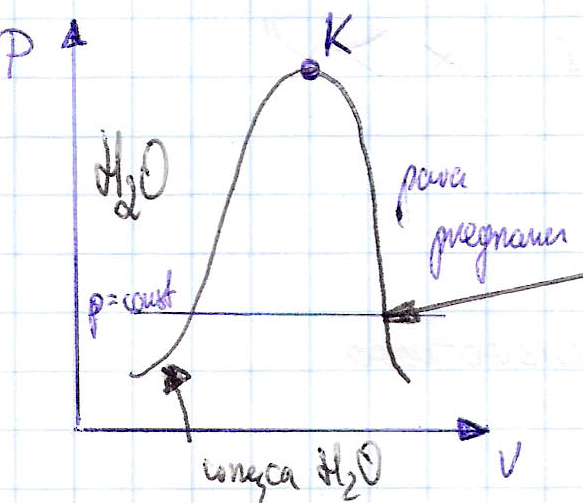
woda jako czynnik termodynamiczny istniej jako wrząca woda, para wilgotna [mieszanina pary suchej nasyconej i pary nienasyconej{wrząca woda dla danego ciśnienia}]oraz jako para przegrzana [nie zawiera wrzącej wody].
Wrząca woda- woda, która jest w temp nasycenia [temp wrzenia] przy dużym ciśnieniu ale nie zawiera pary.
Para sucha nasycona- para w temp. nasycenia, która nie zawiera żadnych kropelek wody przy danym ciśnieniu
Para wilgotna nienasycona- mieszanina wrzącej wody i pary nasyconej suchej do określenia jej stanu wprowadzamy stopień suchości p=const, T=const. , parametry liczymy ze wzorów:
,
,
Para przegrzana- para mająca temp wyższą od nasycenia, więc mamy ju tylko gaz p i T - nie pokrywają się, zatem znajomość p i T jednoznacznie określa stan pary suchej przegrzanej. Poszczególne stany pary rozdzielają krzywe gazowe.
Lewa (dolna) - jest miejscem geometrycznym parametrów wrzącej wody (v',s',i',p,T) dal różnych ciśnień (temperatur)
Prawa (górna) krzywa - miejsce geometryczne parametrów pary suchej nasyconej (v'',s'',i'',p,T) dla różnych ciśnień/ temp.
Krzywe te rozdzielają punkt K. Powyżej niego nie istnieje ciecz - nie ma tam zatem pary wilgotnej jest tylko gaz (para przegrzana)z dala od krzywych możemy traktować gaz jak GD.
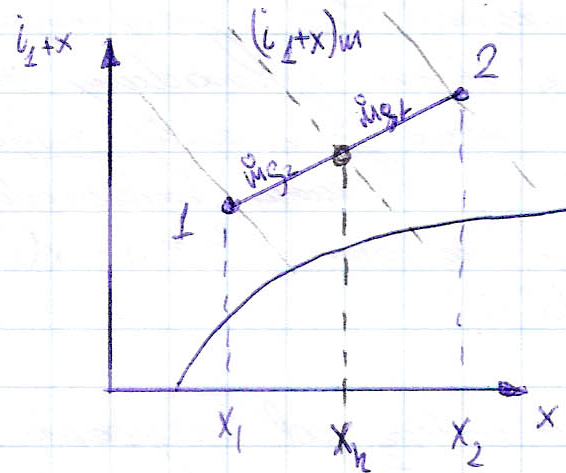
18.Omów możliwe stany powietrza wilgotnego i parametry je określające
A)Parametry: ciśnienie, temperatura, ciśnienie cząstkowe gazu suchego (pg) ciśnienie cząstkowe pary (Pp)zgodnie z prawem Daltona
p- ciśnienie cząstkowe mieszaniny, wilgotność bezwzględna (gęstość pary wodnej przy ciśnieniu cząstkowym gdy wypełnia V (
), wilgotność względna
,
-max ciś. nasycenia przy danej temp => wilgotność bezwzględna mówi ile jest masy pary w jednostce objętości gazu wilgotnego, natomiast wilgotność względna [w %] pokazuje jak dlaeko jesteśmy od stanu nasycenia gdy pp=pn => 100% -> ϕ=1 stopień wilgoci [oznaczamy jako X jak st. suchości ale to co innego]
, maksymalny st. Wilgoci (x'')-występuje dla pp=pn
B)Możliwe są następujące stany powietrza/gazu wilgotnego
-gaz wilgotny nienasycony: mieszanina pary suchej nasyconej i powietrza suchego pp<pn gp<gp'' ϕ<1 x<x''
-gaz wilgotny nasycony -wciąż nie ma wykroplonej wody pp=pn gp=gp'' ϕ=1 x=x''
-gaz wilgotny przesycony - nastąpiło wykroplenie części pary wodnej, mamy wykroploną wodę oraz nad nią gaz wilgotny. Pp=pn gp=gp'' ϕ=1 zaś x>x''
19.Omów i narysuj znane ci przemiany pow wilgotnego
1.mieszanie izobarycno - adiabatyczne 2 strumieni powietrza wilgotnego
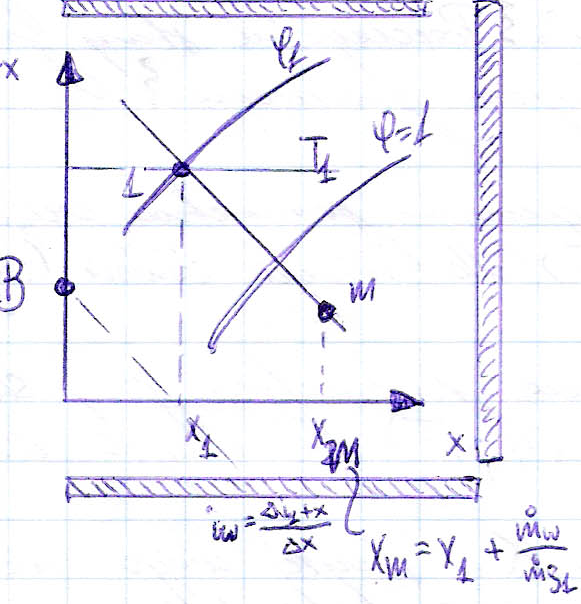
2.nawilżanie izobaryczno-adiabatyczne
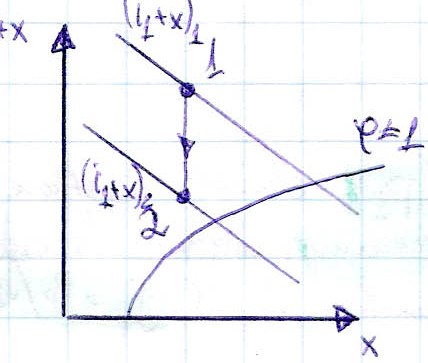
3. 2.
3.ochładzanie lub ogrzewanie powietrza nienasyconego
przemiany te odbywają się bez zmiany ilości czynnika kondensującego za 1 kg gazu suchego czyli x=const
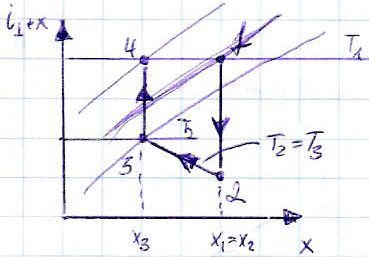
4.osuszanie powietrza
Wyszukiwarka
Podobne podstrony:
mechanika plynow teoria ściąga
RP Teoria Sciąga, Budownictwo, II TOB zaoczne PP, I sem, Probabilistyka i prawdopodobieństwo, labora
Analiza matematyczna Teoria sciaga
mechanika budowli teoria sciaga
Rachunek kosztow dla inzynierow dr inz. Eugeniusz Neumann [ teoria] [ ściąga], rachKosztowDlaInz1, 1
Materiałki teoria ściąga (1)
Finanse teoria SCIAGA
terma teoria
Teoria sciaga (2)
badania operacyjne teoria sciaga, chomik, studia, Studia 2 rok, Badania operacyjne
analiza teoria sciaga
Rachunek kosztow dla inzynierow dr inz. Eugeniusz Neumann [ teoria] [ ściąga], rachKosztowDlaInz, 1
TEORIA W-F, Teoria ściągawka, 1
teoria 15 v3
Integracja europ od bozeny sciaga v3 (2)
matematyka teoria ściąga wektory proste plaszyzny
mat teoria sciaga
więcej podobnych podstron