24 XI 2005
|
Protokół
Przewodność roztworów elektrolitów mocnych i słabych
|
||
|
Doświadczenie przeprowadzili:
Jańczyk Martyna
Wabik Jacek
Durka Krzysztof |
Ocena z przygotowania: |
Ocena ze sprawozdania: |
T=298 K
Roztwór wzorcowy – KCl
|
R/Ω |
/ Ω-1·m-1 |
|
|
|
HCl
|
C/mol·dm-3 |
R/Ω |
|
|
|
|
|
|
|
|
|
|
|
|
CH3COOH
|
C/mol·dm-3 |
R/Ω |
|
|
|
|
|
|
|
|
|
|
|
|
H2O
|
|
R/Ω |
|
H2O |
|
Opracowanie wyników:
Stałą naczynka konduktometrycznego wyznaczamy na podstawie pomiaru oporności roztworu KCl o dokładnie znanej przewodności elektrolitycznej ( dla T=298,15 K).
Kw= χw·Rw
Kw=
Dla roztworów kwasu solnego wyznaczamy przewodność elektrolityczną zgodnie ze wzorem:
χ=Kw/R
A następnie przewodność molową elektrolitu – Λ
HCl
|
|
R/Ω |
χ/ Ω-1·m-1 |
Λ/ m2·Ω-1·mol-1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Takie same obliczenia przeprowadzamy dla roztworów kwasu octowego
CH3COOH
|
|
R/Ω |
χ/ Ω-1·m-1 |
Λ/ m2·Ω-1·mol-1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Obliczmy przewodność elektrolityczną wody.
H2O
|
|
R/Ω |
χ/ Ω-1·m-1 |
|
H2O |
|
|
Jak wynika z otrzymanych danych przewodność elektrolityczna wody destylowanej jest mała w porównaniu z przewodnością badanych elektrolitów, dlatego nie ma potrzeby uwzględniać tej poprawki w obliczeniach.
W
celu wyznaczenia granicznej przewodności molowej Λ![]() dla
roztworu kwasu solnego,
dla
roztworu kwasu solnego,
należy
ekstrapolować dane doświadczalne w układzie Λ=f(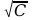 ). Jest to wykres funkcji liniowej Λ=a
). Jest to wykres funkcji liniowej Λ=a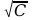 +b,
której współczynnik b jest szukaną wartością granicznej
przewodności molowej
+b,
której współczynnik b jest szukaną wartością granicznej
przewodności molowej
(wykres)
Λ![]() =
=
Wartość odczytana z tablicy:
Λ![]() =
0,042615
m2·Ω-1·mol-1
=
0,042615
m2·Ω-1·mol-1
Obliczony błąd względny:
Graniczną wartość przewodności molowej dla kwasu octowego wyliczamy korzystając z prawa niezależnej wędrówki jonów na podstawie danych z tabeli (przy założeniu że roztwór jest nieskończenie rozcieńczony co umożliwia również utożsamianie stosunku przewodności do stopnia dysocjacji)
Graniczne
przewodności Λ![]() molowe
soli dla
T=298,15
molowe
soli dla
T=298,15
|
Sól |
104
Λ |
|
CH3COONa |
91,00 |
|
NaCl |
126,45 |
|
HCl |
426,15 |
(napisać ze wstępu)
Obliczone wartości stopni dysocjacji dla poszczególnych stężeń roztworu kwasu octowego zestawiono w tabeli.
CH3COOH
|
|
Λ/ m2·Ω-1·mol-1 |
Λ |
α |
|
|
|
0,039070 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
d) Wyrażenie stężeniowej stałej dysocjacji roztworu kwasu octowego za pomocą stężenia początkowego i stopnia dysocjacji:
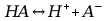 gdzie
gdzie
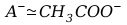
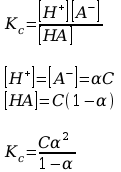 ,
gdzie
C – stężenie początkowe
,
gdzie
C – stężenie początkowe
Jest to wzór rozcieńczeń Ostwalda.
(wniosek)
e) Korzystając z zależności
(napisać ze wstępu)
oraz wzoru rozcieńczeń Ostwalda otrzymujemy:
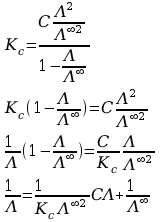
Otrzymana zależność jest pozwala na obliczenie wartości stałej dysocjacji kwasu octowego Kc oraz wartości granicznej przewodności molowej. Funkcja
1/Λ = a(C Λ)+b
Jest funkcją liniową. Zatem należy wykonać wykres zależności 1/Λ w funkcji iloczynu
(C Λ). Wartości funkcji i argumenty zestawiono w tabeli.
CH3COOH
|
C/mol·m-3 |
(1/Λ)/ m-2·Ω·mol |
(C·Λ)/ m-1·Ω-1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Współczynniki
a i b prostej dadzą nam odpowiednio
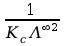 oraz
oraz
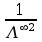
(wykres)
Wyszukiwarka
Podobne podstrony:
Metrologia statystyczne opracowanie wyników
Opracowanie wyników (2)
Opracowanie wynikow Aneks do instrukcji 2012
9 SZYB WINDOWY POMIAR PROSTOLINIOWOŚCI ŚCIAN W WYBRANYCH PRZEKROJACH OPRACOWANIE WYNIKÓW
B Kamys Statystyczne metody opracowania wyników pomiarów
Analiza błędów Statystyczne opracowanie wyników pomiarów
Opracowanie wyników
opracowanie wynikow
opracowanie wynikow#
Opracowanie wyników pomiaru
Opracowanie wyników
opracowanie wyników
Opracowanie wyników pomiarowych - błędy, bledy, Gęstość jest cechą substancji określającą masę jedno
cw6-lepkosc, OPR WYN, OPRACOWANIE WYNIKÓW
sprawdzone, fiz 01 - opracowanie wyników, Opracowanie wyników
cw5-adsorpcja, OPR wyn, OPRACOWANIE WYNIKÓW
METODYKA OPRACOWYWANIA WYNIKÓW POMIAROWYCH, MET0DYKA-spr., POLITECHNIKA RADOMSKA
24, Opracowanie wyników
Zastosowanie programów statycznych do opracowania wyników pomiarów