Frankiewicz Waldemar
II chem. Inf.
Wyznaczanie entalpii rozpuszczania.
1). Cel ćwiczenia:
Celem ćwiczenia jest wyznaczenie zmiany entalpii układu, w którym następuje rozpuszczania substancji stałej w cieczy. Proces ten jest izobaryczny, a więc zmiana entalpii układu jest równa pobranemu lub oddanemu ciepłu.
2). Część teoretyczna:
` Procesowi rozpuszczania się jednej substancji w drugiej towarzyszą efekty cieplne związane ze zmianami zachodzącymi w stanie obu substancji. Jeżeli proces rozpuszczania prowadzimy w warunkach izobarycznych to efekt cieplny równa się zmianie entalpii układu. ΔH=ΔU+pΔV jeżeli p= const. to:
ΔH=ΔU i ΔU=Q => ΔH=Q.
Wielkość:
Δh÷n=Q gdzie
Δh—zmiana entalpii;
n—ilość moli;
Q—wymienione ciepło;
nazywamy ciepłem rozpuszczania-jest to ilość ciepła związana z izobarycznym i izotermicznym rozpuszczaniem odniesionym do jednego mila substancji rozpuszczonej. Ciepło rozpuszczania Q jest sumarycznym efektem cieplnym całego procesu, podczas którego pierwsze porcje substancji wprowadzamy do czystego rozpuszczalnika, ostatnie do roztworu o stężeniu prawie końcowym. Możemy wyróżnić ciepła cząstkowe rozpuszczania i rozcieńczania: Qc i Qr. Związek pomiędzy wielkościami Q, Qc i Qr przedstawia równanie:
Q=Qc+![]()
Qr
Q—ciepło rozpuszczania;
Qc—ciepło cząstkowe rozpuszczania;
Qr—cząstkowe ciepło rozcieńczenia;
nr—ilość moli rozpuszczalnika;
n—ilość moli substancji rozpuszczonej;
3).Obliczenia;
Tk=16,5oC
Tp=25,4oC
Δl=106mm
Współczynnik korelacyjny f=![]()
=-0,0840[deg·mm-1]
Przyrost temperatury dla poszczególnych procesów: ΔTx=Δlx·f
ΔT1 = 7 · (-0,0840) = -0,588
ΔT2 = 19·(-0,0840) = -1,596
ΔT3 = 23·(-0,0840) = -1,932
ΔT4 = 20·(-0,0840) = -1,68
ΔT5 = 18·(-0,0840) = -1,512
ΔT6 = 17 (-0,0840) = -1,428
Ilość moli tiosiarczanu sodu
M pięciowodnego tiosiarczanu sodu=248,9g/mol
I odważka: 6,017 g
II odważka:12,028 g
III odważka: 24,027 g
IV odważka: 24,013 g
V odważka: 24,017 g
VI odważka: 24,021 g
n1= 0,025 mol
n2= 0,048 mol
n3= 0,096 mol
n4= 0,096 mol
n5= 0,096 mol
n6= 0,096 mol
![]()
= 0,073
![]()
= 0,169
![]()
= 0,265
![]()
= 0,361
![]()
= 0,457
Ilość wody w kalorymetrze Mwody = 500,81g
nwody = 27,823 mol
liczba moli wody przypadającej na jeden mol tiosiarczanu sodu Nk=![]()
N1 = 1112,92
N2 = 381,14
N3 = 164,63
N4 = 104,99
N5 = 77,07
N6 = 60,88
Współczynnik korelacyjny f = -0,0840 Liczba moli wody w kalorymetrze nw = 27,823 |
|||||
Nr pomiaru |
Liczba moli tiosiarczanu w poszczególnych pomiarach |
Łączna liczba moli tiosiarczanu sodu w roztworze |
Lx [mm] |
Tx [deg] |
Nk [mol] |
1 |
0,025 |
0,025 |
7 |
-0,588 |
1112,92 |
2 |
0,048 |
0,073 |
19 |
-1,596 |
381,14 |
3 |
0,096 |
0,169 |
23 |
-1,932 |
164,63 |
4 |
0,096 |
0,265 |
20 |
-1,68 |
104,99 |
5 |
0,096 |
0,361 |
18 |
-1,512 |
77,07 |
6 |
0,096 |
0,457 |
17 |
-1,428 |
60,88 |
Stężenia procentowe tiosiarczanu sodu:
Cp=![]()
·100%
Cp1 = 1,12%
Cp2 = 4,63%
Cp3 = 7,7 %
Cp4 = 11,65%
Cp5 = 15,24%
Cp6 = 18,55%
Cr = -25,5·%Na2S2O3+4185
Cr0 = 4185,00
Cr1 = 4156,44
Cr2 = 4066,93
Cr3 = 3988,65
Cr4 = 3877,92
Cr5 = 3796,38
Cr6 = 3711,98
Nr pomiaru |
Cp [%] |
Cr |
1 |
1,12 |
4156,44 |
2 |
4,63 |
4066,93 |
3 |
7,7 |
3988,65 |
4 |
11,65 |
3877,92 |
5 |
15,24 |
3796,38 |
6 |
18,55 |
3711,98 |
ΔHk=-CpΔTx
ΔH1=-(-0,40925*790 + 0,50081·4185)·(- 0,588) = 1042,3
ΔH2=-(-0,40925*790 + 0,50141·4156,44)·(-1,596 ) = 2810,2
ΔH3=-(-0,40925*790 + 0,50261·4066,93)·(-1,932) = 3324,5
ΔH4=-(-0,40925*790 + 0,50502·3988,65)·(-1,68) = 2840,9
ΔH5=-(-0,40925*790 + 0,50742·3877,92)·(-1,512) = 2486,4
ΔH6=-(-0,40925*790 + 0,50982·3796,38)·(-1,428 ) = 2302,1
Entalpia rozpuszczania przypadająca na jeden mol tiosiarczanu sodu:
Δhk = 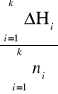
Δh1 = 41692 J/mol
Δh2 = 58546 J/mol
Δh3 = 34630 J/mol
Δh4 = 29593 J/mol
Δh5 = 25881 J/mol
Δh6 = 23980 J/mol
4) Wnioski:
W procesie prowadzonym izobarycznie entalpia rozpuszczania równa jest ciepłu wymienionemu z otoczeniem. Rozpuszczanie tiosiarczanu sodu jest procesem endotermicznym. Następnie pobieranie ciepła przez układ wynika z tego, że energia potrzebna do rozerwania sieci krystalicznej jest większa od energii solwatacji. Układ pobiera ciepło więc entalpia jest dodatnia. Podczas rozpuszczania tiosiarczanu sodu rośnie jego entropia ponieważ rośnie jego nie uporządkowanie jonów. Ciepło wydzielone podczas kolejnych porcji tiosiarczanu sodu zależy od stężenia roztworu.
Wyszukiwarka
Podobne podstrony:
Prawo administracyjne lato Robik, prawo administracyjne(25)
3, prawo administracyjne(25)
prawo administracyjne(2), prawo administracyjne(25)
skrypt adm cz oglna, prawo administracyjne(25)
Skrypt kompilacja, prawo administracyjne(25)
Prawo administracyjne 25 10 2011
naukaadmnistracji, prawo administracyjne(25)
Prawo administracyjne lato Tomek, prawo administracyjne(25)
Administracyjne, prawo administracyjne(25)
25.03.2010, prawo administracyjne wykłady
25.02.2010, prawo administracyjne wykłady
Prawo finansowe 25.04, administracja, II ROK, III Semestr, rok II, sem IV, prawo finansowe
organizacja ochrony prawnej (25 str), Prawo Administracyjne, Gospodarcze i ogólna wiedza prawnicza
25.03.2010, prawo administracyjne wykłady
Elementy prawa prawo administracyjne
prawo administracyjne5
prawo administracyjne wyklady
więcej podobnych podstron