Egzamin z Chemii Fizycznej 2011
1Uzupełnij
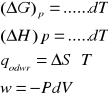
2
|
A)Opisz stan końcowy (A,B,C,D,E) B)Opisz ciepło > pobierane, < oddawane, =brak wymiany C)Opisz temperaturę: maleje↓,rośnie↑,stała const D)Jakie wielkości są równe 0, do wyboru: w,ΔH ΔG, ΔS, q... |
|
Stan końcowy |
Ciepło |
Temperatura |
Równe 0 |
Izobara |
B |
> |
↑ |
|
Izoterma |
E |
= |
= |
|
Izochora |
C |
> |
↑ |
|
Adiabata |
D |
= |
↑ |
q, S |
3 Dana jest reakcja
PCl3+Cl2→PCl5
Cp Cp=Cpprod-Cpsubstr
Δng. ng=ng (prod)-ng (substr) ng=1-2=-1 (napisz wzór i wartość)
4 Ciepło tworzenie PCl5 równe jest -.......(podane).Napisz reakcje tworzenia
5 Stała reakcji ....maleje...........(rośnie, maleje) ze wzrostem temperatury gdy..G.(?)....>0
Stała równowagi reakcji jest mniejsza od ….. gdy ......<0
6 Składnik B w roztworze doskonale rozcieńczonym (mniej lotny) spełnia prawo...Henrego...które wygląda...PB=KH*xB....(wzór)
7 Wzór Arheniusa, gdy temperatura rośnie wtedy k..rośnie.....(rośnie, maleje) + jednostki składowych równania
![]()
Ea-energia aktywacji
A- czynnik przedwykładniczy
k- stała szybkości
8 Napisać zależność potencjału chemicznego czystego składnika od ciśnienia
![]()
![]()
9 Miareczkowanie octanu sodu kwasem solnym. Przewodnictwo molowe najpierw... delikatnie wzrasta....(wzrasta, maleje), bo jon Na+ są mniej ruchliwe ......niż.....H+...... potem...wzrasta...(wzrasta, maleje)bo w roztworze jest nadmiar HCl
10 Czym miareczkujesz wypisz wszystkie możliwości(podane potencjały dla określonych par utleniacz reduktor)
Ti(II)/Ti(III) -0,37V
Sn(II)/Sn(IV) -0,15V
Fe(II)/Fe(III) -0,171V
Ce(III)/Ce(IV) 1,72V
Fe(II) Ti(III), Sn(IV)
Sn(II) Ti(III), Fe(III)
Ti(III) Ce(III)
11Wiedzac że CuSO4 ma molalność m opisz:
A)Iloczyn jonowy
B)związek molalności z aktywnością a=mγ a-aktywność
m- molalność
γ- jonowy wsp. aktywności
12 Narysować schemat ogniwa siarczanortęciowego z wodorowym bez połączeń ciekłych. Użyc odpowiedniego buforu. Podane E0, jaki jest potencjał elektrody
Hg|HgSO4|H2SO4|H2|Pt
13 Podany wykres fazowy(metanol, heksan)
|
xch= ych= Liczba stopni swobody w pkt: K.....f=2+1-1=2...... L f=2+2-2=2 M..... f=2+1-1=2.(obliczenia) Temperatura ostatecznego przejścia w parę…..59,5 W jakiej kolejności opuszczają kolumnę
Substancja wyżej wrząca metanol Substancja niżej wrząca heksan |
14 Zaleznosc RTlnK od temperatury.....
![]()
15 Wzór na entalpie reakcji (opisać)
H=U+(PV)
U-energia wewnętrzna układu [J]
P- ciśnienie [Pa]
V- objętość [m3]
16 Wpisz rzędowość reakcji
Stała szybkości nie zależy od stężenia początkowego
Okres połowicznej przemiany ma zależność wykładniczą I-rzędowa
Okres połowicznej przemiany maleje 2krotnie gdy T wzrasta 2krotnie
Okres połowicznej przemiany jest odwrotnie proporcjonalny do stężenia początkowego II-rzędowa
17 Reakcja z produktem pośrednim, napisać reakcje, wzór na szybkość reakcji
A→B→C
![]()
![]()
![]()
18 Zależność między siłą tarcia a prędkością opadania cząstki koloidalnej(wzór, opisać)
19 Jakie właściwości rozpuszczalnika wpływają na ..obniżenie (obniżenie, podwyższenie) temperatury krzepnięcia
Molowe ciepło topnienia
Stała krioskopowa
Masa molowa
20 Od czego zależy wzniesienie w kapilarze (wpisać ↑↓)
1 ↑kąt zwilżania ↑
2 ↑napięcie powierzchniowe↑
3 ↑promień kapilary, promień krzywizny↓
4 ↑gęstość cieczy↓
21 Narysuj Izotermę Langumira, opisz (słownie) co jest na osi y
θ-ilość obsadzonych miejsc
22 Ciśnienie osmotyczne- cisnienie jakie należy wywrzeć na roztwór aby powstrzymać przepływ od wyższego do niższego (niższego, wyższego)stężenia.iśnienie po stronie wyższego stężenia jest ……….. niż po stronie z niższym stężeniem. Potencjał jest
23 Od czego zależy dyfuzja i jak
Temperatura wzrasta
Masa cząsteczki maleje
Promień cząsteczki maleje
Lepkość maleje
24 Odchyleniem krzywej topnienia wody jest ujemne bo..................>0
25 Katalizator reakcji a stan równowagi :
-obniża/podwyższa energię aktywacji
- przyspiesza/spowalnia reakcje odwrotną
-nie ma wpływu na stan równowagi (może chodziło o to)
26 Jak kontrolujemy roztwory jonowe???
a)dyfuzyjnie
b)aktywacyjnie
Która odpowiedź i dlaczego
![]()
Wyszukiwarka
Podobne podstrony:
wyklad z czwartku chemia fizycz dnia19 marca
Chemia fizyczna sprawozdanie (6 1) id 112219
Chemia fizyczna wykład 11
chemia fizyczna38
chemia fizyczna07
chromatografia jonowymienna 2, Rok I, chemia fizyczna, chemia fizyczna-protokoły
10.6 poprawione, semestr 4, chemia fizyczna, sprawka laborki, 10.6
Pojęcia na egzamin z metali, Chemia Fizyczna, chemia fizyczna- laborki rozne, Rozne
Tabelka pomiarowa do 21, BIOTECHNOLOGIA POLITECHNIKA ŁÓDZKA, CHEMIA FIZYCZNA
CHEMIA FIZYCZNA- spektrografia sc, Ochrona Środowiska pliki uczelniane, Chemia
Kolokwium nr 2 (2), Technologia chemiczna, Chemia fizyczna, 3 semestr, fizyczna paczi
Chemia fizyczna 18, chemia fizyczna, chemia, FIZYCZNA - raporty
mmgg, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, chemia fizyczna cz II sprawka
Pytania z wejściówek, analityka medyczna UMP 2014, chemia fizyczna, ćwiczenia
raport5.2, UMK, Chemia fizyczna
Chemia fizyczna - sprawozdanie 2-1, Chemia Fizyczna
więcej podobnych podstron