Podstawowe Prawa gazowe
1). Zależność objętości gazu doskonałego od ciśnienia, przy stałej temperaturze
(Prawo Boyle'a-Marriotte'a, 1660-1676)
Objętość V danej masy gazu doskonałego jest odwrotnie proporcjonalna do jego ciśnienia p, przy zachowaniu stałej temperatury T.
![]()
![]()
![]()
2). Zależność objętości gazu doskonałego od temperatury, przy stałym ciśnieniu
(Prawo Gay-Lussaca lub inaczej prawo Charlesa, 1787-1808)
Pod stałym ciśnieniem p objętość V danej masy gazu doskonałego jest wprost proporcjonalna do temperatury bezwzględnej T.
![]()
![]()
![]()
3). Zależności między objętością V, ciśnieniem p i temperaturą T gazu opisują tzw. równania stanu gazu doskonałego
a). ![]()
![]()
b). równanie Clapeyrona
![]()
gdzie: n - liczba moli gazu [mol]
R - stała gazowa (R=8,31447 J mol-1 K-1)
4). Prawo Avogadra (hipoteza Avogadra)
Liczby cząsteczek różnych gazów są sobie równe w określonej objętości, przy stałym ciśnieniu i temperaturze zakładając, że gazy te właściwościami są zbliżone do gazu doskonałego.
Empirycznie dowiedziono, że 1 mol dowolnego gazu w warunkach normalnych (T = 273,15 K, p = 101 325 Pa) zajmuje objętość nazywaną objętością molową
V0 = 0,022414 m3 mol-1 = 22,414 dm3 mol-1
Natomiast stała Avogadra - jest to liczba cząsteczek dowolnej substancji znajdująca się w 1 molu: NA = 6,022∙1023 mol-1
Z powyższych praw można wyprowadzić również wzór na gęstość gazu d:
![]()
5). Prawo Daltona (prawo ciśnień cząstkowych)
Ciśnienie mieszaniny gazów p równa się sumie ciśnień, jakie wywierałyby poszczególne składniki mieszaniny gdyby były same w danej objętości. Ciśnienie całkowite mieszaniny gazowej jest równe sumie ciśnień parcjalnych (cząstkowych) wszystkich składników pi.
![]()
czyli: ![]()
6). Prawo Henry'ego
Prężność pary substancji rozpuszczonej nad jej roztworem zmienia się proporcjonalnie ze składem roztworu. Prawo to spełniane jest przez lotne substancje rozpuszczone w rozcieńczonych roztworach.
![]()
![]()
gdzie: kH - stała Henry'ego [Pa mol-1 dm3]
Sposoby wyrażania stężeń gazów
1). Ułamek molowy xi
![]()
gdzie: nA, n - liczba moli składnika A oraz całkowita w mieszaninie
pA, p - ciśnienie cząstkowe składnika A i całkowite mieszaniny
2). Ciśnienie parcjalne (cząstkowe) pA
![]()
3). Stężenie objętościowe cV (dokładniej: objętościowo-objętościowe)
Wyrażane jest w:
a). procentach objętościowych:
![]()
gdzie: VA - objętość składnika A
V - objętość mieszaniny np. powietrza
b). ppm lub ppb (częściach na milion lub miliard)
![]()
![]()
4). Stężenie masowe cM (dokładniej masowo-objetościowe cM/V)
![]()
Przeliczanie stężeń gazów
1). z równań na cV, cM i d można wyprowadzić zależności pomiędzy nimi:
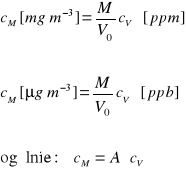
gdzie: M - masa molowa gazu [g mol-1]
V0 - objętość molowa gazów w temperaturze T i pod ciśnieniem p,
wyznaczana z równań stanu gazu
Współczynnik ![]()
(gęstość zanieczyszczenia gazowego) jest zależny od:
rodzaju substancji gazowej (różna masa molowa M)
warunków pomiaru (ciśnienie i temperatura wpływają na V0)
stąd umiejętność jego wyliczania jest niezbędna.
2). Inne przeliczenia:
a). stężenie:
1 % = 10-2
1 ppm = 10-6 = 10-4 %
1 ppb = 10-9 = 10-7 %
b). objętość:
1 m3 = 1000 dm3
1 dm3 = 1000 cm3
1 dm3 = 1 l (litr)
1 cm3 = 1 ml (mililitr)
gdzie: M - masa molowa [g mol-1]
V0 - objętość molowa gazów w temperaturze T i pod ciśnieniem p, wyznaczana z równań stanu gazu
Wyszukiwarka
Podobne podstrony:
cw prawa gazowe
Immunologlubiny i inne, Pielęgniarstwo, farmakologia, Nauka
Analiza środowiskowa, Pielęgniarstwo, farmakologia, Nauka
prawa gazowe, chemia - liceum
Prawa gazowe 2 id 385360 Nieznany
Znieczulenie do wybudzania, Pielęgniarstwo, farmakologia, farmakologia
pielęgniarstwo jako nauka
w1.FARMAKOLOGIA OGÓLNA, wykłady PMWSZ w Opolu - Pielęgniarstwo, Farmakologia
chemia ogólna quiz ekolokwium e kolokwium, prawa gazowe, prawa gazowe
Etyka pielęgniarswa jako nauka normatywna, Pielęgniarstwo licencjat AWF, Filozofia i etyka zawodu pi
w7.FARMAKOLOGIA KRWI I UKŁADU KRWIOTWÓRCZEGO, wykłady PMWSZ w Opolu - Pielęgniarstwo, Farmakologia
środki zwiotczające, Pielęgniarstwo, farmakologia, farmakologia
Podstawy prawa wykład (4.01.2007), Nauka o państwie
prawa gazowe
wyklad 1 prawa gazowe
farmakologia sciaga, Pielęgniarstwo, farmakologia, farmakologia
rzym prawa na rzeczy cudzej, Nauka, Prawo, I rok
Państwo prawa itp, US, I semestr, Nauka o państwie i prawie
więcej podobnych podstron